El síndrome nefrótico idiopático es la glomerulopatía más frecuente en la infancia, afecta a 1-3/100 mil niños menores de 16 años y se presenta con más frecuencia entre los 2 y 10 años. Su causa es desconocida, y la mayoría de las veces responde a corticoides, con buen pronóstico a largo plazo. El síndrome nefrótico corticorresistente representa un 10-20% de los síndromes nefróticos idiopáticos en pediatría. Tiene mal pronóstico, y su manejo constituye un desafío terapéutico significativo. La mitad de los pacientes evoluciona a insuficiencia renal crónica terminal en un plazo de 5 años, estando expuestos además a las complicaciones secundarias a un síndrome nefrótico persistente y a efectos adversos de la terapia inmunosupresora. El objetivo fundamental del tratamiento es conseguir una remisión completa, pero una remisión parcial se asocia a una mejor sobrevida renal que la falta de respuesta. Este documento surgió de un esfuerzo colaborativo de la Rama de Nefrología de la Sociedad Chilena de Pediatría con el objetivo de ayudar a los pediatras y nefrólogos infantiles en el tratamiento del síndrome nefrótico idiopático en pediatría. En esta segunda parte, se discute el manejo del síndrome nefrótico corticorresistente, así como de las terapias no específicas.
Idiopathic nephrotic syndrome is the most common glomerular disease in childhood, affecting 1 to 3 per 100,000 children under the age of 16. It most commonly occurs in ages between 2 and 10. Its cause is unknown, and its histology corresponds to minimal change disease in 90% of cases, or focal segmental glomerulosclerosis. Steroid-resistant nephrotic syndrome represents 10-20% of idiopathic nephrotic syndrome in pediatrics. It has a poor prognosis, and its management is a significant therapeutic challenge. Half of patients evolve to end-stage renal disease within 5 years, and are additionally exposed to complications secondary to persistent NS and to the adverse effects of immunosuppressive therapy. The primary goal of treatment is to achieve complete remission, but even a partial remission is associated with a better renal survival than the lack of response. This paper is the result of the collaborative effort of the Nephrology Branch of the Chilean Society of Pediatrics with aims at helping pediatricians and pediatric nephrologists to treat pediatric idiopathic nephrotic syndrome. In this second part, handling of steroid-resistant nephrotic syndrome as well as nonspecific therapies are discussed.
El síndrome nefrótico (SN) se caracteriza por proteinuria en rango nefrótico, hipoalbuminemia y edema generalizado. Afecta a 1-3/100.000 niños menores de 16 años1,2. La gran mayoría de los casos comienza entre los 2 y 10 años, correspondiendo este grupo a SN idiopático (SNI) o primario3. Más del 80% de los casos responden a esteroides (síndrome nefrótico corticosensible [SNCS]), con buen pronóstico a largo plazo y preservación de la función renal2,3.
El SNCR representa un 10-20% de los SNI en pediatría2. En estos pacientes, si no se logra remisión parcial o completa, el pronóstico a largo plazo es reservado, con un 50% de progresión a insuficiencia renal crónica terminal a 5 años4,5. Los pacientes se encuentran expuestos además a las complicaciones secundarias a un SN persistente y a efectos adversos de la terapia inmunosupresora. Su manejo constituye un desafío terapéutico significativo, por lo que debe ser necesariamente abordado por un nefrólogo infantil2,6,7.
El tiempo mínimo de tratamiento para hablar de corticorresistencia es incierto. Aproximadamente el 95% de los pacientes con SNCS responden a corticoides dentro de las 4 semanas de iniciado el tratamiento, y un 98% antes de las 8 semanas3. Es por esto que, en general, se define SNCR como aquel que no responde a las 8 semanas de tratamiento esteroidal2,8,9. Si bien algunos grupos recomiendan el uso de pulsos de metilprednisolona a niños que no han remitido después de la cuarta semana de prednisona en dosis diaria antes de catalogar de corticorresistencia, no hay evidencia actual que apoye esta conducta8.
La evaluación inicial de los pacientes con SNCR debe incluir función renal y biopsia renal2. La histología corresponde principalmente a glomeruloesclerosis focal y segmentaria (GEFS), y en menor frecuencia a enfermedad por cambios mínimos o glomerulonefritis membranoproliferativa10,11. Dentro del grupo de las GEFS se han detectado mutaciones genéticas para proteínas estructurales del podocito en 10-30%. Estos pacientes no responden a terapia inmunosupresora, progresando a enfermedad renal crónica y eventualmente insuficiencia renal crónica terminal9,12,13. Es difícil plantear una recomendación con respecto al estudio genético dado la poca disponibilidad, su alto costo y la baja prevalencia de mutaciones detectadas2,7
El objetivo fundamental del tratamiento es conseguir una remisión completa, pero una remisión parcial se asocia a una mejor sobrevida renal que la falta de respuesta6.
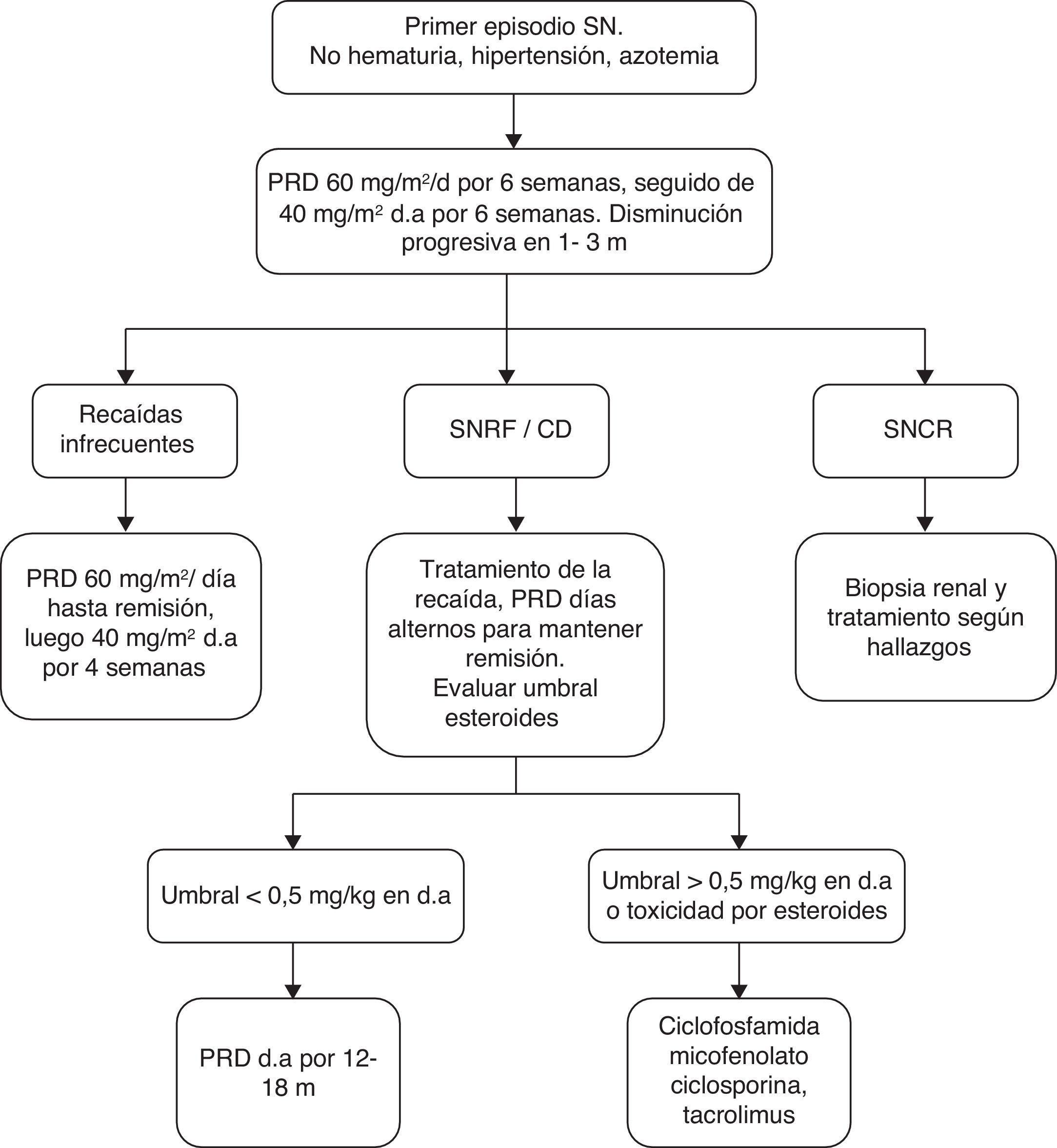
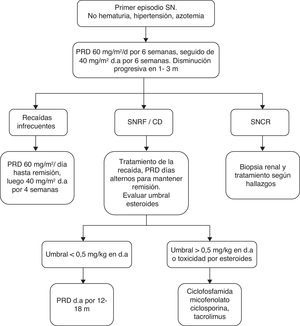
Estas recomendaciones no se aplican a niños con SNCR que presenten histologías diferentes a CM y GEFS ni a GEFS con mutación genética demostrada (fig. 1).
Algoritmo de manejo. Tomado de Bagga et al.40. CD: corticodependiente; d.a.: días alternos; PRD: prednisona; SNCR: síndrome nefrótico corticorresistente;SNRF: síndrome nefrótico recaedor frecuente.
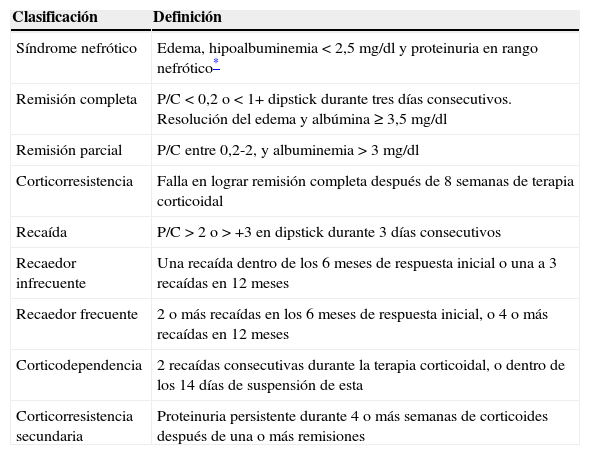
Las definiciones se listan en la tabla 1.
Definiciones de síndrome nefrótico
| Clasificación | Definición |
|---|---|
| Síndrome nefrótico | Edema, hipoalbuminemia<2,5mg/dl y proteinuria en rango nefrótico* |
| Remisión completa | P/C<0,2 o<1+ dipstick durante tres días consecutivos. Resolución del edema y albúmina ≥ 3,5mg/dl |
| Remisión parcial | P/C entre 0,2-2, y albuminemia>3mg/dl |
| Corticorresistencia | Falla en lograr remisión completa después de 8 semanas de terapia corticoidal |
| Recaída | P/C>2 o>+3 en dipstick durante 3 días consecutivos |
| Recaedor infrecuente | Una recaída dentro de los 6 meses de respuesta inicial o una a 3 recaídas en 12 meses |
| Recaedor frecuente | 2 o más recaídas en los 6 meses de respuesta inicial, o 4 o más recaídas en 12 meses |
| Corticodependencia | 2 recaídas consecutivas durante la terapia corticoidal, o dentro de los 14 días de suspensión de esta |
| Corticorresistencia secundaria | Proteinuria persistente durante 4 o más semanas de corticoides después de una o más remisiones |
1. Inhibidores de la calcineurina (ICN)6,7,9,11,14–17
a) Ciclosporina (CsA): terapia de elección en el SNCR, logrando 31% remisión completa y 38% remisión parcial a 6 meses. Se usa inicialmente asociada a prednisona (PRD).
Dosis: 4-5mg/kg/d (150mg/m2/d) cada 12 horas, asociado a PRD 30-40mg/m2 en días alternos. Monitorizar con niveles plasmáticos: al inicio del tratamiento, sospecha de no adherencia, falta de respuesta o nefrotoxicidad. Nivel plasmático inicial aconsejado: CsA C0 80-150ng/ml (no sobrepasar los 200ng/ml), en remisión idealmente 60-80ng/ml (<100ng/ml). La monitorización principal es la clínica, permitiendo que los niveles plasmáticos sean algo inferiores de los deseados, mientras mantenga proteinuria negativa.
La mayoría de los pacientes que responden lo hacen entre los 2 y 3 meses. Si hay respuesta parcial o completa, continuar el tratamiento por un mínimo de 12 meses, disminuyendo luego a la menor dosis efectiva posible para mantener durante al menos uno a 2 años más. Mantener PRD en la dosis indicada durante 6 meses y luego disminuir de manera progresiva hasta suspender o mantener con la mínima dosis posible en días alternos (tabla 2).
Síndrome nefrótico idiopático corticorresistente. Resumen de tratamiento
| Clínica | Tratamiento | Duración | Comentarios |
|---|---|---|---|
| SNCR | 1.- Ciclosporina | ||
| 4-5mg/kg/día (150mg/m2/día) c/12h | 6 meses | Nivel plasmático aconsejado: | |
| -Inicial: C0 80-150ng/ml (< 200ng/ml) | |||
| a) Si hay respuesta (remisión completa/parcial) continuar durante 12 meses, disminuyendo a la menor dosis efectiva posible y mantener durante 12-24 meses más | -Remisión>6 meses: C0 60-80ng/ml (<100ng/ml) | ||
| b) Si no hay respuesta suspender | Controlar función renal cada 3 meses y perfil lipídico anual | ||
| Prednisona 30-40mg/m2 en días alternos | 6 meses | Efectos adversos: HTA, cosméticos (hipertricosis, hiperplasia gingival), hipercolesterolemia y disfunción renal | |
| Disminuir los corticoides de manera paulatina | Intentar suspender o mantener la mínima dosis posible (idealmente días alternos) | ||
| 4.- Tacrolimus | |||
| 0,12-0,15mg/kg/día cada 12 horas | Igual que ciclosporina | Preferido especialmente en adolescentes | |
| Nivel plasmático C0 5-8ng/ml | |||
| Prednisona 30-40mg/m2 en días alternos | 6 meses | Efectos adversos: HTA, nefrotoxicidad, hiperglucemia, y rara vez neurotoxicidad (cefalea, convulsiones) | |
| Disminuir los corticoides de manera paulatina | Intentar suspender o mantener la mínima dosis posible (idealmente días alternos) |
C0: tiempo cero, predosis; HTA: hipertensión arterial; SNCR: síndrome nefrótico corticorresistente.
En caso de no respuesta, se aconseja completar 6 meses de tratamiento antes de suspenderlo.
La duración óptima de la terapia con ICN y la dosis de PRD y su tiempo de asociación es desconocida.
No usar en pacientes con compromiso de función renal (velocidad de filtración glomerular menor de 60ml/min/1,73m2) y/o cuya biopsia demuestre signos de daño crónico irreversible (atrofia tubular moderada a severa, fibrosis intersticial avanzada) y/o con hipertensión arterial no controlada.
Efectos adversos: hipertensión arterial, cosméticos (hipertricosis, hiperplasia gingival), hipercolesterolemia y disfunción renal. Si la creatinina aumenta en un 25%, disminuir la dosis en 50%, y si no se normaliza, suspender la ciclosporina y evaluar realización de biopsia renal.
b) Tacrolimus: ICN preferido especialmente en adolescentes ya que no tiene los efectos adversos cosméticos de la ciclosporina. Hay menos estudios controlados que con CsA.
Dosis 0,12-0,15mg/kg/d cada 12 horas, también asociado a PRD en las mismas dosis que con CsA. Mantener nivel plasmático basal (C0) entre 5 y 8ng/ml.
Efectos adversos: HTA, nefrotoxicidad, hiperglucemia, y rara vez neurotoxicidad (cefalea, convulsiones).
En los pacientes que reciben ICN, se debe plantear biopsia renal si se observa disminución de la función renal (ascenso de la creatinina en más del 50% del valor basal) que persiste a pesar de realizar un descenso en la dosis o al descontinuar el tratamiento. Es discutible la utilidad de la biopsia renal para evaluar nefrotoxicidad en pacientes con tratamiento prolongado y sin alteración de la función renal.
Conducta frente a las recaídas:
- a)
Durante la reducción de la PRD: volver a la dosis inicial de PRD.
- b)
Durante la reducción de la CsA: aumentar la dosis de CsA a 150mg/m2/d, asociando prednisona 30-40mg/m2/días alternos durante un mes, con reducción gradual posterior.
- c)
Frente a una recaída después de un mes de retirada la ciclosporina se sugiere:
- -
Manejo con esteroides, ya que se ha observado que los pacientes con SNCR una vez que alcanzan una remisión (parcial o total) con los ICN, pueden hacerse corticosensibles.
- -
Volver a la dosis previa efectiva del inmunosupresor que se usó, o
- -
Iniciar un nuevo agente inmunosupresor no probado previamente, para minimizar la dosis acumulativa tóxica2,7,14.
- -
2. Terapias alternativas a ICN
En aquellos pacientes que no alcanzan remisión con ICN puede considerarse el uso de micofenolato mofetil (MMF), esteroides en altas dosis o una combinación de estos fármacos. Los agentes alquilantes (ej: ciclofosfamida), no están recomendados para el tratamiento de niños con SNCR2,11,18.
a) Micofenolato mofetil19–23: existen datos limitados y no concluyentes, en relación a la eficacia de micofenolato mofetil en pacientes con SNCR. Mientras algunos estudios muestran remisión parcial o completa entre un 23 y 62% de los casos, otros evidencian beneficios limitados.
Dosis: 25-35mg/kg/día o 600 -1.200mg/m2/d cada 12h, asociado a prednisona en esquema similar al utilizado con ICN.
Efectos adversos: depresión medular (controlar perfil hematológico mensual al inicio y luego cada 3 meses: si leucocitos <4.000/mm3, suspender transitoriamente), diarrea y meteorismo (mejoran al fraccionar la dosis cada 8 horas).
b) Esteroides en dosis altas24,25: existe evidencia de muy baja calidad que cursos prolongados de esteroides, después del esquema de tratamiento convencional, puedan aumentar la probabilidad de remisión.
c) Rituximab (RTX)26–29: su uso exitoso solo ha sido reportado en estudios retrospectivos de casos aislados mostrando una respuesta favorable en 20-50% de los casos. Si bien en muchos de los pacientes no es posible suspender los inmunosupresores, las dosis requeridas de estos pueden disminuir de forma significativa. Un estudio clínico randomizado reciente no mostró beneficio al usar RTX 2 dosis, en comparación al tratamiento con ICN más PRD, desaconsejando su uso en este grupo de pacientes (28). Dosis: 375mg/m2 (máx 1 g) ev semanal, por 1-4 dosis. Se sugiere la monitorización del tratamiento con la medición de subpoblación linfocitaria CD19, esperando valores<1%, lo que se logra en más del 80% de los casos después de la primera dosis de RTX.
Efectos adversos: rash cutáneo, fiebre, escalofríos, dolor abdominal, hiper- e hipotensión, taquicardia, mialgias. Estos síntomas pueden ser minimizados con premedicación de antihistamínicos y/o corticoides, desaparecen al detener la infusión y raramente recurren. Broncoespasmo y shock anafiláctico son menos frecuentes. Existe mayor riesgo de infección por gérmenes habituales y oportunistas, se recomienda el uso de cotrimoxazol profiláctico por riesgo de infección por Pneumocystis jiroveci. La leucoencefalopatía multifocal progresiva causada por poliomavirus JC, que se ha descrito en pacientes con LES, enfermedades malignas y artritis reumatoidea, no se ha reportado en pacientes con SN. Hay reportes de casos anecdóticos de neumonitis intersticial, miocardiopatía, pancolitis y daño renal agudo.
Terapia inespecíficaBloqueo sistema renina angiotensina30–32
Para reducir la proteinuria en pacientes con SNCR se recomienda asociar bloqueadores del sistema renina-angiotensina a la terapia inmunosupresora. Los fármacos recomendados son los inhibidores de la enzima convertidora de angiotensina y/o los antagonistas del receptor de angiotensina II. Datos en adultos han demostrado mejoría en la sobrevida renal en pacientes con SN que alcanzan una reducción de 50% o más en relación a su proteinuria basal. Intentar utilizar la mayor dosis posible tolerable para el paciente. La asociación con antagonistas de aldosterona tendría efectos aditivos potenciales.
Enalapril dosis inicial: 0,08mg/kg/día hasta 5mg/día, máximo: 0,6mg/kg/día hasta 40mg/día en 1 o 2 dosis diarias. Losartán dosis inicial: 0,7mg/kg/día hasta 50mg/día, máximo: 1,4mg/kg/día hasta 100mg/día en una dosis diaria.
Monitorización de función renal y K+ plasmático. Suspender en caso de hiperkalemia o aumento de creatinina mayor a 30%. Contraindicado con velocidad de filtración glomerular menor de 30ml/min/1,73m2 y en embarazo. Mujeres en edad fértil deben ser aconsejadas de anticoncepción.
Manejo de las complicaciones1. Trombosis33–35:
Si bien es una complicación poco frecuente, se asocia con morbimortalidad significativa. Se presenta en aproximadamente el 3% de los niños con SN, en su mayoría son trombosis venosas y raramente el compromiso es arterial. Recurren en un 6 a 20% de los casos. Los factores de riesgo de tromboembolismo incluyen edad (SN congénito y adolescentes >12 años), severidad de la enfermedad, inmovilización, uso de catéter venoso central (CVC), punción de vasos profundos, hipovolemia, infecciones intercurrentes y nefropatía membranosa. Los síntomas incluyen edema y dolor de extremidad, disfunción del CVC, síndrome de vena cava superior y/o compromiso respiratorio en caso de embolia pulmonar.
Profilaxis: las estrategias no farmacológicas incluyen mantener actividad física, adecuada hidratación, uso de medias de compresión graduadas y en lo posible evitar CVC. No hay estudios controlados randomizados que demuestren seguridad y eficacia del uso de tromboprofilaxis farmacológica en niños con SNI. En general, se limita su uso al grupo de niños con alto riego de trombosis. El rol de la aspirina en bajas dosis es incierto. Tratamiento: heparina de bajo peso molecular inicialmente, y en caso de requerir terapias anticoagulantes prolongadas continuar con anticoagulantes orales. En niños con primer evento tromboembólico se recomienda mantener terapia durante 3 meses y luego profilaxis anticoagulante hasta que el SN esté en remisión. Si el trombo se relaciona con CVC, este puede removerse después de 3 a 5 días de anticoagulación.
2. Osteoporosis36–42:
Es conocido que los glucocorticoides son causa de osteoporosis, necrosis de la cabeza de fémur, disminución en el contenido mineral óseo y de la densidad mineral ósea en niños con SN. La mineralización ósea durante la infancia determina el contenido mineral óseo en el adulto. Estudios en adultos con SN en la infancia han demostrado disminución significativa de la densidad mineral ósea y mayor riesgo de fractura, especialmente con dosis de corticoides>30mg/d por más de 5 días repetidos durante más de 4 veces al año, y con pulsos repetidos de corticoides. Estudios en niños con SN han demostrado disminución de la densidad mineral ósea, incluso después del primer episodio, lo que puede ser prevenido con aporte de calcio y vitamina D. Si bien no existe una indicación clara en la literatura, se recomienda el suplemento diario de calcio (500-1.000mg) y vitamina D (400 U-1000 U) en los pacientes que reciben corticoides durante más de 3 meses. Los niveles de 25-hidroxicolecalciferol (25OHD) son difíciles de interpretar pues la vitamina D y su proteína trasportadora se pierden por la orina durante la recaída del SN y por lo tanto los niveles bajos no reflejan necesariamente el estado de los depósitos. Los niveles de 25OHD en remisión son contradictorios y no tendrían relación con las características de la enfermedad ni con el tratamiento utilizado. En pacientes que reciben corticoides durante más de un año se recomienda controlar calcio, fósforo, FA y PTH, radiografía de columna dorsolumbar y densitometría ósea.
3. Dislipidemia43–47:
Los pacientes con SNCS generalmente no requieren tratamiento ya que la hiperlipidemia es intermitente y de corta duración. En los casos de SNCR e hiperlipidemia persistente el tratamiento incluye manejo nutricional y farmacológico según guías publicadas. En caso de dislipidemia severa el manejo deberá ser en conjunto con especialistas. Se recomienda una dieta con<7-10% de grasas saturadas e ingesta de colesterol<200-300mg/d.
El tratamiento farmacológico está indicado en niños mayores de 10 años con LDL>190mg/dl o>160mg/dl más otro factor de riesgo. Dado que el colesterol es importante para el desarrollo y crecimiento, no se recomienda su uso en niños menores de 8 años, aunque se ha planteado en caso de dislipidemias severas (LDL>500mg/dl). De elección son las estatinas (inhibidores de la HMG-CoA reductasa) con un perfil de seguridad semejante a los adultos. Su uso en SN ha sido efectivo aunque solo son trabajos prospectivos no controlados.
Dosis: lovastatina y simvastatina 5-40mg/d. Atorvastatina 10-20mg/d. Efectos secundarios poco frecuentes: miopatías y aumento de transaminasas, requiere monitorización con transaminasas y CPK plasmáticas. La disminución de la dosis o la suspensión del fármaco revierte el efecto. Precaución con el uso concomitante con fármacos que se metabolizan en citocromo P450 (macrólidos, antifúngicos, ICN). Esta contraindicado en el embarazo por lo que mujeres en edad fértil deben ser aconsejadas de anticoncepción.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.