El síndrome nefrótico idiopático es la glomerulopatía más frecuente en la infancia, afecta a 1-3/100 mil niños menores de 16 años y se presenta con más frecuencia entre los 2 y 10 años. Su causa es desconocida, y la histología corresponde a enfermedad por cambios mínimos en más del 90% de los casos, o a glomeruloesclerosis focal y segmentaria.
Un 80 a 90% responde a esteroides (síndrome nefrótico corticosensible), con buen pronóstico a largo plazo y preservación de la función renal en el tiempo. De los pacientes con síndrome nefrótico corticosensible, el 70% presenta una o más recaídas en su evolución, y de estos, la mitad se comporta como recaedor frecuente o corticodependiente, grupo que concentra el riesgo de toxicidad por esteroides. Los pacientes con síndrome nefrótico corticorresistente tienen mal pronóstico, evolucionando el 50% a insuficiencia renal crónica terminal. El objetivo de la terapia del síndrome nefrótico idiopático es inducir y mantener la remisión de la enfermedad, disminuyendo los riesgos secundarios a la proteinuria, pero minimizando los efectos adversos de los tratamientos, especialmente por el uso prolongado de corticoides. Este documento es producto de un esfuerzo colaborativo de la Rama de Nefrología de la Sociedad Chilena de Pediatría con el objetivo de ayudar a los pediatras y nefrólogos infantiles en el tratamiento del síndrome nefrótico idiopático en pediatría. En esta primera parte, se presentan las recomendaciones de manejo del síndrome nefrótico corticosensible.
Idiopathic nephrotic syndrome is the most common glomerular disease in childhood, affecting 1 to 3 per 100,000 children under the age of 16. It most commonly occurs in ages between 2 and 10. Its cause is unknown and its histology corresponds to minimal change disease in 90% of cases, or focal segmental glomerulosclerosis.
80 to 90% of cases respond to steroids (steroid-sensitive nephrotic syndrome) with good prognosis and long-term preservation of renal function over time. 70% of patients with SSNS have one or more relapses in their evolution, and of these, 50% behave as frequent relapsing or steroid-dependent, a group that concentrate the risk of steroid toxicity. Patients with steroid-resistant nephrotic syndrome have a poor prognosis and 50% of them evolve to end-stage renal disease. The goal of therapy is to induce and maintain remission of the disease, reducing the risk secondary to proteinuria while minimizing the adverse effects of treatments, especially with prolonged use of corticosteroids. This paper is the result of the collaborative effort of the Nephrology Branch of the Chilean Society of Pediatrics with aims at helping pediatricians and pediatric nephrologists to treat pediatric SNI. In this first part, recommendations of steroid-sensitive nephrotic syndrome are discussed.
El síndrome nefrótico (SN) se caracteriza por proteinuria en rango nefrótico, hipoalbuminemia y edema generalizado. Afecta a 1-3/100.000 niños menores de 16 años1,2. La gran mayoría de los casos comienza entre los 2 y 10 años, correspondiendo este grupo a SN idiopático (SNI) o primario3. Quedan fuera del alcance de esta guía los menores de un año, que en su gran mayoría son de causa genética4, y los SN secundarios a lupus eritematoso sistémico, púrpura de Schöenlein Henoch, vasculitis, malignidades e infecciones.
El SNI responde en un 80-90% a la terapia esteroidal y la histopatología más frecuente es la enfermedad por cambios mínimos. Dentro de las otras entidades histológicas, la segunda en frecuencia corresponde a glomeruloesclerosis focal y segmentaria, con una tasa de respuesta inicial a corticoides de solo 20-50%3. Aproximadamente el 80-90% de los pacientes presenta una o más recaídas durante el curso de su enfermedad, pero mantiene adecuada respuesta a corticoides, con buen pronóstico a largo plazo y función renal normal. Los pacientes resistentes a esteroides, que en su mayoría corresponden a glomerulonefritis focal y segmentaria, tienen mal pronóstico a largo plazo y un 50% desarrolla enfermedad renal crónica. En este último grupo, estudios nacionales e internacionales evidencian que alrededor de un 10-30% presenta mutaciones genéticas para proteínas estructurales del podocito5,6.
El objetivo de la terapia del SNI es lograr remisión de la enfermedad, minimizando así los riesgos secundarios a la proteinuria, tales como dislipidemia, infecciones bacterianas invasivas, eventos tromboembólicos y desnutrición. La mortalidad se ha reducido de un 40-60% a un 0,7% después de la aparición de los antibióticos y la introducción de la terapia esteroidal7.
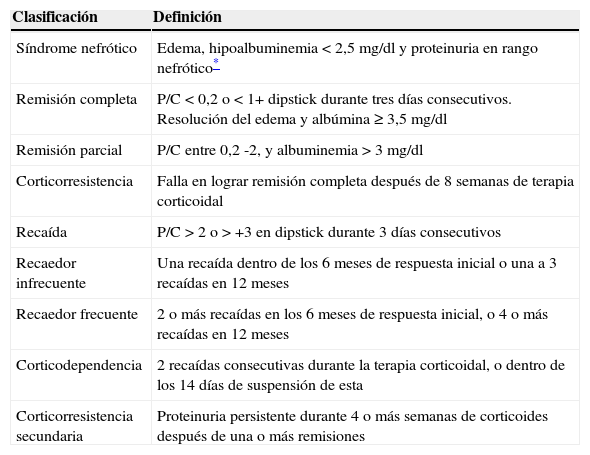
DefinicionesLas definiciones se listan en la tabla 1.
Definiciones de síndrome nefrótico
| Clasificación | Definición |
|---|---|
| Síndrome nefrótico | Edema, hipoalbuminemia<2,5mg/dl y proteinuria en rango nefrótico* |
| Remisión completa | P/C<0,2 o<1+ dipstick durante tres días consecutivos. Resolución del edema y albúmina ≥ 3,5mg/dl |
| Remisión parcial | P/C entre 0,2 -2, y albuminemia>3mg/dl |
| Corticorresistencia | Falla en lograr remisión completa después de 8 semanas de terapia corticoidal |
| Recaída | P/C>2 o>+3 en dipstick durante 3 días consecutivos |
| Recaedor infrecuente | Una recaída dentro de los 6 meses de respuesta inicial o una a 3 recaídas en 12 meses |
| Recaedor frecuente | 2 o más recaídas en los 6 meses de respuesta inicial, o 4 o más recaídas en 12 meses |
| Corticodependencia | 2 recaídas consecutivas durante la terapia corticoidal, o dentro de los 14 días de suspensión de esta |
| Corticorresistencia secundaria | Proteinuria persistente durante 4 o más semanas de corticoides después de una o más remisiones |
P/C: proteinuria/creatininuria.
Prednisona (PRD) en dosis única matinal por vía oral. Consta de 2 fases:
a) Diaria: 60mg/m2 o 2mg/kg al día, máximo 60mg, durante 6 semanas.
b) Días alternos: 40mg/m2 o 1,5mg/kg en días alternos, máximo 40mg, durante 6 semanas. Luego disminuir dosis de forma progresiva en 1 a 3 meses hasta suspender.
Las dosis y duración óptima del tratamiento del primer episodio de SN aún no están completamente definidas, y son objeto de controversias. Aunque algunos estudios prospectivos y un metaanálisis han demostrado que el alargar la terapia con prednisona de 3 a 6 meses en el primer episodio de un síndrome nefrótico corticosensible permite remisiones sostenidas y disminuye la frecuencia de recaídas8,9, dos estudios clínicos randomizados recientes, de buena calidad metodológica, mostraron que la prolongación del tratamiento esteroidal de 3 a 6 meses no disminuyó la frecuencia de recaídas a los 12 meses de seguimiento, ni la proporción de pacientes con recaídas frecuentes y necesidad de otros tratamientos inmunosupresores, pese a una mayor dosis acumulada10,11.
Tratamiento de las recaídasPrednisona 60mg/m2 o 2mg/kg (máximo 60mg) en una dosis diaria hasta la remisión completa durante al menos 3 días, luego 40mg/m2 o 1,5mg/kg (máximo 40mg) en días alternos durante 4 semanas.
Síndrome nefrótico corticodependiente - recaedor frecuenteAproximadamente el 40-45% de los niños con síndrome nefrótico corticosensible presentan recaídas frecuentes (RF) o corticodependencia (CD)2,12. Los factores asociados con mayor riesgo de RF-CD son: menor tiempo a la primera recaída (marcador más consistente), número de recaídas en los primeros 6 meses desde el comienzo, menor edad y hematuria al comienzo, sexo masculino y mayor tiempo en lograr la primera remisión2.
El pronóstico a largo plazo para la mayoría de estos pacientes es muy bueno, con preservación de la función renal. Por este motivo, es fundamental limitar los efectos adversos asociados al tratamiento, especialmente por uso prolongado de corticoides (detención de crecimiento lineal, cambios conductuales, obesidad, síndrome de Cushing, hipertensión arterial, cataratas, intolerancia a la glucosa y desmineralización ósea)2.
Los niños con síndrome nefrótico con recaídas frecuentes CD deben ser manejados por nefrólogos infantiles. La elección del tratamiento a seguir debe balancear los beneficios con los potenciales efectos adversos.
1. Prednisona: prolongar la terapia por un período de 6 a 18 meses, a la menor dosis posible, para mantener la remisión sin efectos adversos indeseables2,13,14. Después del tratamiento de la recaída, disminuir los esteroides de manera progresiva hasta llegar a una dosis en lo posible≤10mg/m2 en días alternos. Se sugiere disminuir la dosis en 10mg/m2 cada 2 semanas hasta llegar a 10mg/m2 (o 0,5mg/kg) en días alternos, mantener esta dosis durante 3 a 6 meses y luego intentar disminuir a 5mg/m2 (o 0,25mg/kg) en días alternos hasta completar 9-18 meses de tratamiento. Si no se logra remisión con días alternos, volver a dosis diaria en la mínima dosis posible por el mismo periodo2.
Con el fin de disminuir el riesgo de recaída en los pacientes que están recibiendo PRD en días alternos, en caso de presentar infecciones respiratorias u otras, se sugiere administrar la dosis de prednisona en forma diaria durante 7 días15,16.
2. Agentes ahorradores de esteroides: están indicados cuando hay efectos adversos relacionados con los corticoides o recaídas con prednisona >10mg/m2 o 0,5mg/kg en días alternos (o su equivalente en dosis diaria)2,12,17. No hay ensayos clínicos randomizados que permitan elegir uno de ellos sobre los otros como agente de primera línea, sin embargo un metaanálisis de 32 estudios demostró que los agentes alquilantes y ciclosporina disminuyeron el número de recaídas en síndrome nefrótico con recaídas frecuentes al comparar con prednisona sola2,18. Considerando la relación costo-beneficio se sugiere el siguiente orden:
a. Ciclofosfamida2,17,18
Puede lograr remisión prolongada con suspensión de todo tipo de fármacos, aunque puede tener efectos adversos significativos. Más efectivo en síndrome nefrótico con recaídas frecuentes que en síndrome nefrótico corticodependiente (SNCD). Dosis: 1-3mg/kg/d durante 8-12 semanas (no sobrepasar dosis acumulada máxima de 168mg/kg). Iniciar con paciente en remisión. Aumentar ingesta de agua durante el tratamiento. Disminuir prednisona de manera paulatina, hasta suspender en 3 meses.
Considerar vía intravenosa si el niño no puede deglutir el comprimido entero (y no se puede preparar el elixir) o hay mala adherencia. Dosis: 500mg/m2/dosis mensual durante 6 meses. No se recomienda un segundo pulso. Los comprimidos no se pueden fraccionar. En caso de niños pequeños que no degluten cápsulas, se puede preparar una solución oral de ciclofosfamida 10mg/ml19,20.
Controlar perfil hematológico cada 15 días el primer mes y luego una vez al mes. Suspender transitoriamente con leucopenia <4.000/mm3 y en caso de infección moderada a severa. Efectos adversos: alopecia, cistitis hemorrágica, aumento riesgo de infección, infertilidad (con dosis acumulada>200mg/kg).
b. Inhibidores de calcineurina (ICN)2,12,17,18,22:
En comparación con ciclofosfamida no tiene diferencias en recaídas durante el tratamiento. Mantiene remisión en 80-85% de los pacientes que recayeron con ciclofosfamida. Tiene alta tasa de recaídas al suspenderlo.
Ciclosporina: dosis 4-5mg/kg/d (150mg/m2/d) cada 12 horas. Iniciar con el paciente en remisión. Disminuir los esteroides de manera paulatina e intentar suspenderlos en 6 meses. Si no es posible, mantenerlos en la mínima dosis posible, si es posible en días alternos. Monitorizar con niveles plasmáticos: al inicio del tratamiento, sospecha de no adherencia, falta de respuesta o nefrotoxicidad. Nivel plasmático aconsejado: CsA C0 80-150ng/ml (no sobrepasar los 200ng/ml).
En pacientes estables en remisión durante más de 6 meses disminuir la dosis de ciclosporina a la menor posible, para lograr niveles plasmáticos<100 (idealmente entre 60-80) ng/ml. Mantener durante 12-24 meses, con disminución progresiva en 3 a 6 meses hasta suspender. Controlar la función renal cada 3 meses y perfil lipídico anual. No hay datos que demuestren beneficio de realizar biopsia renal de rutina con tratamientos prolongados (mayor de dos años). Efectos adversos: hipertensión arterial, cosméticos (hipertricosis, hiperplasia gingival), hipercolesterolemia y disfunción renal. Si la creatinina aumenta en un 25%, disminuir la dosis en 50%, y si no se normaliza suspender la ciclosporina y evaluar realización de biopsia renal.
Tacrolimus: agente alternativo a la ciclosporina, preferido especialmente en adolescentes ya que no tiene los efectos adversos cosméticos de la ciclosporina. Dosis 0,1mg/kg/d cada 12 horas, niveles plasmáticos basales 5-8ng/ml. Efectos adversos: hipertensión arterial, nefrotoxicidad, hiperglucemia, y rara vez neurotoxicidad (cefalea, convulsiones).
c. Micofenolato mofetil (MMF)2,18,21,22
Inferior a ciclosporina en prevenir recaídas, presenta un mejor perfil de seguridad. También indicado como agente ahorrador de ciclosporina. Alta tasa de recaídas al suspender el MMF.
Dosis: 800-1200mg/m2/día o 30mg/kg/d de MMF (o su equivalente en ácido micofenólico) en 2 dosis durante al menos 12-24 meses. Al retirar, disminuir progresivamente la dosis hasta suspender en 3 a 6 meses. Disminuir de manera paulatina los corticoides e intentar suspenderlos en 6 meses. Si no es posible, mantener en la mínima dosis posible, ojalá en días alternos. Efectos adversos: depresión medular (controlar perfil hematológico mensual al inicio y luego cada 3 meses: si los leucocitos son <4000/mm3, suspender transitoriamente), diarrea y meteorismo (mejoran al fraccionar la dosis cada 8 horas).
Conducta frente a recaídas durante el tratamiento con MMF o ICN: si hay recaída y el paciente está sin esteroides, reanudar PRD en protocolo de recaída habitual, revisar dosis y niveles plasmáticos. Con recaídas frecuentes, considerar mantener dosis baja de esteroides asociados (< 0,5mg/kg en días alternos). En casos más severos puede ser necesario el uso combinado de MMF e ICN, para permitir suspensión de esteroides y menores niveles plasmáticos de ICN22,23.
Si hay recaída después de un mes de suspendido MMF o ICN, intentar manejo solo con esteroides.
3. Rituximab (RTX): la eficacia del uso de RTX en SNI se basa principalmente en series de casos y en escasos estudios controlados. A pesar de las limitaciones de los datos disponibles, diferentes publicaciones lo recomiendan para casos seleccionados de SNCD, RF o SNCR, ya sea en los pacientes de difícil manejo del SN o que presentan signos de toxicidad a los fármacos usados2,24–26. En algunos casos, permite lograr una remisión sostenida, interrumpir otras terapias IS o al menos disminuir en forma significativa la dosis de estas, sin mayores riesgos de infecciones severas. Los mejores resultados se ven en SNCD, con un 60-80% de respuesta favorable, siendo limitados en SNCR, principalmente secundario a glomerulonefritis focal y segmentaria, donde la respuesta favorable es aproximadamente en un 30-45%27–33. Por lo anterior, sugerimos considerar el uso de este medicamento principalmente en el grupo de pacientes con SNCD y RF que persisten con recaídas frecuentes a pesar de combinaciones óptimas de PRD y agentes ahorradores de corticoides y/o a quienes tienen serios efectos adversos con la terapia. Criterios de exclusión: pacientes con cleareance de creatinina<60ml/min/1,73 m2 y en anasarca, o con infección viral activa, portadores de VHB, VHC o VIH o antecedente de tratamiento de TBC27,28,33,34.
Dosis: 375mg/m2 (máx. 1 g) ev semanal. Actualmente no hay consenso en el número de dosis recomendada. En la mayoría de las publicaciones se ha utilizado un mínimo de 2 y un máximo de 4 dosis de RTX, incluyendo retratamientos28,29,33–35, desaconsejando mayor número de dosis27,35. Se sugiere la monitorización del tratamiento con la medición de subpoblación linfocitaria CD19, esperando valores<1%, lo que se logra en más del 80% de los casos después de la primera dosis de RTX. Sin embargo, no se ha establecido la relación entre el número de dosis y la recuperación de los linfocitos B y entre esta y la ocurrencia de recaídas30,35,36. Para iniciar el RTX, el paciente debe estar en remisión. Una vez completadas una a 2 dosis de RTX, disminuir prednisona e ICN de manera progresiva hasta suspender, siempre que la proteinuria se mantenga negativa27,28,32. Estudios recientes han demostrado que el uso de MMF en dosis habituales como tratamiento de manutención, concomitante al RTX logra remisiones más prolongadas37,38. Efectos adversos26: la mayoría de ellos son relacionados con la infusión del medicamento y están directamente relacionados con la velocidad de infusión. Incluyen: rush cutáneo, fiebre, escalofríos, dolor abdominal, hiper- e hipotensión, taquicardia, mialgias. Estos síntomas pueden ser minimizados con premedicación de antihistamínicos y/o corticoides, desaparecen al detener la infusión y raramente recurren. Broncoespasmo y shock anafiláctico son menos frecuentes. Existe mayor riesgo de infección por gérmenes habituales y oportunistas, se recomienda el uso de cotrimoxazol profiláctico por riesgo de infección por Pneumocystis jiroveci. La leucoencefalopatía multifocal progresiva causada por poliomavirus JC, que se ha descrito en pacientes con LES, enfermedades malignas y artritis reumatoidea, no se ha reportado en pacientes con SN. Hay reportes de casos anecdóticos de neumonitis intersticial, miocardiopatía, pancolitis y daño renal agudo.
Indicaciones de biopsia renal en síndrome nefrótico idiopático2,13La biopsia solo será prioritaria en aquellos pacientes que no responden a corticoides o que manifiesten características dentro de su cuadro clínico sugerentes de histología diferente a enfermedad por cambios mínimos:
- a)
Edad menor de un año.
- b)
SN corticorresistente.
- c)
SN asociado a hematuria macroscópica, HTA, falla renal (VFG<90ml/min/1,73m2), hipocomplementemia.
- d)
Disminución de la función renal en niños que reciben terapia con ICN.
La evaluación histológica debe incluir las 3 técnicas, microscopia óptica, inmunofluorescencia y microscopia electrónica.
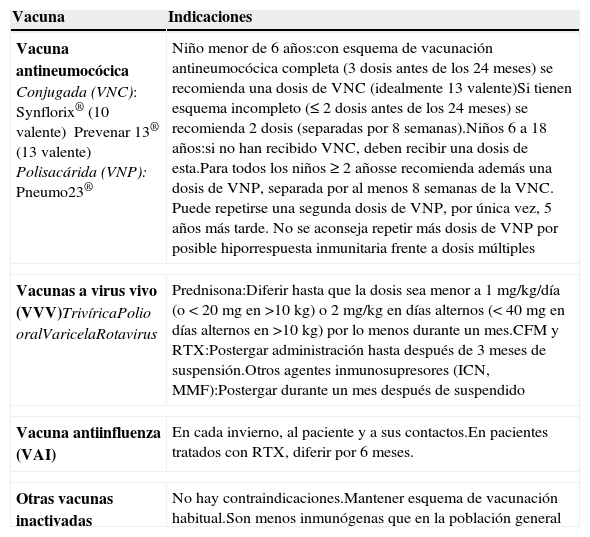
Inmunizaciones2,17,39,40Tanto por su enfermedad de base como por los tratamientos inmunosupresores a los que se ven expuestos, los pacientes con SN tienen un estado de inmunodepresión, por lo cual requieren de ajustes en el esquema de vacunación habitual (PNI), así como también de vacunas complementarias (tabla 2).
Vacunas en síndrome nefrótico
| Vacuna | Indicaciones |
|---|---|
| Vacuna antineumocócicaConjugada (VNC):Synflorix® (10 valente)Prevenar 13® (13 valente)Polisacárida (VNP):Pneumo23® | Niño menor de 6 años:con esquema de vacunación antineumocócica completa (3 dosis antes de los 24 meses) se recomienda una dosis de VNC (idealmente 13 valente)Si tienen esquema incompleto (≤ 2 dosis antes de los 24 meses) se recomienda 2 dosis (separadas por 8 semanas).Niños 6 a 18 años:si no han recibido VNC, deben recibir una dosis de esta.Para todos los niños≥2 añosse recomienda además una dosis de VNP, separada por al menos 8 semanas de la VNC. Puede repetirse una segunda dosis de VNP, por única vez, 5 años más tarde. No se aconseja repetir más dosis de VNP por posible hiporrespuesta inmunitaria frente a dosis múltiples |
| Vacunas a virus vivo (VVV)TrivíricaPolio oralVaricelaRotavirus | Prednisona:Diferir hasta que la dosis sea menor a 1mg/kg/día (o<20mg en >10kg) o 2mg/kg en días alternos (< 40mg en días alternos en >10kg) por lo menos durante un mes.CFM y RTX:Postergar administración hasta después de 3 meses de suspensión.Otros agentes inmunosupresores (ICN, MMF):Postergar durante un mes después de suspendido |
| Vacuna antiinfluenza (VAI) | En cada invierno, al paciente y a sus contactos.En pacientes tratados con RTX, diferir por 6 meses. |
| Otras vacunas inactivadas | No hay contraindicaciones.Mantener esquema de vacunación habitual.Son menos inmunógenas que en la población general |
CFM: ciclofosfamida; ICN: inhibidores de calcineurina; MMF: micofenolato; RTX: rituximab.
Especial énfasis hay que hacer en la vacunación antineumocócica, recomendada a todos los niños con SN, por alto riesgo de infección invasiva por neumococo. Se aconseja preferir esquema mixto, vacuna conjugada-polisacárido, ya que esta última es menos inmunogénica pero contiene más serotipos que la conjugada.
Se debe postergar la administración de vacunas a virus vivos hasta que el paciente esté con una dosis de esteroides≤1mg/kg/d durante más de un mes. No se recomienda la vacuna polio oral, se prefiere vacuna polio inactivada. Los contactos pueden ser vacunados de acuerdo a calendario de vacunación vigente, a excepción de vacuna polio oral. En caso de inmunización a contactos con polio oral, evitar la exposición directa del niño con secreciones gastrointestinales de los contactos vacunados durante 3-6 semanas después de la vacunación. En vacuna de varicela, evitar contacto cercano con paciente si desarrolla lesiones secundarias a la vacuna tabla 3.
Síndrome nefrótico idiopático corticosensible. Resumen de tratamiento
| Clínica | Tratamiento | Duración | Comentarios |
|---|---|---|---|
| SN comienzo | Prednisona vía oral en dosis única matinal: | ||
| 60mg/m2/día o 2mg/kg/día (máximo 60mg) | 6 semanas | ||
| 40mg/m2 o 1,5mg/kg d.a. (máximo 40mg) | 6 semanas | ||
| Disminuir dosis en 10mg/m2 cada 1-4 semanas | Completar 3-6 meses en total | ||
| Recaída | Prednisona vía oral en dosis única matinal: | ||
| 60mg/m2/día o 2mg/kg/día (máximo 60mg) | Hasta proteinuria (–) por 3 días | ||
| 40mg/m2 o 1,5mg/kg d.a. (máximo 40mg) | 4 semanas | ||
| SNRF | Recaídas con prednisona<0,5mg/kg días alternos | Si no se logra remisión con días alternos, volver a dosis diaria en la mínima dosis posible por el mismo periodo | |
| SNCD | Prednisona | ||
| 60mg/m2/día | Hasta proteinuria (–) durante 3 días | ||
| 40mg/m2 d.a | 4 semanas | Frente a infecciones respiratorias u otras, en pacientes que están recibiendo PRD en días alternos, administrar la misma dosis en forma diaria por 7 días | |
| 30mg/m2 d.a. | 2 semanas | ||
| 20mg/m2 d.a. | 2 semanas | ||
| 10mg/m2 d.a. (o 0,5mg/kg d.a.) | 3 a 6 meses | ||
| 5mg/m2 d.a. (o 0,25mg/kg d.a) | Completar 9 a 18 meses | ||
| Recaídas con prednisona>0,5mg/kg días alternos | |||
| 1.- Ciclofosfamida | Controlar perfil hematológico cada 15 días el primer mes y luego una vez al mes | ||
| a) Prednisona oral diaria hasta remisión | |||
| b) Ciclofosfamida oral | |||
| 1-3mg/kg/día (dosis acumulada máxima 168mg/kg) | 8-12 semanas | Suspender transitoriamente con leucocitos < 4000/mm3 y en caso de infección moderada a severa | |
| +prednisona | |||
| 40mg/m2 d.a. | 4 semanas | ||
| 30mg/m2 d.a. | 2 semanas | ||
| 20mg/m2 d.a. | 2 semanas | Efectos adversos: alopecia, cistitis hemorrágica, aumento riesgo de infección, infertilidad | |
| 10mg/m2 d.a (o 0,5mg/kg d.a.) | 2 semanas | ||
| 5mg/m2 d.a. (o 0,25mg/kg d.a.) | 2 semanas | ||
| 2a.- Ciclosporina | |||
| 4-5mg/kg/día (150mg/m2/día) en 2 dosis | 12-24 meses, disminuir progresivamente hasta suspender en 3 a 6 meses | Nivel plasmático aconsejado: | |
| Disminuir los corticoides de manera paulatina | Intentar suspender en 6 meses o mantener la mínima dosis posible (idealmente días alternos) | -Inicial: C0 80-150ng/ml (< 200ng/ml) | |
| -Remisión>6 meses: C0 60-80ng/ml (<100ng/ml) | |||
| Controlar función renal cada 3 meses y perfil lipídico anual | |||
| Efectos adversos: HTA, cosméticos (hipertricosis, hiperplasia gingival), hipercolesterolemia y disfunción renal | |||
| 2b.- Tacrolimus | |||
| 0,1mg/kg/día cada 12 horas | 12-24 meses, disminuir progresivamente hasta suspender en 3 a 6 meses | Preferido especialmente en adolescentes | |
| Disminuir los corticoides de manera paulatina | Intentar suspender en 6 meses o mantener la mínima dosis posible (idealmente días alternos) | Niveles plasmáticos basales C0 5-8ng/ml | |
| Efectos adversos: HTA, nefrotoxicidad, hiperglucemia, y rara vez neurotoxicidad (cefalea, convulsiones) | |||
| 3.- Micofenolato mofetil | |||
| 800-1200mg/m2/día o 30mg/kg/día en 2 dosis | 12-24 meses, disminuir progresivamente hasta suspender en 3 a 6 meses | Efectos adversos: depresión medular (controlar perfil hematológico mensual al principio y luego cada 3 meses: si leucocitos < 4000, suspender transitoriamente), diarrea y meteorismo (mejoran al fraccionar la dosis cada 8 horas) | |
| Disminuir los corticoides de manera paulatina | Intentar suspender en 6 meses o mantener la mínima dosis posible (idealmente días alternos) |
C0: hora cero, nivel pre-dosis; d.a.: día alterno; PRD: prednisona; SNCD: síndrome nefrótico córtico dependiente; SNRF: síndrome nefrótico recaedor frecuente.
Los pacientes deben ser inmunizados anualmente con vacuna antiinfluenza, independiente del estado de inmunosupresión.
Insuficiencia suprarrenalPacientes que reciben cursos prolongados de corticoides tienen riesgo de supresión de glándula suprarrenal por lo que su disminución deberá ser gradual (no mayor a 20-25% de la dosis cada 1-4 semanas). Al llegar a una dosis de PRD de 5-7,5mg/m2 en días alternos (equivalente a 10-15mg/m2/d de cortisol, dosis de sustitución fisiológica), se sugiere medición de cortisol basal (tomar el día en que le toca recibir la PRD, antes de esta), para suspender esteroides con valores≥10 ug/dl. En caso de cirugía, anestesia o infecciones graves se deberá suplementar con corticoides parenterales en dosis de 2-4mg/kg/d de hidrocortisona y luego 0,3 a 1mg/kg/d de prednisona oral mientras dure el estrés y luego suspender rápidamente13,41.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.