Los procesos destructivos del periodonto apical están en su mayoría mediados por proteasas específicas. Existe evidencia de que los niveles de metaloproteinasa de matriz extracelular-9 (MMP-9) en el fluido crevicular gingival (FCG) podrían reflejar la presencia de periodontitis apical asintomática (PAA). El objetivo de este estudio fue evaluar la actividad de MMP-9 durante la respuesta reparativa periapical en controles postendodóncicos entre una semana y 6 meses y en controles sanos.
Materiales y métodosEn este estudio prospectivo se incluyeron 28 pacientes con periodontitis apical asintomática, y se tomaron muestras de FCG a partir de dientes con PAA en línea base y controles postendodóncicos de una semana, uno, 3 y 6 meses. Adicionalmente se incluyeron controles contralaterales sanos. Las muestras se eluyeron y analizaron mediante gelatinogramas y densitometría.
ResultadosEn pacientes con periodontitis apical asintomática se identificaron tanto la proforma como la forma activa de la MMP-9. Estas presentaron aumentos significativos en controles postendodóncicos de 3 y 6 meses con signos de reparación periapical.
ConclusionesLos niveles de MMP-9 aumentaron significativamente en dientes con diagnóstico de PAA durante la fase reparativa. Estos resultados sugieren que MMP-9 también cumpliría un papel fisiológico durante la reparación periapical, que es susceptible de ser evaluado a través del análisis del FCG.
Apical destructive periodontal processes are largely mediated by specific proteases. Evidence supports that the levels of extracellular matrix metalloproteinase-9 (MMP-9) could reflect the presence of asymptomatic apical periodontitis (AAP) in gingival crevicular fluid (GCF). The aim of this study was to evaluate the activity of MMP-9 during reparative response in periapical post endodontic controls between 1 week and 6 months later and in healthy controls.
Materials and methodsA prospective study was performed on 28 patients with a diagnosis of AAP. GCF samples were taken from AAP teeth at baseline and post-endodontic controls at 1 week, 1, 3 and 6 months. Additional healthy contralateral controls were obtained, and samples were eluted and analyzed by densitometric scanning and gelatin zymography.
ResultsIn patients with asymptomatic apical periodontitis, both the pro form and the active form of MMP-9 were identified. These showed significant increases in post-endodontic controls at three and six months, with signs of periapical repairing.
ConclusionsMMP-9 levels significantly increased in teeth diagnosed with AAP during the reparative phase. These results suggest that MMP-9 might be involved in the healing of apical tissues that might be reflected in GCF.
La periodontitis apical asintomática (PAA) se define como la inflamación y destrucción del periodonto apical, que tiene su procedencia en el tejido pulpar necrótico1. La PAA se encuentra asociada con un área radiolúcida periapical detectada radiográficamente y ausencia de sintomatología clínica. Esta se caracteriza por la formación de una lesión osteolítica perirradicular que histológicamente puede corresponder a un granuloma periapical (GPA) o quiste radicular inflamatorio (QRI). El GPA puede progresar eventualmente hacia el desarrollo de un QRI, como resultado de la proliferación de los restos epiteliales de Malassez frente al estímulo inflamatorio crónico1.
El inicio de esta enfermedad se ve reflejado por una inflamación aguda del ligamento periodontal apical y del hueso circundante, causada por productos bacterianos que invaden los tejidos periapicales desde el canal radicular2,3. Luego los agentes causales, que usualmente son bacterias, sus antígenos y toxinas, pueden sobrepasar la capacidad resolutiva de los mecanismos de defensa del organismo y la lesión progresará hacia la cronicidad2.
El diagnóstico y estudio de las lesiones periapicales principalmente se realiza mediante biopsia y estudio anatomopatológico en dientes extraídos, o mediante el análisis de muestras del exudado periapical tomadas a través del canal radicular4.
Ambos métodos son invasivos, y no permiten el seguimiento de la lesión. Por esta razón el fluido crevicular gingival (FCG), que es un extravasado plasmático obtenido de forma no invasiva desde el surco gingivo-dentario, podría representar una alternativa para el estudio de este tipo de lesiones5. El FCG está constituido por moléculas derivadas del suero, células del periodonto, leucocitos y productos bacterianos provenientes del biofilm subgingival. En condiciones inflamatorias este fluido contiene componentes derivados de los procesos de destrucción de la matriz extracelular de los tejidos periodontales, y además representa una fuente importante de moléculas asociadas con el catabolismo de los tejidos perirradiculares y, en particular, con el tejido óseo6-8.
A nivel óseo la degradación de colágeno es uno de los eventos principales donde los osteoclastos participan activamente en el sitio de reabsorción, producto principalmente de la actividad de metaloproteinasas de matriz extracelular (MMP). Los productos resultantes de la proteólisis del colágeno intersticial realizada por la MMP-13 u otras colagenasas se desnaturalizan y se transforman en gelatina, la cual es susceptible a la acción de las MMP-2 y 99,10. Más aún, la presencia de proformas y formas activas de MMP-9 se ha demostrado en lesiones periapicales de origen endodóncico (LPOE) y FCG5,11. La MMP-9 es capaz de degradar sustratos tales como laminina, elastina, fibronectina, colágeno tipo iv y colágeno tipo vii12-14. Adicionalmente, existe una interconexión en la activación de la cascada proteolítica entre las MMP, lo que podría perpetuar la destrucción ósea perirradicular15. En estudios previos se determinó que existen niveles aumentados de MMP-9 en lesiones extraídas de dientes con periodontitis apical en relación con dientes sanos16,17. Por otra parte, MMP-9 cumpliría un papel fisiológico reclutando células pro-osteolíticas facilitando la remodelación del tejido óseo perirradicular18,19.
Debido al rol que posee la MMP-9 en el proceso de destrucción y progresión de las LPOE9, se estima que la presencia de MMP-9 en el FCG podría representar un método sencillo de monitorización de los estados de salud o enfermedad de los tejidos perirradiculares5. Por lo anteriormente señalado se propone que la actividad de la MMP-9 presenta variaciones durante la fase reparativa de dientes con PAA. El objetivo de este estudio fue evaluar la actividad de MMP-9 durante la respuesta reparativa periapical en controles postendodóncicos de una semana, un mes, 3 meses y 6 meses y en controles sanos.
MetodologíaSelección de pacientesSe incluyeron 28 pacientes que acudieron a la clínica de endodoncia de la Facultad de Odontología de la Universidad de Chile entre los años 2009 y 2011 con diagnóstico de PAA, de acuerdo con los siguientes criterios12: dientes que no respondieran a los test de diagnóstico pulpar (frío probado con cloruro de etilo, calor probado con transpoliisopreno), dientes con respuesta normal o levemente aumentada a la percusión, presencia de destrucción ósea apical ≥3mm en relación con el diente en cuestión observada al examen radiográfico (imagen radiográfica compatible con GPA o QRI). Se excluyeron del presente estudio individuos que presentaran tratamientos con antibioterapia, corticoides o antiinflamatorios en los últimos 6 meses, enfermedades sistémicas, embarazo, traumatismo oclusal, enfermedades periodontales marginales, tales como gingivitis, periodontitis crónica y periodontitis agresiva (definidas por la presencia de pérdida de inserción clínica>1mm, aumento de profundidad al sondaje>3mm, sangrado al sondaje en más del 10% de los sitios analizados en el examen y presencia de placa bacteriana en más del 20% de los sitios analizados).
Recolección de muestra de fluido crevicular gingivalPara la obtención de FGC los dientes con PAA y controles contralaterales sanos se aislaron con tórulas de algodón, se secaron suavemente y posteriormente se introdujeron tiras de papel absorbente (periopaper™, ProFlow, Amityville, NY, EE. UU.) en el surco gingivo-dentario hasta ejercer una leve resistencia contra el tejido, por un período estandarizado de 30seg. Se repitió lo anterior en 6 sitios: mesiovestibular, vestibular, distovestibular, mesiopalatino/lingual, palatino/lingual, distopalatino/lingual. Se obtuvieron muestras de dientes sanos y diente con PAA en la línea base y postratamiento endodóncico tras una semana, un mes, 3 meses y 6 meses. Se excluyeron aquellas tiras que se contaminaron con saliva o sangre. Luego fueron almacenadas en un tubo Eppendorf a –80°C. El FGC fue eluido utilizando 40μl de amortiguador de elución Tritón X-100 al 0,01%, con un cóctel inhibidor de proteasas libre de EDTA (Roche, Basel, Suiza). Luego se vortexeó 30segy se dejó 30min a 4°C. Se centrifugó a 12.000rpm durante 5 minutos a 4°C, y se recuperó el sobrenadante. El procedimiento de elución se realizó 2 veces, hasta un volumen final de 80μl/tira, y luego las muestras fueron almacenadas a –80°C hasta su posterior análisis.
GelatinogramaAlícuotas de las eluciones de FCG (2μl) se cargaron en geles SDS-PAGE al 10% con 1mg/ml de gelatina como sustrato; se lavaron 2 veces en Tritón X-100 2,5% durante 15min, e incubaron en un tampón Tritón X-100 al 0,01% durante 17h a 37°C. Para visualizar las bandas correspondientes a la MMP-9 los geles se tiñeron con azul brillante de Coomassie R-250 y destiñeron con solución de ácido acético al 10%. La actividad gelatinolítica correspondiente se detectó como bandas semitransparentes sobre un fondo azul. Se realizaron densitometrías de las bandas obtenidas mediante el software GEL LOGIC™ (GEL LOGIC™, Carestream Health Incorporated, Rochester NY, EE.UU.). Los resultados se expresaron en unidades arbitrarias de densitometría.
Análisis estadísticoPara realizar la prueba de normalidad se realizó el test de Shapiro-Wilk. Las comparaciones entre los dientes enfermos en la línea base y los dientes sanos se analizaron mediante test de Mann Whitney. La comparación entre los dientes enfermos en línea base y dientes tratados después de una semana, un mes, 3 meses y 6 meses se analizó con el test de Wilcoxon. Para la determinación de los parámetros clínicos y demográficos y la medición de MMP-9 se utilizó el test de Mann Whitney correlación de Spearman. La significación se estableció si p<0,05.
ResultadosLas características de los pacientes con PAA se presentan en la tabla 1. Luego de 6 meses de tratamiento todos los dientes demostraron signos de reparación periapical sobre la base de sus parámetros clínicos y radiográficos. Todos los dientes tratados se encontraron clínicamente asintomáticos y no se identificó lesión radiográfica, excepto en 2 dientes en donde el tamaño de la lesión se redujo considerablemente.
Las características generales de los 28 sujetos de estudio se presentan en la tabla 1.
Mediante análisis zimográfico de FCG se identificaron la proforma y forma activa de la MMP-9. Ocasionalmente se identificó la proforma de la MMP-2 como una banda de tenue intensidad, mientras que su forma activa no se identificó en las muestras analizadas (fig. 1).
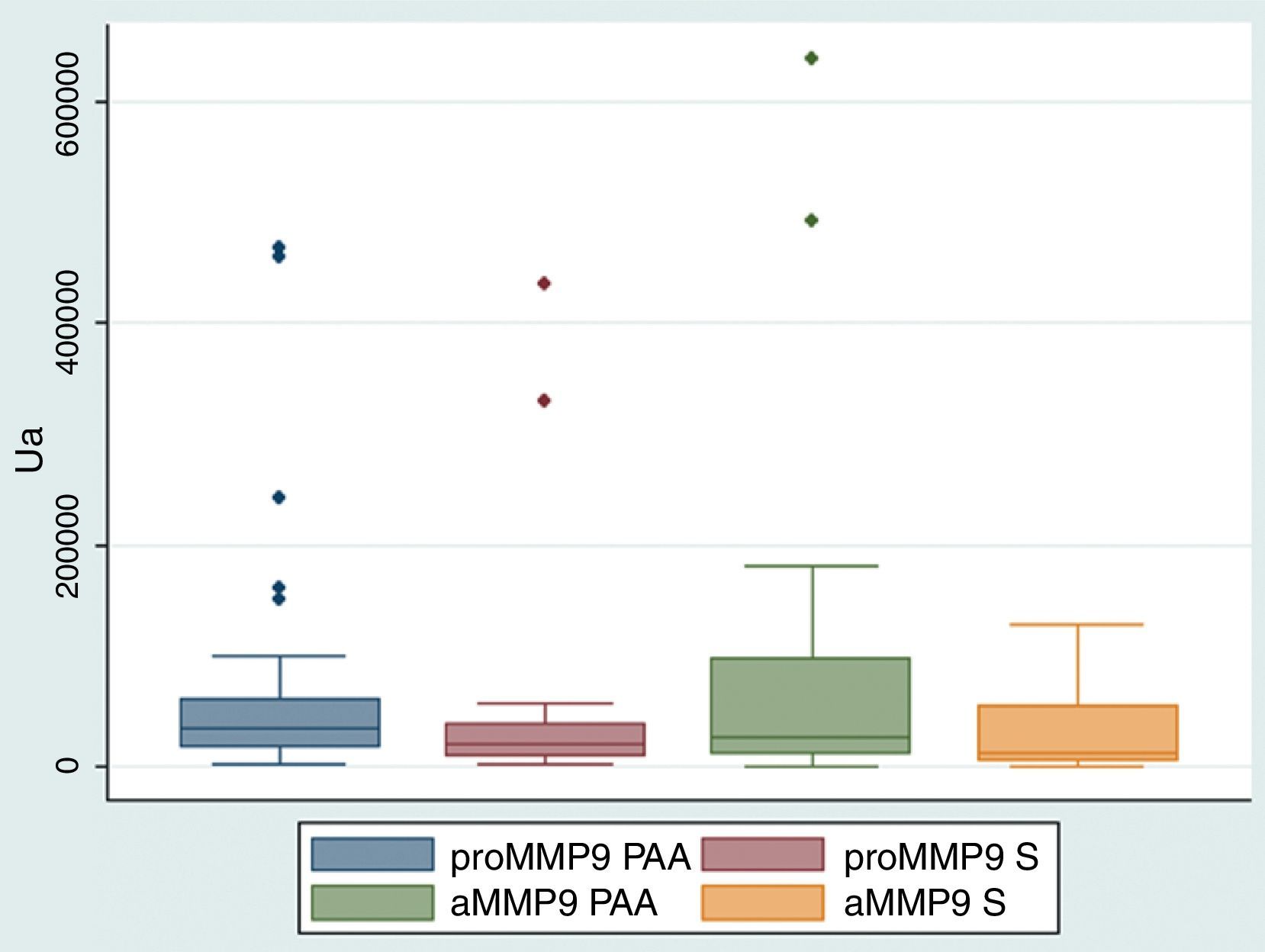
Con respecto a los niveles de MMP-9 no se observaron diferencias estadísticamente significativas en los niveles de proMMP-9 o su forma activa entre dientes con PAA y controles contralaterales; sin embargo, en PAA los niveles de proMMP-9 y MMP-9 activa mostraron una tendencia a ser mayores (p>0,05; fig. 2).
El análisis de FCG de los niveles de proMMP-9 postratamiento versus la línea base demostró aumentos significativos al mes, 3 y 6 meses, mientras que la MMP-9 activa aumentó significativamente respecto de la línea base a los 3 y 6 meses (p<0,05; figs. 3 A y B, respectivamente).
A y B. Niveles de MMP-9 en FCG de sujetos con periodontitis apical asintomática.
aMMP-9: forma activa de metaloproteinasa de matriz extracelular-9, n=28; BL: línea base; PAA 1M, 3M y 6M: uno, 3 y 6 meses postratamiento endodóncico respectivamente; PAA 1S: una semana postratamiento endodóncico; proMMP-9: proforma de metaloproteinasa de matriz extracelular-9.
*p<0,05.
Adicionalmente, se evaluaron las posibles asociaciones entre los niveles de MMP-9 del FCG, el tamaño radiográfico de la lesión periapical, la edad, el sexo y el tabaquismo, sin embargo no se encontró asociación entre estas variables (p>0,05).
DiscusiónLa PAA es una enfermedad de alta prevalencia20,21 que se produce frente a la invasión bacteriana del sistema de canales radiculares2. Sin el tratamiento adecuado la PAA puede llevar a la pérdida dentaria, e incluso a complicaciones perimaxilares y sistémicas2.
Dentro de las MMP la MMP-9 cumple con un rol primordial en la PAA. La actividad de las MMP-9 permite la remoción de la matriz ósea orgánica para que el osteoclasto reabsorba el tejido óseo, tanto durante los procesos osteo-destructivos como durante la reparación y remodelación19, particularmente la gelatina, que corresponde a colágeno desnaturalizado22. En el presente estudio se identificaron tanto la proforma como la forma activa de MMP-9 en el FCG de dientes con PAA y sanos, y se determinaron aumentos significativos de la MMP-9 durante el proceso de reparación periapical tras el tratamiento endodóncico.
A pesar de que no existió una diferencia estadísticamente significativa, los niveles, tanto de la proforma como la forma activa de la MMP-9, tendieron a ser mayores en sujetos con PAA en relación con dientes sanos. La presencia y niveles elevados de MMP-9 se han reportado previamente, tanto en lesiones periapicales23 como FGC de dientes con PAA en relación con controles. Además, en lesiones periapicales sintomáticas existiría un aumento en la expresión y actividad de la MMP-95,24. Estudios desarrollados en periodontitis apical experimental han demostrado que MMP-2 y 9 se inmunolocalizan en lesiones perirradiculares durante su desarrollo24, proponiendo que estas MMP desempeñarían un rol crítico en el desarrollo inflamatorio de este tipo de lesiones16, probablemente durante la fase inicial de la degradación de la matriz extracelular. Adicionalmente, la expresión aumentada de MMP-9 participaría del desarrollo de las lesiones periapicales en una fase más tardía16,17. Por otro lado, un estudio reciente determinó que ratones nulos para MMP-9 desarrollaban lesiones de mayor tamaño y respuestas inflamatorias más exacerbadas en comparación con ratones silvestres25. En conjunto, los antecedentes sugieren que MMP-9 en niveles fisiológicos presentaría un rol protector de los tejidos periapicales a través de su participación en la homeostasis ósea, mientras que la actividad patológicamente elevada de la MMP-9 estaría asociada con la destrucción de los tejidos perirradiculares.
En el presente estudio, luego de realizar el tratamiento endodóncico en dientes con PAA se identificó una tendencia al aumento en la proforma de la MMP-9, así como también un aumento significativo de la forma activa de la MMP-9 tras un mes de haber realizado el tratamiento endodóncico. Estas diferencias se acentuaron y presentaron significación estadística para ambas formas enzimáticas de la MMP-9 tras 3 y 6 meses. Estos resultados demuestran que las formas activas y proformas de la MMP-9 no solo se asociarían con el desarrollo de las lesiones apicales, como proponen estudios previos16,23, sino que también estarían involucradas en los procesos reparativos periapicales18,26.
En síntesis, el presente estudio demuestra que la actividad de la MMP-9 aumenta significativamente en FCG durante la fase reparativa posterior al tratamiento endodóncico. Estos resultados sugieren que la MMP-9 no solo participaría de la destrucción de los tejidos perirradiculares, sino que también cumpliría un papel fisiológico durante la reparación.
ConclusionesLos niveles de proMMP-9 aumentaron significativamente tras un mes, 3 y 6 meses de haber realizado el tratamiento endodóncico, mientras que MMP-9 activa aumentó significativamente 3 y 6 meses postratamiento. Estos resultados sugieren que MMP-9 también cumpliría un papel fisiológico durante la reparación periapical, que es susceptible de ser evaluado a través del análisis del FCG.
FinanciaciónEste trabajo fue financiado por el proyecto FONDECYT 1120138.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosLos autores agradecen a FONDECYT por su apoyo en el trabajo de investigación y divulgación.