Las alteraciones del equilibrio ácido-base se pueden presentar en pacientes de forma primaria o secundaria a un proceso patológico como la diabetes mellitus o la falla renal entre otros. El objetivo de este artículo es explicar y orientar la correlación clínica del paciente con los parámetros de los gases arteriales de manera sencilla y precisa, para realizar un diagnóstico de las alteraciones del equilibrio ácido-base correcto, que permita efectuar intervenciones terapéuticas adecuadas y oportunas. Se realizó una revisión no sistemática de la literatura científica en la cual se consultaron las siguientes bases de datos: PubMed, ScienceDirect, Scopus y OvidSP en busca de artículos relevantes. Se concluyó que el exceso o déficit de base es una herramienta útil de los gases arteriales, que aunada a la historia clínica, el pH y la presión parcial de CO2 estima de forma muy precisa el componente metabólico del equilibrio ácido-base.
Acid-base balance disorders can be found in a primary or secondary form in patients with a disease process such as Diabetes Mellitus or acute renal failure, among others. The objective of this article is to explain and guide the correlationship between the clinical findings in the patient and the parameters of arterial blood gases in a simple and precise manner, in order to make the correct acid-base balance diagnosis and adequate therapeutic interventions. A non-systematic review of the scientific literature was conducted through a search in the PubMed, Science Direct, Scopus, and OvidSP databases. The conclusion was that base excess or deficit in arterial blood gases is a useful tool which along with the clinical history, pH, and partial pressure of CO2, provides an accurate estimate of the metabolic component of the acid-base balance.
Con el paso del tiempo investigadores como Henderson, Hasselbalch, Stewart, Siggaard y Andersen entre otros, han aportado fundamentos para el entendimiento del equilibrio ácido-base y aún continúan las discusiones sobre cuál debe ser el enfoque en la práctica clínica; una aproximación simple, fácilmente reproducible o una compleja con múltiples parámetros de laboratorio. Debido a que el enfoque clínico para abordar al paciente finalmente termina teniendo implicaciones diagnósticas, pronósticas y terapéuticas, es imperativo ser precisos y rápidos en el proceso1–7.
MetodologíaSe realizó una revisión no sistemática de la literatura en bases de datos como PubMed, ScienceDirect, Scopus y OvidSP. En la búsqueda avanzada se utilizaron los términos MESH: Acid-Base, Equilibrium OR Acid-Base imbalance OR Acidosis OR Alkalosis OR Hydrogen-Ion Concentration, incluidos en el título, el resumen o las palabras claves, y se limitó a artículos a partir del año 2002.
Posteriormente se procedió a seleccionar artículos de acuerdo al título y resumen de manera que se clasificaron por temáticas consideradas relevantes por los autores para su posterior revisión minuciosa como historia, fisiología, fisiopatología, consecuencias, divergencias, enfoque clínico (según diferentes autores), diagnóstico, pronóstico y manejo.
Fisiología en el enfoque tradicional —Henderson y HasselbalchEl ion hidrógeno libre (H+) en sangre arterial se encuentra a una concentración entre 35 y 45nmoles/L lo que equivale a mantener un pH entre 7,45 y 7,35; el pH es definido como el logaritmo negativo (en base 10) de la concentración sanguínea de estos8–10. La concentración de iones hidrógeno (H+) es uno de los parámetros más importantes de equilibrio acido-base, y esta depende de las interacciones entre la presión arterial de dióxido de carbono (PaCO2), la concentración plasmática del ion bicarbonato (HCO3−), la disociación constante del ácido carbónico y la solubilidad del dióxido de carbono como lo determinó la ecuación de Henderson y Hasselbalch. El dióxido de carbono (CO2) se combina de manera reversible con el agua para formar ácido carbónico, posteriormente este se disocia en HCO3−+H+ (CO2+H2O↔H2CO3↔H++HCO3−). Esta reacción es catalizada por la enzima anhidrasa carbónica presente en los eritrocitos, las nefronas, el intestino, el páncreas, el músculo estriado y el endotelio de los capilares pulmonares7,8,10,11.
Mecanismos compensadoresPara mantener el equilibrio ácido-base en el fluido extracelular, la compensación de los cambios es realizada por:
- 1)
El sistema respiratorio elimina o retiene CO2 a través de cambios en ventilación alveolar (hiperventilando o hipoventilando respectivamente en respuesta a cambios censados por quimiorreceptores), generando cambios en la PaCO2, gas que debido al bajo peso molecular y alta solubilidad pasa fácilmente entre las diferentes membranas y compartimientos biológicos de manera que altera la [H+]4–6,9,12–16.
- 2)
El sistema renal por medio del túbulo proximal aumenta o disminuye la secreción de H+ (ácido) y reabsorbe cerca del 80% del HCO3− filtrado, el 16% se reabsorbe en el segmento ascendente grueso y en el túbulo contorneado distal, mientras otro 4% se reabsorbe en el túbulo colector; pero además produce nuevo bicarbonato por 2 mecanismos: 1) A partir de glutamina (2/1) en el túbulo proximal, por deaminación, resultando alfa-cetoglutarato que es metabolizado con CO2 y H2O para formar HCO3− mientras el amonio (NH4+) se disocia en amoniaco (NH3) para ser transportado a la luz tubular. 2) A partir de fosfatos en forma de sales neutras que se filtran por el glomérulo uniéndose a los H+ de la luz y generando HCO3− en las células del túbulo proximal, distal y ducto colector en relación 1 a 1, aunque representan apenas una pequeña fracción (acidez titulable). El bicarbonato se constituye entonces como el factor principal del control metabólico (no respiratorio) del equilibrio ácido-base4–6,9,12–16.
Los cambios agudos en el pH sanguíneo inducen efectos regulatorios en la estructura y función de las proteínas y enzimas, lo que a su vez genera cambios en las funciones celulares tales como la glucólisis, la gluconeogénesis, la mitosis, la síntesis de ADN, entre otras12,13. Por lo anterior es fundamental entender la concurrencia de los elementos que gobiernan el mantenimiento del pH dentro de los límites fisiológicos, tales como: HCO3−, H+, fosfatos, albúmina, Na+, K+, Cl−, lactato, uratos, cetoácidos entre otros; y permitiendo que se conserven, en lo que respecta a equilibrio ácido-base, las complejas y eficientes funciones celulares12–14,17.
Enfoque de StewartA finales de 1970 y principios de 1980, Peter Stewart, un fisiólogo canadiense propuso otro enfoque para la fisiología y las alteraciones en el equilibrio ácido-base a partir de un modelo matemático que consideraba los fluidos corporales como un sistema fisicoquímico, que seguía 3 principios fundamentales: 1) Conservación de la carga eléctrica; 2) Conservación de la masa; y 3) La ley de acción de masas. El enfoque a partir de la ecuación de Henderson-Hasselbalch no considera todos los factores que influyen en la [H+] y por consiguiente no explica las complejas anormalidades metabólicas del equilibrio ácido–base13,14,18,19; de manera que el HCO3− se replantea como una variable dependiente, estableciendo que los cambios en la [H+] y por ende del pH solo podían darse modificando 3 variables: 1) La PaCO2; 2) La concentración total de ácidos débiles no volátiles ([ATOT]); y 3) La diferencia entre iones fuertes (SID)1,2,7,13,14,18,19.
La PaCO2 es definida como la presión ejercida por el CO2 en sangre arterial dentro de la mezcla de gases (independiente de cada gas) con implicaciones fisiológicas ya mencionadas. La [ATOT] corresponde a la albumina, los fosfatos inorgánicos y al HCO3− (iones débiles), que están parcialmente disociados en el tampón sanguíneo1,2,7,13,14,18,19. La SID es la diferencia entre la suma de las concentraciones de las cargas positivas fuertes (cationes) y las concentraciones de las cargas negativas fuertes (aniones) del plasma, siendo los más importantes el sodio, el potasio, el calcio, el magnesio, el cloro y el lactato, que están totalmente disociados y no participan en reacciones de transferencia de protones. Normalmente en plasma hay un exceso de cationes, por lo que la SID es un valor positivo, generalmente entre 40 y 48mEq/L (cargas e iones presentes). Un aumento de SID corresponde a un incremento del pH (alcalosis) y una disminución de la SID corresponde a un descenso del pH (acidosis)2,14,20.
Para determinar el componente metabólico del equilibrio ácido-base con el modelo de Stewart, debemos tener en cuenta el cálculo del gap de iones fuertes (SIG) y para ello se debe calcular primero la SID aparente (SIDa) y la SID efectiva (SIDe). La SIDa está dada por la fórmula SIDa= ([Na+]+[K+]+[Mg2o+]+[Ca2+])−([Cl−]+[lactato−]), en la cual no se tiene en cuenta el aporte de los ácidos débiles; mientras la SIDe viene dada por la fórmula SIDe= [(2,46×10−8)×(PCO2/10−pH)]+[[albúmina]g/L×0,123×(pH−0,631)]+[[fosfatos]mmol/L×0,309×(pH−0,469)], en la que se incluyen además los ácidos débiles. Entonces, para el cálculo del SIG se realiza la diferencia entre SIDa y SIDe (SIG=SIDa−SIDe), e indica la presencia de otros aniones débiles no medidos como: los cetoácidos, los sulfatos, los uratos, el citrato, el piruvato, el acetato y el gluconato2,3,13,15,21–26.
El SIG es igual a cero cuando a la [Cl−] y a la [lactato−] solo se les suman los tampones plasmáticos (bicarbonato, albúmina y fosfatos); en otros términos SIG=0, si SIDa=[HCO3−]+[albúmina−]+[HPO32−]2,3,13,21–25.
Enfoque de Siggaard-AndersenEn 1960 Siggaard-Andersen implementaron un método que utilizaba la sangre capilar para determinar el equilibrio ácido-base basados en la ecuación de van Slyke. En este se destaca el uso del exceso o déficit de base (BE), que representa el número de miliequivalentes adicionales de ácido o base que se deben agregar a un litro de sangre para normalizar el pH a una temperatura de 37°C y para su cálculo se tiene en cuenta la PaCO2 y el pH (medidos). Esta variable se divide en BE y BE estándar (SBE), cuya diferencia radica en que la máquina de gases calcula esta última, estimando una concentración de hemoglobina de 5g/dl en el líquido extracelular6,24,27–33.
El SBE tiene una relación directa con los cambios en la SID y la concentración total de ácidos débiles, es decir, un déficit de base (SBE negativo) corresponde a una SID positiva y representa la presencia de aniones no medidos (p. ej., Lactato), mientras un SBE positiva corresponde a una SID negativa. Por lo tanto representa una medida confiable del componente metabólico y es una herramienta clínica práctica6,24,27–33.
ConsideracionesDerksen et al.19 mostraron que el enfoque hecho por Henderson-Hasselbalch puede ser considerado una versión simplificada del modelo general de Stewart, y que no son completamente diferentes (aunque este último implemente más variables) debido a que la interpretación clínica finalmente va a ser la misma. Considerando el soporte teórico del modelo de Stewart y comparándolo con el razonamiento tradicional, este brinda un mejor entendimiento del mecanismo fisiopatológico de base, pero no muestra diferencias en el diagnóstico de trastornos del equilibrio ácido-base, ni en el manejo terapéutico inicial19,34–38.
Con respecto a las implicaciones pronósticas todavía no hay consenso, pues el aumento en la SID se ha correlacionado, en algunos grupos, con resultados desfavorables19,39, el déficit de base y el lactato se han posicionado como factores independientes de mortalidad en pacientes con trauma y cirugía cardiovascular39,40; mientras Kurtz et al.2 concluyeron que ambos enfoques son intercambiables cuantitativamente y no brindan ventajas diagnósticas, ni pronósticas2,20.
Aplicación clínica: paso a paso para el diagnóstico de alteraciones del equilibrio ácido-baseLas alteraciones del equilibrio ácido-base pueden ser primarias, pero lo más frecuente es que sean secundarias a enfermedades como la diabetes mellitus, falla renal, convulsiones, sepsis, gastroenteritis, fistulas, pancreáticas, obstrucción intestinal, o el uso de medicamentos como la isoniazida, furosemida o el linezolide. Igualmente, durante el curso de una enfermedad con alteraciones del equilibrio ácido-base se pueden llegar a alterar otros sistemas, como el inmune, con alteraciones en los mediadores de inflamación o el óseo, con alteraciones en la resorción y la formación ósea; sin embargo, los mecanismos fisiopatológicos no están bien dilucidados5,41,42.
Para hacer la aproximación diagnóstica de los trastornos del equilibrio ácido-base, es imprescindible relacionar la historia clínica (vómitos, diarrea, edema, disnea, trauma, si ha recibido transfusiones, o toma de fármacos) y el examen físico (signos de deshidratación o edema, polipnea, tetania, coma) del paciente con los parámetros de los gases arteriales. Para ello se debe determinar qué componente predomina (respiratorio o metabólico) y analizar la coherencia del mecanismo de compensación, teniendo siempre presente que hay compensaciones fisiológicas exageradas que llevan a trastornos mixtos o combinados del equilibrio acido-base5,26,43–46.
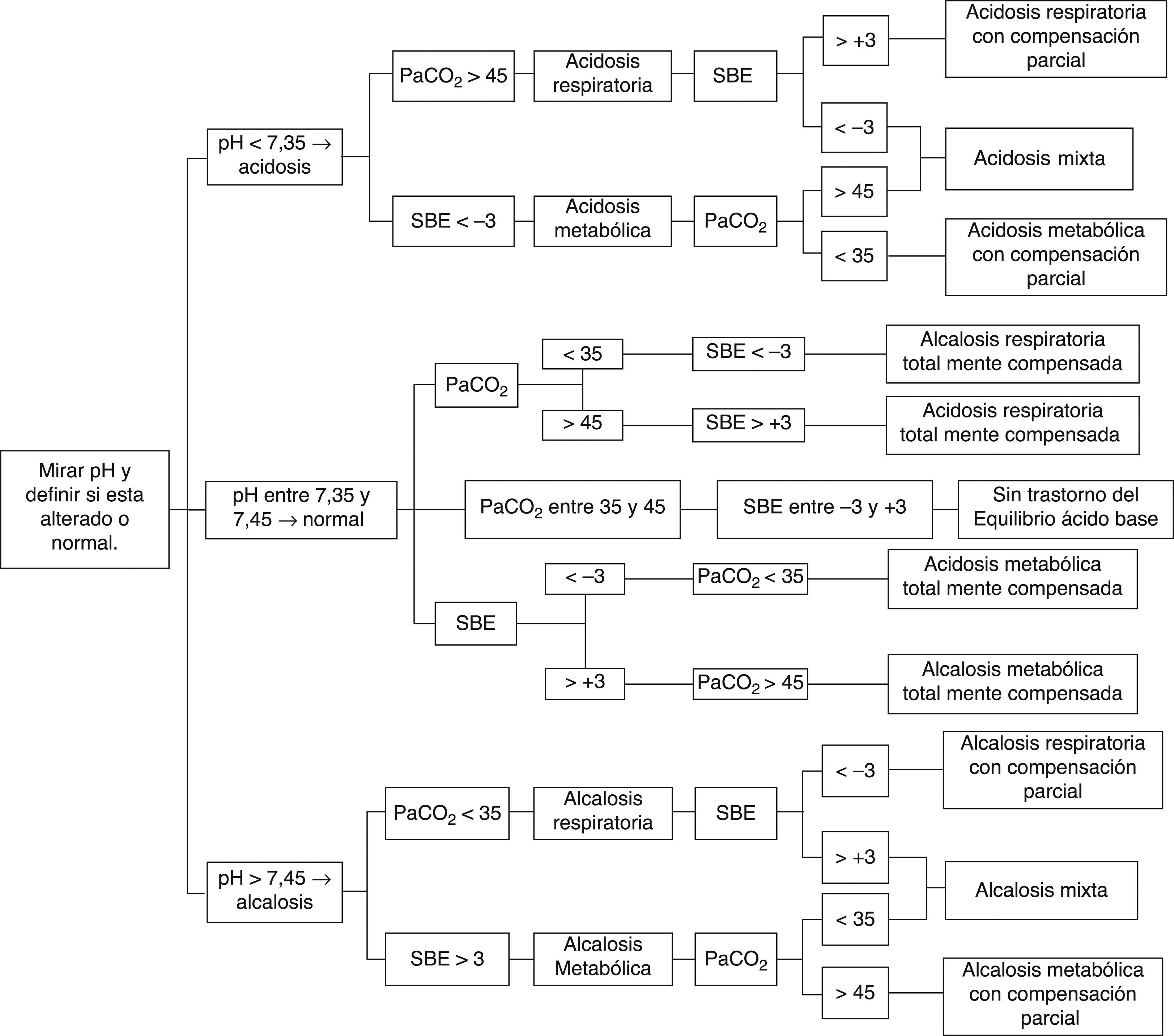
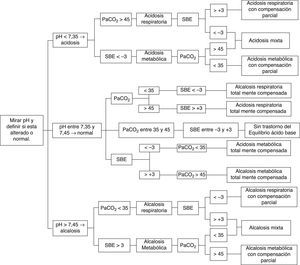
Con el fin de facilitar la interpretación y diagnóstico de las alteraciones del equilibrio ácido base es imperativo un enfoque expedito, sin complejas y múltiples variables, que estime los componentes metabólicos; por ello recomendamos usar el enfoque que implementa el SBE y seguir el algoritmo propuesto en la figura 1, con el siguiente orden de análisis:
- 1.
Paciente: conocer y analizar el contexto clínico del paciente.
- 2.
Alteración primaria: establecer si el pH sanguíneo indica acidosis (<7,35), alcalosis (>7,45) o si está en el rango de referencia (entre 7,35 y 7,45), donde las posibilidades son una compensación total o que no exista un trastorno del equilibrio ácido-base.
- 3.
Origen de la alteración primaria: de acuerdo al contexto clínico, decidir si se va analizar el componente respiratorio (PaCO2) o metabólico (SBE), para determinar el origen o predominio de la alteración del equilibrio ácido-base:
- •
PaCO2<35mmHg indica alcalosis respiratoria o PaCO2>45mmHg indica acidosis respiratoria (rango de referencia entre 35 y 45mmHg).
- •
SBE<−3mmol/L indica acidosis metabólica o SBE>+3mmol/L indica alcalosis metabólica (rango de referencia entre −3 y +3mmol/L).
- •
- 4.
Coherencia del mecanismo de compensación o trastorno mixto (combinado): una vez se determina el origen de la alteración primaria (respiratoria o metabólica) se verifica si el otro componente intenta compensar o compensa totalmente el pH (p. ej., acidosis respiratoria con alcalosis metabólica); incluso si por el contrario ayuda a perpetuar el trastorno (p. ej., acidosis metabólica con acidosis respiratoria)5,6,26,29,32,43–45,47–50.
Paso a paso para el diagnóstico de alteraciones del equilibrio ácido-base 5,6,26,29,32,43–45,47–50.
Siguiendo el algoritmo diagnóstico para las alteraciones del equilibrio ácido-base propuesto en la figura 1, se analizarán los siguientes casos:
Caso 1: paciente de 35 años con antecedente de alcoholismo fue encontrado inconsciente en su apartamento por un vecino. Es llevado al servicio de urgencias al cual ingresa con presión arterial de 100/60mmHg, frecuencia cardiaca 124lpm, afebril, respuesta leve a estímulo doloroso. Se le toman gases arteriales de ingreso, que arrojan los siguientes resultados: pH 6,92; PaCO2 80mmHg y SBE −14,2mmol/L.
Según el algoritmo planteado se debe iniciar por definir con el pH (acidosis o alcalosis o normal); en este caso es<7,35 lo que corresponda a acidosis. Continuamos con el componente metabólico dado por el BE (<−3mmol/L) y hay una acidosis metabólica. Finalmente analizamos PaCO2 (>45mmHg), lo que nos lleva inesperadamente al diagnóstico inicial de acidosis respiratoria; es decir, no hay compensación respiratoria. Recopilando los análisis podemos concluir que el diagnóstico es una acidosis mixta51.
Caso 2: paciente de 72 años de edad, que ingresa al servicio de urgencias con síntomas de fiebre, dolor en abdomen inferior y disnea. Anuria de 2 días. Antecedente de diabetes mellitus tipo 2 en tratamiento con metformina. Al examen físico se encuentra deshidratada, con taquipnea, frecuencia cardiaca de 120lpm; presión arterial 110/80mmHg, resto del examen sin alteración. Se le toman gases arteriales de ingreso que arrojan los siguientes resultados: pH 6,82; PaCO2 20,2mmHg y SBE −30,2mmol/L.
Observando el pH para este caso, es<7,35 lo que corresponda a acidosis. Analizamos entonces el componente metabólico dado por el BE (<−3mmol/L) y hay una acidosis metabólica. Finalmente analizamos la PaCO2 (<35mmHg), lo que nos lleva al diagnóstico de alcalosis respiratoria. Recopilando los resultados podemos concluir que el diagnóstico es una acidosis metabólica con compensación parcial (los mecanismos fisiológicos no logran llevar el pH al rango de referencia)19.
Caso 3: mujer de 51 años de edad que ingresa al hospital con síntomas de fiebre, disnea y tos. Cinco días atrás fue dada de alta después de presentar gastroenteritis por citomegalovirus. Antecedente de falla renal hipertensiva con trasplante renal hace 15 meses, fue medicada con prednisolona, valganciclovir, metoprolol, acetaminofén, micofenalato de mofetilo y ranitidina. Al examen físico: temperatura de 41¿C, frecuencia cardiaca de 90lpm, presión arterial de 170/80<mmHg, frecuencia respiratoria de 33rpm; y a la auscultación, estertores basales izquierdos. Se le toman gases arteriales que arrojan los siguientes resultados: pH 7,42; PaCO2 19,5mmHg y BE −10,4<mmol/L.
Para este caso, el pH está dentro del valor de referencia7,42; dados los antecedentes de trasplante por falla renal y gastroenteritis, se empieza analizando el componente metabólico con el SBE (−10,4mmol/L) que revela acidosis metabólica. Luego, y esperando una respuesta compensadora, la PaCO2 disminuida (19,5<mmHg) indica alcalosis respiratoria; todo lleva a concluir en el diagnóstico final de una acidosis metabólica totalmente compensada. Es de suma importancia hacer una adecuada correlación clínica al evaluar los parámetros de los gases arteriales, puesto que se podría hacer un diagnóstico erróneo, y en este caso el no hacer dicha correlación llevaría a un diagnóstico de alcalosis respiratoria totalmente compensada19,52.
ConclusionesPara el análisis del equilibrio ácido-base con el modelo de Stewart se incluyen prácticamente todas las variables fisiológicas disponibles en el plasma, pero con dificultades para ser aplicada en la práctica clínica. El enfoque tradicional de Henderson-Hasselbalch puede ser considerado un modelo simplificado y medible fácilmente, sin cambiar el diagnóstico y por ende el manejo del paciente en forma inicial.
Igualmente el BE es un valor calculado por la máquina de gases sanguíneos a partir de valores como pH y PaCO2, siendo los mismos que se emplean en el enfoque tradicional, y que estiman de forma muy precisa el componente metabólico del equilibrio ácido-base calculado por el método de Stewart. Entonces y para efectos prácticos, las siguientes 3 variables: el pH, la PaCO2 y el SBE, pueden lograr un diagnóstico certero del equilibrio ácido-base mediante el algoritmo propuesto (fig. 1) para el desarrollo del diagnóstico de trastornos del equilibrio ácido-base en la práctica clínica.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.