Presentación de un caso clínico y revisión no sistemática de la literatura sobre cardiomiopatía periparto, describir su incidencia, etiología y fisiopatología.
Material y métodosCon autorización del Comité de Ética de nuestra institución, se presenta el caso de una paciente de origen étnico mestizo que durante su puerperio consulta por astenia, adinamia, asimetría en miembros inferiores acompañado de deterioro de clase funcional, su posterior manejo en Unidad de Cuidados Intensivos y desenlace. La búsqueda bibliográfica se realizó en PubMed, Scielo y Bireme.
ResultadosLa cardiomiopatía periparto es una enfermedad con una importante morbimortalidad. Su curso clínico varía entre una mejoría progresiva, falla cardiaca, trasplante o muerte. Encontramos algunos reportes a nivel nacional.
ConclusionesLa cardiomiopatía periparto afecta a una población joven y sana, desde el final del embarazo y hasta cinco meses posparto. Su etiología y patogénesis son desconocidas, las hipótesis propuestas son: la miocarditis viral, una respuesta autoinmune y/o hemodinámica anormal al embarazo, susceptibilidad genética, desnutrición, y la apoptosis.
La recuperación de las fracciones de eyección del ventrículo izquierdo (FEVI) depende de una detección temprana menor a siete días desde el inicio de los síntomas, la FEVI inicial mayor a 30% y diámetro ventricular izquierdo diastólico menor a 60mm. La mortalidad está asociada con la paridad mayor de cuatro, la edad avanzada y origen étnico negro que es 6,4 veces mayor comparados con las caucásicas.
To present a clinical case and to conduct a non-systematic review of the literature on peripartum cardiomyopathy, and to describe its incidence, aetiology and pathophysiology.
Material and methodsWith the authorization of the Ethics Committee of our institution, we present the case of a patient of mestizo ethnic origin who developed asthenia, adynamia, lower limb asymmetrical pain and functional class deterioration during the post-partum period, and her management in the Intensive Care Unit and final outcome. The search of the literature was conducted in PubMed, Scielo and Bireme.
ResultsPeripartum cardiomyopathy is associated with significant morbidity and mortality. The clinical course varies between progressive improvement, heart failure, transplant or death. Some national reports were found.
ConclusionsPeripartum cardiomyopathy affects a young and healthy population during a period of time ranging between the end of pregnancy and five months postpartum. The aetiology and pathogenesis are unknown, but several hypotheses have been proposed: viral myocarditis, autoimmune and/or abnormal haemodynamic response to the pregnancy, genetic susceptibility, malnutrition, and apoptosis.
The prognosis of recovery of LVEF depends on early detection within seven days of the onset of symptoms, an initial LVEF greater than 30%, and a LVDD smaller than 60mm. Mortality is associated with parity greater than four, older age and black ethnic background (6.4 times higher than in Caucasians).
La cardiomiopatía periparto (CMPP) fue descrita en 1880 por Virchow y Porak, al encontrar asociación entre falla cardiaca y puerperio. En 1937, Gouley et al., describen su origen idiopático en mujeres jóvenes y sanas. Su incidencia, etiología y patogénesis son desconocidas. En Colombia existen seis reportes de caso, sin información étnica, la etnia negra es la más afectada a nivel mundial1.
Información de la pacientePresentamos el caso de una paciente de 23 años, ama de casa, natural de Umbita (Boyacá, Colombia), etnia mestiza. Peso 45 kg y talla 1,50 mts. Su único antecedente es una cesárea en su primer embarazo a término por macrosomía fetal sin complicaciones. Perfil ginecoobstétrico: G1P1C1V1A0.
Hallazgos clínicosA los 30 días posparto, el cuadro clínico se caracteriza por astenia, adinamia y dolor abdominal tipo cólico, edema de miembros inferiores, coluria y fiebre no cuantificada. Deterioro de su clase funcional. Al examen físico, se encuentra con hepatomegalia y distensión abdominal marcada que progresa a anasarca en un tiempo no cuantificado.
Evaluación diagnósticaEn el sitio primario de atención, con un parcial de orina sugestivo de infección se inició piperacilina/tazobactam. Posteriormente con vancomicina por pobre respuesta. Luego presenta dolor en miembro inferior izquierdo con asimetría encontrándose trombosis venosa profunda (TVP) superficial izquierda por doppler venoso y al cabo de 15 días es remitida.
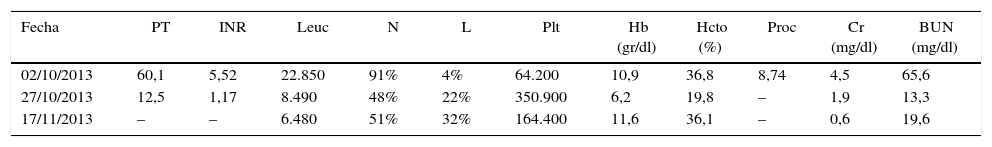
En urgencias, presenta una falla respiratoria hipóxica secundaria a edema pulmonar requiriendo soporte ventilatorio invasivo, vasopresor con noradrenalina e inotropia con dobutamina. En UCI, con ingurgitación yugular grado II a 45°, con un soplo aórtico grado II y estertores en ambos campos pulmonares. El abdomen, distendido con hepatomegalia de 3cm por debajo de reborde costal, doloroso a la palpación y anasarca. Extremidades con edema grado III. Asimetría de diámetro en miembro inferior izquierdo. Examen neurológico normal. Se establece una falla múltiple de órganos (tabla 1).
Paraclínicos
| Fecha | PT | INR | Leuc | N | L | Plt | Hb (gr/dl) | Hcto (%) | Proc | Cr (mg/dl) | BUN (mg/dl) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 02/10/2013 | 60,1 | 5,52 | 22.850 | 91% | 4% | 64.200 | 10,9 | 36,8 | 8,74 | 4,5 | 65,6 |
| 27/10/2013 | 12,5 | 1,17 | 8.490 | 48% | 22% | 350.900 | 6,2 | 19,8 | – | 1,9 | 13,3 |
| 17/11/2013 | – | – | 6.480 | 51% | 32% | 164.400 | 11,6 | 36,1 | – | 0,6 | 19,6 |
| Fecha | TGO (U/L) | TGP (U/L) | Na (mmol/Lt) | K(mmol/Lt) | Cl(mmol/Lt) | Bb T (mg/dl) | Bb D (mg/dl) | Bb I (mg/dl) | P | Ca |
|---|---|---|---|---|---|---|---|---|---|---|
| 02/10/2013 | 198 | 772 | 156 | 5,8 | 110 | mmol/Lt | Ca | |||
| 27/10/2013 | 51 | 48 | 140 | 3,7 | 102 | mmol/Lt | ||||
| 17/11/2013 | 138 | 3,9 | 4,4 | 3 | 2,6 | 7,3 | 8,3 |
Bb: bilirrubina; BUN: nitrogeno uréico; Ca: calcio; Cl: cloro; Cr: creatinina; D: directa; Hb: hemoglobina; Hcto: hematocrito; I: indirecta; INR: International Normalized Ratio; K: potasio; L: linfocitos; Leuc: leucocitos; N: neutrófilos; Na: sodio; P: fósforo; Plt: plaquetas; Proc: procalcitonina; PT: tiempo de protrombina;T: total; TGO: aspartato aminotransferasa; TGP: alanino aminotransferasa.
Fuente: autores.
Se inicia terapia de reemplazo renal. Cubrimiento antibiótico con meropenem y linezolid por sospecha de choque séptico de origen urinario, sin aislamientos microbiológicos.
Se descartaron dengue, toxoplasmosis, VIH, hepatitis viral, citomegalovirus, Epstein Barr, hemoparásitos, parvovirus B19, enfermedad de Chagas, enterovirus y sífilis. Se descartó lupus eritematoso sistémico y síndrome de anticuerpos antifosfolípidos.
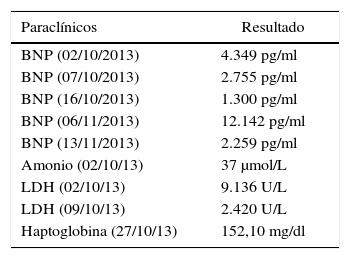
El ecocardiograma transtorácico inicial evidencia un trastorno severo de la contractilidad global, con unas fracciones de eyección del ventrículo izquierdo (FEVI) y del derecho (FEVD) del 12 y 15% respectivamente. El diámetro ventricular izquierdo diastólico (DDVI) de 49mm, y un valor de péptido natriurético cerebral de 4.349 pg/ml, cuyo punto de corte para falla cardiaca es superior 500 pg/ml, considerándose diagnóstico de CMPP.
Intervención terapéuticaSe optimiza su manejo de falla cardiaca disminuyendo la respuesta ventricular con carvedilol, betabloqueador cardioselectivo, enalapril, inhibidor de enzima convertidora de angiotensina y espironolactona con el objetivo de bloquear el eje renina-angiotensina-aldosterona (bloqueo neurohumoral). Recibe levosimendán 12,5mg (dos dosis) en infusión a 0,1 mcg.kg−1.min−1 para 24 horas. Evolución favorable en su perfil hemodinámico y gasimétrico, permitiendo el retiro del soporte multisistémico. Los valores de péptido natriurético cerebral disminuyen (tablas 2 y 3).
Exámenes especiales
| Paraclínicos | Resultado |
|---|---|
| BNP (02/10/2013) | 4.349 pg/ml |
| BNP (07/10/2013) | 2.755 pg/ml |
| BNP (16/10/2013) | 1.300 pg/ml |
| BNP (06/11/2013) | 12.142 pg/ml |
| BNP (13/11/2013) | 2.259 pg/ml |
| Amonio (02/10/13) | 37 μmol/L |
| LDH (02/10/13) | 9.136 U/L |
| LDH (09/10/13) | 2.420 U/L |
| Haptoglobina (27/10/13) | 152,10 mg/dl |
BNP: péptido natriurético cerebral; LDH: deshidrogenasa láctica.
Fuente: autores.
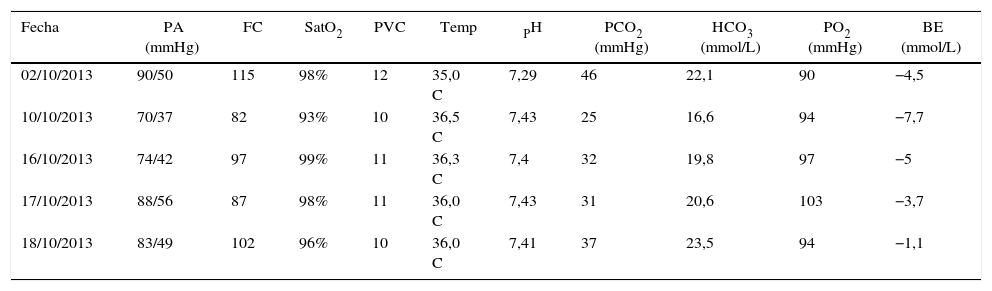
Perfil hemodinámico, gasimetría arterial, venosa y soporte vasopresor
| Fecha | PA (mmHg) | FC | SatO2 | PVC | Temp | PH | PCO2 (mmHg) | HCO3 (mmol/L) | PO2 (mmHg) | BE (mmol/L) |
|---|---|---|---|---|---|---|---|---|---|---|
| 02/10/2013 | 90/50 | 115 | 98% | 12 | 35,0 C | 7,29 | 46 | 22,1 | 90 | −4,5 |
| 10/10/2013 | 70/37 | 82 | 93% | 10 | 36,5 C | 7,43 | 25 | 16,6 | 94 | −7,7 |
| 16/10/2013 | 74/42 | 97 | 99% | 11 | 36,3 C | 7,4 | 32 | 19,8 | 97 | −5 |
| 17/10/2013 | 88/56 | 87 | 98% | 11 | 36,0 C | 7,43 | 31 | 20,6 | 103 | −3,7 |
| 18/10/2013 | 83/49 | 102 | 96% | 10 | 36,0 C | 7,41 | 37 | 23,5 | 94 | −1,1 |
| Fecha | Lactato | PaO2/FIO2 | SVO2 | Noradrenalina (mcg.kg−1.min−1) | Dobutamina (mcg.kg−1.min−1) |
|---|---|---|---|---|---|
| 02/10/2013 | 11,3 | 180 | 56% | 0,1 | 5 |
| 10/10/2013 | 2,2 | 268 | 56% | 0,2 | 7,5 |
| 16/10/2013 | 1,7 | 346 | 52% | 0,16 | Suspendida |
| 17/10/2013 | 1,5 | 367 | 56% | 0,06 | |
| 18/10/2013 | 1,8 | 335 | 71% | Suspendida |
BE: base exceso; FC: frecuencia cardiaca; PA: presión arterial; PASP: presión sistólica arteria pulmonar; PVC: presión venosa central; SatO2: saturación oxígeno; Temp: temperatura.
Fuente: autores.
La estrategia ventilatoria se desarrolló con éxito en 11 días (tabla 4).
Programación del ventilador
| Soporte mecánico invasivo | 02/10/2013 | 06/10/2013 | 11/10/2013 |
|---|---|---|---|
| Modo | AC | AC | CPAP |
| Volumen corriente (ml/min) | 405 | 405 l | – |
| Frecuencia respiratoria (por minuto) | 14 | 8 | – |
| PEEP | 8 | 10 | 6 |
| Presión soporte | – | – | 8 |
| FiO2 | 50% | 35% | 35% |
CPAP: presión positiva continua en la vía aérea; Modo AC: asistido controlado.
Fuente: autores.
Al vigésimo día en UCI, se recupera la diuresis espontánea, suspendiendo la terapia de reemplazo. Finalmente en piso, a cargo de Medicina Interna y Falla Cardiaca. La biopsia endomiocárdica evidencia edema, con muy escaso infiltrado linfoide intersticial, sin evidencia de lesiones trombóticas o vasculíticas, con cardiomiocitos de diferentes tamaños. Sin depósitos de material amiloide, constituyendo un patrón inespecífico. La paciente actualmente se encuentra en estudio pretrasplante cardiaco. Después de 45 días, la evolución ecocardiográfica evidencia una discreta recuperación de las FEVI y FEVD a 18% y 30-35% respectivamente, pero con incremento del DDVI (tabla 5). Durante la hospitalización no se presentaron eventos adversos ni imprevistos.
Ecocardiogramas transtorácicos
| Fecha | FEVI | FEVD | DDVI | PSAP | Descripción |
|---|---|---|---|---|---|
| Oct 3/13 | 12% | 15% | 49 mm | 45 mmHg | Compromiso global de la contractilidad, severa dilatación VD, movimiento disincrónico septum IV. Aurícula izquierda muy dilatada con volumen 115ml. No valvulopatía. Septum IV íntegro |
| Nov 6/13 | 13% | 25% | 56 mm | 45 mmHg | Persiste compromiso global de la contractilidad, severa dilatación VD |
| Nov 23/13 | 18% | 30-35% | 55 mm | 40 mmHg | Compromiso global de la contractilidad, aurícula derecha dilatada e izquierda con volumen 43ml,disfunción diastólica tipo II |
DDVI: diámetro diastólico VI; FEVD: fracción de eyección VD, FEVI: fracción de eyección VI; PSAP: presión sistólica arteria pulmonar VD: ventrículo derecho; VI: ventrículo izquierdo.
Fuente: autores.
La CMPP es idiopática, afecta a mujeres sanas, desarrollando una falla cardiaca con disfunción ventricular izquierda desde el final del embarazo y hasta cinco meses posparto1,2.
Su incidencia o prevalencia es desconocida, el rango de distribución es muy amplio según el aérea geográfica, 1:4.000 nacimientos vivos para Norteamérica, 1:299 en Haití, 1:100 en Nigeria3-5. Los factores de riesgo incluyen: incremento de la edad, etnia negra, tiempo prolongado de uso de tocolitos, obesidad, exposición a sustancias psicoactivas y pobreza2. Bello et al., en su metaanálisis encontraron que la presencia de preeclampsia, hipertensión gestacional, multiparidad y embarazo gemelar, son factores de alto riesgo6-8. Encontramos dos reportes a nivel nacional que albergan 6 pacientes (tabla 6)9,10.
Información casos nacionales
| Edad | Etnia | PO | Semanas embarazo | FEVI (%) | DDVI (mm) | Levosimendán | Mortalidad | |
|---|---|---|---|---|---|---|---|---|
| 1 | 30 | Mestiza | G1P1C1V1 | No | 12 | 49 | Sí | No |
| 2 | 32 | NI | G3P2C2M1 | 34 | 30 | NI | No | No |
| 3 | 21 | NI | G1PO | 33 | 35 | 56 | No | No |
| 4 | 40 | NI | G2P1 | 34 | 20 | 57 | Sí | No |
| 5 | 30 | NI | G1P0 | Aborto | 32 | 56 | No | No |
| 6 | 21 | NI | G1P0 | 21 | 25 | 59 | No | No |
| 7 | 21 | NI | G1P0 | 38 | 25 | 60 | No | No |
DDVI: diámetro diastólico VI; FEVI: fracción de eyección VI; NI: no información; PO: perfil obstétrico; VI: ventrículo izquierdo.
Fuente: autores.
Su etiología y patogénesis son desconocidas, pero con varias hipótesis propuestas, como son: la miocarditis viral, una respuesta autoinmune y/o hemodinámica anormal al embarazo, susceptibilidad genética, desnutrición, y apoptosis. La oportunidad de realizar la biopsia endomiocárdica por motivos médicos y administrativos, implica una muy amplia distribución del rango de aislamientos microbiológicos entre de 0 a 100% de los casos. Entre los aislamientos virales descritos están: citomegalovirus, parvovirus B19, Ebstein Barr, herpes simple tipo 6, H1N1, influenza A/B, los cuales podrían ser los disparadores del desarrollo de la respuesta autoinmune o simplemente son hallazgos incidentales por encontrarse una incidencia similar de aislamientos en pacientes sin cardiomiopatía periparto11-13. Posiblemente existe más de un disparador, se ha planteado que las células fetales pudieran generar un microquimerismo capaz de generar la respuesta. Se han encontrado niveles altos de interleucina 6(IL-6), factor de necrosis tumoral, proteína C reactiva constituyéndolos en predictores de mortalidad11. El rol de los micronutrientes como vitamina A, B12, C, betacaroteno, y selenio no es concluyente y varía por regiones geográficas. La pobreza podría incrementar la tendencia a infecciones1.
El diagnóstico es realizado por exclusión con confirmación ecocardiográfica al evidenciarse una FEVI menor del 45%2.
La estrategia terapéutica en la CMPP es similar a la de una falla cardiaca. El momento del diagnóstico, preparto o posparto es determinante en la selección de los medicamentos. Durante el embarazo se pueden utilizar betabloqueadores aunque están asociados a bajo peso neonatal. En el posparto la combinación de inhibidores de la enzima convertidora de angiotensina sumado al uso de diurético es adecuado. La digoxina puede ser utilizada14,15.
La bromocriptina está siendo utilizada como terapia coadyuvante para bloquear el receptor 16KDa implicado en la patogénesis, con el objetivo de recuperar la función ventricular izquierda. El esquema terapéutico es: 2,5mg cada 12 horas durante 15 días y continuar a 2,5mg día durante seis semanas. Los efectos secundarios son de origen trombótico16-19.
Con el levosimendán se encontró que no modifica la mortalidad frente al grupo control, igualmente la FEVI, presión sistólica de arteria pulmonar y los DDVI sistólico y diastólico no presentaron diferencias estadísticamente significativas entre los supervivientes del grupo control. Se utilizó a 0,1 mcg.kg−1.min−1 por 24 horas20,21.
La anticoagulación con heparinas de bajo peso molecular y no fraccionadas son seguras durante el embarazo y se recomienda con FEVI menor de 25%. Se prefiere utilizar la no fraccionada por su corta vida media y reversibilidad en caso de urgencia. Warfarina en el periodo posparto, con énfasis en las pacientes con bromocriptina2,15.
Goland et al., encontraron que el pronóstico está ligado con un diagnóstico temprano, retrasos en el diagnóstico mayores de una semana, asociado a una FEVI menor o igual a 25% y una etnia no caucásica, incrementan la posibilidad de desarrollar complicaciones mayores: arritmias cardiacas ventriculares, paro cardiaco, tromboembolismo, falla cardiaca refractaria, y la posibilidad de trasplante cardiaco y muerte22,23. Del grupo de las miocarditis, la CMPP presenta una probabilidad de recuperación de la FEVI mayor al 50% a 6 meses, entre un 80 a 90% de la pacientes con dos criterios: FEVI mayor a 30% y el DDVI menor de 60mm, frente a un 30 a 40% de los casos con FEVI menor de 30% y DDVI mayor a 60mm12,24. Pillarisetti et al., proponen implantar cardiodesfibriladores en el grupo de pacientes con función ventricular izquierda menor de 30% y DDVI mayor a 60mm, para prevención primaria de muerte súbita25.
La mortalidad varía por regiones geográficas, para Estados Unidos está entre 0 a 19%, Brasil y Haití entre el 14 al 16%. El porcentaje de trasplante cardiaco en Estados Unidos está entre el 6 al 11%. Los factores asociados a mayor mortalidad son la paridad mayor de cuatro, la edad avanzada y origen étnico negro es 6,4 veces mayor comparados con las caucásicas2,5.
En Colombia, existen seis reportes, un caso del Hospital Universitario del Valle (Cali) y las cinco restantes corresponden a un estudio retrospectivo sobre enfermedad cardiaca en el embarazo realizado del 2005 al 2009 en la Clínica El Prado (Medellín)9,10. En 2005, Medellín tenía una población de mujeres entre 15 a 49 años de 754.580 que corresponde al 30,19% de la población de la ciudad26. Nuestra paciente de etnia mestiza, poco estudiada a nivel mundial, presenta similitudes en relación a los reportes nacionales en cuanto a edad y primigestación. Los reportes nacionales se presentaron durante el embarazo con unos promedios de FEVI y DDVI de 26% y 57,6mm respectivamente. No hay información sobre el origen étnico (tabla 6). Únicamente una paciente requirió levosimendán, sin trasplante cardiaco ni mortalidad. Nuestra paciente con una FEVI y DDVI de 12% y 49mm respectivamente, diagnóstico por exclusión requirió manejo ventilatorio invasivo, soporte vasopresor, inotrópico e inodilatador. La biopsia endomiocárdica se realiza de manera diferida con un patrón inespecífico.
ConclusionesLa CMMP afecta a una población joven y sana, desde el final del embarazo y hasta cinco meses posparto. Su etiología y patogénesis son desconocidas, las hipótesis propuestas son: la miocarditis viral, una respuesta autoinmune y/o hemodinámica anormal al embarazo, susceptibilidad genética, desnutrición, y la apoptosis. La recuperación de la FEVI depende de: una detección temprana menor a siete días desde el inicio de los síntomas, la FEVI inicial mayor a 30% y DDVI menor a 60mm. La mortalidad está asociada con la paridad mayor de cuatro, la edad avanzada y origen étnico negro que es 6,4 veces mayor comparados con las caucásicas.
Perspectiva del pacienteLa paciente y su familia manifestaron de manera positiva su experiencia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.