Paciente de 26 años con diagnóstico de teratoma inmaduro de ovario derecho. Se le realizó resección del tumor más salpingooforectomía en junio de 2014. Recibió manejo adyuvante con carboplatino y ciclofosfamida por un ciclo en enero de 2015, pero sin respuesta. Se realizó laparotomía exploradora por obstrucción intestinal evidenciándose masa pélvica e implantes peritoneales a nivel hepático.
Valoró oncología clínica del INC en febrero del 2015, se inicia manejo con esquema PEB; recibió el primer ciclo sin complicaciones. El segundo ciclo fue retrasado por infección en la pared abdominal. Empezó tratamiento con sodio sérico normal, con posterior descenso sin alteración en el resto de electrolitos, función renal, ni estado ácido base. La paciente no presentó síntomas neurológicos y estuvo euvolémica. Se inició estudio de hiponatremia haciéndose diagnóstico de SIADH. Se indicó manejo con restricción hídrica y dieta hipersódica, con posterior ascenso gradual de niveles séricos de Na, considerándose SIADH secundario a uso de cisplatino.
The case is presented of a 26 year-old patient diagnosed with an immature teratoma of the right ovary. Tumour resection plus salpingo-oophorectomy was performed in June 2014. She received one cycle of adjuvant treatment with carboplatin and cyclophosphamide, but with no response. An exploratory laparotomy was performed due to an intestinal obstruction, which showed a pelvic mass and peritoneal implants at hepatic level.
She was assessed in the oncology clinic of the Colombian National Institute (INC) in February 2015, and treatment with a platinol (cisplatin), etoposide, and bleomycin (PEB) scheme was started. She received the first cycle without complications, but the second cycle was delayed due to an infection in the abdominal wall. She started the treatment with a normal serum sodium, with a subsequent decrease with no changes in the rest of the electrolytes, kidney function, or acid-base status. The patient showed no neurological signs and was euvolaemic. A hyponatraemia study was performed, ending up making the diagnosis of inappropriate antidiuretic hormone secretion (IADHS). A water restriction and high sodium diet was indicated, with the subsequent gradual increase in the serum Na levels. The IADHS was considered secondary to the use of cisplatin.
El cisplatino es usado ampliamente en el tratamiento de una variedad de enfermedades malignas, incluyendo tumores germinales, cáncer de ovario, cáncer de vejiga, cáncer de cabeza y cuello, cáncer de esófago, cáncer de células pequeñas y no pequeña de pulmón, sarcomas y tumores trofoblásticos. Los eventos adversos más frecuentes son: náuseas, vómito, ototoxicidad, mielosupresión, neurotoxicidad manifestada por neuropatía sensorial periférica, y nefrotoxicidad1; esta última es causada por el acumulo a nivel de la corteza renal del medicamento con niveles hasta cinco veces mayores que en el plasma. El evento fisiopatológico central es el daño en el segmento S3 del túbulo proximal que lleva a la caída en la tasa de filtración glomerular con elevación secundaria de la creatinina y otros azoados, siendo este el principal hallazgo del daño renal2. Otras manifestaciones secundarias a la alteración de la reabsorción son la caída en los niveles plasmáticos de electrolitos como el magnesio y sodio, entre otros3 (tabla 1). De esta forma se desarrolla el riñon perdedor de sal4, la principal causa de hiponatremia luego del uso de este quimioterapéutico, el cual se caracteriza por hipovolemia y pérdida de grandes cantidades de sodio en orina. Algunas veces, por un mecanismo no claramente establecido, el cisplatino estimula la secreción de hormona antidiurética5 llevando a la presentación del síndrome de secreción inapropiada de hormona antidiurética (SIADH)6. El SIADH es un desorden osmoregulatorio que lleva a hiponatremia hipoosmolar euvolémica inicialmente asociado a elevación de la hormona antidiurética (ADH), pero eventualmente los niveles plasmaticos pueden ser normales e inclusive bajos, por lo cual otros recomiendan el nombre de síndrome de antidiuresis inapropiada7. Varios agentes antineoplásicos han sido vinculados con su desarrollo, los más frecuentes son los alcaloides de la vinca y ciclofosfamida, y rara vez cisplatino8.
Manifestaciones renales del tratamiento con cisplatino5
| Lesión renal aguda (20–30%) Hipomagnesemia (40–100%) Síndrome de Fanconi Acidosis tubular renal distal Hipocalcemia Riñón perdedor de sal Alteración de concentración renal Hiperuricemia Proteinuria transitoria Deficiencia de eritropoyetina Microangiopatia trombótica Falla renal crónica |
En este artículo se reporta un caso de SIADH relacionado con el uso de platino en una paciente con diagnóstico de teratoma inmaduro durante el tratamiento con esquema PEB (cisplatino, etopósido y bleomocina), se hace hincapié en la importancia de un adecuado proceso diagnóstico que permita un manejo apropiado y la continuidad de la mejor alterativa terapéutica.
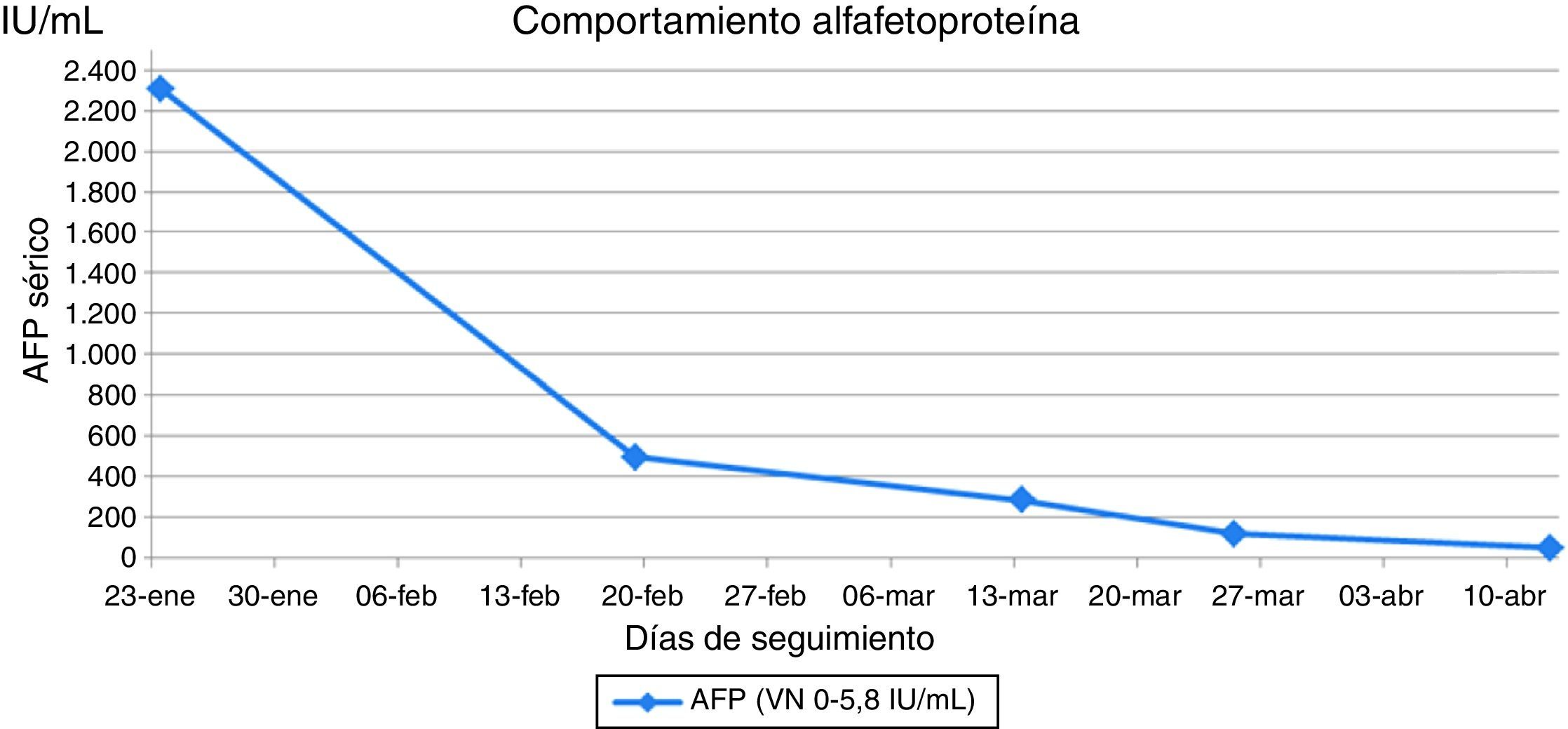
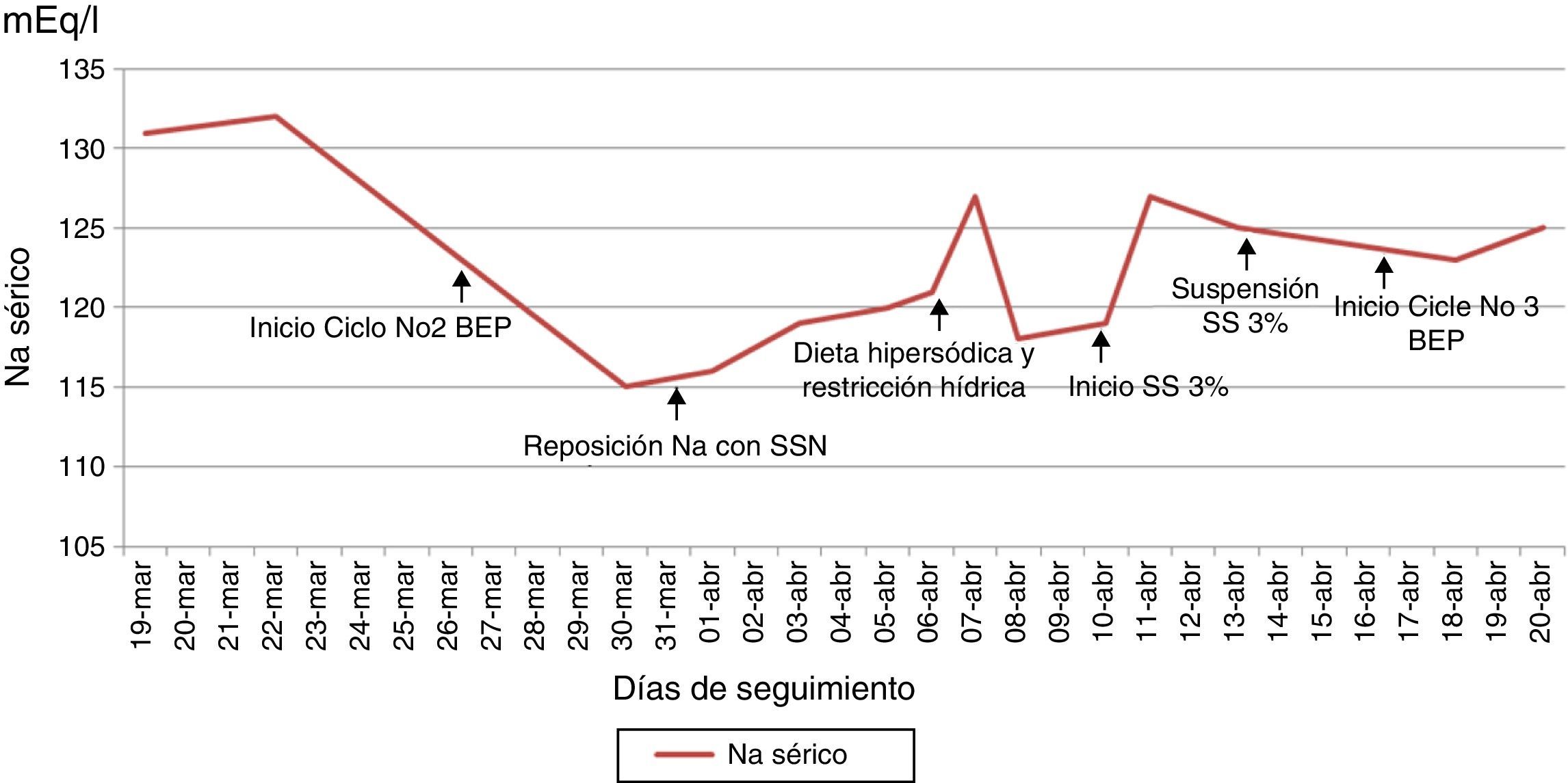
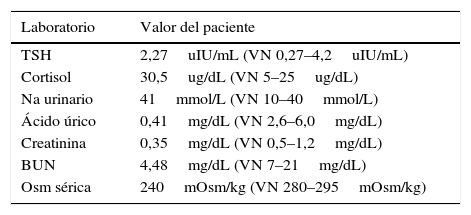
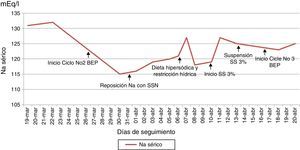
Reporte de casoSe presenta el caso de una paciente de 26 años con diagnóstico de teratoma inmaduro grado 3 (alto grado) de ovario derecho, estadio inicial desconocido en mayo de 2014. Se realizó manejo quirúrgico no oncológico en junio de 2014 con resección de tumor ovárico derecho más salpingooforectomía derecha. Antes de ser conocida por el servicio de oncología del Instituto Nacional de Cancerología (INC) recibió manejo adyuvante con carboplatino y ciclofosfamida por un ciclo en enero de 2015 sin respuesta, en ese mismo mes se realizó laparotomía exploradora por cuadro de obstrucción intestinal evidenciándose masa pélvica e implantes peritoneales a nivel hepático, con toma de biopsia que confirmó en conjunto con la elevación de marcadores tumorales la sospecha diagnóstica (fig. 1). Fue valorada por oncología clínica del INC en febrero de 2015, considerándose manejo con esquema PEB; recibió el primer ciclo el 20 de febrero de 2015 sin mayores complicaciones. El segundo ciclo comenzó el 26 de marzo de 2015 retrasado por infección en la pared abdominal secundaria a fístula entre tumor y ésta. La paciente inició el tratamiento con sodio sérico normal (fig. 2), al quinto día de tratamiento se realizaron paraclínicos encontrándose sodio sérico (Na) de 115mEq/l sin alteración en el resto de electrolitos, función renal ni estado ácido base. La paciente no presentó durante el seguimiento signos neurológicos de hiponatremia y siempre estuvo euvolémica (sin deshidratación, hipotensión, ortostatismo o reducción del gasto urinario). Se inició estudio de hiponatremia encontrándose una osmolaridad plasmática baja que en una paciente euvolémica requería descartar causas de hiponatremia hipoosmolar euvolémica. Haciendo el diagnóstico de SIADH, se descartó hipotiroidismo e insuficiencia suprarrenal, se encontró sodio urinario alto (sin consumo de diuréticos) junto con ácido úrico y nitrógeno ureico bajos en sangre (tabla 2). Se indicó manejo con restricción hídrica a 800ml/24 horas y dieta hipersódica, con posterior ascenso gradual de niveles séricos de Na hasta 127mEq/l. Fue valorada por endocrinología quienes estuvieron de acuerdo con el diagnóstico y se continuó con el manejo instaurado, durante la evolución presentó caída nuevamente el Na sérico adicionándose al manejo solución salina hipertónica al 3%. Al haber tenido una respuesta serológica adecuada (fig. 1) y considerándose que PEB es la mejor opción de tratamiento en este tipo de tumores, se decidió continuarlo con vigilancia hospitalaria y con medidas generales para prevenir hiponatremia (restricción hídrica y dieta hipersódica), además se usó furosemida IV luego de administración de líquidos endovenosos necesarios por el sumistro de cisplatino (solo 500 cc día), sin complicaciones y con estabilidad del Na sérico (fig. 2).
Reporte de laboratorios
| Laboratorio | Valor del paciente |
|---|---|
| TSH | 2,27uIU/mL (VN 0,27–4,2uIU/mL) |
| Cortisol | 30,5ug/dL (VN 5–25ug/dL) |
| Na urinario | 41mmol/L (VN 10–40mmol/L) |
| Ácido úrico | 0,41mg/dL (VN 2,6–6,0mg/dL) |
| Creatinina | 0,35mg/dL (VN 0,5–1,2mg/dL) |
| BUN | 4,48mg/dL (VN 7–21mg/dL) |
| Osm sérica | 240mOsm/kg (VN 280–295mOsm/kg) |
La hiponatremia es una anormalidad electrolítica común en los pacientes oncológicos8,9, siendo usualmente definida como un nivel sérico de sodio < 135mEq/l. Puede ser evidenciada de manera incidental tanto en los laboratorios iniciales como en los exámenes previos a la administración de cada ciclo, o se puede manifestar clínicamente con síntomas neurológicos como cefalea, náuseas, emesis, debilidad muscular, letargia, desorientación e hiporreflexia, o con cuadros graves como convulsiones, coma o paro respiratorio. Estos últimos se explican por hipertensión endocraneana secundaria a edema cerebral por la osmolaridad sérica baja que genera un gradiente osmótico que favorece el movimiento de agua del plasma al cerebro. El diagnóstico diferencial de la hiponatremia es importante para seleccionar un tratamiento apropiado y corregir la anormalidad, basados en la evaluación clínica y de laboratorio.
En el caso de la paciente, su hiponatremia se asoció con el inicio de quimioterapia con etopósido, bleomicina y cisplatino; entre estos el agente principalmente relacionado con esta alteración es el cisplatino. La hiponatremia asociada al uso de este último casi siempre es explicada por nefrotoxicidad8,10,11, secundaria a daño en distintos niveles de la nefrona, especialmente en el túbulo proximal, resultando en alteración para la reabsorción de sodio y agua. Esto condiciona un mayor estímulo sobre la mácula densa en el túbulo distal que activa un mecanismo de retroalimentación túbulo-glomerular, lo que lleva a la reducción en el flujo sanguíneo renal desencadenando un descenso de la filtración glomerular. El asa de Henle8 también se puede ver afectada por el cisplatino, ya que la pérdida de los gradientes favorecen un defecto en la concentración de la orina, limitando la reabsorción de agua. Además se ha reportado que el cisplatino puede reducir la expresión de aquaporinas en los túbulos colectores, lo que favorece mayor alteración en la reabsorción de agua. Todo lo anterior lleva a la presencia del síndrome de riñón perdedor de sal, que en resumen se caracteriza por aumento de la natriuresis, con incremento en el sodio urinario y el gasto urinario. En nuestro reporte de caso, el diagnóstico de síndrome de riñón perdedor de sal está en contra, dado que la paciente siempre estuvo euvolémica, por lo que se deben descartar causas de hiponatremia euvolémica.
La secreción inapropiada de hormona antidiurética11,12 es una alteración que puede relacionarse con el cisplatino pero que se presenta en menos de 1% de los casos, y se caracteriza por presencia de hiponatremia secundaria a retención de agua por una producción persistente de hormona antidiurética o un péptido similar, a pesar de la hipotonicidad del agua corporal y un adecuado volumen circulante. De acuerdo a lo descrito, la hiponatremia y la concentración inapropiada de sodio en orina pueden ser dados por un efecto central del cisplatino sobre la secreción de ADH, al igual que el efecto directo en la función tubular renal10,13,14; este efecto dual hace que la hiponatremia y el deterioro neurológico puedan ser más graves.
El síndrome también ha sido documentado después del tratamiento con vincristina15 ciclofosfamida16, además del incremento de las concentraciones de hormona antidiurética asociados con emesis17 inducida por la quimioterapia, por lo que todos estos desencadenantes deben ser tenidos en cuenta. Es de resaltar que si bien nuestro caso se orienta más al desencadenamiento de SIADH por uso de cisplatino, no se debe dejar de lado otra potencial causa de dicha alteración como lo puede ser el teratoma inmaduro de ovario per se, teniendo en cuenta el reporte de dicha asociación18, en el que se expone el caso de una paciente de 17 años de edad, quien presenta una masa pélvica asociada a hiponatremia, con posterior evidencia de SIADH y un teratoma inmaduro de ovario grado 2, sin que se encontraran otras causas de SIADH, comportándose como un síndrome paraneoplásico, la cual se resolvió posterior al manejo con cirugía curativa y quimioterapia, y postulándose que el teratoma inmaduro está constituido por estructuras neurohipofisarias que favorecen la liberación de ADH18.
El diagnóstico1 se realiza ante un paciente con euvolemia clínica, hiponatremia hipoosmolar, sodio urinario elevado, estado ácido base y potasio normales, con función renal, suprarrenal y tiroideas normales (tabla 3). El caso reportado desarrolló hiponatremia hipoosmolar con signos de dilución sérica (ácido úrico y nitrógeno ureico bajos) y sodio urinario elevados, sin signos de hipovolemia, falla renal ni uso de diuréticos, además se descartó déficit hormonal, por lo cual se consideró que la hiponatremia que presentaba fue secundaria a SIADH (tabla 4).
Criterios para definición de síndrome de secreción de hormona antidiurética (SIADH)1
| Hiponatremia Hipoosmolaridad plasmática Ácido úrico y nitrógeno ureico bajos en sangre Osmolaridad urinaria elevada Excreción renal de sodio elevada Ausencia de evidencia clínica de depleción de volumen Función renal normal Función adrenal normal Función tiroidea normal |
Diferencia entre SIADH y RSWS (Síndrome de riñón perdedor de sal)1,11
| SIADH | RSWS | |
|---|---|---|
| Volúmen | Euvolémico | Hipovolémico |
| Sodio sérico | Bajo | Bajo |
| Sodio urinario | >40mmol/L | ≫40mmol/L |
| Osmolaridad palsmática | Bajo | Bajo |
| Osmolaridad urinaria | >osm plasmática | >osm plasmática |
| Gasto urinario | Reducido | Aumentado |
| Niveles de ADH | Elevado | Disminuido |
Littlewood y Smith14 reportaron un caso de SIADH asociado con uso de cisplatino en dos pacientes, uno con cáncer de célula pequeña indiferenciado de pulmón y otro con carcinoma escamocelular indiferenciado de pulmón, uno de los pacientes desarrolló una profunda hiponatremia con presencia de convulsiones que se presentaron un día después de la administración de cisplatino. Porter19 también describió un caso de una paciente con antecedente de un carcinoma endometroide de ovario, que fue admitida al hospital al sexto día de inicio del tercer ciclo de quimioterapia con cisplatino, quien cursaba con 5 días de alteración del estado mental dado por letargia y confusión, con tensión arterial normal y clínicamente bien hidratada. Le realizan estudios y encuentran Na 108mEq/l, osmolaridad plasmática 201mosm/l, osmolaridad urinaria en 538mosm/l, y hacen diagnóstico de SIADH e inician manejo con restricción hídrica.
En los casos reportados y en el caso actual, la hiponatremia se presentó en los primeros días del suministro de cisplatino. Se debe tener en cuenta que SIADH es infrecuente, pero es una condición que potencialmente puede comprometer la vida del paciente, como complicación de la quimioterapia con cisplatino3. Además es de vital importancia reconocer que la hiponatremia de este síndrome puede verse agravada por la sobrehidratación intravenosa con cristaloides, usada en los pacientes a quienes se les suministra cisplatino para evitar la nefrotoxicidad.
La hiponatremia debe ser considerada cuando se presentan síntomas o signos neurológicos en el paciente que recibe cisplatino. No existe descripción clara en la literatura sobre el manejo estandar de estos pacientes20 a la mayoría se les suspendió el tratamiento quimioterapéutico y recibieron tratamiento estándar descrito para SIADH como restricción hídrica, dieta hipersódica, solución salina hipertónica y en algunos casos furosemida9,14,19.
En el caso reportado se evidenció hiponatremia en el primer control de sodio que se realizó, la cual empeoró con el inicio del ciclo de quimioterapia, dado la presencia de hiponatremia severa, sin que se presentaran síntomas asociados a la misma, y sin que aún se hubiese realizado el diagnóstico de SIADH, teniendo en cuenta que dicho diagnóstico se realiza habiéndose descartado inicialmente otras patologías como lo son hipotiroidismo e insuficiencia suprarrenal. Por lo anterior se inició manejo con SSN, sin mejoría adecuada de los niveles de sodio, con posterior confirmación del diagnóstico de SIADH, realizándose el manejo inicial descrito para la misma, con persistencia de hiponatremia decidiéndose el inicio de manejo con solución salina hipertónica, con lo que se logró mejoría del nivel sodio, con posterior estabilidad del valor en plasma aún luego del inicio del tercer ciclo del mismo esquema de quimioterapia (fig. 2). Es de resaltar que dentro del manejo inicial del SIADH se encuentra el control de la causa desencadenante, y además junto a las medidas como restricción hídrica y dieta hipersódica, se debe tener en cuenta el uso temprano de solución salina hipertónica ante la presencia de hiponatremia severa. El diagnóstico apropiado y oportuno sumado al conocimiento fisiopatológico y la aplicación de medidas generales permitieron continuar con el mejor esquema de tratamiento en primera línea para tumores germinales21, que ha demostrado respuesta serológica en esta paciente (fig. 1).
La hiponatremia asociada a cisplatino, aunque es una condición relativamente rara, puede asociarse a morbilidad importante y puede llegar a ser potencialmente fatal. El diagnóstico acertado de las posibles causas favorece la mejor intervención, ya que estas pueden ser tan distintas como hidratación vigorosa para el síndrome de riñón perdedor de sal o restricción hídrica estricta en el SIADH. El reconocimiento de estas causas, el proceso diagnóstico y el tratamiento acertado, permitieron continuar con el manejo quimioterapéutico ideal en esta paciente. Se propone que el seguimiento estricto permite continuar el platino en casos donde este sea la mejor alternativa terapéutica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Dr. Brugés, Instituto Nacional Cancerología, Jefe del Departamento de Oncología Clínica.