Toda cirugía de revascularización miocárdica debe estar dirigida a lograr que el paciente permanezca el mayor tiempo posible sin necesidad de una nueva revascularización. La revascularización arterial total contribuye a alcanzar este propósito.
ObjetivoDemostrar que ambas arterias mamarias pueden ser utilizadas, en varias configuraciones, para lograr la revascularización arterial total.
MétodosSe incluyeron 35 pacientes, 29 de género masculino y 6 del femenino, con edad promedio de 54,2 años, a quienes se les revascularizaron una o ambas arterias mamarias, en el período entre enero de 2012 y septiembre de 2014, para un seguimiento medio de 13,1 meses. El valor del Euroscore aditivo fue de 0 para los hombres y 1 para las mujeres.
ResultadosSe describieron siete configuraciones para lograr la revascularización arterial total, usando una o ambas arterias mamarias y el remanente distal de una de las arterias mamarias como únicos injertos. No hubo fallecimientos ni complicaciones mayores en los pacientes revascularizados. Seis meses después todos permanecían asintomáticos y sin nuevos signos de isquemia en los territorios revascularizados.
ConclusionesLa revascularización arterial total, utilizando una o ambas arterias mamarias y el remanente distal de una de ellas es posible y arroja buenos resultados en pacientes seleccionados.
The aim of all coronary artery bypass grafts should be to allow patients to stay as long as possible without the need to repeat revascularization. Total arterial revascularization contributes to achieving these purposes.
ObjectiveTo demonstrate that both mammary arteries can be used in various configurations to achieve total arterial revascularization.
Methods35 patients were included, 29 male and 6 female, with age average of 54.2 years, who were revascularized with one or both mammary arteries in the period between January 2012 and September 2014, with a mean follow-up time of 13.1 months. The additive EuroSCORE was 0 for men and 1 for women.
ResultsSeven configurations are described to achieve total arterial revascularization using one or both mammary arteries and the distal remnant of a mammary arteries as single grafts. There were no deaths or major complications in patients revascularized. Six months later, all were asymptomatic with no new signs of ischemia in revascularized territories.
ConclusionsTotal arterial revascularization using one or both mammary arteries and distal remaining one is possible and gives good results in selected patients.
El fallo de los injertos coronarios es la principal causa de reaparición de angina, de nuevos eventos coronarios e incluso de la muerte de los pacientes revascularizados. El éxito de toda cirugía coronaria estará dado porque tanto el injerto, como la anastomosis coronaria y el vaso coronario distal al sitio de anastomosis, permanezcan libres de obstrucción. El injerto ideal es aquel que pueda mantener un flujo sanguíneo adecuado a los territorios revascularizados, bien en reposo, como durante el esfuerzo, y que además permanezca libre de hiperplasia intimal y obstrucciones ateroscleróticas. Con la revascularización arterial total se logran los mejores resultados, en comparación con el empleo de la vena safena1–6.
Por su parte, los conductos arteriales se clasifican en tres grupos: arterias somáticas, dentro de las que se encuentran ambas arterias mamarias (AAM), esplácnicas, dentro de las que clasifica la gastroepiploica y de los miembros, y entre estas la radial. Todas han sido estudiadas desde los puntos de vista embriológico, anatómico y fisiológico demostrándose que las arterias somáticas y en particular las mamarias, tienen solo función de conductos, con fibras predominantemente elásticas, con un contenido un poco mayor en fibras musculares más allá de su bifurcación y de ahí su resistencia al vasoespasmo. Se ha demostrado que el endotelio de las arterias mamarias libera más óxido nítrico y factor de relajación derivado del endotelio que el resto de los conductos arteriales tanto en reposo como ante estímulos vasoconstrictores. Las arterias esplácnicas y de los miembros, en correspondencia con las funciones que realizan los órganos y miembros que irrigan, son más musculares y por tanto más susceptibles al vasoespasmo; también se ha demostrado que son más propensas a ser afectadas por la aterosclerosis7,8. En un artículo publicado en 1975, en el cual se realizó un estudio posmortem de las arterias mamarias de 215 pacientes, se encontró que solo en 9 estaban afectadas por la aterosclerosis, pero curiosamente ninguno tenía lesiones que rebasaran el 50% de la luz del vaso. Se observó, además, que las lesiones se encontraban con más frecuencia en el sitio de su bifurcación. Allí la aterosclerosis es infrecuente y se plantea que es el conducto menos atacado por esta9,10. Tector, coautor del artículo en mención, ha publicado sus resultados en diferentes revistas donde demuestra que las arterias mamarias son excelentes conductos arteriales. Los buenos resultados de su trabajo y la experiencia acumulada, le posibilitaron hacer aportes y consideraciones importantes para lograr la revascularización arterial total usando las arterias mamarias como único conducto arterial. De la misma forma, el seguimiento de sus pacientes revascularizados a corto, mediano y largo plazo le permitió llegar a la conclusión de que las arterias torácicas internas son los mejores conductos para lograr la revascularización en los pacientes que necesitan cirugía de revascularización coronaria1–5,11–14.
Motivados por todo lo anterior, los autores del trabajo de investigación que aquí se expone, se trazaron como objetivo realizar la revascularización arterial total con el uso de una o AAM, específicamente en pacientes más jóvenes (menores de 60 años) en quienes es mayor la expectativa de vida. A pesar de esto, la posibilidad de nuevas revascularizaciones está presente, así que también se propuso optimizar los injertos arteriales, siempre que sea viable, teniendo en cuenta los vasos coronarios afectados y la localización de las lesiones en las arterias coronarias. En este artículo se presentan las alternativas con las cuales se ha podido alcanzar la revascularización arterial total (RAT) con el uso de una o AAM y el remanente distal de una de ellas, como únicos injertos.
MetodologíaÁmbito del estudioLa investigación se llevó a cabo en el servicio de cirugía cardiaca del Cardiocentro de Santa Clara, Cuba, y constituye un estudio no experimental de seguimiento prospectivo, en el que se incluyeron 35 pacientes revascularizados con el uso de una o AAM mediante una de las siete alternativas de revascularización descritas en este documento y que permitieron alcanzar la RAT sin el uso de otro conducto arterial, en el período comprendido entre enero de 2012 y septiembre de 2014. A cada paciente le fue calculado el valor del Euroscore aditivo, del que resultó un valor de 0 para el sexo masculino y de 1 para el femenino.
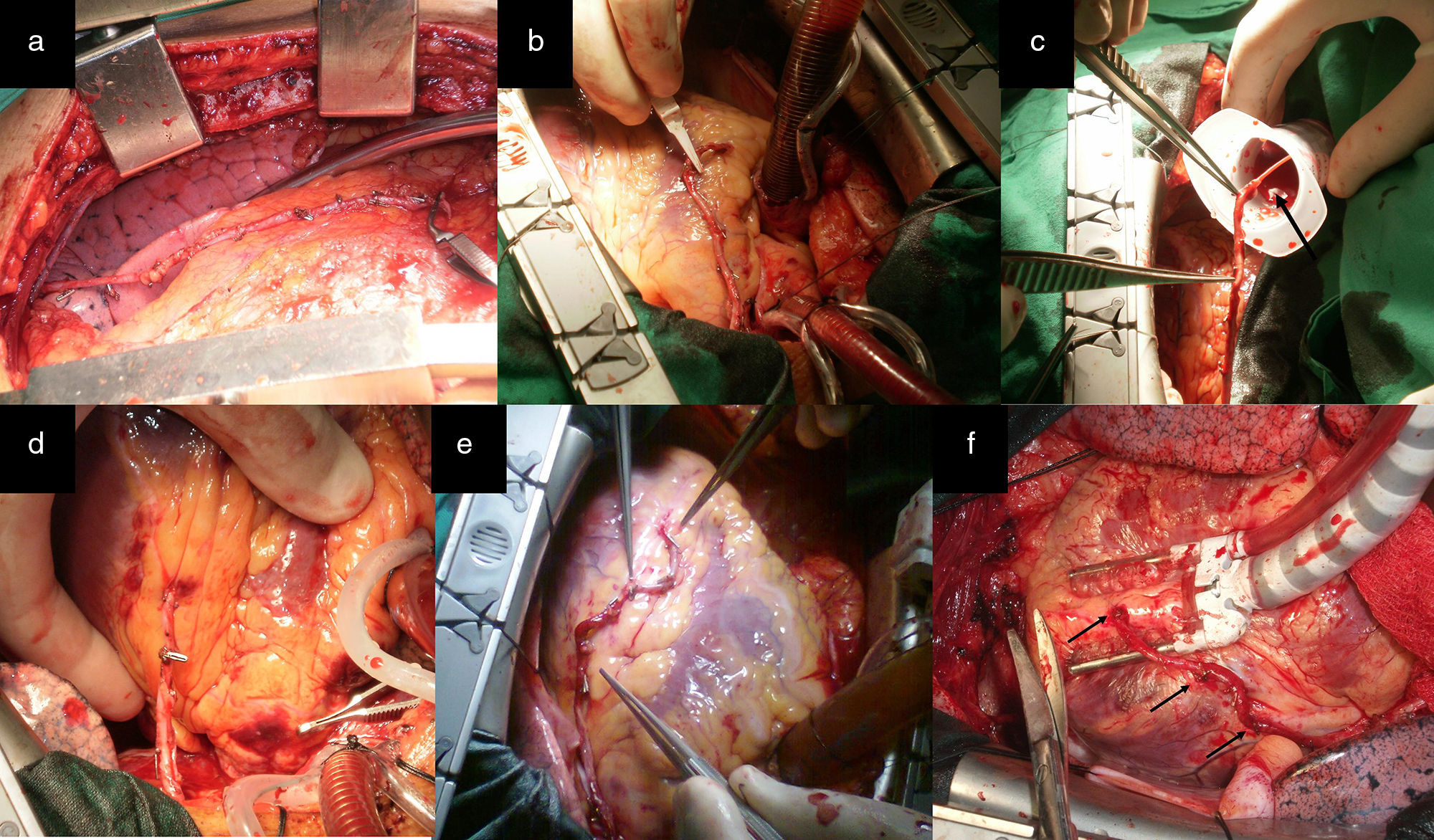
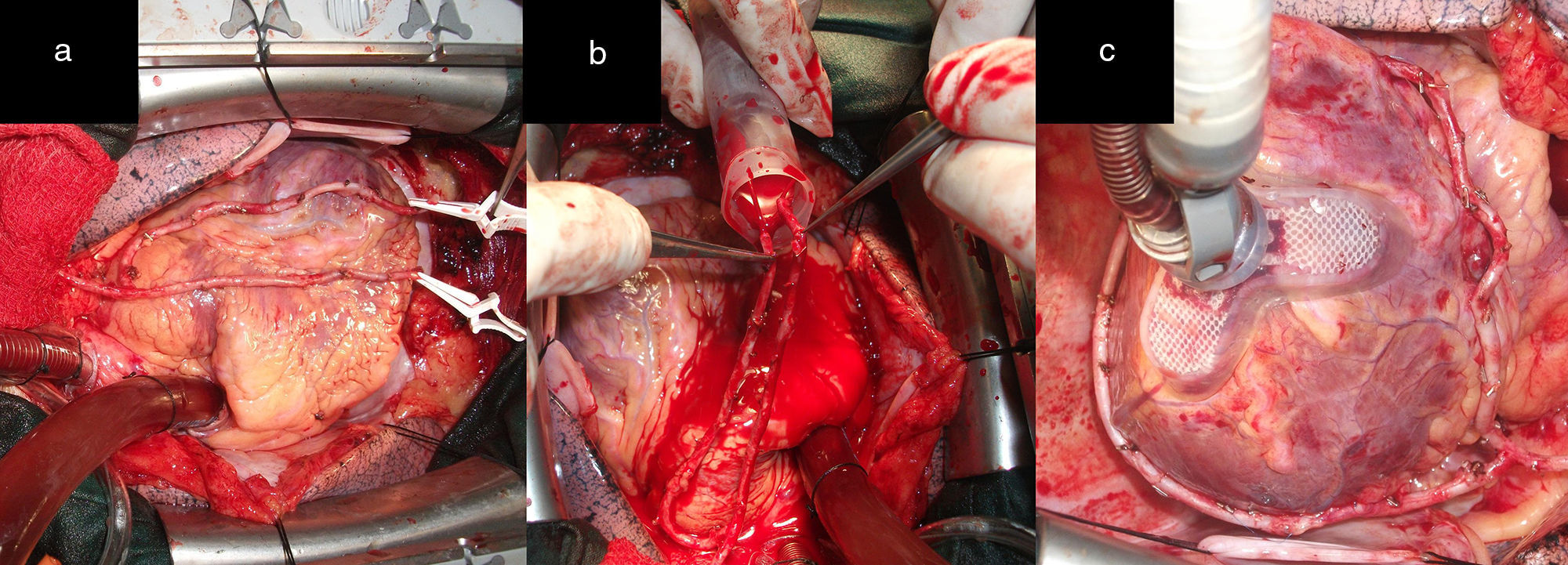
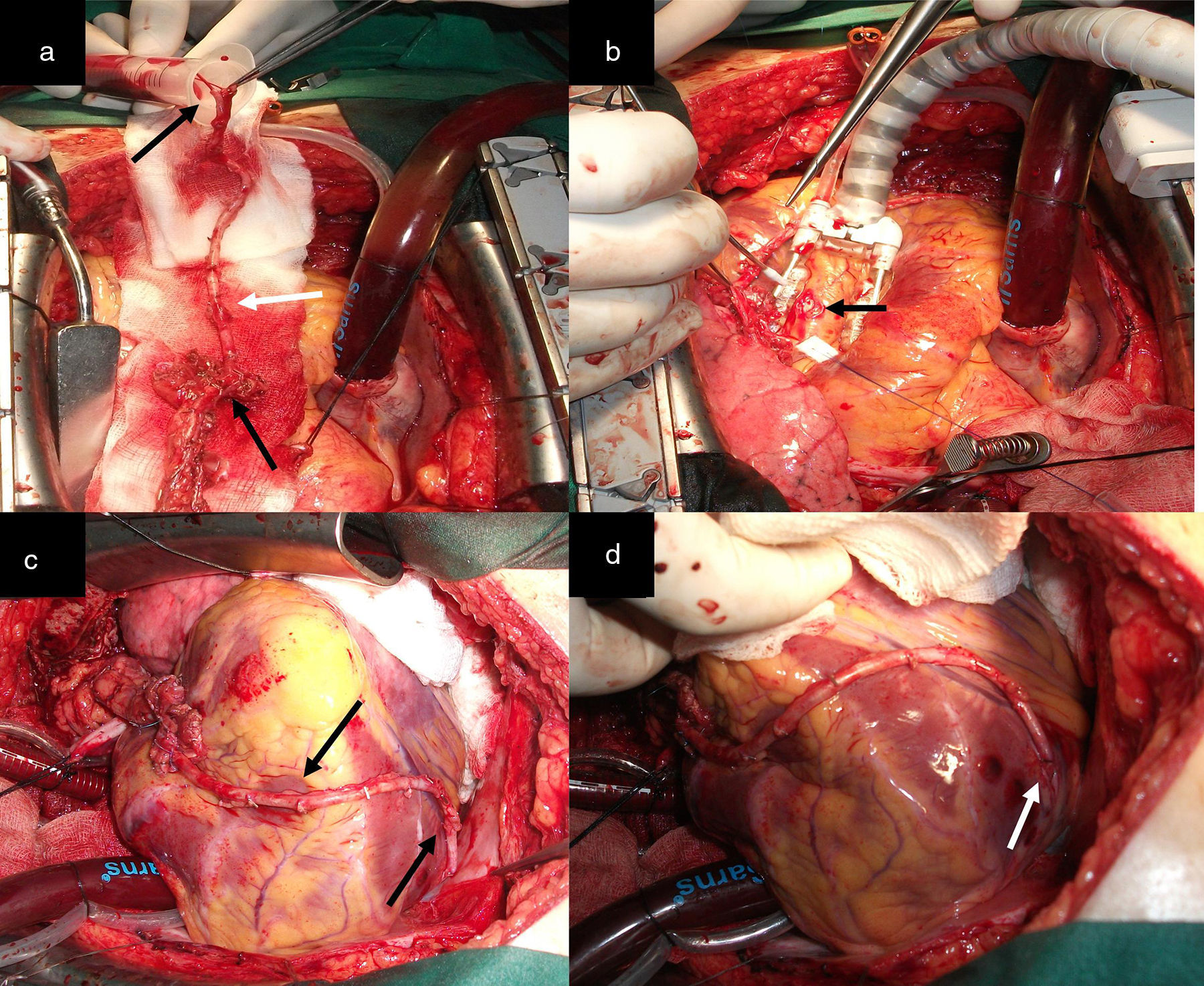
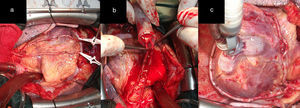
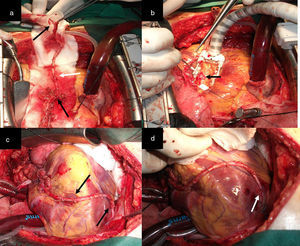
ProcedimientosA cada paciente se le realizó un análisis de la disposición anatómica de los sistemas coronarios que irrigan las caras anterior, lateral y posterior del corazón, la localización y extensión de las lesiones, el calibre de los lechos distales, así como el tamaño y la función del ventrículo izquierdo, para determinar los casos revascularizables. Todos fueron abordados a través de esternotomía media longitudinal. Las arterias mamarias fueron disecadas de forma esqueletonizada desde su origen en la arteria subclavia hasta su bifurcación, donde fueron seccionadas, ocluidas en su extremo distal y preservadas en solución salina tibia con papaverina, con lo que se obtuvo longitud, dilatación y flujo suficientes (mayor de 100mL/min) (fig. 1 a, b y c). Una vez expuesto el corazón se realizó la inspección y palpación de los vasos coronarios. Con todos estos elementos se seleccionó la alternativa apropiada para cada caso. Todos fueron revascularizados a corazón abierto, reservándose el uso de la circulación extracorpórea (CEC) sin parada cardiaca, para aquellos con inestabilidad eléctrica o hemodinámica preoperatoria o durante la intervención quirúrgica y cuando se abordara la cara lateral y posterior del corazón.
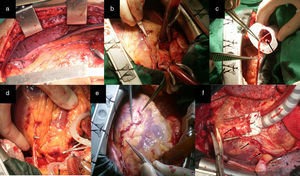
a) y b) Disección esqueletonizada de la AMI. Anastomosis proximal de AMI a ADA. Anastomosis con la AMI L-L a la primera arteria diagonal y a saltos, primero L-L y después T-L en la ADA. c), d) y e) La punta de las pinzas señala los sitios de la anastomosis. Dos anastomosis secuenciales, L-L de AMI a la primera y segunda arteria diagonal y T-L a la ADA. f) Las flechas negras señalan los sitios de la anastomosis.
De cada paciente se obtuvieron las variables edad, sexo y el hecho de presentar o no los siguientes factores de riesgo: hábito de fumar, hipertensión arterial, diabetes, obesidad, antecedente de infarto agudo de miocardio no reciente (más de tres meses), historia familiar de cardiopatía isquémica, enfermedad pulmonar obstructiva crónica, fracción de eyección, arteriopatía periférica, número de vasos coronarios afectados, valor del Euroscore, número de anastomosis realizadas, alternativa de revascularización utilizada, uso o no de CEC, estadía postoperatoria y tiempo de seguimiento en meses.
Para evaluar los resultados de la revascularización miocárdica se tuvieron en cuenta: mortalidad, presencia de complicaciones mayores (bajo gasto postoperatorio que requirió drogas inotrópicas durante más de 48 horas y/o balón de contrapulsación intraaórtico, necesidad de una nueva reintervención coronaria, reintervención por sangrado, infarto cardiaco perioperatorio, disfunción respiratoria o neurológica que necesitó ventilación mecánica durante más de 24 horas, disfunción renal con necesidad de ultrafiltración o diálisis y mediastinitis o sepsis generalizada), además de los resultados de la prueba de esfuerzo evaluativa o la ecocardiografía de estrés con dobutamina realizada a los seis meses de la revascularización.
Análisis estadísticoLos datos de cada paciente se introdujeron en una base de datos y se procesaron en el sistema estadístico SPSS versión 15 para Windows.
Estadística descriptiva de todas las variables incluidas en el estudioLas variables cuantitativas se expresaron como media±desviación típica, en tanto que las variables cualitativas se enunciaron como valor absoluto y porcentaje.
La asociación de variables cualitativas entre sí se realizó por medio del estadístico χ2. La comparación de medias se hizo con la prueba T para comparación de la media en dos muestras independientes. Se asumió significación estadística cuando el valor de p fue ≤ a 0,05.
Aspectos ético-legalesTodos los pacientes firmaron el consentimiento informado para ser sometidos a este tipo de intervención. Se mantuvo la confidencialidad de la información recogida en cada uno de los aspectos del estudio y se solicitó autorización del servicio de cirugía cardiaca para la recolección de la misma.
ConfiguracionesRevascularización utilizando la arteria mamaria izquierda como único injertoAlternativa 1Correspondió a los pacientes con lesiones críticas (70% o más) de la arteria descendente anterior (ADA) y sin otras lesiones en las demás arterias coronarias. En la figura 1 d se observa anastomosis de la arteria mamaria interna (AMI) a la ADA, alternativa de elección cuando la lesión es única, ya sea en sus segmentos proximal, medio o distal. Cuando existe más de una obstrucción están indicados los injertos de mamaria en la ADA a saltos (fig. 1 d). La figura 1 e representa a los pacientes que presentaron, además de lesiones en la ADA, lesiones proximales en sus ramos diagonales y que fueron revascularizados a través de anastomosis secuenciales con la AMI. La situación se torna más compleja cuando las lesiones en los ramos diagonales se alejan de la ADA, con lechos distales revascularizables y que irrigan una región importante de la cara anterior del corazón. En estos casos las alternativas representadas en las figuras 1 d y e no son recomendables, pues se pueden producir acodaduras y tensión en el sitio de la anastomosis en detrimento del flujo sanguíneo de todos los territorios revascularizados distales de la cara anterior. La disección de la AMI de forma esqueletonizada y preservada en solución tibia de papaverina, permite obtener un injerto arterial de mayor longitud y calibre. En las figuras 1 a, b y c, que representan a un paciente con una lesión crítica y proximal de la ADA revascularizado con la AMI, se observa siempre un remanente de la AMI (RDAMI), que tal vez podía ser útil para revascularizar otros territorios de la cara anterior y lateral, teniendo en cuenta que, en virtud de la localización de la obstrucción en la ADA, este segmento en ocasiones tenía más de 5cm.
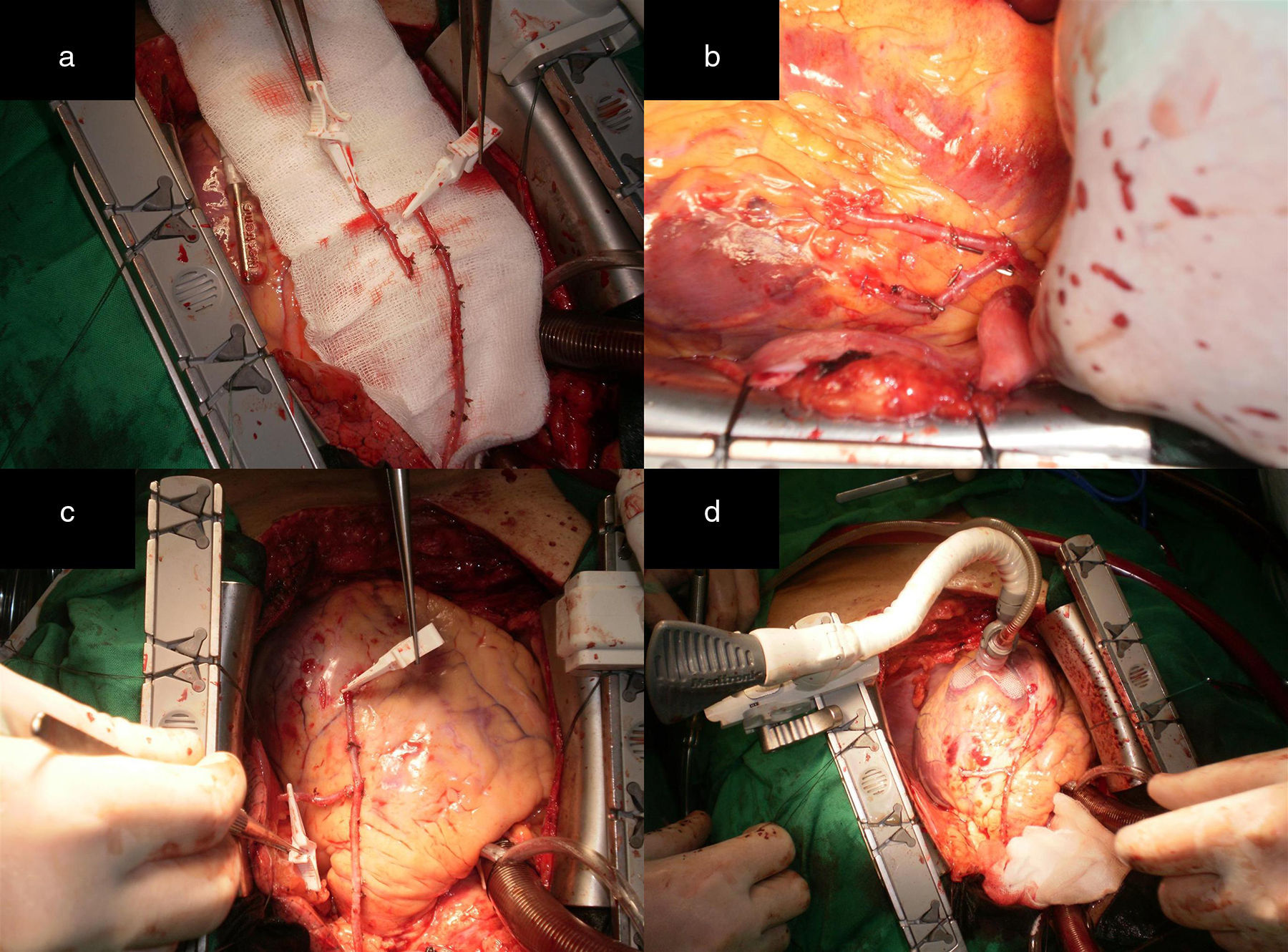
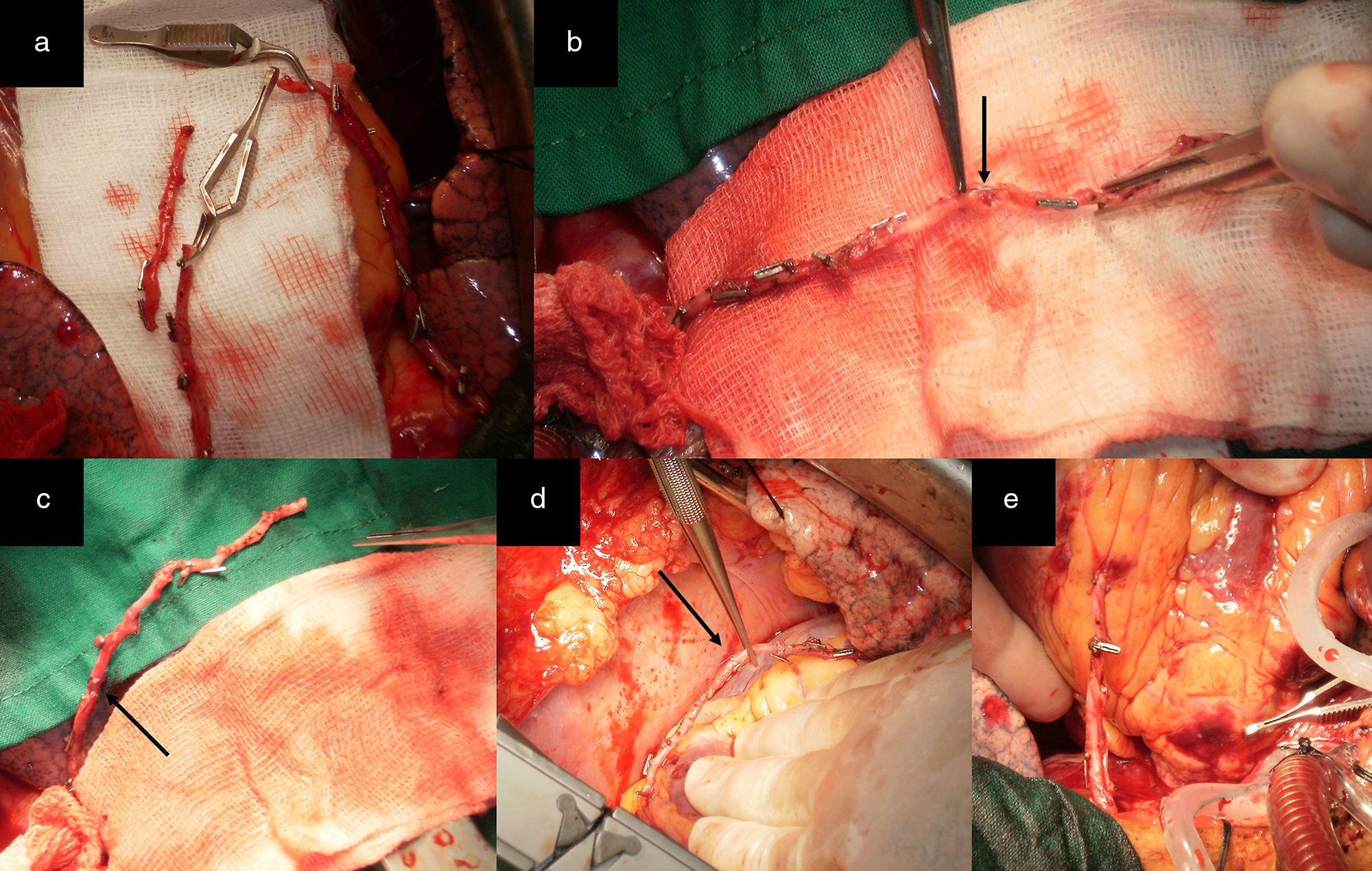
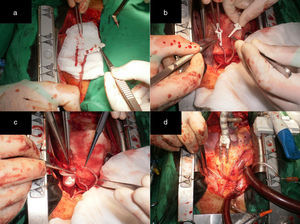
Alternativa 2Esta correspondió a pacientes con lesiones críticas en la ADA en su segmento proximal o medio y en una arteria diagonal, donde la disposición anatómica de la arteria diagonal y/o la localización de las lesiones, impidieron realizar con seguridad injertos secuenciales con la AMI. En estos casos este remanente distal de la AMI puede ser anastomosado en Y o T a la AMI proximal pediculada (esto se conoce como mini Tector) (fig. 2 a) y realizar una anastomosis término-lateral (T-L) a la arteria diagonal, logrando su revascularización sin tensión, angulaciones o acodaduras en el sitio de la anastomosis (fig. 2 b). Esta alternativa también puede ser aplicada en los siguientes casos:
- •
Pacientes con lesiones críticas proximales o medias de la ADA y en el ramo intermedio (fig. 2 c y d).
- •
Pacientes con lesiones proximales de la ADA y de la arteria circunfleja en su distribución proximal o media. Para realizar esta configuración la lesión en la ADA debe ser proximal, y cuanto más lo sea, así será la longitud del remanente distal que se tendrá para revascularizar la arteria obtusa marginal (figs. 3 y 4).
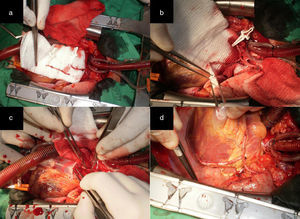
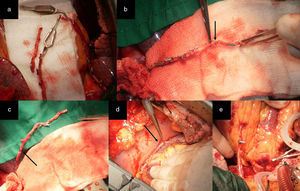
Figura 3.a) Remanente distal de la AMI. b) El RDAMI se anastomosó en Y a la AMI pediculada. c) Excelente flujo a través de ambos conductos arteriales (superior a 100mL/min). d) Anastomosis T-L en una arteria obtusa marginal que se encuentra en el segmento proximal de la distribución de la ACX. La AMI se anastomosó de forma T-L a la ADA.
(0.43MB).Figura 4.a) Remanente distal de la AMI. b) El RDAMI se anastomosó en T a la AMI pediculada. c) Excelente flujo a través de la AMI (superior a 100mL/min). d) Anastomosis T-L a una arteria obtusa marginal que se encuentra en el segmento medio de la distribución de la ACX. La AMI se anastomosó de forma T-L a la ADA.
(0.45MB).
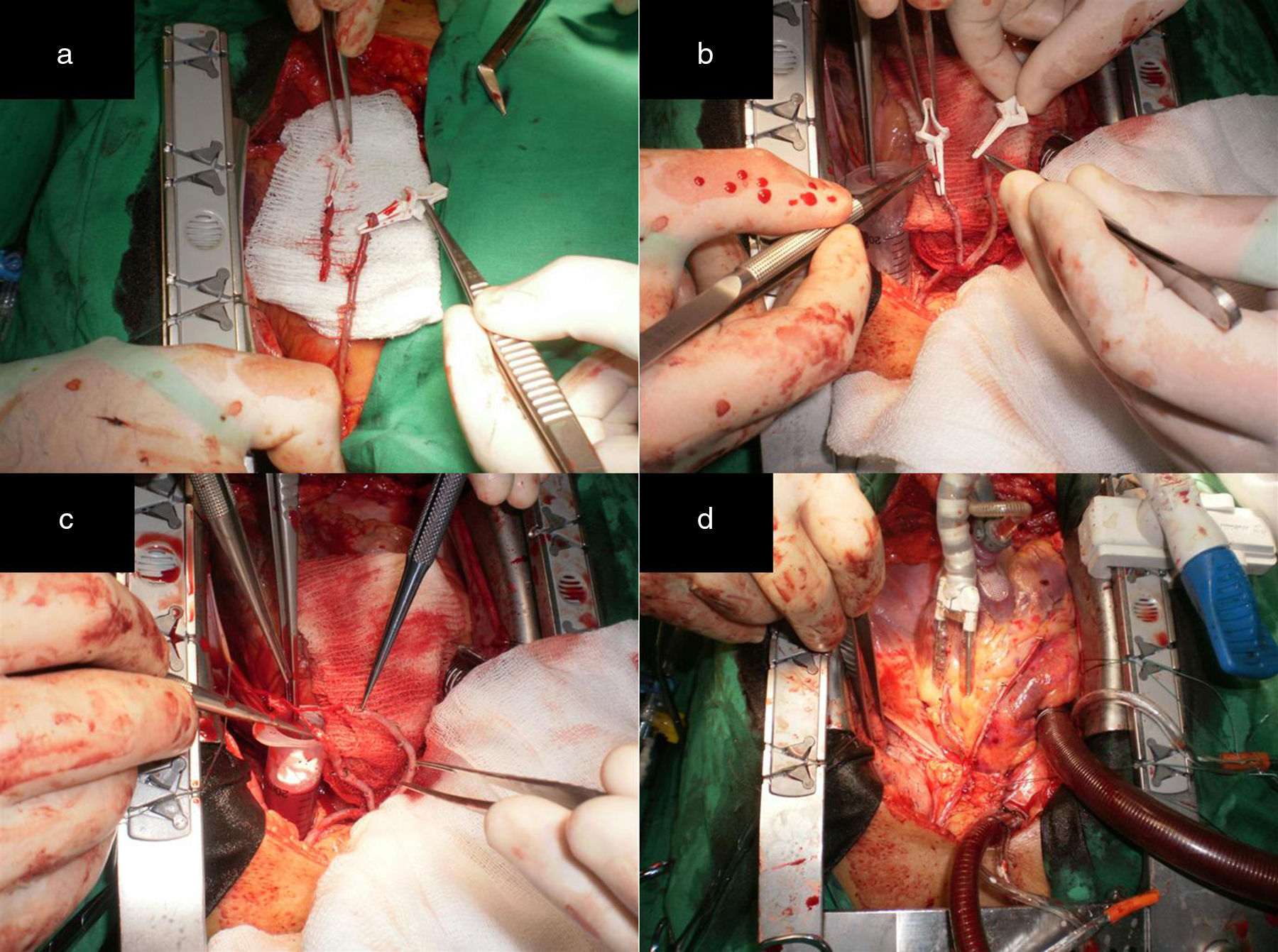
a) Remanente distal de la AMI RDAMI anastomosado primero en Y a la AMI proximal pediculada (mini Tector) y luego de forma T-L a la arteria diagonal. b) La AMI se anastomosó de forma T-L a la ADA. c) El RDAMI se anastomosó en T a la AMI pediculada en el lugar equidistante al sitio para la anastomosis en el ramo intermedio. Anastomosis T-L en el ramo intermedio. d) La AMI se anastomosó de forma T-L a la ADA.
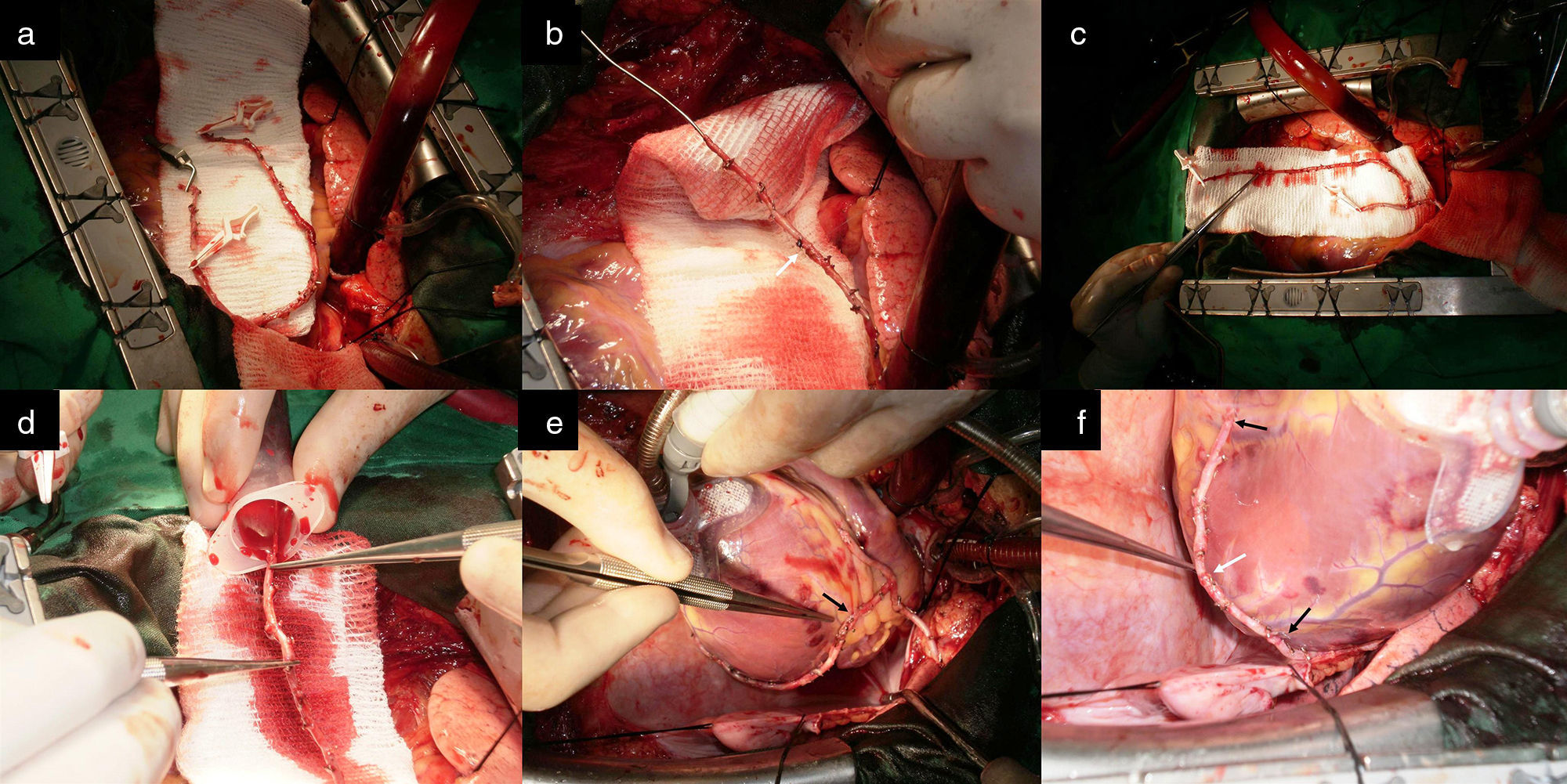
Para el desarrollo de la tercera configuración, la AMI se dejó in situ y la arteria mamaria derecha (AMD) se obtuvo como injerto libre y fue anastomosada en T a la AMI. Esta alternativa se usó para realizar la RAT en pacientes con lesión en el tronco de la arteria coronaria izquierda, lesiones críticas en los tres vasos coronarios principales y lesiones críticas en la ADA y en la arteria circunfleja (ACX). Con la AMI se revascularizó la región anteroseptal del corazón y con la AMD las regiones lateral y posterior del mismo a través de injertos secuenciales (fig. 5).
Alternativa 4Para la realización de la cuarta y quinta configuraciones es necesario que la lesión en la ADA sea proximal, lo que permite obtener un remanente distal de la arteria mamaria interna (RDAMI) para ser usado como extensión del injerto de AMD. La AMI fue anastomosada de forma T-L a la ADA.
La cuarta configuración técnica es aplicable a pacientes con lesiones críticas en el tercio proximal de la ADA, en la arteria coronaria derecha (ACD) o en el origen de la arteria descendente posterior (ADP), y sin lesiones en la ACX. El RDAMI, se usó para extender en longitud la arteria mamaria derecha y revascularizar la cara inferior del corazón (fig. 6). Con esta configuración se obtuvieron dos entradas de flujo sanguíneo al corazón.
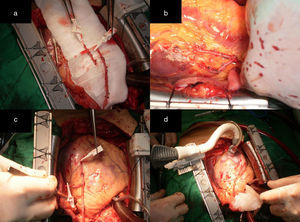
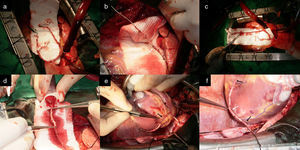
a) Ambas arterias mamarias esqueletizadas y RDAMI. b) Anastomosis T-T del remanente de AMI a la AMD in situ. La flecha negra muestra el sitio de anastomosis de la extensión en la AMD in situ, que permitió alcanzar la ADP para realizar una anastomosis T-L sin tensión. c) y d) La flecha negra muestra el sitio de anastomosis de la extensión en la AMD anastomosada previamente en T a la AMI in situ, que posibilitó alcanzar la ADP para realizar una anastomosis T-L sin tensión. e) Anastomosis T-L de la AMI a la ADA.
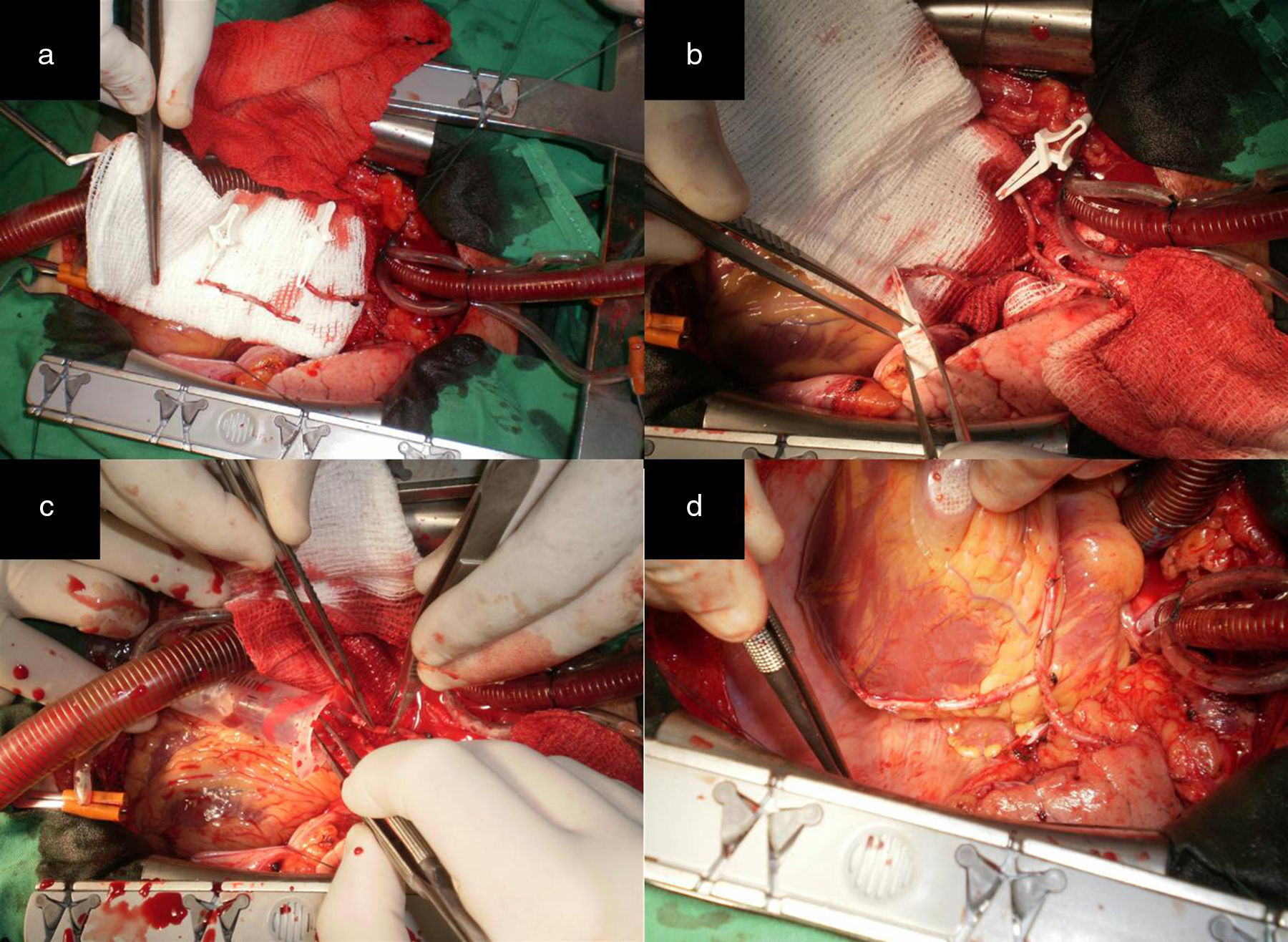
La figura 7 ilustra una configuración muy útil para lograr la RAT en pacientes con ventrículo izquierdo dilatado o remodelado. Esta alternativa fue adoptada en pacientes con lesiones críticas y proximales de los tres vasos coronarios principales. A diferencia de la anterior, la AMD se obtiene como injerto libre, se anastomosa en T a la AMI y es extendida con el RDAMI. La ADA fue revascularizada con la AMI, y con la AMDE fueron revascularizadas las regiones lateral y posterior del corazón.
a) Muestra ambas arterias mamarias esqueletizadas y el RDAMI. b) La AMD fue anastomosada en T a la AMI. c) La flecha blanca indica el sitio de la anastomosis T-T del remanente de AMI a la AMD. Se observa la AMD extendida que asegura longitud suficiente para revascularizar las caras lateral y posterior de un corazón dilatado. d) La punta de la pinza señala el sitio de la anastomosis. Excelente flujo a través de AMD extendida (superior a 100mL/min). e) y f) La AMI fue anastomosada de forma T-L a la ADA y con la AMDE se hicieron anastomosis mamario-coronarias L-L secuenciales al ramo intermedio, a la arteria obtusa marginal y T-L a la ADP de la ACD sin tensión (flechas negras). Las flechas blancas muestran el sitio de anastomosis en la AMDE.
La sexta configuración técnica correspondió a un paciente con lesiones críticas de la ADA en su tercio medio, una arteria diagonal y de la ACX en su origen, sin lesiones en la ACD. La localización de las lesiones y el sitio elegido para la anastomosis en la arteria diagonal impedían realizar un injerto secuencial con la AMI, por lo que se decidió utilizar el remanente distal de la AMD y anastomosarlo en Y a la AMI para revascularizar la arteria diagonal (fig. 8 a y b). La AMI fue anastomosada a la ADA y la AMD a la arteria obtusa marginal.
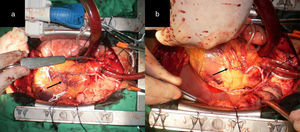
a) y b) Muestra la AMI, la AMD anastomosada en T a la AMI y la flecha negra señala al remanente distal de la AMD que fue anastomosado a la AMI en un sitio equidistante al sitio para la anastomosis en la arteria diagonal. Representa la RAT, donde AMI fue anastomosada T-L a la ADA, el remanente distal de la AMD T-L a la arteria diagonal (flecha negra) y la AMD fue anastomosada T-L a la arteria obtusa marginal.
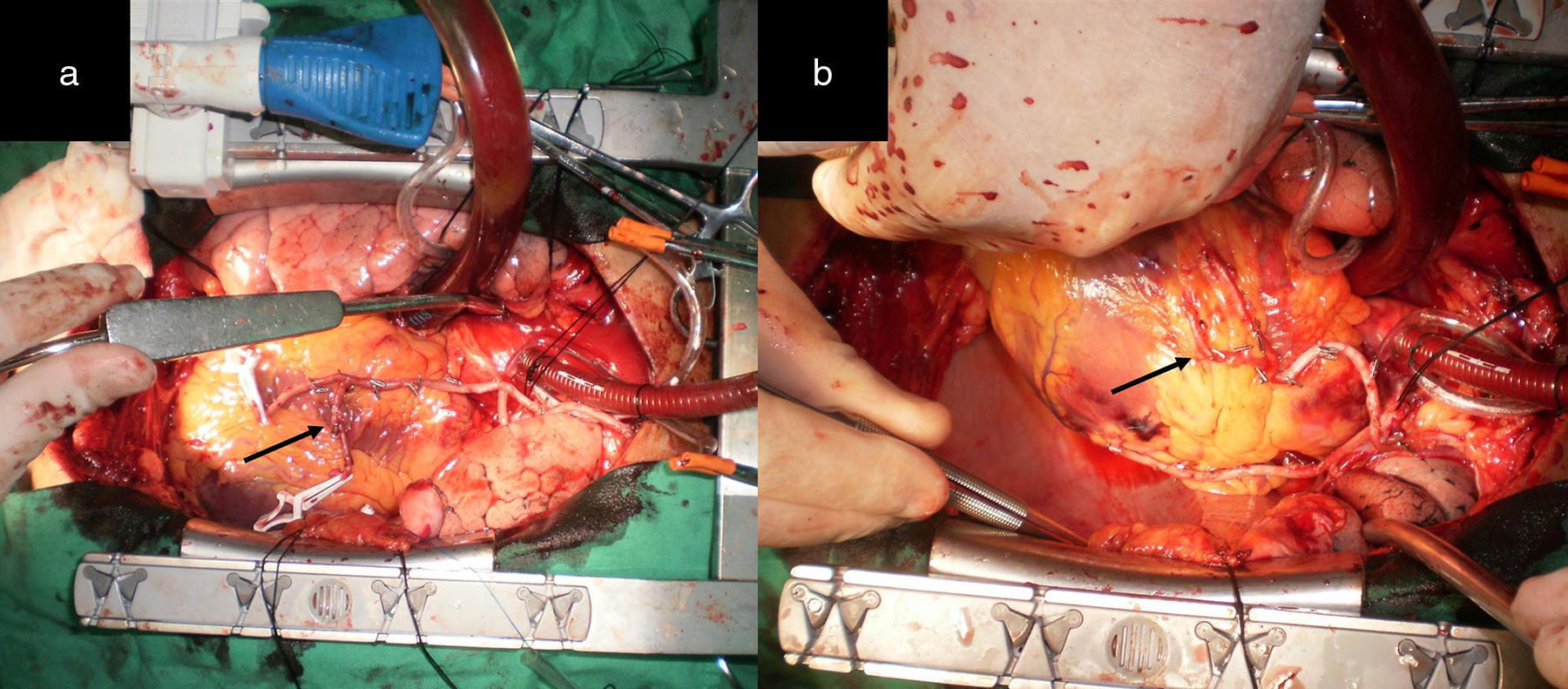
La figura 9 representa la séptima configuración técnica, que corresponde a un paciente con lesiones críticas en el tercio medio de la ADA y en el origen de la ADP, sin lesiones en la ACX y un ventrículo izquierdo dilatado. La AMD se anastomosó en forma T-T a la AMI. Para lograr la revascularización, la AMI fue anastomosada en L-L a la ADA y la AMD en T-L a la ADP.
Estas configuraciones pueden ser desarrolladas con o sin el uso de circulación extracorpórea de acuerdo con la preferencia y experiencia de los cirujanos. Todas las anastomosis fueron hechas con prolene 8/0.
ResultadosEn esta serie de pacientes predominó el sexo masculino y los factores de riesgo más frecuentes fueron la hipertensión arterial y el hábito de fumar. No se registró antecedente de enfermedad pulmonar obstructiva crónica y arteriopatía periférica en ninguno de los casos, por lo que no se tuvieron en cuenta en el análisis estadístico. En cuanto al número de vasos coronarios afectados, predominaron los pacientes con enfermedad de los tres vasos coronarios (tabla 1).
Distribución de los pacientes según sexo y otras variables cualitativas estudiadas
| Sexo | n | % |
|---|---|---|
| Masculino | 29 | 82,9 |
| Femenino | 6 | 17,1 |
| Total | 35 | 100 |
| Hábito de fumar | 20 | 57,1 |
| Hipertensos | 21 | 60 |
| Diabéticos | 6 | 17,2 |
| Obesidad | 5 | 14,3 |
| Historia familiar | 10 | 28,6 |
| Infarto agudo de miocardio previo | 11 | 31,4 |
| Enfermedad de TCI | 2 | 5,7 |
| Enfermedad de TCI y ACD | 3 | 8,6 |
| Enfermedad de tres vasos | 18 | 51,4 |
| Enfermedad de dos vasos | 7 | 20 |
| Enfermedad de un vaso | 5 | 14,3 |
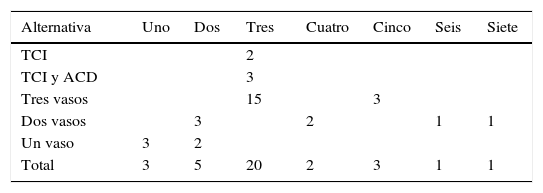
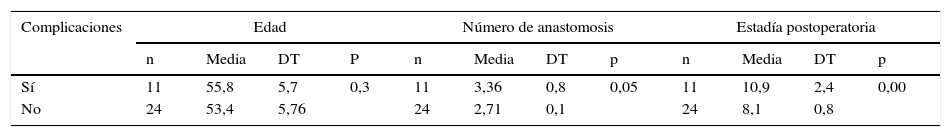
La media de la edad, el número de anastomosis por paciente y la estadía postoperatoria se recogen en la tabla 2. Todos los pacientes tenían buena fracción de eyección en el momento de la cirugía (≥ 50%), por lo que no se tuvo en cuenta en los análisis estadísticos. En la tabla 3 se aprecia que, a pesar de que el promedio total de anastomosis por pacientes está por debajo de tres, cuando se analizó de forma particular respecto al número de vasos coronarios afectados se constató que el promedio de anastomosis estuvo por encima del número de vasos coronarios afectados, lo que demuestra que todos los pacientes fueron revascularizados de forma completa. En la tabla 4 se muestra que las alternativas de revascularización siempre se desarrollaron teniendo en cuenta los vasos coronarios lesionados, el sitio de las estenosis y el tamaño de la cavidad ventricular izquierda. El conocimiento de todas estas alternativas posibles es importante si se tiene en cuenta que el objetivo principal es alcanzar la RAT con el uso de AAM sin la necesidad de otro conducto arterial. Esta serie de pacientes corresponde a 35 casos consecutivos, con 60 años o menos, en quienes fue posible lograr la RAT con AAM utilizando alguna de las alternativas descritas. La obtención de AAM de forma esqueletizada y su conservación en solución de papaverina tibia también contribuyó a alcanzar este propósito pues aumentaron en longitud y flujo sanguíneo.
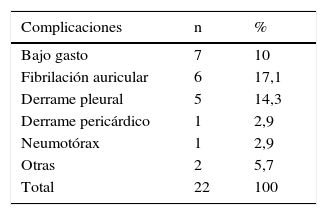
No hubo fallecimientos ni complicaciones mayores. Se reportaron un total de 22 complicaciones en 11 pacientes (tabla 5). La más frecuente fue el bajo gasto cardiaco. Las causas más comunes fueron atontamiento miocárdico, hipovolemia, vasoplejía y trastornos metabólicos posperfusión. Ninguno de los pacientes sufrió infarto miocárdico perioperatorio. De los pacientes con derrame pleural, dos necesitaron ser evacuados. Otras complicaciones fueron la presencia de íleo paralítico en un paciente que además presentó bajo gasto cardiaco y a quien fue necesario evacuarle un derrame pleural, y un paciente con sepsis urinaria.
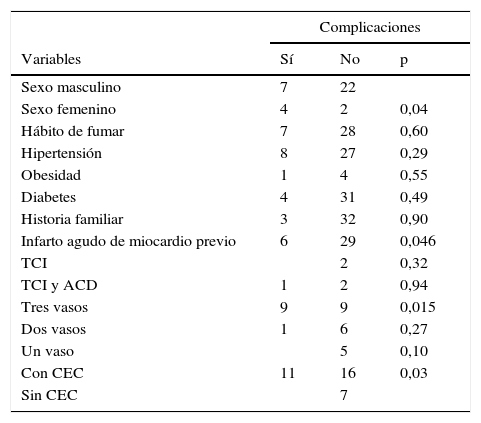
Las tablas 6 y 7 muestran la presencia de complicaciones y su relación con las variables preoperatorias estudiadas. Estuvieron relacionados de forma significativa el sexo femenino, el antecedente de infarto miocárdico previo, la enfermedad de los tres vasos coronarios, el uso de CEC, el número de anastomosis realizadas y la estadía postoperatoria.
Complicaciones según el sexo y las variables cualitativas estudiadas
| Complicaciones | |||
|---|---|---|---|
| Variables | Sí | No | p |
| Sexo masculino | 7 | 22 | |
| Sexo femenino | 4 | 2 | 0,04 |
| Hábito de fumar | 7 | 28 | 0,60 |
| Hipertensión | 8 | 27 | 0,29 |
| Obesidad | 1 | 4 | 0,55 |
| Diabetes | 4 | 31 | 0,49 |
| Historia familiar | 3 | 32 | 0,90 |
| Infarto agudo de miocardio previo | 6 | 29 | 0,046 |
| TCI | 2 | 0,32 | |
| TCI y ACD | 1 | 2 | 0,94 |
| Tres vasos | 9 | 9 | 0,015 |
| Dos vasos | 1 | 6 | 0,27 |
| Un vaso | 5 | 0,10 | |
| Con CEC | 11 | 16 | 0,03 |
| Sin CEC | 7 | ||
Está demostrado que el sexo femenino es un factor de riesgo en cirugía cardiaca al igual que el antecedente de infarto miocárdico previo. El uso de CEC desencadena una respuesta inflamatoria sistémica que hace que los pacientes estén más propensos a presentar complicaciones postoperatorias, y que además está directamente relacionada con el tiempo de perfusión. Su relación con el número de anastomosis es indicativa de la extensión de la enfermedad coronaria, hecho al que además se suma un mayor tiempo de CEC.
De forma general, la evolución postoperatoria estuvo matizada por la ausencia de fallecidos y de complicaciones mayores. Seis meses después, a todos los pacientes se les realizó una prueba de esfuerzo evaluativa o una ecocardiografía de estrés con dobutamina para evaluar los resultados de la revascularización coronaria y no se evidenciaron signos de isquemia en los territorios revascularizados. En la actualidad están asintomáticos e incorporados a sus labores habituales y sin evidencia de nuevos eventos isquémicos en los controles realizados cada seis meses.
DiscusiónNo existen dudas de que la revascularización coronaria con el uso de injertos arteriales es la mejor opción para los pacientes jóvenes con enfermedad de las arterias coronarias tributarios de tratamiento quirúrgico, y que los injertos de arteria mamaria son los mejores conductos arteriales y los más duraderos. Numerosos injertos arteriales han sido utilizados para lograr la RAT, entre los que se encuentran las arterias mamarias, así como la radial, gastroepiploica y epigástrica. Se han descrito varias configuraciones usando combinaciones de estos injertos arteriales, para alcanzar la RAT15,16. En este artículo se describen siete configuraciones, con las que se logró la RAT, usando solamente AAM y el segmento distal de una de ellas como únicos injertos arteriales.
Los injertos de mamaria tienen otras ventajas como: calibre y morfofisiología similares a los de las arterias coronarias, suficiente reserva de flujo para suplir las necesidades del corazón tanto en reposo como ante situaciones de demanda aumentada; además, se afectan menos por el flujo competitivo que el resto de los injertos, no son atacados por la hiperplasia intimal, se eliminan las complicaciones relacionadas con la safenectomía, se evitan las complicaciones cerebrovasculares relacionadas con la manipulación de la aorta, y el vasoespasmo es menos frecuente que cuando se usan otros injertos arteriales. En los pacientes que en el futuro necesiten una nueva reintervención, la reentrada esternal es más segura y se eliminan los riesgos de embolia por la manipulación de los injertos venosos5,13,17–21. Para aprovechar las ventajas de los injertos de mamaria se ha tratado de aumentar su longitud, incluso cuando su disección se realiza de forma no esqueletonizada, y usarla más allá de su bifurcación. La disección de las arterias mamarias de forma esqueletonizada permite obtener un conducto de mayor longitud y con menor riesgo de sepsis mediastinal. En los pacientes del estudio se desecharon los segmentos de mamaria distales a la bifurcación, por contener más fibras musculares y estar más propensos a presentar lesiones ateroscleróticas. Los excelentes resultados reportados por Tector en los pacientes revascularizados con las arterias mamarias en sus artículos1–5,11–14 han sido corroborados por artículos más recientes17–24, lo que evidencia la vigencia en nuestros días de la técnica que tanto ha defendido a lo largo de su carrera. En estos artículos se reportan indicadores muy bajos de mortalidad y complicaciones mayores a corto, mediano y largo plazo, similares a los reportados en este trabajo pero con un seguimiento medio de 13,1 meses. Navia et al.19 en su serie de pacientes con un riesgo medio mayor que el aquí se reportó (media del Euroscore 2,7±3,1), informó de una mortalidad a los 30 días de solo 0,88%. Logró la RAT en el 100% de sus pacientes con la técnica descrita por Tector13 y realizando la disección de la AMD más allá de su bifurcación, con lo que se garantizó la RAT en pacientes con ventrículo izquierdo aumentado de tamaño. Estimamos que es importante señalar que también influyen en nuestros resultados el hecho de que los pacientes son relativamente jóvenes, con escasas comorbilidades, y buena función ventricular, o que en más del 90% de los casos las arterias mamarias fueron disecadas de forma esqueletizada y en todos se realizó la RAT. Estudios reportan que no puede ignorarse que esta última mejora la supervivencia de los pacientes revascularizados24 y que continúa aumentando la evidencia que tiene el uso de AAM sobre el mejoramiento de la supervivencia25.
Estas alternativas evitan el uso de la vena safena como injerto aortocoronario u otro injerto arterial ya sea como injerto libre anastomosado a la AMI, a la AMD o a la aorta, para completar la revascularización. Se evitan las complicaciones relacionadas con la manipulación de la aorta y las derivadas de la disección de otros conductos. Los pacientes diabéticos o con enfermedad pulmonar obstructiva crónica se pueden beneficiar con estas alternativas, primero por la disección de forma esqueletonizada de las arterias mamarias y segundo al no ser necesario disecar la AMD, en algunos casos, para completar la revascularización arterial. De igual forma, se pueden beneficiar los pacientes con lechos distales finos, en quienes la desproporción entre el calibre de la vena safena y el vaso coronario hace que estos injertos no tengan buenos resultados, las mujeres que habitualmente tienen vasos coronarios finos y los enfermos con aorta de porcelana. Otras ventajas son la optimización de los injertos, ya sean arteriales o venosos, en pacientes relativamente jóvenes que pueden ser candidatos a futuras nuevas revascularizaciones y que permite a los cardiólogos intervencionistas tratar obstrucciones de las anastomosis realizadas con el remanente distal sin comprometer la anastomosis distal en la ADA5,11–13,17–24.
Nuestra técnica habitual para revascularización coronaria en los pacientes jóvenes es la RAT con el uso de AAM de forma esqueletonizada y donde a AMD se anastomosa en Y o T, como lo describió Tector13,14, y más recientemente lo desarrollaron otros autores18–21. Esta corresponde a la tercera configuración de nuestro trabajo, con la cual se revascularizó a la mayoría de los pacientes.
Para el desarrollo de las configuraciones es preciso tener en cuenta el número de vasos coronarios afectados, la localización de las lesiones, el tipo de anastomosis y la disposición y variedad de los injertos15.
Otros autores han reportado otras configuraciones usando el segmento distal de la AMI. Prapas et al.26 en su artículo usan el remanente distal de la ADA, en algunos pacientes, anastomosado a la AMD (previamente anastomosada en T a la AMI) para alcanzar a revascularizar una arteria AD, el ramo intermedio o la primera obtusa marginal. Esto es similar a la configuración 6 de nuestro trabajo, pero en este se usó el remanente distal de la AMD, anastomosado a la AMI para alcanzar la AD. Prefieren dejar de 4 a 6cm proximales de la AMD in situ para anastomosar la arteria radial y alcanzar la ADP. En nuestro trabajo se logró alcanzar la ADP, después de obtener la AMD como injerto libre y extenderla con el RDAMI (configuración 5). Esta configuración es muy útil para lograr la RAT en pacientes con ventrículo izquierdo dilatado o remodelado.
Bonacchi et al.27, en un paciente con enfermedad de los tres vasos coronarios, usó el segmento distal de la AMI anastomosado de forma término-lateral a la AMD para lograr la revascularización de la ACD, mientras que la AMD fue destinada para revascularizar el territorio circunflejo. Con la AMI revascularizaron la ADA. Con esta configuración, a nuestro juicio, se puede provocar tensión sobre la línea de sutura si fuera necesario vascular el corazón para revisión de las anastomosis y hacer hemostasia. Buxton16 reporta la extensión de la AMD in situ con la arteria radial para alcanzar la ADP. En la configuración 4 se mostró que es posible extender la AMD con el RDAMI y alcanzar la ADP sin tensión.
Tector en uno de sus artículos13 plantea que si la AMI resulta lesionada en su parte proximal durante su disección, puede ser seccionada a ese nivel y anastomosada de forma término-terminal a la AMD in situ. En nuestro artículo, de forma similar, en un paciente con una lesión media de la ADA y proximal de la ACD, se anostomosó la AMD pediculada a la AMI in situ, lográndose la RAT (fig. 9).
a) y b) La AMD (flecha blanca) se anastomosó T-T a la AMI (flecha negra inferior). En esta misma figura la flecha negra superior muestra el excelente flujo por la AMD después de anastomosada a la AMI. c) y d) La AMI fue anastomosada L-L a la ADA (ver flecha negra). Las flechas negras muestran el recorrido de la AMD hasta la ADP. Muestra la AMD anastomosada de forma T-L a la ADP (ver flecha blanca).
Bakay et al.28 recientemente reportaron la RAT en 92 pacientes utilizando la AMD in situ para revascularizar la ADA y también disecaron la AMI más allá de su bifurcación para obtener más longitud; como injerto in situ la utilizaron para revascularizar las regiones lateral y posterior del corazón. Reportaron un fallecimiento de causa no cardiaca e incidencia baja de complicaciones (cinco pacientes con sepsis mediastinal, que relacionan con la disección de la AMI más allá de la bifurcación y cinco reintervenciones por sangrado). Un 23,5% de sus pacientes presentaron fibrilación auricular. En nuestro caso, se prefirió no extender la disección de AAM más allá de la bifurcación por los motivos ya expuestos en este mismo documento.
No son frecuentes los artículos donde se estudie el tema de las configuraciones en cirugía coronaria y la mayoría de estos abordan esta temática utilizando varios injertos arteriales para lograr la RAT. Nuestro trabajo aborda este difícil tema, pero esta vez para alcanzar la RAT usando solamente AAM. En esta serie de pacientes y de forma consecutiva, fue posible revascularizar a todos los pacientes con alguna de las configuraciones descritas. Se estima que la novedad de esta investigación radica en que demostró la plasticidad y versatilidad de configuraciones con las que se pueden usar una o ambas arterias mamarias como únicos injertos arteriales para lograr la RAT.
No hay dudas de que siempre que se deba revascularizar a un paciente joven, los mejores injertos son AAM. Estos pacientes necesitarán nuevas revascularizaciones en el futuro, y por tanto, es necesaria y debe tenerse en cuenta la optimización de injertos. Los resultados obtenidos en los pacientes revascularizados con estas configuraciones son buenos y ya se están aplicando en pacientes con mayor riesgo quirúrgico.
Como conclusión se resalta que cada paciente a revascularizar con una de estas alternativas debe ser individualizado y sometido a una evaluación, donde se considere, además de edad, sexo, factores de riesgo, comorbilidades y función cardiaca, la disposición anatómica de los sistemas coronarios, la localización y la extensión de las lesiones, el calibre de los lechos distales, así como el tamaño del ventrículo izquierdo. Esto permitirá seleccionar la alternativa de revascularización que necesita cada paciente utilizando una o ambas arterias mamarias y el segmento distal de una de ellas, sin la necesidad de usar otro injerto.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.