El mapeo en electrofisiología cardiovascular es la técnica que permite delimitar una zona del endocardio y/o del epicardio, considerada de interés diagnóstico y/o terapéutico, donde se encuentra circunscrita una arritmia, su origen o región crítica que la promueve.
Para su realización tradicionalmente se insertan electrocatéteres en el endocardio y/o epicardio, por vía venosa, arterial o pericárdica mediante la ayuda de los rayos “X”. Los electrocatéteres tienen dos funciones principales, servir de referencia radio-anatómica y permitir, simultáneamente al conectarse a sistemas computarizados, la captura, la ampliación, el registro y la reproducción de señales eléctricas provenientes de zonas específicas del corazón (por ejemplo: haz de His, seno coronario, ventrículo y aurícula derecha) (fig. 1).
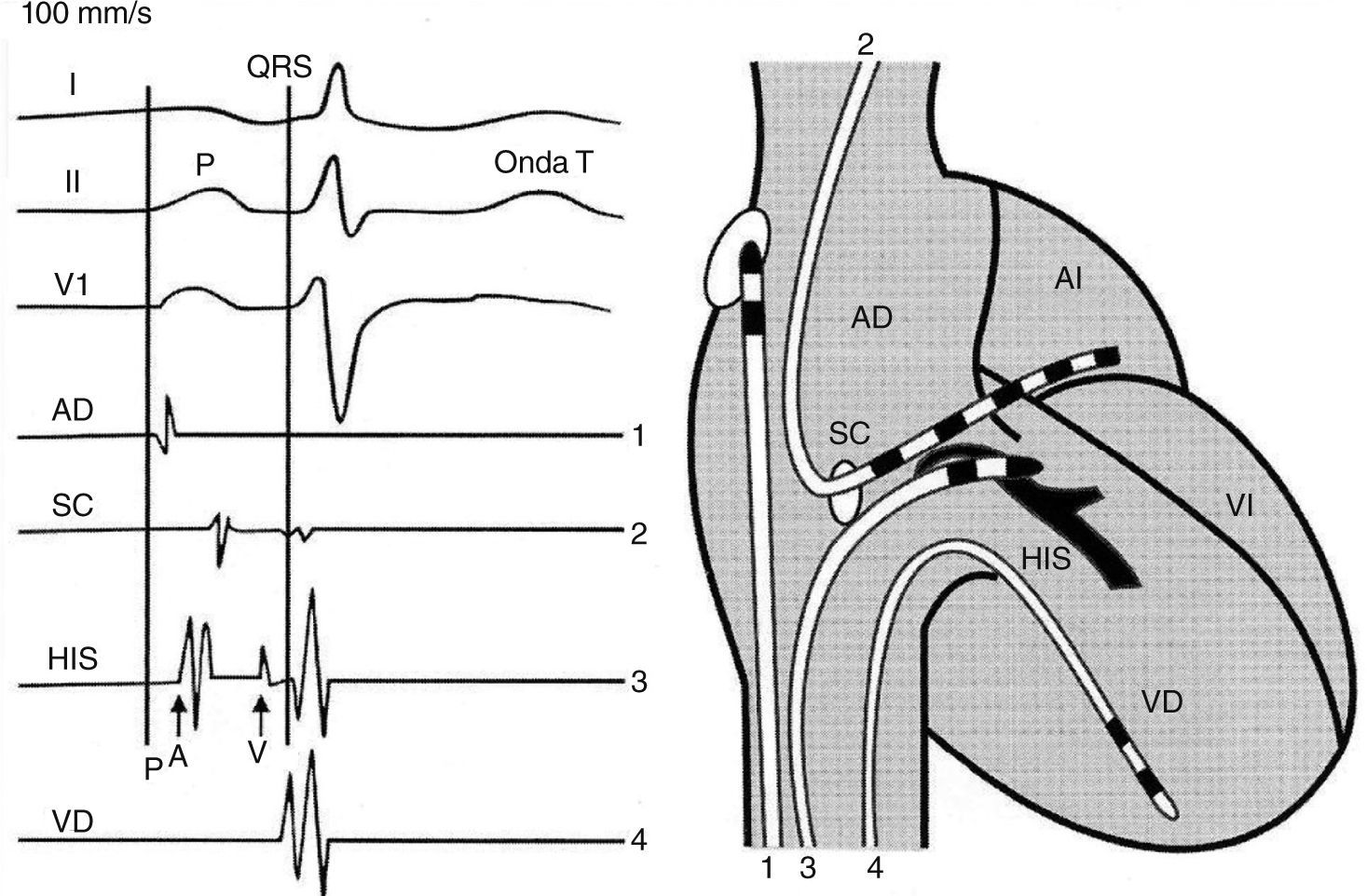
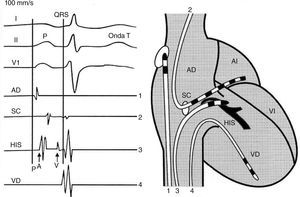
Registro de tres derivaciones del electrocardiograma de superficie, de las señales eléctricas endocavitarias o electrogramas de la aurícula, seno coronario, has de His y ventrículo derecho respectivamente de arriba a abajo. Los electrogramas proceden de los electrocatéteres que se muestran gráficamente en la silueta cardiaca contigua y se correlacionan con ondas, intervalos y complejos del electrocardiograma. Tomado con permiso de Vanegas1.
El registro y la caracterización de las señales eléctricas endocavitarias o electrogramas provenientes de áreas específicas del corazón constituye el “abecedario” que permite entender y diagnosticar las arritmias cardiacas. Estas señales se correlacionan en ritmo sinusal o durante una arritmia (taquicardia supraventricular o ventricular), con las ondas e intervalos del electrocardiograma de superficie, lo cual permite determinar su procedencia o correspondencia, y establecer relaciones entre las señales auriculares y ventriculares, su posición u orden en el tiempo facilitando su identificación y diagnóstico1.
La técnica de mapeo convencional, ampliamente validada, tiene sin embargo las siguientes desventajas:
- 1.
No es tridimensional, esto es, el punto donde se encuentra potencialmente el origen o zona crítica de una arritmia tiene una representación en el plano superior-inferior y derecho-izquierdo pero no anterior-posterior. Esto introduce variaciones anatómicas del sitio exacto que se pretende encontrar para realizar un tratamiento como la ablación por radiofrecuencia. Este mismo asunto implica navegación imprecisa y un margen de error amplio dado que no es posible volver con certeza a un punto específico de interés, bien sea un sitio previo de ablación o de registro.
- 2.
Requiere el uso permanente de los rayos “X”, lo que implica exposición radiológica para el paciente, el médico y el personal de la sala de procedimientos. Esta exposición puede ser prolongada y deletérea especialmente en procedimientos complejos como los relacionados con taquicardia ventricular y fibrilación o taquicardias auriculares.
- 3.
No es posible establecer una correlación precisa entre la amplitud de la señal eléctrica y su sitio de procedencia o región anatómica del corazón. Por ejemplo, no es posible delimitar y visualizar zonas inertes del corazón que estén desempeñando un papel en la generación de las arritmias, tal cual sucede en las taquicardias ventriculares relacionadas con cicatrices de infarto previo. El mapa de ese substrato anatómico (cicatriz) ha cobrado especial interés dado que es susceptible de modificarlo mediante el uso de la ablación por radiofrecuencia atenuando o anulando la posibilidad de que arritmias ventriculares se incuben en las anormalidades anatomo-estructurales y funcionales que se suscitan a dicho nivel.
- 4.
La estructura endocárdica no es visible y consecuentemente la “estela” eléctrica de una arritmia no es reconocible en su trayectoria de desplazamiento. Esto reviste importancia, es decir la potencial visualización de la trayectoria de una arritmia, en las taquicardias que se perpetúan a través de zonas cicatriciales u obstáculos electro-anatómicos endocavitarios (taquicardias macro-reentrantes, aleteos auriculares, taquicardias ventriculares, arritmias en cardiopatías congénitas).
Las anteriores circunstancias llevaron al desarrollo de una técnica llamada reconstrucción y/o mapeo tridimensional, que revolucionó el ejercicio de la electrofisiología cardiovascular invasiva al permitir la aplicación de diversos programas computarizados que facilitaban la reconstrucción tridimensional de las cámaras cardiacas, visualizaban el flujo de las corrientes eléctricas y caracterizaban simultáneamente el tejido de acuerdo con su señal eléctrica en viable o necrótico, estableciendo así diferentes tipos de mapeo endocavitario tridimensional1.
Por lo tanto, el mapeo tridimensional permite en la actualidad abordar arritmias cardiacas causadas por diversos mecanismos representando un complemento de altísimo valor para el estudio electrofisiológico, el mapeo endocavitario y la ablación por radiofrecuencia1.
Principios básicos de la reconstrucción tridimensionalLos sistemas de mapeo tridimensional disponibles hoy se dividen principalmente en dos tipos: basado en el principio de campo electromagnético (CARTO®) o basado en el principio del gradiente de voltaje (ENSITE VELOCITY®).
Sistema CARTO®En este tipo de mapeo tridimensional se tienen los siguientes conceptos:
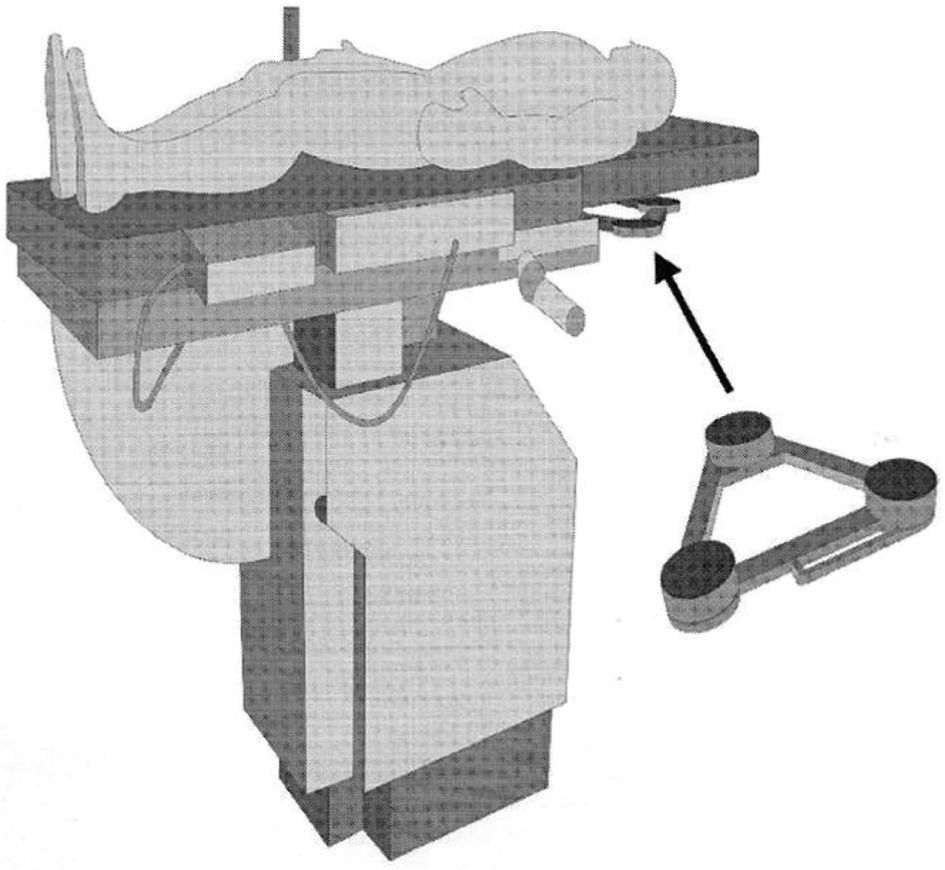
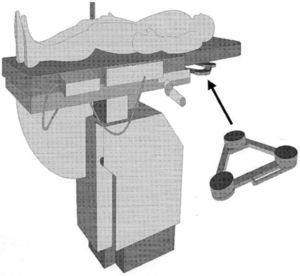
Concepto del campo magnéticoEsta técnica y/o equipo utiliza la creación de un campo magnético de carácter inducido o artificial, de magnitud ultra-baja equivalente a 0,000005 o 5 x 10(-6) Teslas. El campo magnético es generado a partir de tres magnetos diferentes situados en los extremos de un triángulo que se ubica inmediatamente bajo la tabla del equipo de rayos “X” o fluoroscopia en el área correspondiente al tórax del paciente (fig. 2). La radiación magnética generada tiene como una de sus propiedades físicas la tensión magnética cuya magnitud es inversamente proporcional a la distancia de la fuente radiante. Es decir, la tensión magnética es mayor cuando la distancia a la fuente es menor y viceversa2,3.
Dispositivo de tres polos magnéticos que se ensambla inmediatamente debajo de la mesa del equipo de fluoroscopia, en la región correspondiente al área donde se ubica el tórax del paciente. Tomado con permiso de Vanegas1.
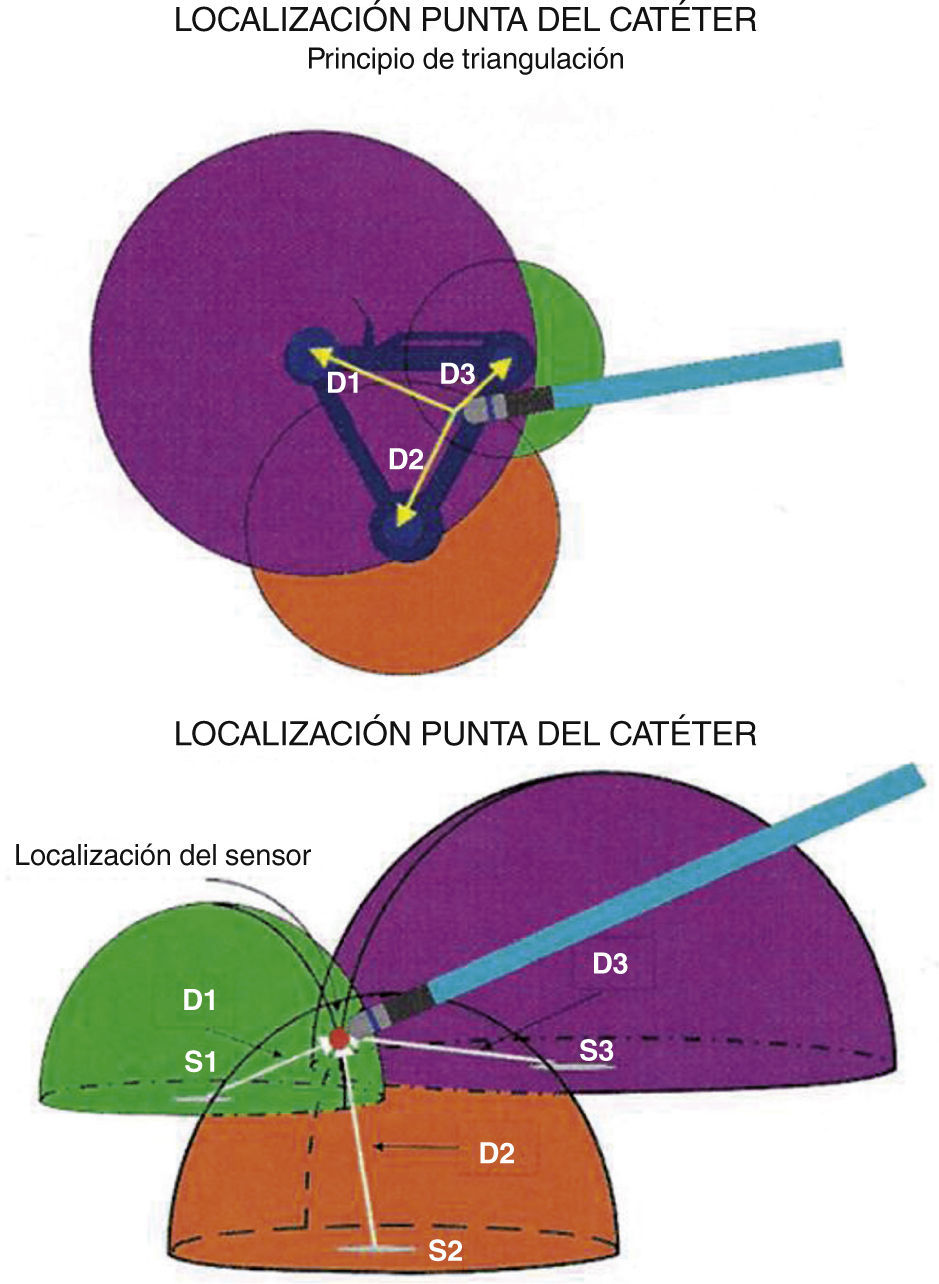
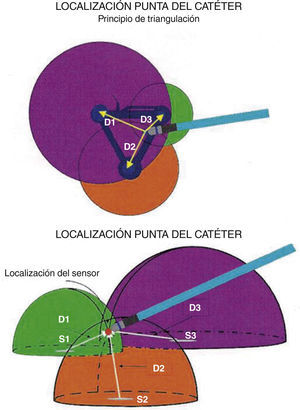
El sistema utiliza un electrocatéter que tiene en su punta un sensor magnético miniaturizado. Cuando dicho catéter se introduce en el endocardio y entra en el área de influencia de los campos magnéticos se puede establecer la distancia, posición y orientación del mismo al comparar las tensiones magnéticas generadas por cada polo. Un sistema computarizado realiza los cálculos algebraicos necesarios para conocer dicha posición en las tres dimensiones: X, Y y Z (fig. 3). Si se obtiene la posición tridimensional exacta de muchos puntos y estos se unen entre sí, es posible crear un “casquete” endocárdico, una estructura tridimensional; a más puntos, más definición de esa estructura, esto es un mapa tridimensional2,3. Un parche de referencia es fijado en la región de la espalda del paciente para cubrir la cámara cardiaca de interés. Si la localización del magneto de referencia o el parche llegan a desplazarse durante el procedimiento, su localización original es registrada por el sistema CARTO® para permitir un reposicionamiento apropiado.
Concepto de campo magnético y triangulación con base en la tensión magnética que se genera en cada polo magnético. Un punto en el espacio puede ser documentado en las tres dimensiones de acuerdo con el cálculo algebraico de la diferencia de tensiones magnéticas entre los tres polos. Tomado con permiso de Vanegas1.
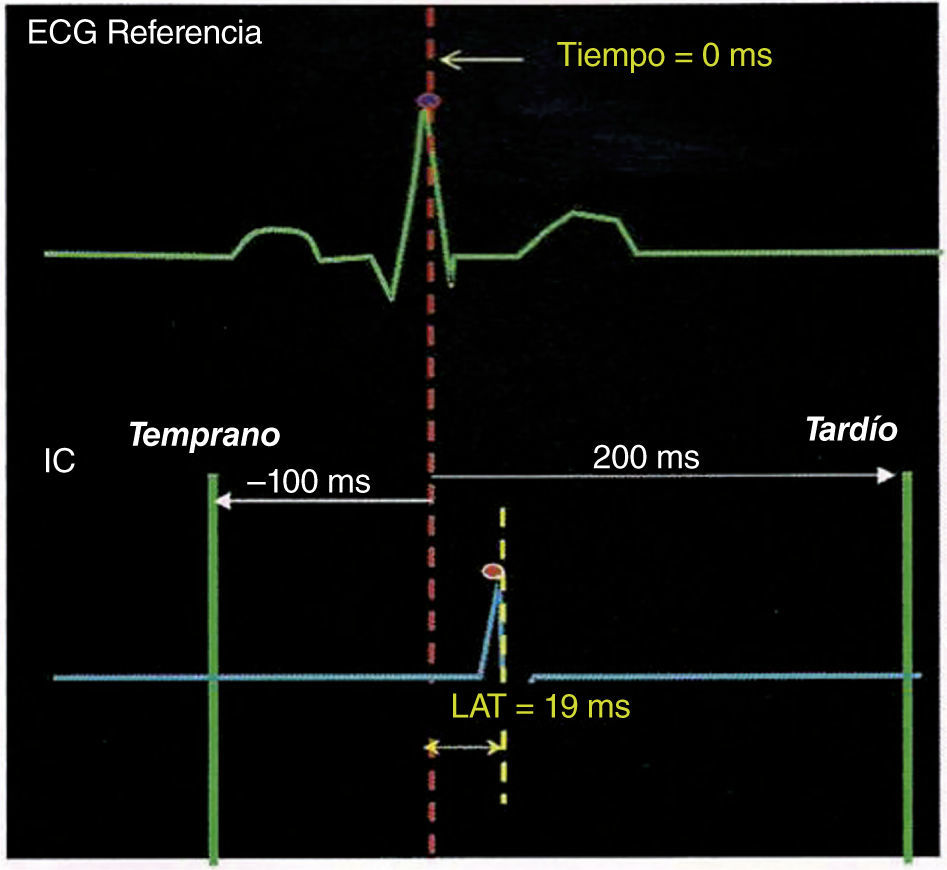
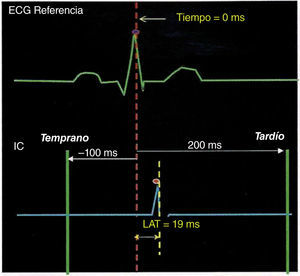
Una vez se puede conocer con certeza la ubicación tridimensional de un punto anatómico del endocardio, es posible conocer la señal eléctrica que pasa por ese punto en un instante determinado, así como la magnitud simultánea de dicha señal expresada en milivoltios. Si se quiere conocer la propagación de una corriente eléctrica en una estructura tridimensional, es necesario saber qué tan temprana o tardía es una señal eléctrica en un momento y punto específico en relación con el tiempo “0” o inicio de la corriente. Para lograr tal fin, se toma una señal eléctrica de referencia (llamada “fiducial point” o tiempo “0”) que puede ser un electrograma endocavitario, por ejemplo la señal eléctrica proveniente de un par de polos del catéter decapolar fijado en el seno coronario o una señal de superficie como el complejo QRS. Para los trastornos del ritmo en los que se mapea la activación auricular (complejos auriculares prematuros, taquicardia auricular, vías accesorias ocultas), es conveniente elegir el seno coronario como tiempo de referencia, debido a su estabilidad de posicionamiento y baja probabilidad de ser desplazado implicando interrupción en el mapeo de activación (comparado con el catéter en la aurícula derecha alta, por ejemplo, que puede ser desalojado por un catéter de mapeo en movimiento). Cualquier componente del electrograma de referencia puede ser elegido como un tiempo de referencia, incluyendo deflexión máxima (pico positivo), deflexión mínima (pico negativo), inclinación superior máxima (dV/dT) o inclinación baja máxima. Los electrodos del seno coronario proximal y medio algunas veces son seleccionados como tiempo de referencia tales como el electrograma auricular dado que estos bipolares con frecuencia son de gran amplitud y fidelidad, características que los hacen mejores que sus contrapartes ventriculares, evitando confusión con el electrograma ventricular. Cuando se mapean las taquicardias ventriculares o los complejos ventriculares prematuros, puede elegirse un registro apical ventricular derecho como un tiempo de referencia estable para la activación ventricular (fig. 4).
Ventana de interés de las señales endocavitarias en relación con un punto de referencia, en este caso el pico de la onda “R”. Una señal intracardiaca con un tiempo de activación local de +19 milisegundos se considerará ligeramente tardía respecto al pico del complejo QRS precedente. Si se emplea una escala de colores donde el rojo es el punto “0” este punto a +19 milisegundos estaría cerca de ese espectro. Tomado con permiso de Vanegas1.
La ventana de tiempo se refiere al rango de tiempo de activación alrededor de la activación electrográfica de referencia. La definición apropiada de la ventana de tiempo requiere una determinación exacta del mecanismo de taquicardia subyacente (taquicardia focal vs. macrorreentrada); un mecanismo de taquicardia erróneamente diagnosticado se traducirá en una definición inadecuada del tiempo de ventana y, en consecuencia, en la creación de un mapa de activación inválido. Una vez el mecanismo de taquicardia ha sido diagnosticado en forma correcta, la ventana de tiempo puede definirse para incluir los extremos de activación cardiaca que precede y sigue al electrograma de activación de referencia.
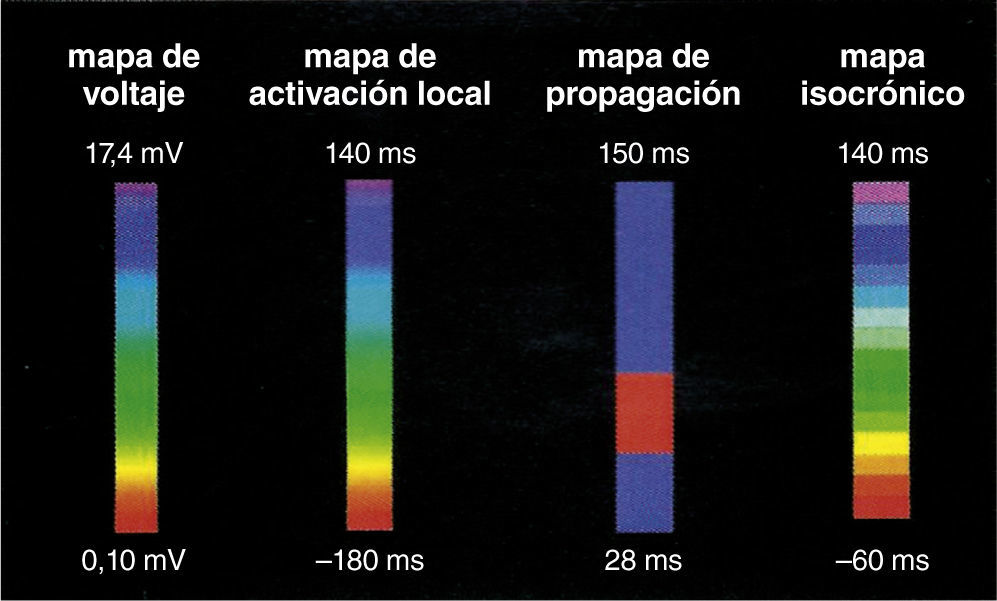
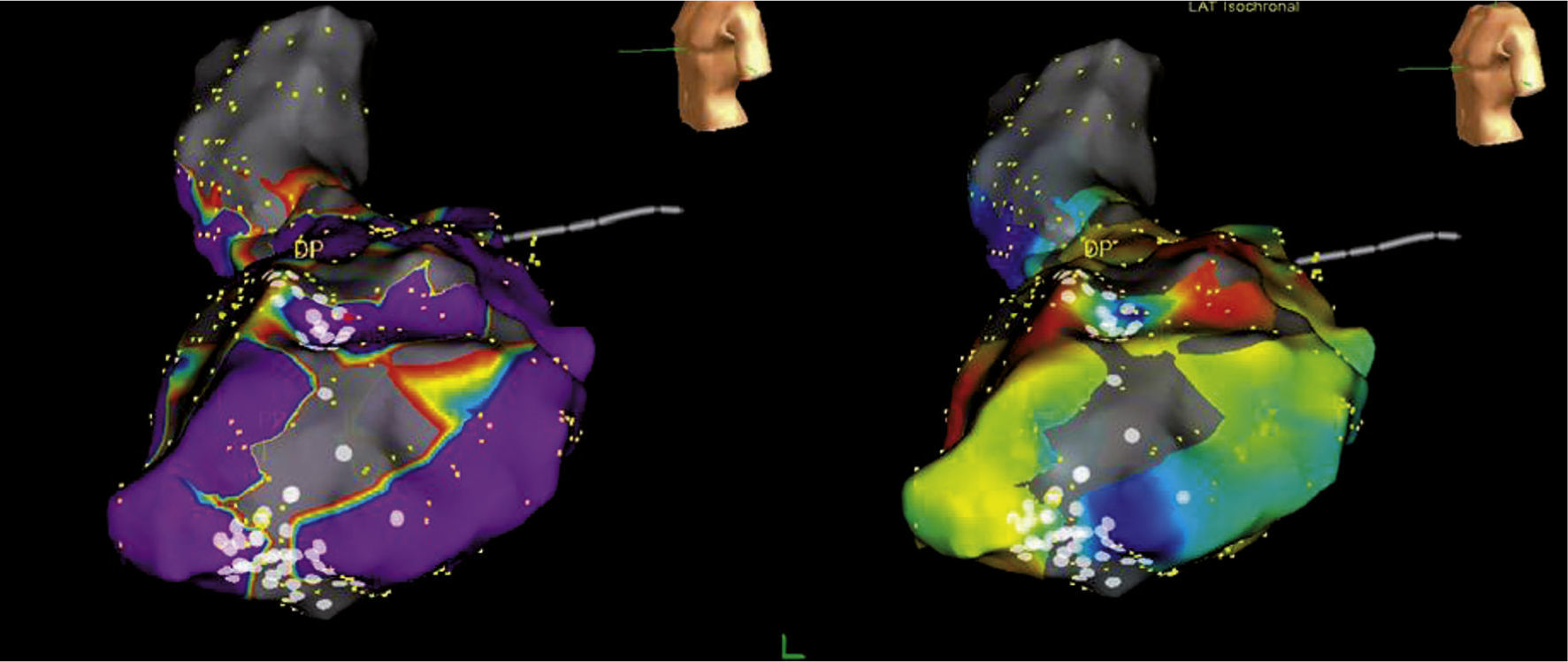
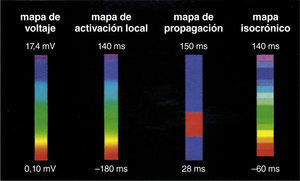
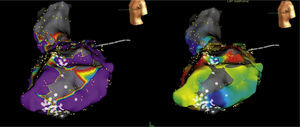
Concepto de la escala de colores y los diferentes tipos de mapas tridimensionalesUna escala de colores como la del arco iris puede emplearse para recrear diferentes mapas, a saber: mapa de activación local, mapa de propagación y mapa de voltaje (fig. 5). En relación con el mapa de activación, si a los puntos precoces se les asigna un color rojo y a los tardíos el lila, con colores intermedios (amarillo, verde y azul) para puntos de mayor a menor precocidad, se podrá obtener un mapa de activación local donde el rojo significa el punto más precoz de una taquicardia o el inicio de un ciclo de la misma5,6. El mapa de activación para el circuito de reentrada muestra que el patrón temprano se encuentra tardío, y para arritmias focales, la activación más temprana está rodeada concéntricamente por la activación más tardía (fig. 6). Además, los electrogramas unipolares son registrados por el sistema y su morfología, tales como un patrón QS, que es útil para las arritmias focales. Es importante determinar la anotación de los electrogramas locales y si hay múltiples componentes registrados en el sitio de mapeo.
Escala de colores usada con diferentes propósitos para recrear un mapa tridimensional. Si se usa para correlacionar el voltaje de un punto específico el color rojo será el más bajo voltaje y el gris indicará ausencia de voltaje (mapa de voltaje, de izquierda a derecha); si se usa para indicar que un punto es precoz, el color rojo indicará la máxima precocidad en relación con una señal de referencia (mapa de activación local). El mapa de propagación utilizará la secuencia dinámica de puntos precoces a tardíos haciendo correr un ciclo cardiaco completo, lo que dará la imagen de propagación de un impulso (mapa de propagación). El mapa isocrónico es una forma de mapa de activación local segmentado por intervalos de tiempo. Tomado con permiso de Vanegas1.
Imagen de una taquicardia de origen focal en la aurícula derecha (zona más precoz en color rojo). Tomado con permiso de Vanegas1.
La escala de colores también puede aplicarse para reconstrucciones basadas en la magnitud de la señal eléctrica (mapa de voltaje). Para tal fin se establece un punto de corte de la amplitud de la señal eléctrica detectada, usualmente 0,5 milivoltios. Toda señal o punto con un valor superior se le asigna un color lila que indica vitalidad tisular. Toda señal inferior a ese valor tendrá un color en el espectro de amarillo, verde, azul y rojo donde el último será asignado a aquellos sitios con menor intensidad de señal y gris para aquellos con señal eléctrica ausente, indicativo de cicatriz. Los otros colores estarán en el rango entre 0,5 milivoltios y ausencia de señal (fig. 7)5,6.
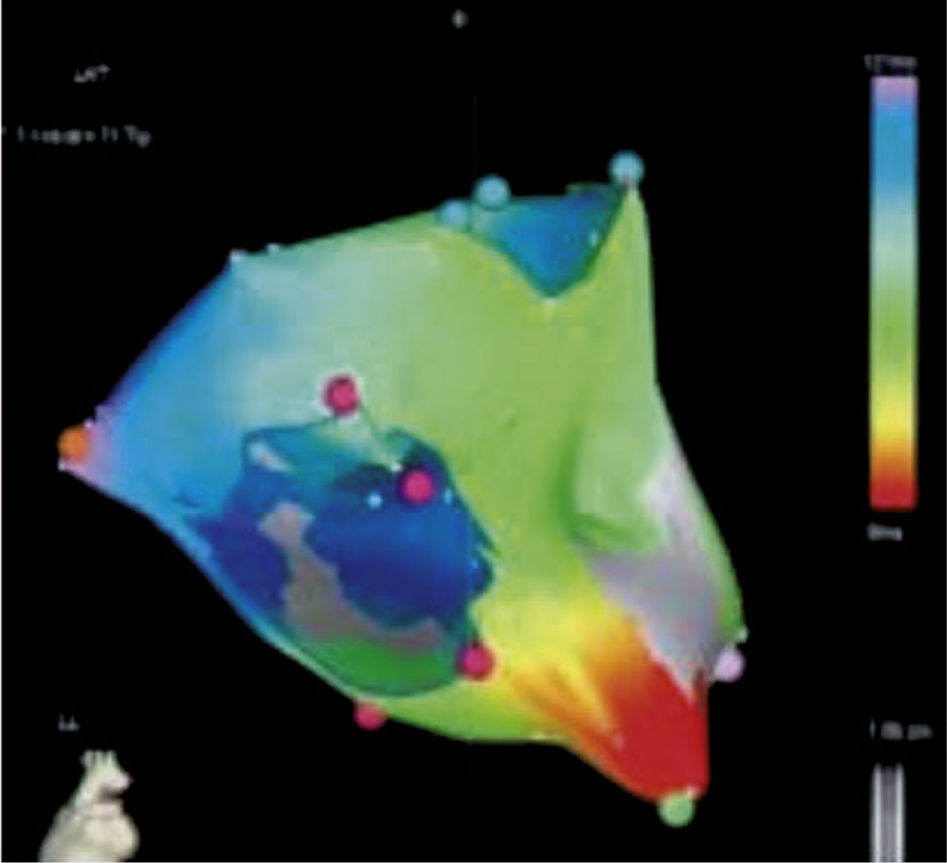
Ejemplos de mapas tridimensionales, de voltaje, de activación local, de propagación e isocrónico. Adjunto a cada mapa está la escala representativa, por ejemplo en el mapa de voltaje, los colores rojo, amarillo y verde indican bajo voltaje mientras que el lila, alto voltaje (mapa de la aurícula izquierda); en el mapa de activación local el rojo es precoz y el lila tardío (mapa del ventrículo derecho para taquicardia ventricular). El mapa de propagación y el isocrónico (del ventrículo derecho) son otras dos formas de expresar el mapa de activación local. Tomado con permiso de Vanegas1.
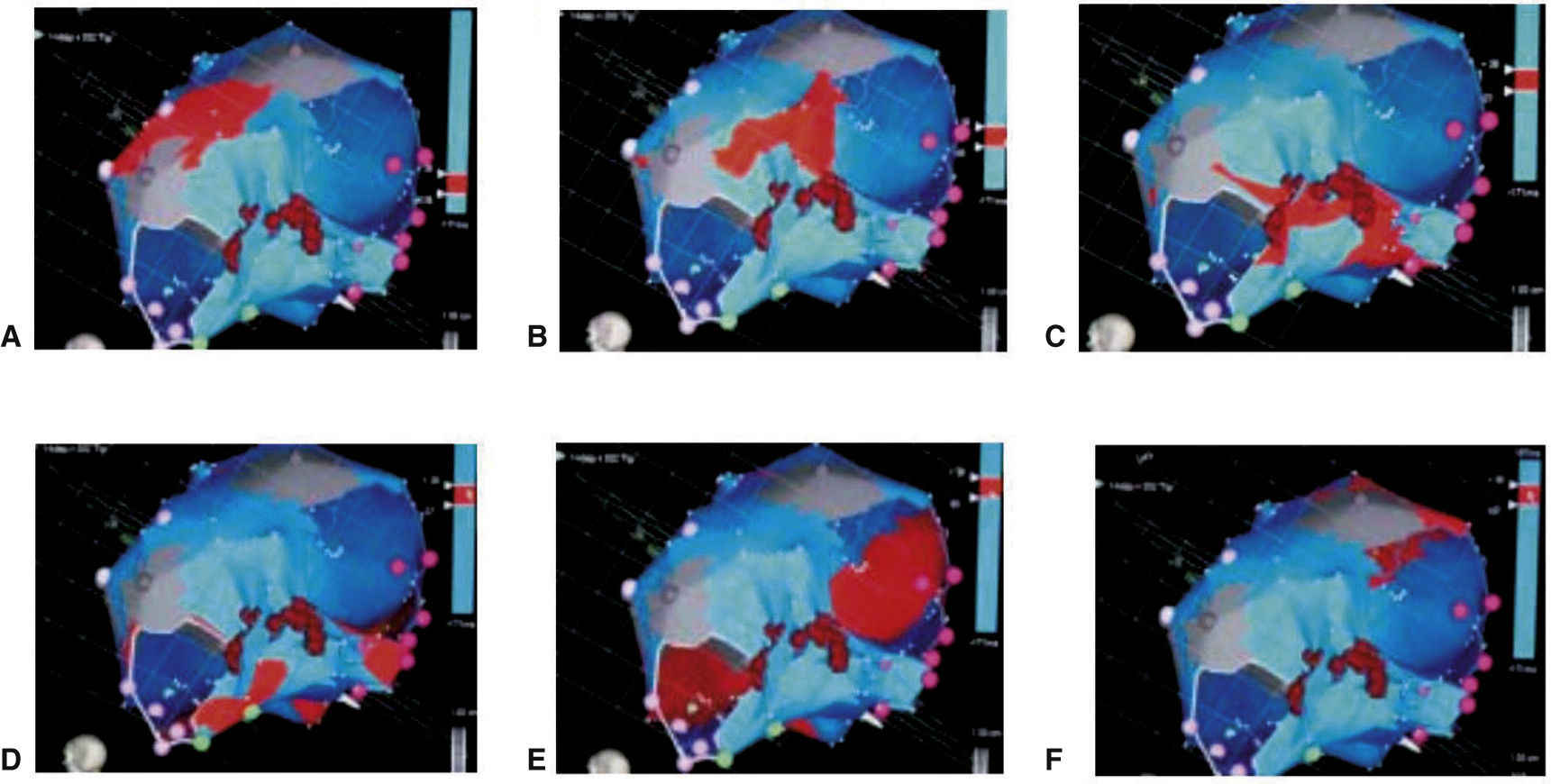
Los mapas de propagación también pueden ser construidos y almacenados de los datos obtenidos a través del mapeo de activación, demostrando la extensión de la activación a través de una cámara cardiaca durante la arritmia (fig. 8). Es importante adquirir un número suficiente de puntos alrededor de la cámara de interés para limitar la interpolación realizada por el sistema para llenar los “gaps” (las brechas) entre los puntos almacenados.
Mapa de propagación de la aurícula derecha (de A a F) visto desde una proyección inferior, en el que se muestra la despolarización de un flutter auricular común (frente de onda en color rojo). Tomado con permiso de Vanegas1.
En resumen, además de facilitar el mapeo de activación, el sistema CARTO® proporciona características de mapeo de localización capaces de registrar sitios de relevancia anatómica, áreas de bajo voltaje endocárdico que representan cicatrices y sitios de ablación. Igualmente pueden identificarse estructuras tales como el haz de His que pueden ser demarcadas para prevenir liberación de energía inadvertida que resulta en deterioro de la conducción cuando se realiza ablación de taquicardias que se originan en esta región. Los vasos tales como el seno coronario o las venas pulmonares también pueden ser demarcados para proporcionar una orientación espacial y permitir un mejor mapeo.
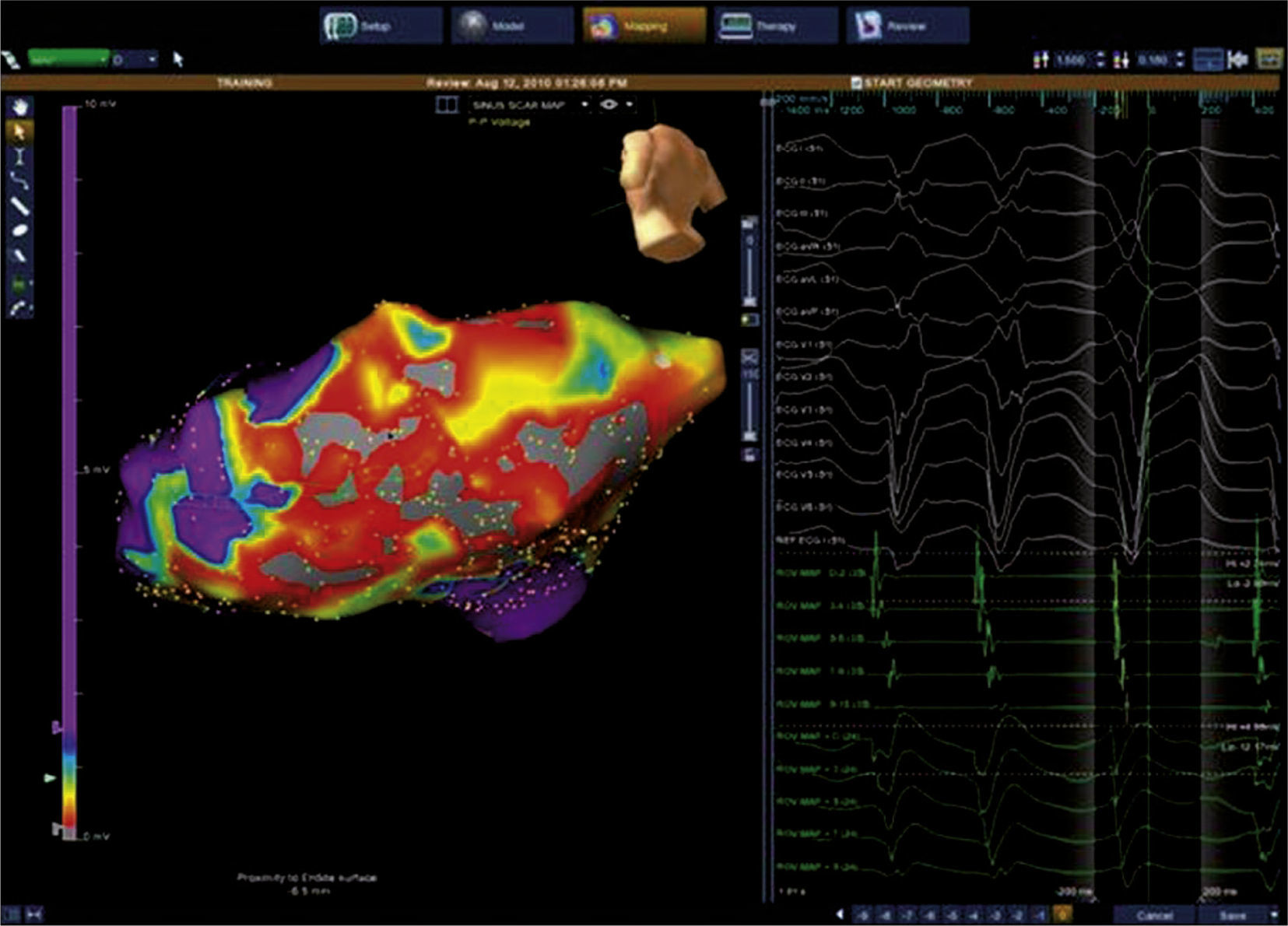
El mapeo de la cicatriz también puede realizarse por medio del trazado de superficie endocárdica y el registro de amplitudes de potenciales locales. Al igual que la activación endocárdica, una escala de voltaje puede ser arbitrariamente elegida para demostrar sólo las áreas de amplitud de voltaje más bajo, para distinguir entre áreas de cicatriz, cicatriz densa y tejido relativamente normal (fig. 9). La ablación puede realizarse para aislar eléctricamente tales áreas, en particular cuando los ritmos que generan inestabilidad hemodinámica o no se sostienen, son inducidos. El “remapeo” después de que existe la geometría de una cámara, permite separar mapas de activación cuando se documentan diferentes morfologías de arritmias originadas en una misma cámara. En esta situación se pueden adquirir y trazar nuevos puntos de tiempo de activación sobre la cámara anatómica previamente construida.
Mapa de voltaje del ventrículo izquierdo; los electrogramas de voltaje bipolar local de ≤ 0,5mV han sido seleccionados arbitrariamente como el umbral para delinear electrogramas de baja amplitud, según la escala de voltaje arriba a la derecha. El área circunscrita de color rojo representa sitios de más baja amplitud, con el área del siguiente voltaje más bajo demarcado por amarillo, verde, azul, etc. El área coloreada en magenta indica electrogramas de voltaje normal.
El sistema CARTO ha desarrollado dos modelos, el primer sistema de navegación electro-anatómica del mundo fue el CARTO XP y es el sistema que acaba de describirse. Este ofrece imágenes de la actividad eléctrica del corazón en código de colores progresivos, de voltaje, en tiempo real y en las 3 dimensiones. El CARTO 3 adiciona tres componentes de utilidad como la tecnología ACL (Advanced Catheter Location), que permite una visualización más segura del catéter, su punta y curvatura; también permite el mapeo anatómico rápido a medida que se mueve el catéter y tiene interfases para conexiones de diferentes catéteres, lo que conlleva procedimientos más rápidos. Estos dos tipos de módulos básicos del sistema CARTO tienen programas adicionales que facilitan el trabajo, como el CARTOMerge, que fusiona imágenes preadquiridas de resonancia nuclear magnética o de tomografía computarizada a la información electro-anatómica antes mencionada. El CARTOSound permite adquirir adicionalmente imágenes tridimensionales con ecografía intracardiaca y trabajar con las imágenes del ecocardiograma intracardiaco, el CARTO RMT se usa para navegación remota de los catéteres mediante robótica, el CARTO CFAE detecta con prontitud zonas atriales de electrogramas complejos para ablación de fibrilación auricular, el CARTO Smart Touch se emplea en catéteres que miden la fuerza de contacto y el CARTO PaSo sirve para mapear mediante estimulación las extrasístoles ventriculares.
Los estudios de validación en humanos han demostrado niveles de precisión especial y exactitud semejantes, al igual que reconstrucción realística de la geometría de la cámara y activación electroanatómica durante el mapeo de la arritmia7.
El sistema EnSiteEl sistema de mapeo tridimensional EnSiteNavX (St. Jude Medical, St. Paul, Minnesota, Estados Unidos) es un sistema de ayuda diagnóstica en procedimientos de electrofisiología y cumple las siguientes funciones:
- 1.
Navegación: exhibe de manera tridimensional (3D) en tiempo real los catéteres de electrofisiología.
- 2.
Modelación: crea superficies que moldean las estructuras anatómicas del corazón y registra el campo de navegación para modelos basados en tomografía axial computarizada (TAC) o resonancia nuclear magnética (RNM).
- 3.
Mapeo: graba actividad eléctrica cardiaca, como trazos de formas de onda, colecta estos datos eléctricos y exhibe su representación en los siguientes mapas de color cargados en los modelos de superficie: mapa isocronal o de activación, isopotencial o de voltaje tanto pico a pico para mapas bipolares como pico negativo para mapas unipolares y complejos auriculares fraccionados (CAFE).
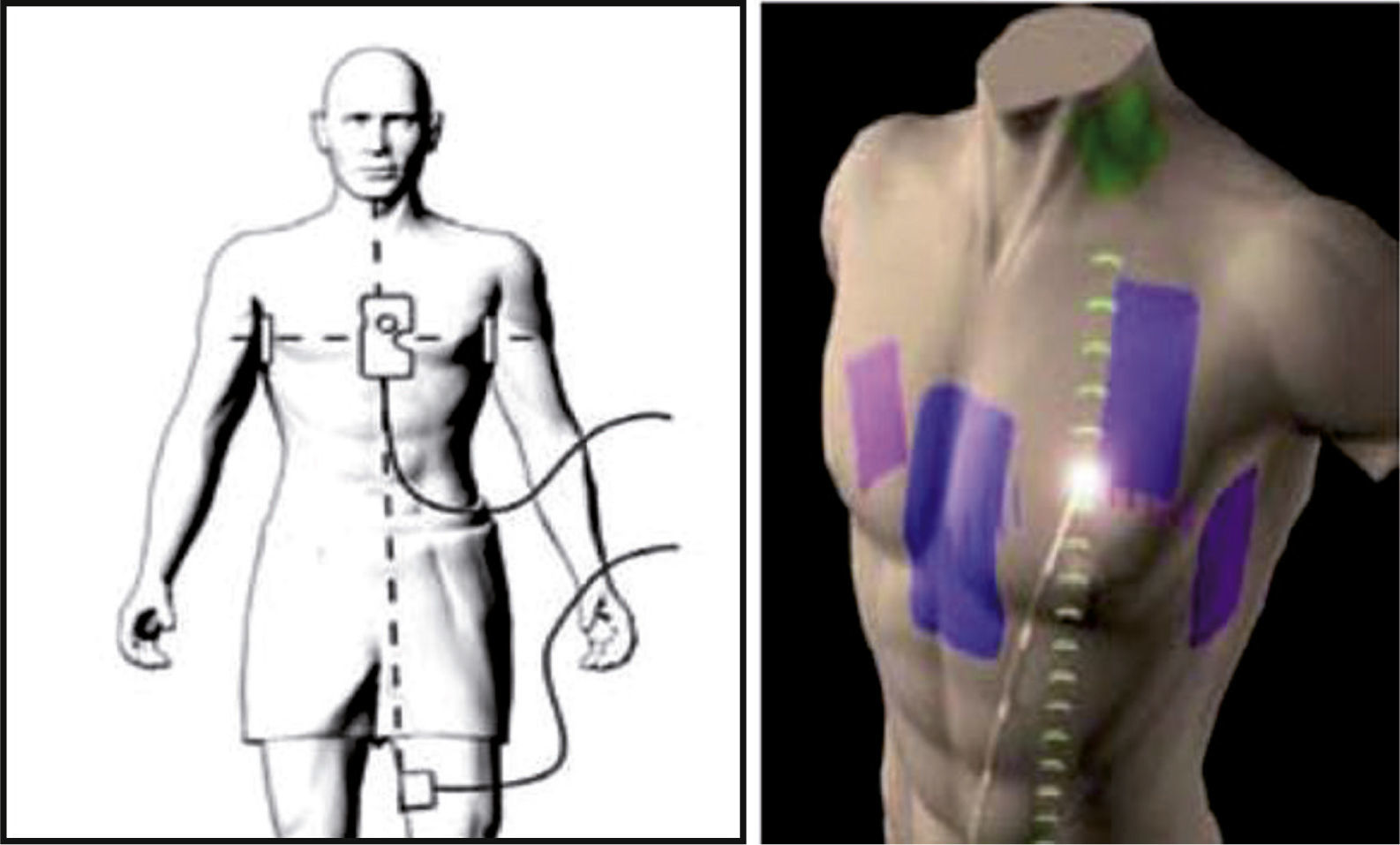
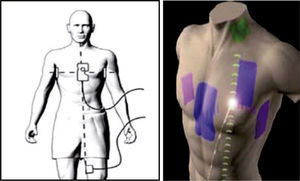
El sistema emplea un conjunto de tres pares de parches adheribles a la piel que se ubican en el tórax y que representan los tres ejes o dimensiones: derecha-izquierda, superior-inferior (cuello-pierna) y anterior-posterior (X, Y y Z) (fig. 10). El principio de funcionamiento del sistema EnSite se basa en la navegación tridimensional por medio de impedancia; el sistema NavX transmite una corriente fija entre los tres pares de parches integrados en una frecuencia de 8,138kHz. Esta señal se conoce como frecuencia localizadora NavX. Los niveles de tensión se ajustan constantemente para mantener el nivel fijo de la corriente transmitida. En cualquier punto dado en el tiempo, el sistema calcula el gradiente de impedancia mediante las variables conocidas intensidad y tensión en la ecuación de la ley de Ohm. En cada uno de los ciclos de transmisión de señales individuales, un parche de cada par envía la señal (“impulsada”) y otro parche sirve como receptor. De manera simplista, la señal emitida puede ser percibida como un 100% de la impedancia y la señal recibida como 0% de la impedancia, para establecer una disminución lineal o gradiente a través de la distancia que la señal viaja.
Representación gráfica de un “set” de parches con los cuales se crea artificialmente un campo con gradientes de voltaje eléctrico a través del tórax de un paciente. Los parches son tres pares que representan los ejes eléctricos X, Y y Z de la tridimensionalidad corporal. El gradiente de voltaje en un punto específico de localización de un catéter en relación con los gradientes entre esos parches permite su ubicación en el espacio (facilitada por St. Jude Medical).
Una vez establecido este gradiente, puede colocarse un electrodo dentro del campo como un receptor adicional. Sobre la base de su ubicación dentro de la pareja de parches se detecta un porcentaje del gradiente: 100% significaría que el electrodo está situado cerca del parche impulsador, 0% cerca del parche receptor y el 50% estaría en la mitad de ambos. La repetición de este cálculo en tres ejes satisfará las necesidades de un sistema básico de coordenadas en tres dimensiones.
Cada par de parches transmite la frecuencia de localizador y todos los electrodos conectados correctamente dentro del rango pueden ser medidos y localizados. El sistema NavX permite además la creación rápida de un modelo detallado de la anatomía cardiaca. El posicionamiento secuencial de un catéter electrodo en diferentes puntos de la superficie del endocardio de cada una de las cámaras, permite establecer la geometría de la misma. El sistema es capaz de obtener hasta 96 puntos anatómicos cada segundo, de tal manera que la anatomía del corazón se forma a partir de la localización tridimensional de cada punto. El algoritmo define la superficie utilizando los puntos más distantes del centro geométrico definido por el sistema. Los mapas de activación y de voltaje pueden ser sobrepuestos al mapa tridimensional de la geometría. Adicionalmente, es posible fusionar las imágenes de la geometría tridimensional con imágenes obtenidas a través de TAC o de RNM para mejorar el detalle y la precisión de la anatomía cardiaca.
Procedimiento de mapeoLos procedimientos de mapeo tridimensional se llevan a cabo de la misma manera que los procedimientos de mapeo convencional. El sistema es capaz de localizar hasta 128 electrodos intracavitarios una vez se encuentran dentro de la vena, por lo que no se requiere fluoroscopia para ascender o posicionar los catéteres, excepto si se encuentra un obstáculo para el avance. El sistema permite realizar varias tareas de manera simultánea, como creación de anatomía, mapas de activación y voltaje por cualquier catéter, por todos a la vez o cualquier combinación que se seleccione. Para iniciar un procedimiento hay tres pasos que se realizan dentro de la configuración:
- 1.
Validación: activa la localización y frecuencias de muestreo del sistema, lo cual habilita la visualización de los catéteres y la información del paciente evitando que este mismo set de parches sea utilizado en un paciente diferente; por tanto, no permite la reutilización ya que podría alterarse la precisión del sistema.
- 2.
Optimización: el sistema realiza una ecualización de impedancias para asegurar una navegación precisa.
- 3.
Compensación respiratoria: se aplica un algoritmo para amortiguar el movimiento generado por el ciclo respiratorio.
El sistema debe contar con una referencia de posición que puede ser un electrodo de un catéter intracavitario. En la última versión de software se ha implementado el sistema de referencia a través de los seis parches de superficie. A continuación se obtiene un mapa de geometría intracardiaca. En primer lugar se toma una referencia anatómica de los puntos más característicos de la cavidad cardiaca de interés. Luego se mueve el catéter por toda la superficie endocárdica. A medida que el catéter se mueve, el sistema automáticamente crea una figura tridimensional de la cámara cardiaca. Si está disponible una imagen de TAC/RNM de la cavidad, ésta se muestra en una de las mitades de la pantalla y puede ser usada para guiar los movimientos del catéter en la otra mitad de la pantalla. Después de completado el mapa anatómico se pueden editar aquellos puntos que representan espacios falsos o tomados por sobre distensión de la cámara.
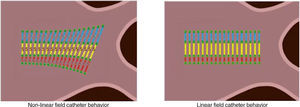
Luego se aplica un algoritmo de escalamiento de campo (field scaling) para convertir el modelo 3D en un modelo más real, ya que el sistema NavX es un sistema basado en voltajes y asume que la localización puede ser determinada por x=aV donde la posición es proporcional al potencial eléctrico. Ésta es solo una aproximación, ya que el tórax humano está compuesto por una gran variedad de tipos de tejidos con impedancia cambiante (heterogeneidades y anisotropías de campo); al aplicar el escalamiento de campo se emplea un algoritmo matemático de transformación no lineal.
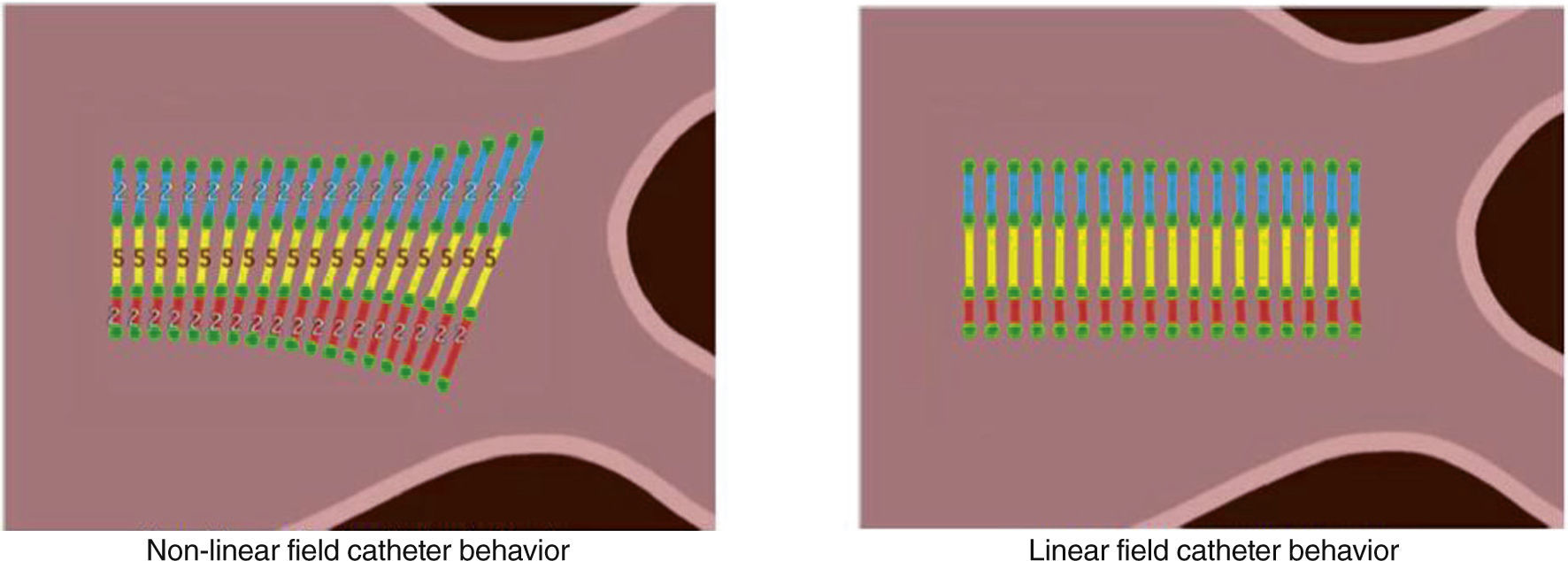
El impacto más significativo del modelo no lineal del NavX se representa en el aspecto de las superficies del modelo anatómico. A medida que el catéter se mueve, los espacios entre electrodos pueden estirarse visualmente o contraerse en respuesta a los cambios de impedancia local. Como resultado, la superficie de la geometría puede aparecer estirada o contraída (fig. 11). Esto es especialmente evidente cuando se navega dentro de venas o introductores muy largos.
El escalamiento de campo ofrece la posibilidad de explicar y corregir estas manifestaciones no lineales. Para que el sistema no lineal sea convertido en un sistema de formato lineal, se debe dar algún tipo de distancia de referencia. Para NavX, esta referencia se encuentra en la separación de los electrodos de los catéteres utilizados para recopilar los datos anatómicos del modelo. Antes de colectar cualquier anatomía, el usuario deberá introducir el tamaño del electrodo y el espaciamiento de los catéteres de mapeo definiéndolos en el menú “sub-tarea de catéter”.
A medida que el sistema recoge las coordenadas que componen la superficie del modelo, los almacena de acuerdo con la separación de los electrodos del catéter utilizado para recoger los datos. El sistema no actualiza y escala la imagen en tiempo real; los datos de coordenadas se guardan de acuerdo con la separación del catéter utilizado. Una vez completado el modelo, el usuario tiene la opción de aplicar el escalamiento de campo para obtener un modelo real y detallado de la cavidad cardiaca.
Simultáneamente, y dependiendo de la sostenibilidad de la arritmia, puede crearse un mapa de voltaje y/o un mapa de activación con cualquiera de los catéteres insertados e incluso pueden tomarse múltiples puntos al mismo tiempo con cada uno de los electrodos de uno o varios catéteres, proceso denominado mapeo multipolar de alta densidad, lo que simplifica el proceso de recolección de puntos de activación. El sistema automáticamente guarda cada punto bipolar colectado de forma unipolar en un historial de datos para su revisión. Además, permite transformar mapas bipolares a unipolares, herramienta útil sobretodo en casos de taquicardia ventricular. El sistema permite visualizar hasta cuatro mapas diferentes de manera simultánea para análisis e interpretación.
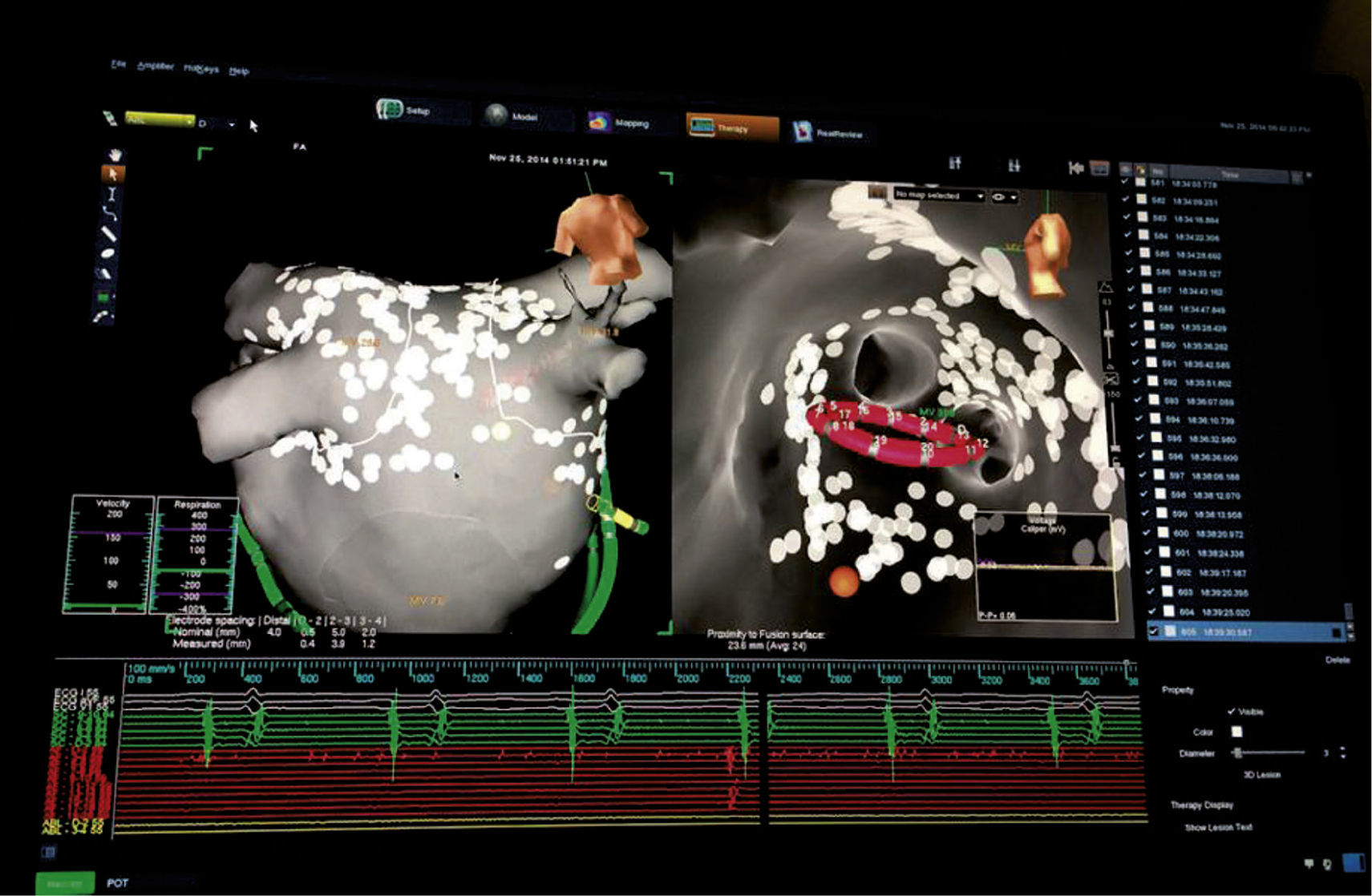
El NavX es un sistema de plataforma abierta, lo cual permite trabajar con cualquier catéter de ablación y diagnóstico, con cualquier generador de radiofrecuencia y/o con criogeneradores. Los sitios de aplicación de radiofrecuencia pueden ser marcados en la superficie del mapa tridimensional para referenciar las lesiones creadas (fig. 12). Adicionalmente, la efectividad de las lesiones puede ser medida a través de la fuerza de contacto con el módulo Tacticath, el cual muestra fuerza de contacto en gramos en tiempo real, vectores de dirección de la fuerza e integral de fuerza tiempo (FTI) con un catéter basado en tecnología óptica.
A la izquierda, se observa una reconstrucción 3D mediante la fusión de una imagen tomográfica con el sistema NavX. En azul la aurícula derecha y en ocre la aurícula izquierda. Se aprecian los dos orificios de las válvulas tricúspide y mitral y los puntos amarillos representan los sitios de aplicación de radiofrecuencia en los antros pulmonares. A la derecha, una vista endocavitaria de la aurícula izquierda durante aislamiento de venas pulmonares. En los puntos amarillos se ha practicado ablación alrededor de las venas pulmonares izquierdas.
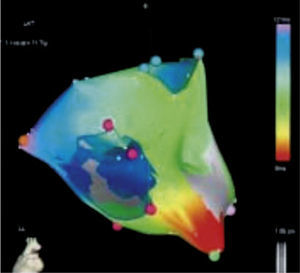
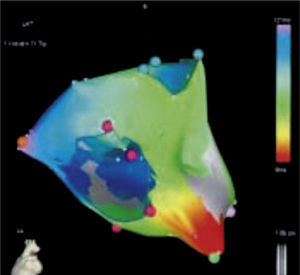
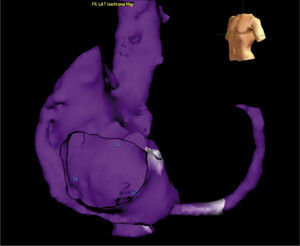
El sistema NavX permite visualizar y navegar con catéteres en cualquiera de las cámaras cardiacas para propósitos diagnósticos y terapéuticos. Permite ver hasta 128 electrodos incluyendo electrodos para estimulación cardiaca (electrodos de marcapaso transitorio). Permite realizar un mapa de anatomía tridimensional, útil para aquellas arritmias con un sustrato anatómico conocido tales como el flutter atrial istmo-dependiente o el aislamiento eléctrico de venas pulmonares para la fibrilación auricular. Permite, así mismo, elaborar un mapa de activación para determinar, con una precisión menor a 1mm, el origen de arritmias focales tales como las extrasístoles ventriculares o las taquicardias atriales tomando múltiples puntos de activación y voltaje en forma simultánea (figs. 13 y 14). Los mapas de activación local, de voltaje y de propagación siguen las mismas características que los mapas obtenidos mediante la técnica de campo electromagnético. La escala de colores tiene el mismo principio y aplicabilidad2,3. La tecnología NavX disminuye de manera significativa la exposición a la radiación para el operador y para el paciente, y permite ubicar todos los catéteres desde el comienzo del procedimiento, por lo que posibilita determinar en tiempo real la relación entre los catéteres y las paredes del endocardio.
Mapa tridimensional de la aurícula derecha logrado mediante un sistema EnSite-Velocity. Sobre el mapa se ha recreado una propagación de corriente de un flutter auricular común. En la reconstrucción se pueden apreciar detalles anatómicos muy claros tales como las venas cavas, la auriculilla derecha, el seno coronario y el orificio de la válvula tricúspide.
Este sistema permite realizar mapeo tridimensional de una cavidad sin recurrir a un electrocatéter que realice punto a punto la reconstrucción tridimensional (3-D). El mapeo de no contacto (“non-contact mapping”) ofrece la posibilidad de realizar mapeo instantáneo de una cámara cardiaca mediante la introducción de un balón inflable “tachonado” de múltiples microelectrodos o microcables (64 microelectrodos) diseñados de tal manera que actúan como una antena que detecta las señales eléctricas unipolares de su medio circundante (fig. 15). Estas señales son amplificadas, filtradas y analizadas por un software o programa matemático que aplica diversas ecuaciones para predecir la distancia a su fuente basándose en la intensidad de la señal y generando los llamados electrogramas virtuales. La utilización de otros electrocatéteres por donde se envía una señal de baja amplitud de 5,68kHz y alternativamente por los polos distal y proximal del balón, permite el cálculo de los ángulos de las señales eléctricas y finalmente la reconstrucción de cualquier cavidad. Esta técnica facilita el rastreo o mapeo 3-D de un solo latido ectópico dado que utiliza 3.360 electrogramas virtuales actualizados 1.200 veces por segundo. Cada electrograma virtual representa un punto en el espacio, y la reconstrucción o unión tridimensional de los mismos permite elaborar la geometría de la cámara cardiaca de interés2,3.
Balón array para mapeo tridimensional de no contacto. El balón se introduce desinflado y una vez posicionado en la cavidad cardiaca se infla con agua. Este se estabiliza utilizando una guía de soporte; está tachonado de múltiples electrodos que actúan como una antena (facilitada por St. Jude Medical).
La electrofisiología cardiovascular ha cambiado sustancialmente desde el advenimiento del mapeo tridimensional. En los albores de la ablación por radiofrecuencia, no se vislumbraba que el mapeo tridimensional fuera esencial en la realización de ese procedimiento. Se utilizaban solo los rayos “X”, y la orientación de los electrocatéteres para el registro de señales y la ablación se basa en la radioanatomía. El mapeo tridimensional ha permitido el reconocimiento estructural de la anatomía cardiaca haciendo que algunas arritmias sean en principio llevadas a ablación esencialmente mediante el reparo anatómico tridimensional. Arritmias como la fibrilación auricular se tratan mediante ablación por radiofrecuencia por la aproximación anatómica y el reconocimiento del ostium y antrum de las venas pulmonares, procedimiento conocido como aislamiento de las venas pulmonares8. La reconstrucción tridimensional de esas estructuras permite orientar los electrocatéteres a esos puntos con el fin de reconocer sitios críticos generadores de arritmias9–11. No se trata de la inducción de arritmias mediante la estimulación eléctrica programada, sino del reconocimiento de una estructura ya previamente identificada como generadora de la arritmia. Esa estructura reconstruida mediante la tecnología 3-D es la que se convierte en blanco de la terapia de radiofrecuencia sin la utilización mayor de radiación “X” (fig. 16).
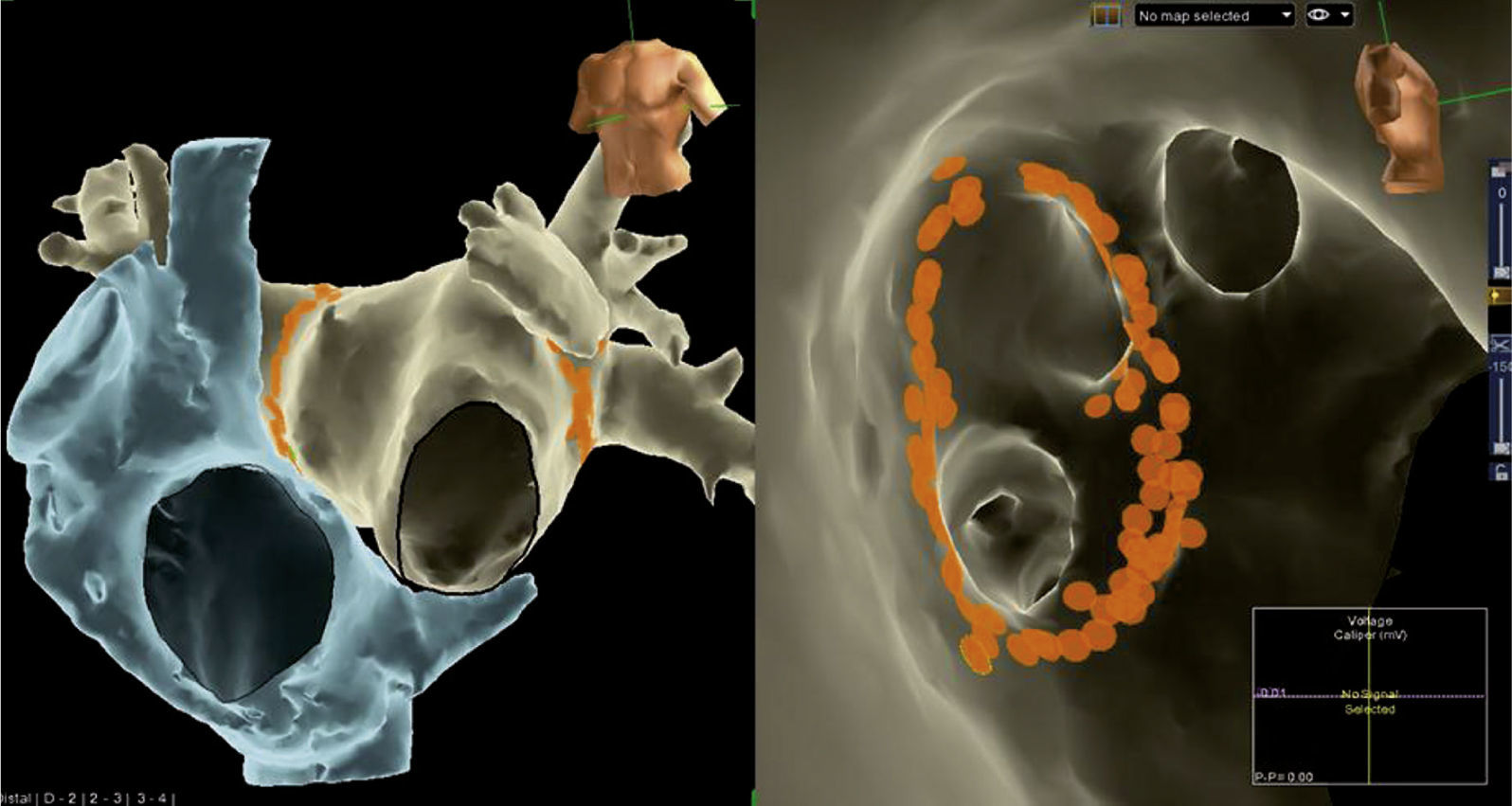
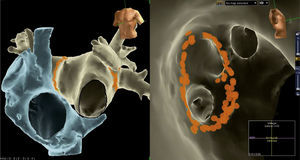
Imágenes de reconstrucción tridimensional logradas mediante un sistema EnSite-Velocity fusionadas a una TAC multicorte de la aurícula izquierda. Se pueden visualizar sin la ayuda de rayos “X” los electrocatéteres de mapeo del seno coronario y de radiofrecuencia en la imagen izquierda, mientras que uno circular de mapeo de las venas pulmonares se visualiza en la imagen derecha. La imagen izquierda muestra las cuatro venas pulmonares y la pared posterior de la aurícula, en tanto que la imagen derecha permite ver el interior de dichas venas gracias a la fusión con la TAC. Los puntos blancos son aplicaciones de radiofrecuencia sobre sitios con documentación de potenciales eléctricos de venas pulmonares o en su cercanía.
Para realizar la reconstrucción 3-D y cotejarla con la estructura real del paciente, se toma una imagen tridimensional (TAC multicorte o RMN del corazón) los días precedentes al procedimiento. Esas imágenes se almacenan en un medio magnético y posteriormente se reproducen en el sistema computarizado tridimensional (CARTO o EnSite-Velocity). Se procesan las imágenes y se depuran sus límites; se reconocen las estructuras críticas, principalmente las venas pulmonares. En el procedimiento, una vez alcanzada la aurícula izquierda mediante punción transeptal y el uso de un electrocatéter circular o de ablación, se realiza reconstrucción 3-D de la misma. Para ello se requiere un electrocatéter insertado en el seno coronario, estático o fijo como punto de referencia. Otro electrocatéter circular o de radiofrecuencia se desplaza por la superficie endocárdica de la aurícula izquierda al tiempo que se reconstruyen sus puntos de reparo anatómico o límites de la estructura. Cada punto detectado o en contacto con el electrocatéter que hace el barrido endocavitario es reconstruido en tres dimensiones. Esa reconstrucción se basa en el principio de gradientes de voltaje o de tensión magnética. La estructura endocárdica reconstruida puede ser cotejada o establecer el llamado “match” con la estructura anatómica de la imagen tridimensional tomada los días anteriores mediante TAC o RMN estableciéndose una correlación con un alto nivel de coincidencia y margen de error de milímetros. De esa manera se puede utilizar una imagen virtual para llevar un catéter de radiofrecuencia a los sitios críticos (antrum y ostium de las venas pulmonares) y realizar la terapia de radiofrecuencia o aislamiento de las venas pulmonares sin la utilización mayor de los rayos “X”12.
Utilidad del mapeo tridimensionalEl mapeo 3-D tiene sus principales fortalezas en:
- •
Reducción del uso de rayos “X”: se ha informado acerca de estudios electrofisiológicos completos incluyendo la inserción de electrocatéteres, la inducción o estimulación eléctrica programada del corazón y el tratamiento de arritmias mediante ablación por radiofrecuencia sin el uso de rayos “X” utilizando exclusivamente sistemas de mapeo 3-D. Aunque esta situación no es la del “día a día”, la exposición y uso frecuente de esta técnica tridimensional permite al operador reducir sustancialmente la utilización de la radiación ionizante, principalmente porque se reconstruye la cavidad cardiaca y simultáneamente se visualizan los electrocatéteres con movimiento en tiempo real. Adicionalmente, el sistema 3-D permite reducir el número de maniobras de comprobación radiológica, es decir la necesidad de obtener dos posiciones radiológicas opuestas en 90 grados para comprobar la localización biplanar exacta de un punto dado. El sistema 3-D reconstruye la silueta cardiaca y ofrece simultáneamente dos planos reduciendo el margen de error del posicionamiento de un electrocatéter. Dado que la exposición prolongada a radiación ionizante se relaciona con mayor incidencia de neoplasias, la reducción de esta radiación mediante el uso de sistemas de mapeo 3-D está a favor de la protección del paciente primordialmente y secundariamente del principal operador y del personal paramédico que lo rodea8,13,14.
- •
Mejor reconocimiento anatómico: la reconstrucción anatómica de la silueta cardiaca, incluyendo sus orificios, válvulas, venas y arterias, permite una concepción integrada y más precisa que la simple radio-anatomía. Lo anterior redunda en más confianza del operador al momento de desplazar los electrocatéteres por el endocardio e igualmente durante el proceso de aplicación de energía de radiofrecuencia. Los puntos de ablación pueden ser “marcados” en un sitio específico sobre el cual se puede volver si el catéter se desplaza de manera inadvertida15.
- •
Integración de imágenes complementarias: tiempo y espacio pueden integrarse en una imagen, lo cual permite recrear el desplazamiento de una corriente eléctrica en el casquete endocárdico. También se pueden integrar imágenes de resonancia o TAC multicorte del corazón con las imágenes de reconstrucción en tiempo real, lo que facilita el trabajo sobre una estructura virtual de alta precisión anatómica.
- •
Reconocimiento y ablación de arritmias de difícil manejo: existen al menos dos tipos de arritmias que son de difícil manejo: aquellas que pueden presentarse de manera aislada y/o de difícil inducción en un estudio electrofisiológico y las que pueden inducirse pero llevan rápidamente a un colapso hemodinámico, por lo que no pueden ser estudiadas apropiadamente. El mapeo 3-D en estos casos puede ejecutarse mediante la técnica de balón o “mapeo de no contacto”, que permite rastrear un latido ectópico atrial y/o ventricular aislado, o unos pocos latidos en serie o inducidos transitoriamente. Los focos ectópicos de taquicardias atriales automáticas no reentrantes son ejemplo de arritmias de difícil inducción que pueden requerir este tipo de tecnología. Así mismo, arritmias ventriculares colapsantes cuyo “gatillo” es un foco o un latido ventricular aislado pueden ser reconocidas en su origen antes de que se induzca la taquicardia16.
- •
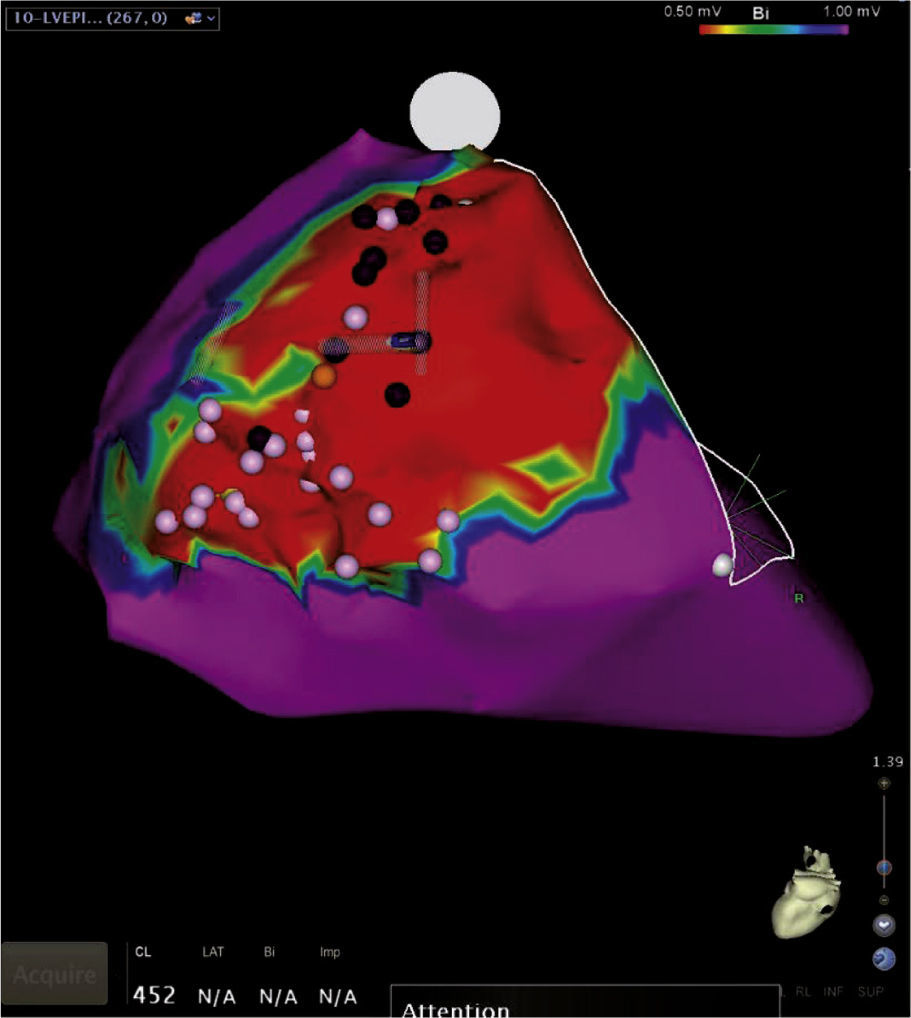
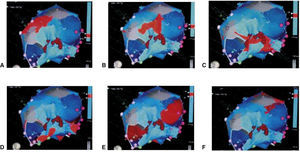
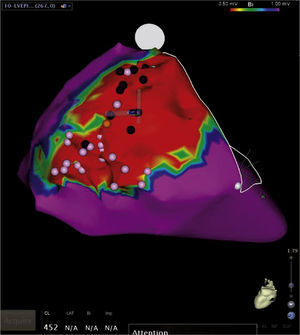
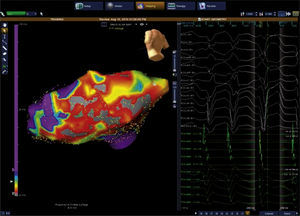
Mapeo y ablación del substrato arritmogénico: las cicatrices endocárdicas y/o epicárdicas producto de un infarto agudo de miocardio han sido identificadas como el sustrato electroanatómico de arritmias ventriculares potencialmente fatales. Esto ha llevado a una aproximación diferente de cuál es su tratamiento preventivo mediante la destrucción o ablación de los canales de tejido miocárdico viable embebidos en esas cicatrices, los cuales sirven de conductos o vías para generar taquicardias ventriculares por reentrada (fig. 17). El mapeo de voltaje permite identificar esos canales o sitios sin recurrir a la inducción repetida de la arritmia o arritmias, lo que ha generado una estrategia más segura para el paciente y ha reducido la complejidad y duración de los procedimientos ablativos13,14.
Figura 17.Mapa de voltaje del ventrículo izquierdo con múltiples cicatrices o lesiones necróticas de infarto previo en la pared inferior, representadas en áreas grises a través de las cuales se observan canales o tejido miocárdico viable pero de bajo voltaje (color rojo) que representan el substrato electroanatómico de arritmias ventriculares. La ablación o destrucción de esos canales interrumpe potenciales corrientes reentrantes generadoras de taquicardias ventriculares como la que se observa en el trazo electrocardiográfico acompañante.
(0.21MB). - •
Mapeo y ablación de taquicardias en cardiopatías congénitas o posquirúrgicas: cuando la anatomía cardiaca es compleja, tal cual sucede en las cardiopatías congénitas, la verdadera fuente de un electrograma puede ser reconocida y ubicada en las diversas estructuras cardiacas que se sobreponen utilizando las dimensiones témporo-espaciales mediante el mapeo 3-D (mapas de voltaje, de activación y propagación). Las arritmias en esta población son de difícil reconocimiento y tratamiento, de ahí que el mapeo tridimensional sea de extremada utilidad para sobrepasar las dificultades técnicas que implican4.
Desventajas:
- •
El sistema CARTO necesita un catéter especial no reutilizable, el cual es más costoso que otros catéteres.
- •
Los cambios en la longitud de ciclo de la taquicardia hacen el mapa impreciso.
- •
Los sistemas CARTO y EnSite tradicionales no son útiles en presencia de ritmos inestables (en este campo es útil el sistema Array).
- •
Para el sistema EnSite el algoritmo que define la superficie endocárdica utiliza los puntos más distantes desde un centro geométrico determinado arbitrariamente, de tal manera que el catéter puede protruir por fuera del mapa geométrico, por lo que en general el mapa tridimensional sobreestima el volumen de la cámara cardiaca.
- •
Para el sistema EnSite los esquemas de interpolación pueden llegar a distorsionar la anatomía cardiaca en las estructuras complejas del corazón, particularmente en las curvaturas o en aquellas que protruyen hacia afuera de este, tales como las venas pulmonares o las auriculillas. Esta limitación ha sido corregida con el algoritmo one-model, herramienta que ajusta el modelo anatómico a la nube de puntos, eliminando la necesidad de asignar diferentes anatomías a las estructuras para mejorar su resolución.
- •
Para el sistema EnSite la posición del catéter de referencia debe ser estable durante todo el procedimiento a fin de mantener con precisión la relación entre los catéteres y el mapa tridimensional. Se han desarrollado dos herramientas nuevas para manejar esta limitante. Primero, la herramienta de referencia posicional, la cual detecta automáticamente movimientos en el electrodo de referencia y permite reajustar la referencia en forma manual o automática. Segundo, se ha mejorado el algoritmo de sistema de referencia eliminando la necesidad de un electrodo intracardiaco como referencia, reemplazándolo por los seis parches como referencia posicional.