La taquicardia por reentrada nodal constituye la taquicardia supraventricular de intervalo RR regular más frecuente1, y comúnmente se manifiesta en forma típica y atípica. La ablación por radiofrecuencia dirigida a la vía lenta del nodo aurículo-ventricular (AV) se considera la técnica de elección en el manejo del paciente con taquicardia por reentrada nodal. Por tradición, se han utilizado dos aproximaciones, una anatómica y otra guiada por electrogramas. Aunque inicialmente se consideraron semejantes2,3, con la técnica de electrogramas se utilizaban diferentes criterios entre los autores y posteriormente se contempló que eran poco específicos del triángulo de Koch porque se encontraban también en sitios lejanos a la localización de la vía lenta. Por ello, en la actualidad la mayoría de electrofisiólogos prefieren la aproximación anatómica al asumir que la vía lenta se localiza en la porción inferior del triángulo de Koch entre el ostium del seno coronario y el anillo tricuspídeo. El éxito de esta técnica de ablación es del 95%, con 2 a 5% de recurrencias, y el riesgo de bloqueo aurículo-ventricular del 0,2 al 0,6%4.
El síndrome de Wolff-Parkinson-White (WPW) se caracteriza por la presencia de una vía anómala que se extiende a través del surco AV; se conecta vía eléctrica desde una aurícula a un ventrículo, con conducción anterógrada (de la aurícula al ventrículo) y se asocia a síntomas como palpitaciones, síncope o muerte súbita. Esta entidad fue la primera condición curada de manera exitosa con ablación por catéter5. El éxito del procedimiento en el síndrome de WPW es cercano al 95-98%6, pues en la literatura se reporta baja frecuencia de complicaciones (< 1%), muertes o accidentes cerebrovasculares en la mayoría de las series7.
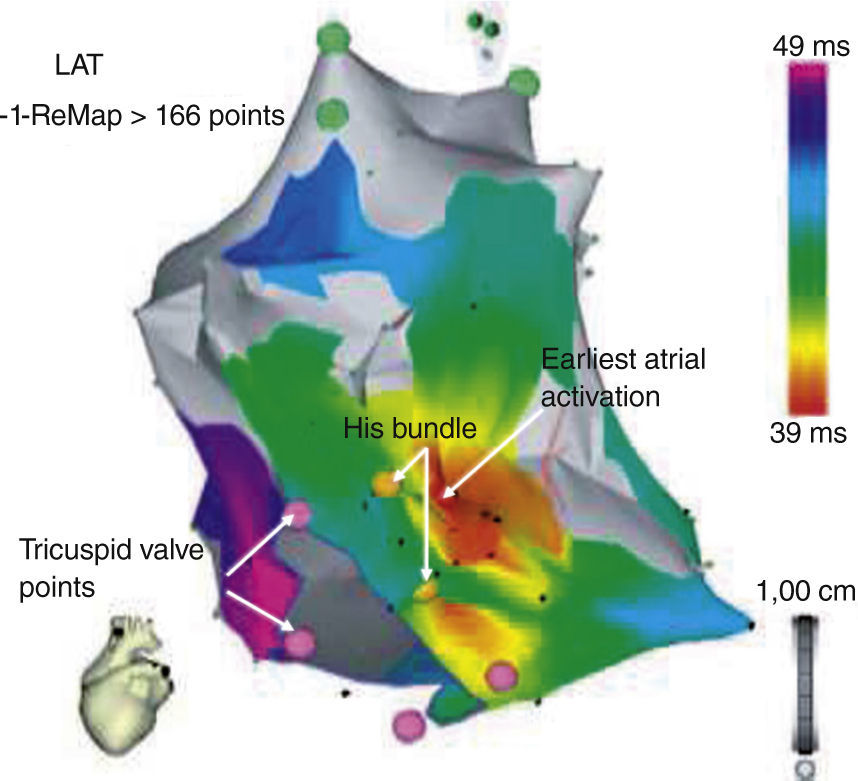
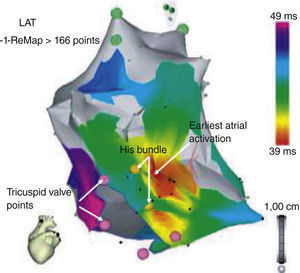
Utilidad del mapeo tridimensionalLas taquicardias por reentrada nodal AV han sido foco de extensas investigaciones con delineamiento del triángulo anatómico de Koch y sus variaciones, que desempeñan un papel trascendental en la fisiología de esta arritmia. Cooke y Wilber8 describieron su experiencia inicial en 14 pacientes con una aproximación anatómica utilizando el sistema CARTO Biosense® para crear un mapa electroanatómico de alta densidad del triángulo de Koch en ritmo sinusal y facilitar así la modificación de la vía lenta. En este estudio, el mapeo electroanatómico del triángulo de Koch podría efectuarse en menos de 30 minutos, y demarcarse áreas anatómicas como ostium del seno coronario, anillo tricuspídeo y región del haz de His. Mediante esta técnica, los autores en mención lograron limitar la liberación de energía de radiofrecuencia a un nivel por debajo de 1cm de la región del His, en teoría, al reducir la posibilidad de daño del nodo AV y bloqueo cardiaco completo. En este estudio, se requirió una media de dos pulsos de energía de radiofrecuencia (RF) para eliminar la taquicardia por reentrada nodal sin casos de bloqueo cardiaco (fig. 1).
Así mismo, el mapeo electroanatómico del triángulo de Koch puede facilitar el entendimiento de la anatomía postquirúrgica, la cardiopatía congénita y las aurículas derechas dilatadas, en los que la distancia y orientación entre el ostium del seno coronario y el His pueden estar alteradas. Recientemente Khairy et al.9 describieron el caso de un paciente con un defecto del canal AV parcialmente reparado mediante cirugía, en el que la modificación exitosa de la vía lenta se realizó con la asistencia del sistema EnSite NavX® (St. Jude Medical).
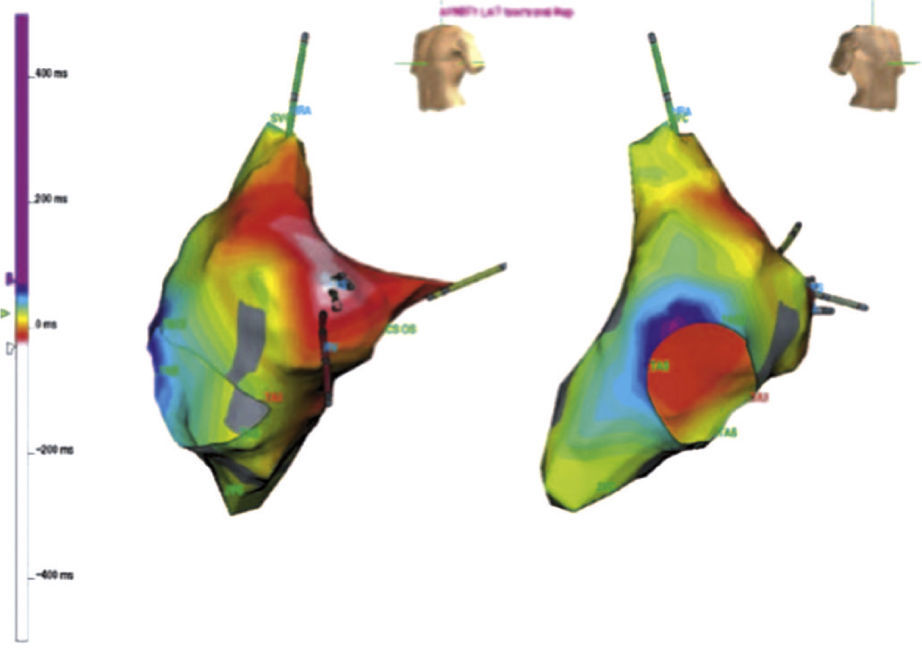
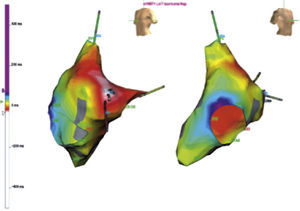
En la figura 2 se aprecia un mapa electroanatómico de la aurícula derecha (sistema EnSite NavX) durante una taquicardia por reentrada del nodo AV, con una activación retrógrada auricular más temprana a nivel del His. El mapeo electroanatómico tridimensional del triángulo de Koch facilitó la delineación de las entradas invertidas del nodo AV con ablación exitosa de la rama superior de la vía lenta del haz de His. Además, uno de los beneficios de utilizar mapeo electroanatómico para la taquicardia por reentrada nodal, incluye reducción del tiempo de fluoroscopia, mediante el sistema CARTO Biosense, en comparación con la fluoroscopia tradicional10,11. De otro lado, Kopelman et al.11 realizaron un estudio prospectivo con distribución aleatoria en el que incluyeron 20 pacientes consecutivos y compararon la modificación de la vía lenta por fluoroscopia convencional con la aproximación guiada por mapeo electroanatómico mediante el sistema CARTO Biosense, con el objetivo de evaluar el éxito del procedimiento temprano y la liberación total de energía. El éxito del procedimiento temprano fue del 100% en ambos grupos. Sin embargo, la exposición fluoroscópica y el tiempo de procedimiento fueron reducidos en el grupo del mapeo electroanatómico con un promedio de 2,7 pulsos de energía en comparación con 5 pulsos en el brazo de fluoroscopia convencional.
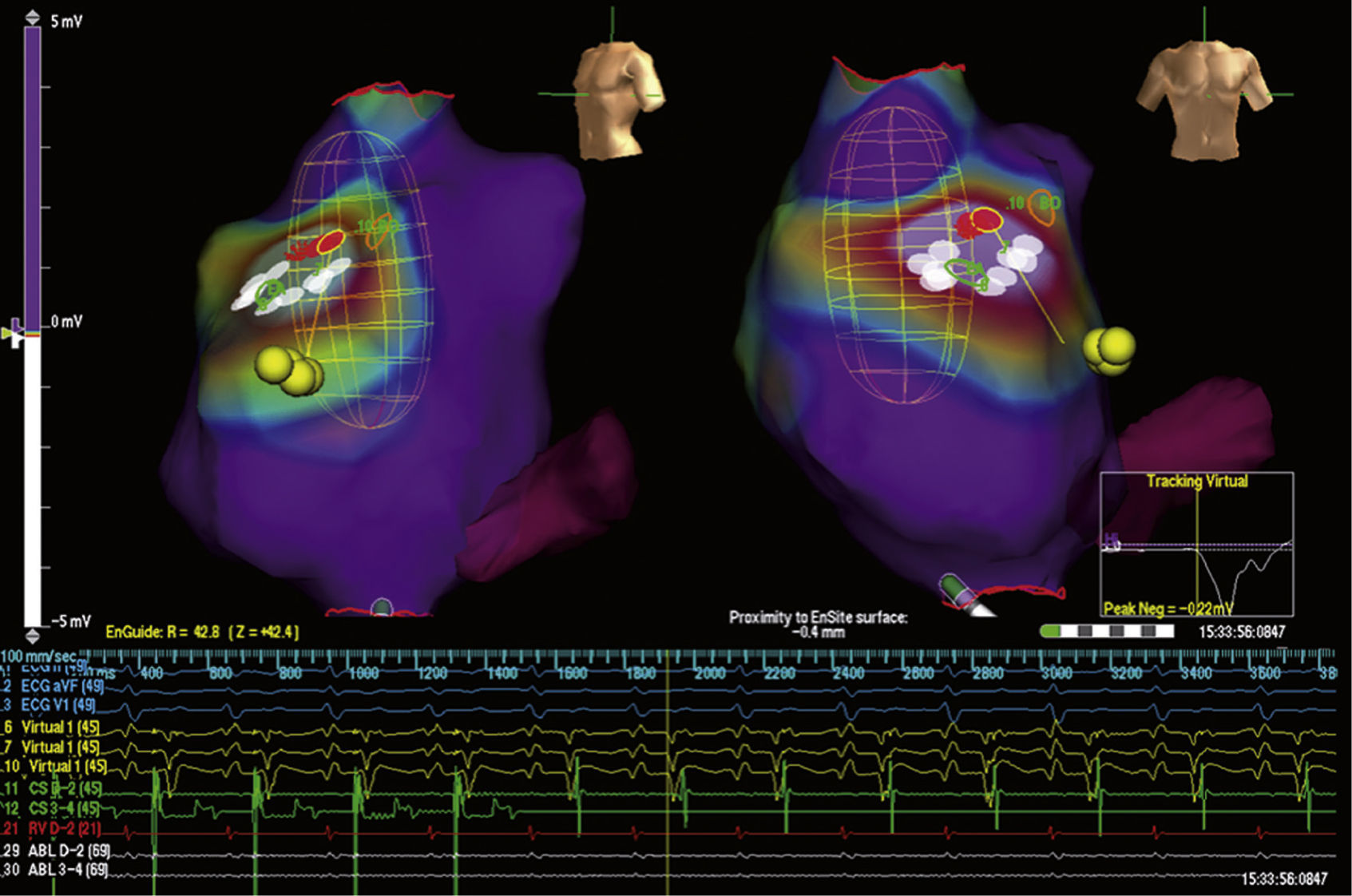
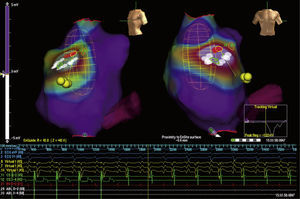
La utilidad de los sistemas de mapeo electroanatómico tridimensional para la localización de la inserción de las vías accesorias en la ablación con catéter ha sido investigada en estudios limitados10,12–15. Los beneficios de los sistemas de mapeo incluyeron la capacidad para delimitar los sitios de interés de difícil acceso o localización (como las vías accesorias con fisiología tipo Mahaim), navegar en áreas previamente investigadas y definir la extensión del nodo AV al reducir la probabilidad de lesión en el caso de las vías accesorias parahisianas. Adicionalmente, algunos estudios sugieren una reducción del tiempo total de fluoroscopia con el uso de sistemas de mapeo electroanatómico12,14,16 (fig. 3).
Mapa de activación, voltaje y propagación durante taquicardia reciprocante AV secundaria a vía accesoria derecha parahisiana con sistema electroanatómico tridimensional EnSite Array. Nótese la región del His (puntos amarillos), el seno coronario (fucsia) y las aplicaciones con energía de RF (puntos blancos) en ritmo sinusal.
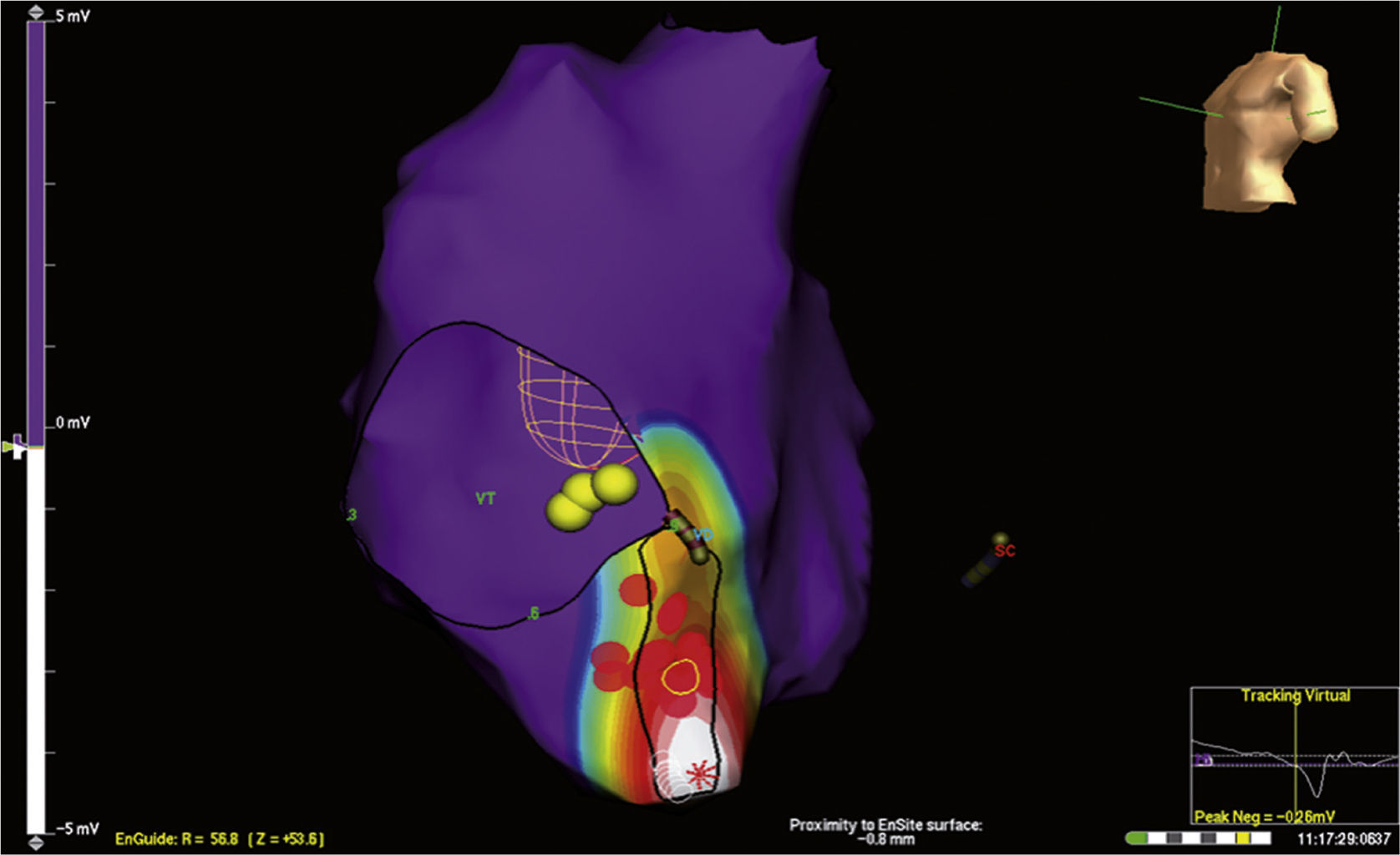
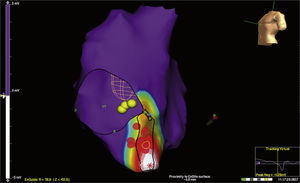
Los sistemas de mapeo electroanatómico también pueden ser útiles en casos de ablación fallida previa. En un estudio de González-Torrecilla et al.15, 17 pacientes con vías accesorias en quienes se había fallado un promedio de dos ablaciones previas con procedimientos convencionales, fueron llevados a ablación guiada por mapeo electroanatómico tridimensional (sistema CARTO Biosense) con una tasa de éxito del 94% (un caso fallido), sin recurrencia, durante un seguimiento promedio de 16±15 meses. De igual forma, se han empleado los sistemas de mapeo electroanatómico EnSite para pacientes con ablación previa fallida de vías accesorias derechas e izquierdas y en casos de inestabilidad hemodinámica durante la arritmia (fig. 4).
Mapeo electroanatómico tridimensional con mapas de activación y voltaje con sistema EnSite Balón Array, de taquicardia reciprocante AV por vía accesoria posteroseptal derecha en un paciente con ablación fallida e inestabilidad hemodinámica. Nótese el sitio de activación temprana (zona blanca) y los puntos de aplicación de RF (rojos).
De otra parte, se han descrito ablaciones exitosas de vías accesorias complejas o que representan un reto, como las asociadas con divertículos del seno coronario o anomalía de Ebstein, con la asistencia de sistemas de mapeo electroanatómico tridimensional17–19. El mapeo 3-D también se ha usado en pacientes con síndrome de WPW, con el objetivo de mapear vías accesorias izquierdas de localizaciones inusuales facilitando su ablación, como ocurre en el caso de las vías accesorias localizadas en el seno coronario. El mapeo 3-D ofrece la posibilidad de detallar la anatomía del seno coronario, las ramas, posibles aneurismas y otras alteraciones a lo largo de su curso, que pueden incluso complementarse con imágenes obtenidas mediante tomografía axial computarizada (TAC) y ser importadas al sistema de mapeo. Permite una mejor y más efectiva ablación de vías oblicuas ya que define el sitio de inserción auricular y ventricular que, dado el recorrido de estas vías, puede hacer más complejo un procedimiento de ablación convencional. En las vías parahisianas la discriminación espacial entre el sitio de inserción de la vía y el registro del His, es de importancia cardinal ya que el posicionamiento inadecuado puede llevar a bloqueo AV o fracaso del procedimiento. Por tanto, el diagnóstico preciso con mapeo 3-D y la ablación con tecnología de catéteres de contacto pueden marcar la diferencia18,20–24.
Para pacientes más vulnerables a los efectos deletéreos de los rayos X, tales como mujeres embarazadas y aquellos con disfunción inmune, al igual que para casos complejos seleccionados, los procedimientos electrofisiológicos guiados con mapeo 3-D asociados a guía ecocardiográfica intracardiaca o transesofágica pueden ser una alternativa para un abordaje seguro; por ejemplo, 9 pacientes embarazadas con taquicardias supraventriculares que no mejoraron con medicación, fueron sometidas a mapeo 3-D con mínimo tiempo de fluoroscopia y sin recurrencias25.
En pacientes pediátricos llevados a ablación de vías accesorias, múltiples publicaciones confirman la seguridad y la eficacia del uso de un sistema de mapeo 3-D y sus beneficios, dados por la necesidad de un mínimo tiempo o no requerimiento de fluoroscopia. Además, el mapeo 3-D y la navegación no fluoroscópica han ayudado a mejorar los resultados en casos congénitos complejos y en problemas o situaciones difíciles encontradas durante el mapeo y la ablación de arritmias pediátricas; otro aspecto de importancia es la exposición considerable a radiación durante dichos procedimientos, tanto para el paciente como para los profesionales y el personal de sala26.
Las preexcitaciones ventriculares y las taquicardias por reentrada AV se observan en 20 a 30% de los pacientes con anomalía de Ebstein. Las vías accesorias se localizan alrededor del anillo tricuspídeo, incluyendo las más raras, como las fibras del tipo Mahaim. Esta anomalía se asocia adicionalmente con la presencia de múltiples vías accesorias. En los pacientes con transposición de los grandes vasos corregida, las vías accesorias se hallan en un 2 a 5% de los casos y se localizan a lo largo del lado izquierdo, en el anillo valvular AV que corresponde a la válvula tricuspídea anatómica. Durante el procedimiento de mapeo 3D y ablación el seno coronario es útil como referencia anatómica para la orientación de la válvula AV del lado izquierdo (tricúspide). En un estudio de 83 pacientes, incluyendo 17 con ventrículo único, se reportó una tasa de éxito del 82% para vías accesorias izquierdas y del 70% para las derechas con el uso de mapeo 3-D y crioablación; en el subgrupo de pacientes con anomalía de Ebstein la tasa de éxito fue del 76 al 83%, levemente menor que en los pacientes con anatomía normal cardiaca. En aquellos con múltiples vías y anatomía más compleja, la tasa de recurrencia fue mayor al 25%, en especial en los niños más pequeños.
La ablación puede ser más difícil y menos exitosa a pesar del mapeo tridimensional, en pacientes con cirugías como Fontan o reemplazo valvular AV, de ahí que deba considerarse la ablación antes de la intervención incluso cuando el paciente está asintomático26–29.
En conclusión, los sistemas de mapeo electroanatómico tridimensional han facilitado el entendimiento de los mecanismos que intervienen en las arritmias complejas y han demostrado que pueden reducir los tiempos de fluoroscopia y del procedimiento, así como mejorar el éxito de la ablación en procedimientos que habitualmente se hacen de manera convencional. La creación de lesiones de ablación lineales y la posibilidad para regresar el catéter a los sitios de ablación previos, constituyen ventajas de estos sistemas.
RecomendacionesClase I- •
La ablación de taquicardias nodales o vías anómalas convencionales guiada por mapeo tridimensional, está indicada cuando se requiere disminuir o evitar el efecto de los rayos X (embarazadas y niños) (nivel de evidencia C).
- •
La ablación de taquicardias nodales o vías anómalas convencionales guiada por mapeo tridimensional, puede estar indicada cuando hay recurrencia de una ablación previa (nivel de evidencia C).
- •
La ablación de taquicardias nodales o vías anómalas convencionales guiada por mapeo tridimensional, puede ser útil en pacientes con anatomía cardiaca compleja (por ejemplo: anomalía de Ebstein, cardiopatía congénita, cardiopatías estructurales y posoperatorio de cirugía cardiaca) (nivel de evidencia C).