El flutter auricular típico es una arritmia macrorreentrante dependiente de la conducción a través del istmo cavotricuspídeo. Es relativamente refractario al tratamiento médico para el control del ritmo y/o de la frecuencia cardiaca. Se puede desarrollar de manera aislada o concomitante con fibrilación auricular. Se asocia a serias complicaciones incluyendo embolia pulmonar y sistémica, taquicardia extrema, isquemia miocárdica, congestión venosa pulmonar, taquicardiomiopatía y falla cardiaca.
El Working Group of arrhythmias of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology ha estandarizado la nomenclatura del flutter auricular, con base en los mecanismos de la arritmia y en su sustrato anatómico más que en la apariencia de la onda de activación auricular en el electrocardiograma. El flutter auricular dependiente del istmo cavotricuspídeo, cuyo circuito de propagación se da en sentido antihorario alrededor del anillo tricuspídeo, se denomina «típico», mientras que aquel que tiene el mismo circuito anatómico pero cuya propagación se da en sentido horario se conoce como «flutter típico reverso»1.
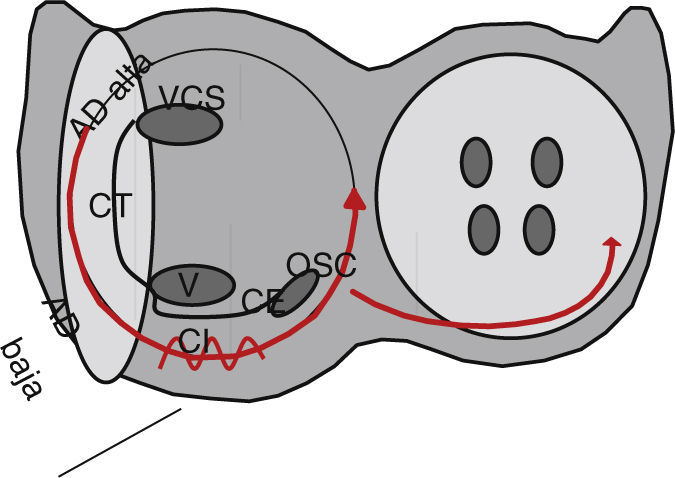
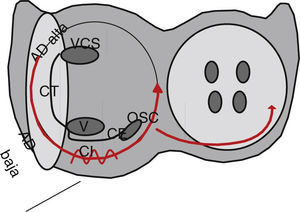
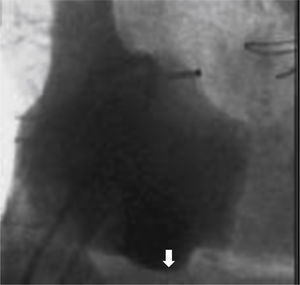
La base anatómica del flutter auricular es el istmo cavotricuspídeo (istmo cavotricuspídeo), una estructura compleja de variabilidad anatómica importante. El istmo cavotricuspídeo está delimitado anteriormente por el anillo tricuspídeo y posteriormente por la vena cava inferior y el remanente de la válvula de Eustaquio (crista de Eustaquio). El circuito del flutter auricular típico tiene como límite anterior el anillo tricuspídeo, en tanto que el posterior está dado por la combinación de barreras anatómicas incluyendo los orificios de la vena cava superior e inferior y la crista terminalis extendiéndose hasta la crista de Eustaquio en forma medial2. Estas estructuras proveen barreras anatómicas y funcionales de conducción que permiten la despolarización de la arritmia a través de una zona protegida de conducción y propagación lentas3,4. La conducción es predominantemente lenta en el istmo cavotricuspídeo, en donde puede ser del 30 al 50% de la longitud de ciclo de la taquicardia. En 90% de los casos (flutter auricular típico), el frente de onda de activación procede de la porción lateral del istmo cavotricuspídeo y se dirige hacia la porción medial del mismo y de allí hacia arriba en el septum y la pared anterior de la aurícula derecha, luego continúa a través del arco inferior en la pared lateral y finalmente se dirige medial anterior a la vena cava inferior, en una dirección antihoraria, cuando se observa el anillo tricuspídeo desde una proyección oblicua anterior izquierda. Si el frente de onda rota en una dirección horaria, se produce el flutter auricular típico reverso y en este caso la longitud de ciclo de la taquicardia (flutter) es regular y tiene un rango de frecuencia entre 240 a 350 lpm (fig. 1)5.
Esquema del circuito de flutter auricular típico. Se observan los anillos tricuspídeo y mitral en proyección oblicua izquierda anterior 40°. El circuito antihorario circula anterior a la crista terminalis (CT), entre los orificios de la vena cava superior (VCS) y la vena cava inferior (VCI), continuando por el istmo cavotricuspídeo (IC) a través de la cresta de Eustaquio, que es la zona de conducción lenta, ascendiendo por la pared septal después del ostium del seno coronario (OSC). El flutter auricular típico reverso tiene los mismos accidentes anatómicos pero en sentido horario. En esta proyección el istmo cavotricuspídeo se puede dividir en septal (hacia el OSC), medio y lateral.
El istmo cavotricuspídeo tiene una longitud entre 20 y 43mm, tiene forma trapezoide y se divide en tres segmentos en el plano frontal: septal, medio y lateral. La región media del istmo es la más delgada, la región lateral generalmente es la más larga, mientras que la zona septal es la más gruesa. De manera longitudinal se observan también tres zonas: muscular hacia la válvula tricúspide, trabeculada en la región medial y membranosa hacia la vena cava inferior. Por debajo del istmo cavotricuspídeo están las ramas distales de la arteria coronaria derecha y las arterias del nodo aurículo-ventricular, venas coronarias y ramas del sistema nervioso autónomo. De medial hacia septal del istmo cavotricuspídeo, están las extensiones inferiores del nodo aurículo-ventricular compacto. Recientemente se ha descrito a la cresta de Eustaquio como línea divisoria en el istmo cavotricuspídeo, la cual forma una prominencia visible y divide dicho istmo en el subeustaquiano, que se extiende desde el punto bisagra de la válvula tricúspide hasta la cresta de Eustaquio en compañía de una porción membranosa más posterior que se extiende desde el pico de la cresta de Eustaquio a la vena cava inferior. Dentro del istmo subeustaquiano se encuentra comúnmente un receso conocido como bolsa de Keith que puede tener de 6 a 10mm de profundidad e incrementar significativamente la dificultad para obtener bloqueo a través del istmo cavotricuspídeo. El istmo cavotricuspídeo medio está localizado alrededor de la hora 6 en la proyección oblicua anterior izquierda a 40° (sitio recomendado para realizar la línea de ablación). Puede ser trazado retirando un catéter de mapeo, insertado en el lugar más inferior del anillo tricuspídeo donde se obtiene una señal anular con un electrograma auricular/ventricular en relación 1/3, hasta el ostium de la vena cava inferior, donde desaparecen los electrogramas (figs. 1 y 2)6.
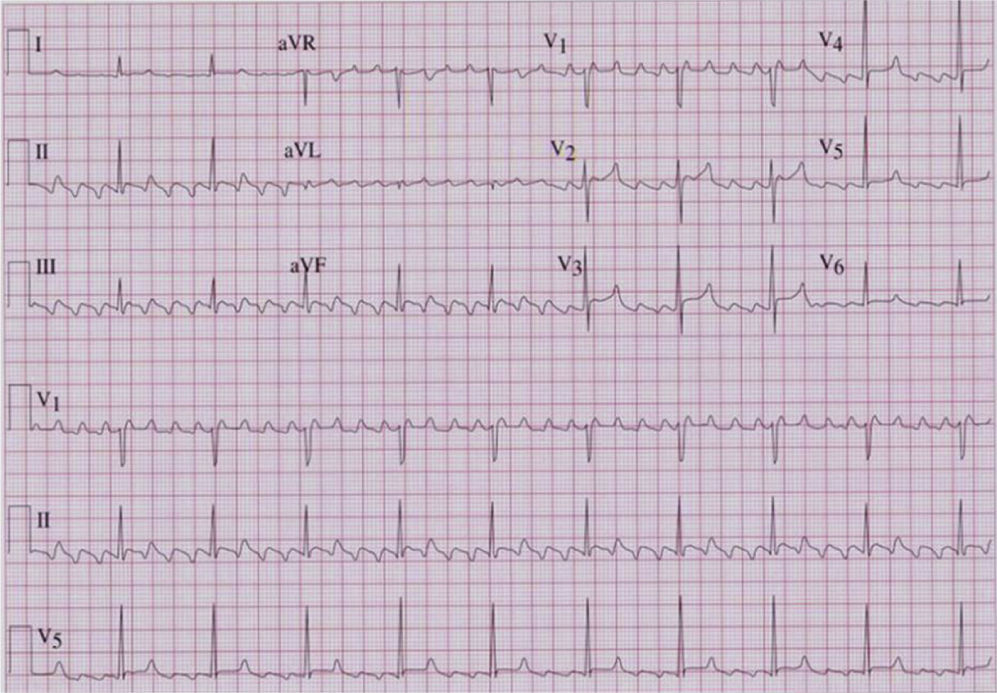
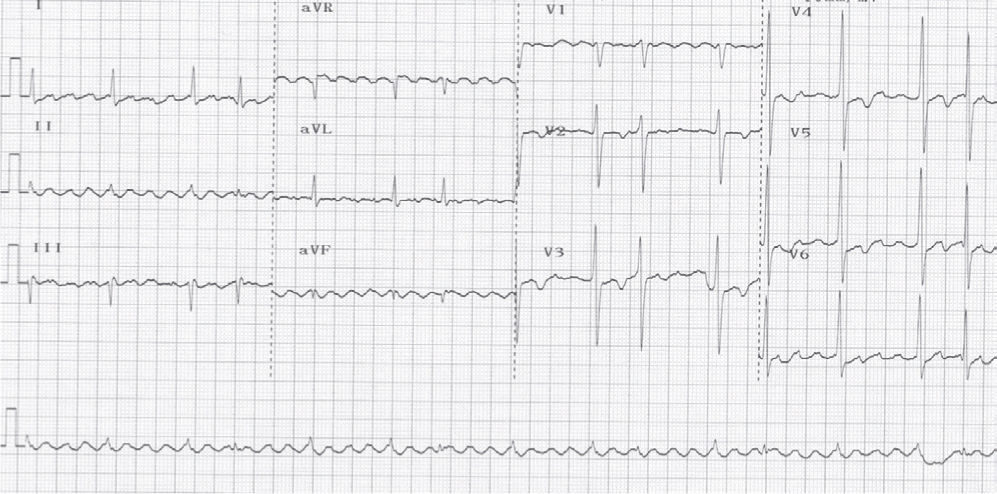
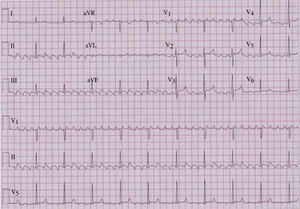
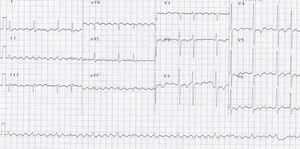
El flutter auricular típico se puede identificar por un patrón electrocardiográfico en derivaciones inferiores que, aunque se describe frecuentemente como una onda negativa, es en realidad una ondulación compleja con una fase descendente lenta, seguida de un pequeño descenso rápido («onda negativa») y un ascenso vertiginoso que termina en una deflexión positiva, para enlazar de nuevo con el descenso lento del ciclo siguiente. En V1 suelen registrarse deflexiones positivas. La frecuencia auricular es típicamente mayor a 240 lpm en ausencia de medicamentos antiarrítmicos. En el flutter auricular típico reverso se encuentran ondas «positivas» en la pared inferior con una longitud de ciclo (LC) similar. Este patrón es considerablemente menos específico que en el flutter típico (figs. 3 y 4)1.
En las guías del American College of Cardiology/American Heart Association/European Society of Cardiology (ACC/AHA/ESC) publicadas en 2003 para el manejo de arritmias supraventriculares7 se recomienda la ablación del flutter auricular típico en las siguientes situaciones:
- •
Flutter auricular pobremente tolerado (clase I, nivel de evidencia B).
- •
Primer episodio de flutter auricular típico bien tolerado (clase IIa, nivel de evidencia B).
- •
Flutter auricular que aparece posterior al inicio de amiodarona para el manejo de fibrilación auricular (clase I, nivel de evidencia B).
Estudios posteriores a estas recomendaciones han comparado el tratamiento con ablación vs. amiodarona como estrategia de primera línea después del primer episodio sintomático de flutter auricular. Con la ablación el éxito a largo plazo es mayor sin exponerse a los eventos adversos de medicamentos antiarrítmicos. El riesgo de fibrilación auricular subsecuente no se modificó. La cardioversión se reserva para el manejo agudo. La terapia antiarrítmica generalmente es inefectiva para prevenir o terminar el flutter auricular8. La recurrencia poscardioversión suele ser alta (70-90%).
Se recomienda realizar la ablación del flutter auricular en pacientes sometidos a ablación por fibrilación auricular (aislamiento de venas pulmonares), en quienes se ha documentado previamente esta arritmia o en casos en que es fácilmente inducible. La ablación empírica del flutter auricular para profilaxis de la arritmia con ablación del istmo cavotricuspídeo es controversial9. La ablación del istmo cavotricuspídeo en pacientes tratados con antiarrítmicos por fibrilación auricular que se organizan en flutter auricular es razonable, particularmente en pacientes que reciben antiarrítmicos clase IC, dado el enlentecimiento que éstos inducen en el istmo cavotricuspídeo, con el riesgo consecuente de conducción ventricular 1:1, especialmente en condiciones de incremento en el tono simpático.
En los pacientes llevados a ablación el objetivo estándar es el bloqueo bidireccional a través del istmo cavotricuspídeo8. El bloqueo bidireccional del istmo cavotricuspídeo puede evaluarse mediante la observación de la secuencia de activación auricular durante la estimulación atrial. Se ha logrado un bloqueo bidireccional cuando al estimular desde el seno carotídeo proximal se obtiene un frente de onda descendente por la pared libre auricular derecha contralateral (fácilmente evaluada con un catéter multielectrodo) y el último sitio de activación a lo largo del anillo está justo lateral a la línea de ablación; y cuando al estimular desde la aurícula derecha lateral o en el sitio lateral a la línea de ablación se obtiene una activación cráneo-caudal del septum auricular y el último sitio de activación a lo largo del anillo tricuspídeo es medial a la línea de ablación5.
La aparición de bloqueo bidireccional se sustenta en lo siguiente5,10–12:
- •
Presencia de un corredor de potenciales ampliamente divididos con un intervalo isoeléctrico de más de 100ms en la línea de ablación.
- •
Retardo de activación mayor a 140ms en el istmo cuando se estimula desde el lado contralateral a la línea de ablación.
- •
Estimulación diferencial a lo largo de la aurícula derecha lateral.
- •
Cambio súbito en la morfología de la onda P, de negativa a positiva (con un PR largo) cuando se estimula lateral a la línea de bloqueo en el momento del mismo.
- •
Mapeo electroanatómico tridimensional utilizando un mapa de activación eléctrica o de propagación del impulso.
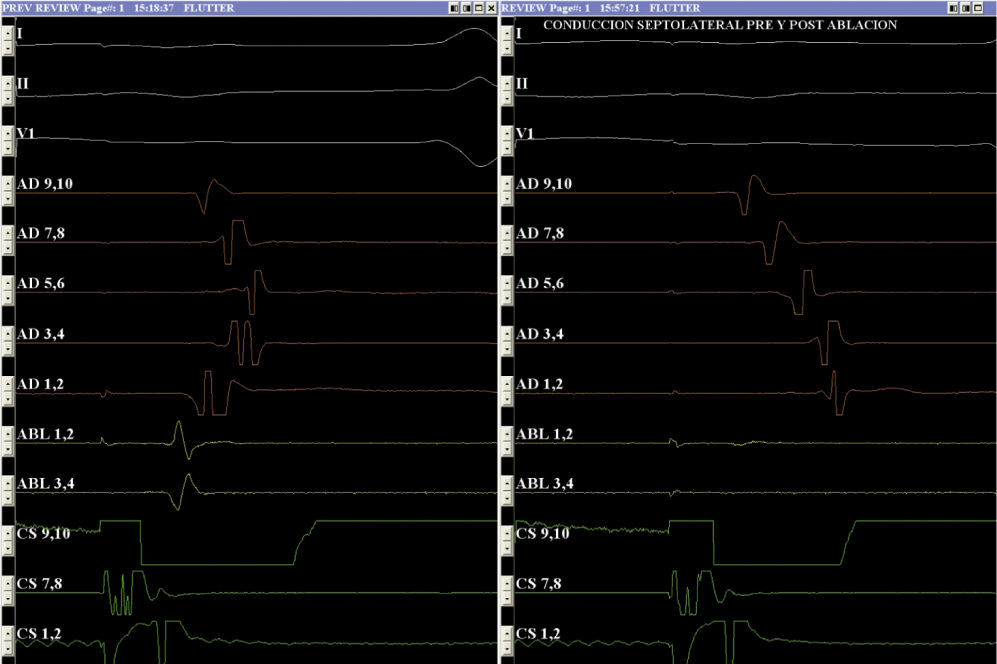
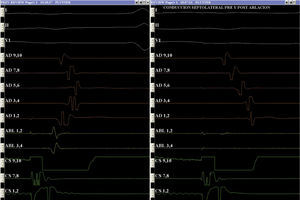
La estimulación diferencial es el método más sensible para excluir la presencia de conducción lenta o fugas a través del istmo cavotricuspídeo y confirmar su bloqueo completo. Cuando el bloqueo está presente, la activación local se vuelve más corta, alejándose de la línea cuando se estimula desde el lado opuesto de la misma (fig. 5).
Conducción intraatrial pre y postablación del istmo cavotricuspídeo. Con estimulación desde el ostium del seno coronario, el sensado auricular más tardío preablación se observa en el canal 5-6 localizado en la pared lateral alta de la aurícula derecha (AD); postablación, se evidencia en el canal 1-2 localizado en la región lateral baja de la AD, con un retardo mayor a 110ms.
La ablación por técnica convencional fluoroscópica con catéteres irrigados persiguiendo el bloqueo bidireccional del istmo cavotricuspídeo, tiene una tasa de éxito del 93 al 95% y una recurrencia de alrededor del 5%13,14.
Existen estudios que han comparado los resultados de la ablación mediante las técnicas convencionales y guiados por mapeo electroanatómico o por ecografía intracardiaca.
Un estudio aleatorizado con 80 pacientes, no encontró diferencias en cuanto al número de aplicaciones de radiofrecuencia y el tiempo del procedimiento con el uso de mapeo 3D, aunque sí en la exposición a la fluoroscopia (29 vs. 8 minutos p = 0,0001). En el seguimiento a 8 meses, las recurrencias fueron semejantes (9%)15.
En un estudio más grande, que incluyó 210 pacientes, en forma aleatoria, se evaluaron los resultados de las dos técnicas y se hallaron resultados semejantes en eficacia, tiempo del procedimiento y recurrencias (6%), con menor fluoroscopia en el grupo de mapeo electroanatómico. En este estudio se valoraron los costos de los procedimientos y encontró menor valor en el grupo convencional (US $ 2.720 vs. 3.870)16. Otros estudios han encontrado resultados semejantes17 y uno con 70 pacientes reportó además menos recurrencias18.
El mapeo electroanatómico se recomienda y es particularmente útil en pacientes cuyo patrón electrocardiográfico del flutter auricular no es típico, con cirugía cardiaca previa o ablación previa del istmo cavotricuspídeo, en quienes las probabilidades de flutter auricular no istmo-dependiente son mayores o es necesario una técnica de modulación de substrato arritmico15. La posibilidad de realizar mapas de activación, propagación y voltaje es de ayuda para determinar el mecanismo de la taquicardia e identificar brechas en líneas previas de ablación y el patrón de fibrosis para definir la técnica de ablación. También puede ser útil cuando se sospecha una variante tipo reentrada de asa baja (tiene un circuito alrededor de la vena cava inferior en lugar del anillo tricuspídeo)19. Existe una zona de bloqueo a través de la crista terminalis o en la unión de la crista y la cresta de Eustaquio. Este circuito reentrante usa el istmo cavotricuspídeo y presenta un objetivo común con el flutter auricular, típico para la ablación.
Estos sistemas de mapeo permiten la visualización tridimensional de las lesiones aplicadas y su relación con las estructuras anatómicas adyacentes. Pueden usarse para realizar mapas de activación durante flutter auricular o ritmo sinusal para confirmar bloqueo bidireccional. El uso de mapeo electroanatómico disminuye el tiempo de exposición a rayos X, aunque no implique disminución en la duración del procedimiento o en el número de lesiones necesarias para lograr el bloqueo del istmo cavotricuspídeo (figs. 6-8).
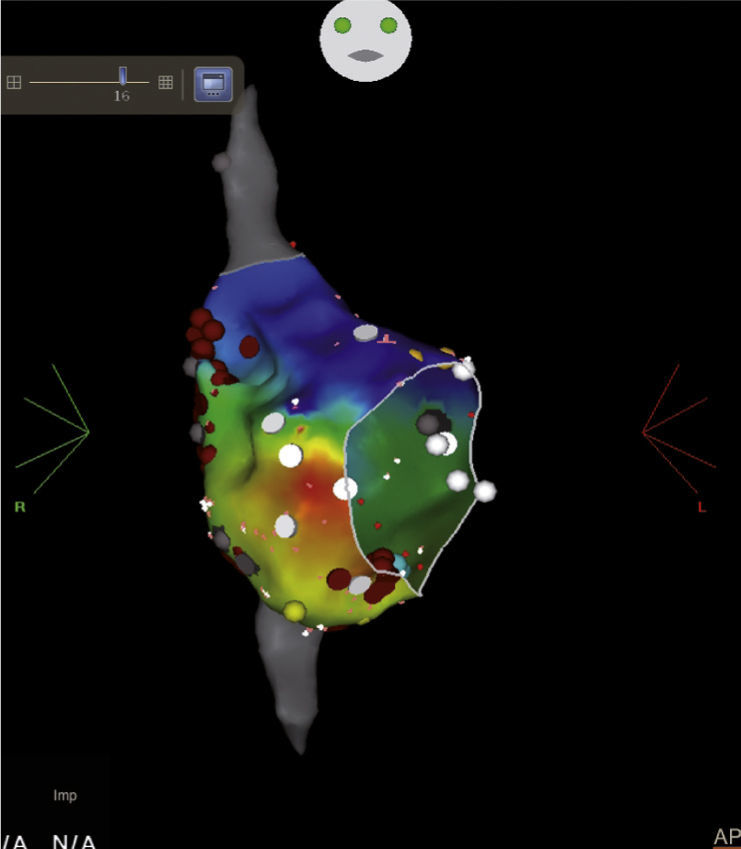
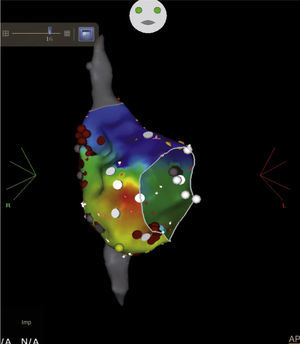
Ablación de flutter auricular típico en un paciente con antecedente de cierre de comunicación interauricular (CIA). Después de la ablación del istmo cavotricuspídeo, cambió la secuencia de activación auricular por un flutter incisional no conocido previamente, con zona de conducción lenta en región posterolateral (flecha). Las aplicaciones de energía de radiofrecuencia en dicha zona interrumpieron el flutter auricular incisional. Los puntos rojos indican las aplicaciones de radiofrecuencia, los blancos son potenciales fraccionados, los grises corresponden a zonas de bajo voltaje y el amarillo el sitio final de la línea de ablación del istmo cavotricuspídeo.
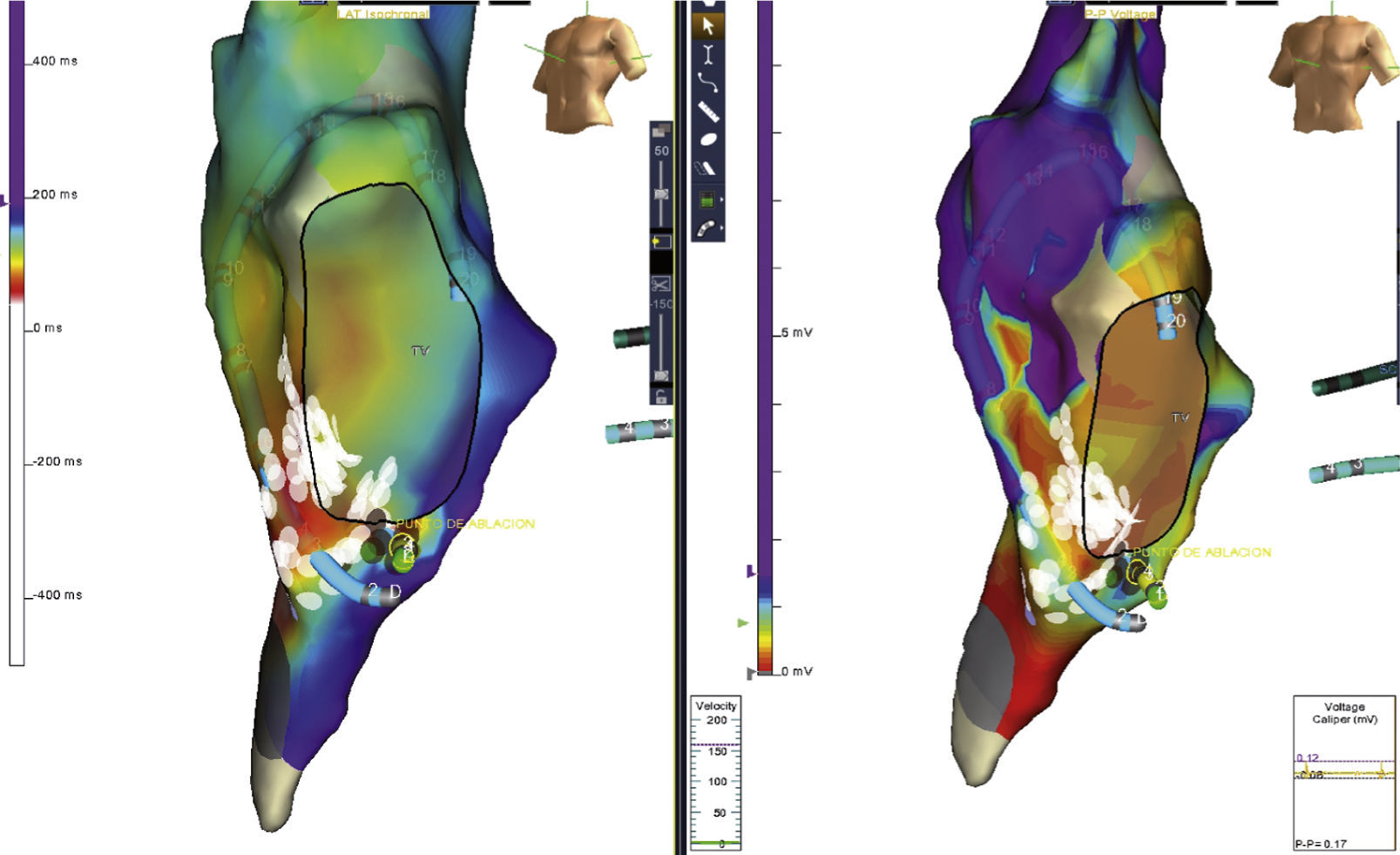
Ablación de flutter auricular típico en una paciente con dilatación severa de la aurícula derecha. Nótese la gran extensión del istmo cavotricuspídeo. Los puntos rojos representan las aplicaciones de radiofrecuencia. Los amarillos el potencial de His. Postablación; el frente de onda al estimular desde OSC (zona blanca) choca contra el istmo cavotricuspídeo y no logra avanzar más allá de la línea de ablación, como se observa claramente en este mapa de propagación.
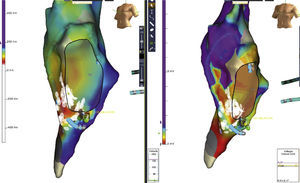
Ablación de un paciente con flutter auricular típico con participación crítica del istmo cavotricuspídeo en el circuito por encarrilamiento. Al completar la ablación del istmo cavotricuspídeo en la zona medial, no se terminó el flutter auricular. Se realizó mapa de precocidad o activación (izquierda) y voltaje (derecha), documentando correlación entre la zona de transición de precocidad con una cicatriz heterogénea hacia el istmo cavotricuspídeo lateral. La realización de una segunda línea de ablación en el istmo cavotricuspídeo lateral interrumpió el flutter auricular.
Más recientemente se ha descrito el papel de la ecografía intracardiaca en la eficacia y efectividad (recurrencias) de la ablación del ismo cavotricuspídeo, documentándose mejoría de los resultados a corto y largo plazo debido a la posibilidad que ofrece de observar las alteraciones anatómicas del istmo en mención y establecer estrategias para una ablación más rápida y eficaz. La posibilidad de observar el contacto del catéter con el istmo permite realizar lesiones más apropiadas (contacto y estabilidad) a través de la observación de desarrollo de edema local. Impacta favorablemente el tiempo de procedimiento, la exposición a radiaciones ionizantes, la tasa de eficacia y la tasa de efectividad a largo plazo. La ecografía incluso permite detectar zonas posibles de recurrencia al detectar las áreas de gap por ausencia de edema20.
ConclusionesEn el flutter auricular típico la estrategia de ablación se dirige al bloqueo bidireccional del istmo cavotricuspídeo. Las estrategias convencionales se asocian con buen desempeño en la mayoría de casos que no han mejorado con el uso de sistemas de mapeo tridimensionales, de ahí que el uso rutinario no se sustente. Estos sistemas han mostrado disminuir el tiempo de fluoroscopia y la utilidad en casos en que las técnicas convencionales han fallado, existen alteraciones anatómicas o hay antecedentes de cirugía cardiaca u otras causas de fibrosis auricular que determinan circuitos complejos. Estudios más recientes demuestran el papel del uso de la ecografía intracardiaca en la eficacia y efectividad de la ablación del istmo cavotricuspídeo.
RecomendacionesClase ILa ablación del istmo cavotricuspídeo guiada por mapeo electroanatómico debe usarse en quienes se necesite disminuir el tiempo de fluoroscopia (por ejemplo embarazadas).
Clase IIA- •
La ablación del istmo cavotricuspídeo guiada por mapeo electroanatómico puede ser utilizada en quienes existan alteraciones anatómicas o antecedente de cirugías cardiacas previas que dificulten el éxito del procedimiento.
- •
La ablación del istmo cavotricuspídeo guiada por mapeo electroanatómico puede usarse en pacientes con ablación técnicamente difícil o recurrencias por ablación previa del istmo cavotricuspídeo.
- •
La ecografía intracardiaca es una herramienta útil y deseable en la ablación del istmo cavotricuspideo por impacto en efectividad y tiempo de radiación.
- •
Los sistemas de mapeo tridimensional carecen de utilidad para uso rutinario en la ablación del istmo cavotricuspídeo e incrementan considerablemente el costo.