El aumento de los implantes de dispositivos de estimulación cardiaca en los últimos años, aunado a la longevidad y al perfil de morbilidad de los pacientes, ha hecho que la incidencia de infecciones asociadas a estos procedimientos aumente. Sin embargo, existe disparidad en Colombia y en el mundo respecto al esquema apropiado de profilaxis antibiótica.
ObjetivoEvaluar la incidencia de infecciones postoperatorias con dos protocolos de antibiótico-profilaxia.
MétodosEnsayo clínico controlado aleatorizado en el que se incluyeron 360 pacientes que recibieron implante de dispositivos cardíacos y fueron aleatorizados en dos grupos para recibir una dosis de antibiótico (cefazolina 1g) (240 pacientes) o tres dosis (120 pacientes). Se realizó seguimiento durante un año. El desenlace principal fue la incidencia de infecciones postoperatorias.
ResultadosNo se observó una diferencia significativa entre la incidencia de infección postoperatoria en los dos grupos (tres dosis vs. una dosis: OR crudo 0.92; IC95% 0.23 - 3.64; p 0.912), con una tasa de 2.9% (7/238) en el grupo de una dosis y de 2.7% (3/110) en el grupo de tres dosis. Tras el análisis multivariado se identificó a la enfermedad renal crónica como un predictor independiente para el desarrollo de complicaciones infecciosas (OR ajustado 4.71; IC95% 1,13 - 19,60).
ConclusiónEl uso de un protocolo de única dosis de antibiótico profiláctico una hora antes del implante de dispositivos de estimulación cardiaca parece no ser inferior al protocolo de tres dosis postoperatorias.
The increase in implantable cardiac stimulation devices in the last few years, along with the longevity and morbidity characteristics of the patient, has led to an increase in infections associated with these procedures. However, there are differences in Colombia and in the rest of the world as regards a suitable antibiotic prophylaxis scheme.
ObjectiveTo evaluate the incidence of post-operative infections with two antibiotic prophylaxis protocols.
MethodsA controlled, randomised clinical trial was performed, in which 360 patients that had received a cardiac device implant were randomised into two groups: one with 240 patients to receive one dose of antibiotic (1g cephazolin), and another of 120 patients to receive 3 doses. The patients were followed-up for one year. The primary outcome was the incidence of post-operative infections.
ResultsNo significant difference was observed in the incidence of post-operative infections between the two groups (three doses versus one dose: crude OR, 0.92; 95% CI; 0.23 - 3.64; P=.912), with a rate of 2.9% (7/238) in the one-dose group, and 2.7% (3/110) in the three-dose group. After the multivariate analysis, chronic kidney disease was identified as an independent predictor of developing infectious complications (adjusted OR=4.71; 95% CI; 1.13 – 19.60).
ConclusionThe use of a single-dose prophylaxis antibiotic protocol one hour before the implantation of cardiac stimulator devices does not appear to be inferior to the three-dose post-operative protocol.
El número de implantes de dispositivos de estimulación cardiaca ha crecido de manera exponencial durante las dos últimas décadas, no solo por el incremento en el diagnóstico de las diferentes enfermedades que indican tales implantes, sino también por la mayor gama de condiciones patológicas en las cuales se usan marcapasos, desfibriladores (CDI) y cardiorresincronizadores (TRC). El aumento en el uso de estos dispositivos, aunado a la longevidad de los pacientes, con el consecuente incremento en la comorbilidad, ha hecho que la incidencia de infecciones asociadas a este tipo de procedimientos muestre una tendencia al crecimiento1,2.
A pesar de la mejor calidad de los dispositivos, menor tamaño y mejor funcionalidad, y de las normas cada vez más exigentes respecto a las medidas de asepsia y antisepsia, aun es una complicación frecuente la infección asociada al implante de dispositivos de estimulación cardiaca3. En algunas series se han reportado incidencias mayores al 2%4.
Se habla de infección asociada al dispositivo implantado cuando se presenta posterior a una intervención, ya sea superficial, de tejidos blandos, endovascular o intracardiaca, dentro del año posterior al procedimiento5. Entre los factores relacionados con el desarrollo de infección se encuentran las enfermedades sistémicas, como diabetes mellitus e insuficiencia renal crónica, otras causas de inmunosupresión, uso de esteroides, anticoagulación oral, ausencia de profilaxis antibiótica adecuada, reintervención, cambio de generador, dispositivos de mayor tamaño, experiencia del operador6. Otros factores que interfieren en el resultado de cualquier intervención son el uso de protocolos diferentes de antibiótico-profilaxia, la técnica quirúrgica, los materiales de sutura, el uso de antibiótico en bolsillo, entre otros, lo que contribuye a un mayor riesgo de infecciones asociadas al implante como se ha documentado en estudios previos7,8.
El microorganismo más implicado es el estafilococo por lo que los antibióticos indicados para profilaxis son cefazolina, una cefalosporina de primera generación, o vancomicina en pacientes con estancia prolongada o quienes se suponen colonizados por gérmenes hospitalarios debido a procedimientos invasivos recientes9. Sin embargo, existe disparidad en las diferentes instituciones en Colombia y en el mundo respecto al esquema apropiado de profilaxis antibiótica. En este estudio se pretende evaluar la incidencia de infecciones postoperatorias con dos protocolos de antibiótico-profilaxia: una dosis versus tres dosis.
Materiales y métodosEste ensayo aleatorizado se realizó en el Departamento de Electrofisiología en una institución de la ciudad de Bogotá que atiende pacientes de bajos ingresos con pobres condiciones nutricionales y múltiples comorbilidades. El período de reclutamiento fue del 1.° de enero de 2014 al 31 de agosto de 2016, y la última fecha de seguimiento fue el 30 de enero de 2018. El protocolo fue aprobado por un comité de ética antes de la inscripción de participantes y se obtuvo el consentimiento informado por escrito de todos los pacientes participantes.
Los pacientes mayores de 18 años, programados para implante de dispositivo cardíaco (marcapasos, cardiodesfibriladores, monitores de eventos, cardiorresincronizadores) fueron elegibles para la inclusión en el estudio. Se excluyeron aquellos pacientes que recibieron dosis adicionales de antibiótico por causa de otro proceso infeccioso sospechado o comprobado.
AleatorizaciónSe estimó un tamaño de muestra total de 360 pacientes con una precisión del 85%. Los pacientes fueron aleatorizados en dos grupos utilizando un número aleatorio generado por computadora, en un radio de 2:1 para el esquema de antibiótico propuesto versus el esquema antibiótico usual, justo antes de la cirugía. Los pacientes en el grupo de tratamiento recibieron dosis única de 1 gramo de cefazolina sódica intravenosa una hora antes de la incisión en la piel sin antibiótico intrabolsillo. Los pacientes en el grupo control recibieron el esquema más usado en el país: una dosis tópica en el sitio quirúrgico (bolsillo) y un total de cuatro dosis de 1g de cefazolina sódica intravenosa: la primera, una hora antes de la incisión en la piel, la segunda, la tercera y la cuarta dosis a las 8, 16 y 24 horas, respectivamente, después del procedimiento. Los cirujanos que proporcionaron el tratamiento asignado y las intervenciones no fueron enmascarados para la asignación del grupo del paciente.
DesenlacesEl desenlace principal fue la presencia de una complicación infecciosa postoperatoria, incluida infección superficial del sitio quirúrgico o infección sistémica, durante los dos años posteriores al procedimiento. Se realizó seguimiento a la semana, a los dos, seis y doce meses y luego cada seis meses hasta completar dos años. Se evaluó, adicionalmente, la presencia de eventos adversos relacionados con el esquema antibiótico.
Procedimiento quirúrgicoEl protocolo de implante de los dispositivos cardíacos fue estándar para los dos grupos de tratamiento: lavado de manos del grupo quirúrgico y enfermería en tres tiempos, con jabón de clorhexidina de manera que se obtenga abundante espuma, hasta el codo el primero, el segundo hasta la mitad del antebrazo y el tercero hasta la muñeca. En un tiempo total no menor a cinco minutos.
Al paciente ambulatorio se le dio la indicación de suspender medicación anticoagulante y antiagregante (para nuevos anticoagulantes orales uno a dos días antes y para warfarina tres días antes del procedimiento), a menos que tuviese antecedente de implante de stent medicado en el último año o tener historia de enfermedad cerebrovascular embólica previa. Al paciente hospitalizado se le suspendió la anticoagulación la noche anterior.
Se indicó baño con jabón quirúrgico la noche anterior y en la mañana del implante. Se verificó la ausencia de restos de pegamento de elementos de monitorización, o estos restos se retiraron con gasas impregnadas con alcohol. En la sala de procedimientos se dejaron los electrodos de monitorización en la parte posterior de los hombros. Se realizaron cinco lavados con clorhexidina, los dos primeros en cruz en una región amplia que abarcó desde la línea media hasta la región lateral de los hombros, pasando por la axila y desde el ángulo de la mandíbula hasta el nivel de la tetilla, en los hombres, o el pezón, en las mujeres. Los tres siguientes lavados se hicieron formando círculos en el área quirúrgica y cerca de cinco centímetros por dentro de los primeros lavados. Posteriormente se quitaron los excesos de jabón con alcohol polivinílico. En todos los casos se usó ropa quirúrgica desechable.
También en todos los casos se usó técnica de punción directa; dos pacientes en el grupo de única dosis y dos del grupo convencional recibieron implante de dispositivos femorales, uno fue resincronizador. Ninguno de los tres pacientes sufrió infección. Se suturó la fascia con suturas absorbibles de igual calidad. Para los dispositivos de mayor tamaño se usó la técnica de doble cámara (ampliar información en https://youtu.be/79zeOeCdy04).
Se dejó cubierta la herida con apósito estéril durante los primeros cinco a siete días y las primeras 24 horas se usó vendaje compresivo. Se realizó consulta de control a la semana de implante para revisión de herida quirúrgica; si se observó algo sospechoso se citó nuevamente cada semana hasta confirmar o descartar infección del sitio operatorio. Se citó nuevamente entre los 45 y 60 días postimplante, a los seis meses, al año y cada seis meses.
Variables evaluadasDatos sociodemográficos, incluyendo edad, sexo y régimen de afiliación e información de comorbilidades como diabetes y enfermedad renal crónica y tipo de procedimiento fueron recolectados para todos los pacientes.
Un médico a cargo del departamento que desconocía la aleatorización verificó el estado de los pacientes al menos una vez en el día octavo del postoperatorio, al mes y cada tres meses, durante un año. De acuerdo con las pautas institucionales los pacientes con una temperatura corporal superior a 38°C se consideran en riesgo de tener una potencial enfermedad infecciosa. En aquellos pacientes con signos de infección sistémica o localizada sin ningún otro signo clínico de infección se realizaban, además del examen físico, paraclínicos adicionales para descartar endocarditis.
Las complicaciones infecciosas se definieron como infección de la herida, presencia de pus de la herida quirúrgica que requiere drenaje abierto, bacteriemia o endocarditis.
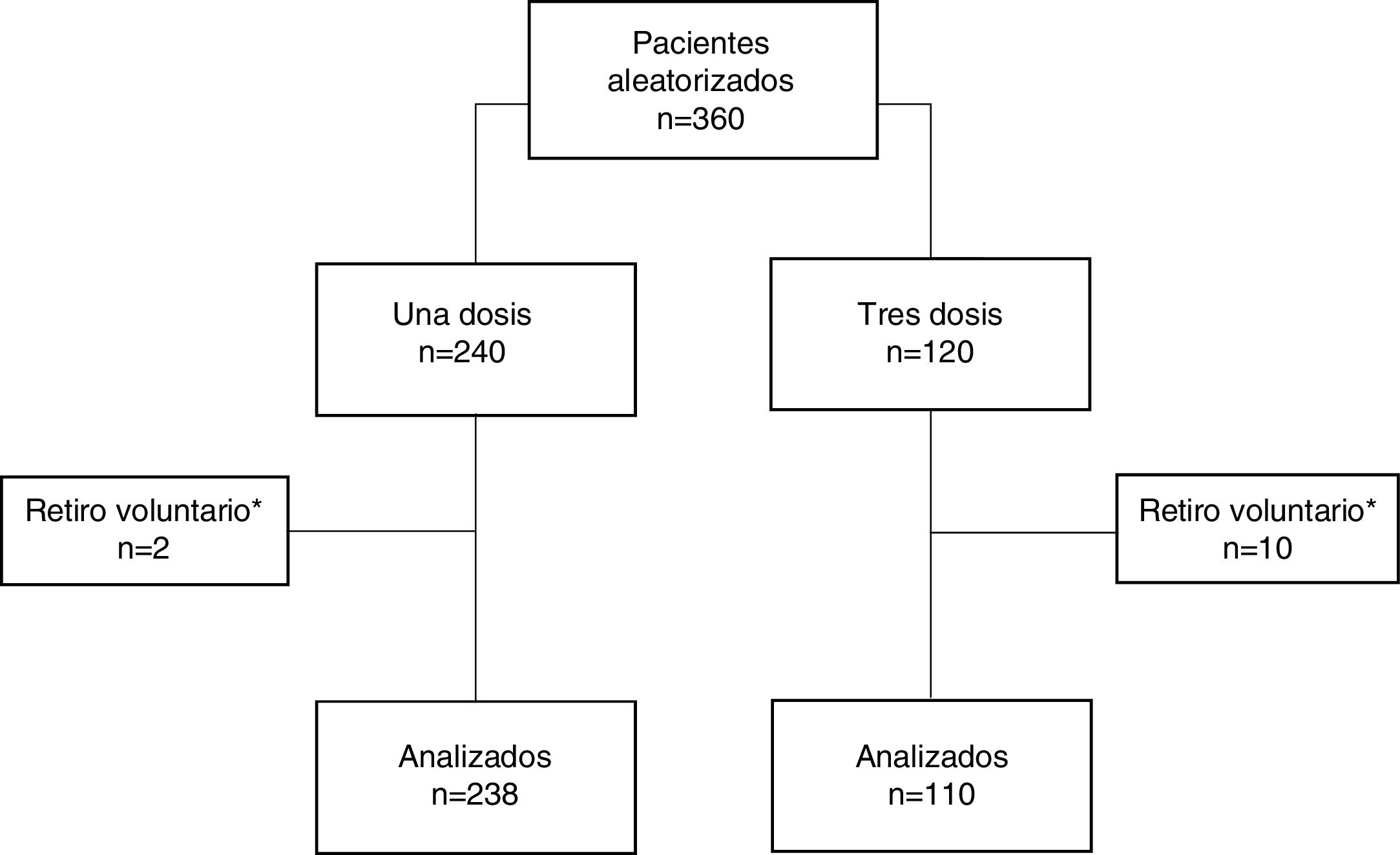
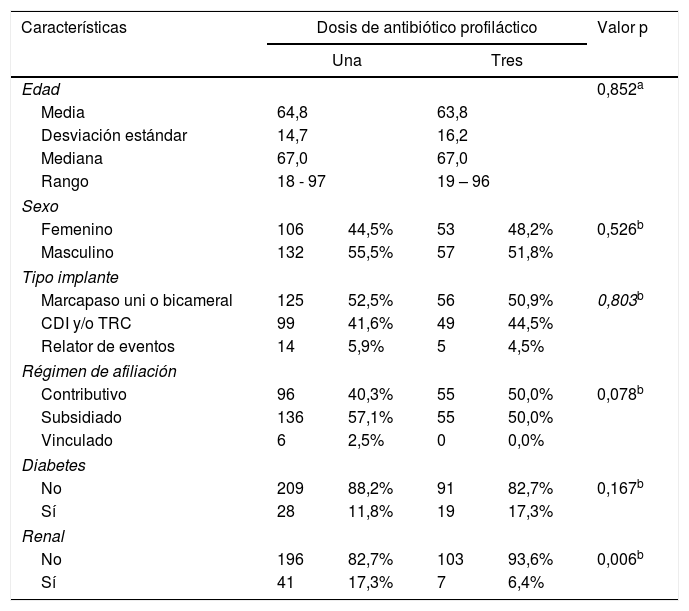
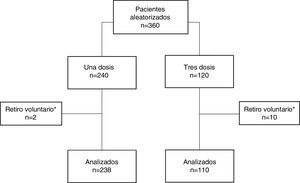
ResultadosUn total de 360 pacientes que recibieron implante de dispositivos cardíacos en nuestra institución fueron aleatorizados en dos grupos, una dosis de antibiótico (240 pacientes) o tres dosis (120 pacientes). Inmediatamente tras la aleatorización se retiraron voluntariamente 2 pacientes del grupo de una dosis y 10 pacientes del grupo de tres dosis, para un total de 238 pacientes en el grupo de una dosis y 110 pacientes en el grupo de tres dosis, población sobre la cual se realizó este análisis (fig. 1). Las características clínicas y perioperatorias fueron similares entre los dos grupos, excepto la presencia de enfermedad renal crónica, que fue mayor en el grupo de una dosis de antibiótico (tabla 1). Se completó seguimiento del 100% de los pacientes incluidos en el estudio.
Características clínicas y perioperatorias
| Características | Dosis de antibiótico profiláctico | Valor p | |||
|---|---|---|---|---|---|
| Una | Tres | ||||
| Edad | 0,852a | ||||
| Media | 64,8 | 63,8 | |||
| Desviación estándar | 14,7 | 16,2 | |||
| Mediana | 67,0 | 67,0 | |||
| Rango | 18 - 97 | 19 – 96 | |||
| Sexo | |||||
| Femenino | 106 | 44,5% | 53 | 48,2% | 0,526b |
| Masculino | 132 | 55,5% | 57 | 51,8% | |
| Tipo implante | |||||
| Marcapaso uni o bicameral | 125 | 52,5% | 56 | 50,9% | 0,803b |
| CDI y/o TRC | 99 | 41,6% | 49 | 44,5% | |
| Relator de eventos | 14 | 5,9% | 5 | 4,5% | |
| Régimen de afiliación | |||||
| Contributivo | 96 | 40,3% | 55 | 50,0% | 0,078b |
| Subsidiado | 136 | 57,1% | 55 | 50,0% | |
| Vinculado | 6 | 2,5% | 0 | 0,0% | |
| Diabetes | |||||
| No | 209 | 88,2% | 91 | 82,7% | 0,167b |
| Sí | 28 | 11,8% | 19 | 17,3% | |
| Renal | |||||
| No | 196 | 82,7% | 103 | 93,6% | 0,006b |
| Sí | 41 | 17,3% | 7 | 6,4% | |
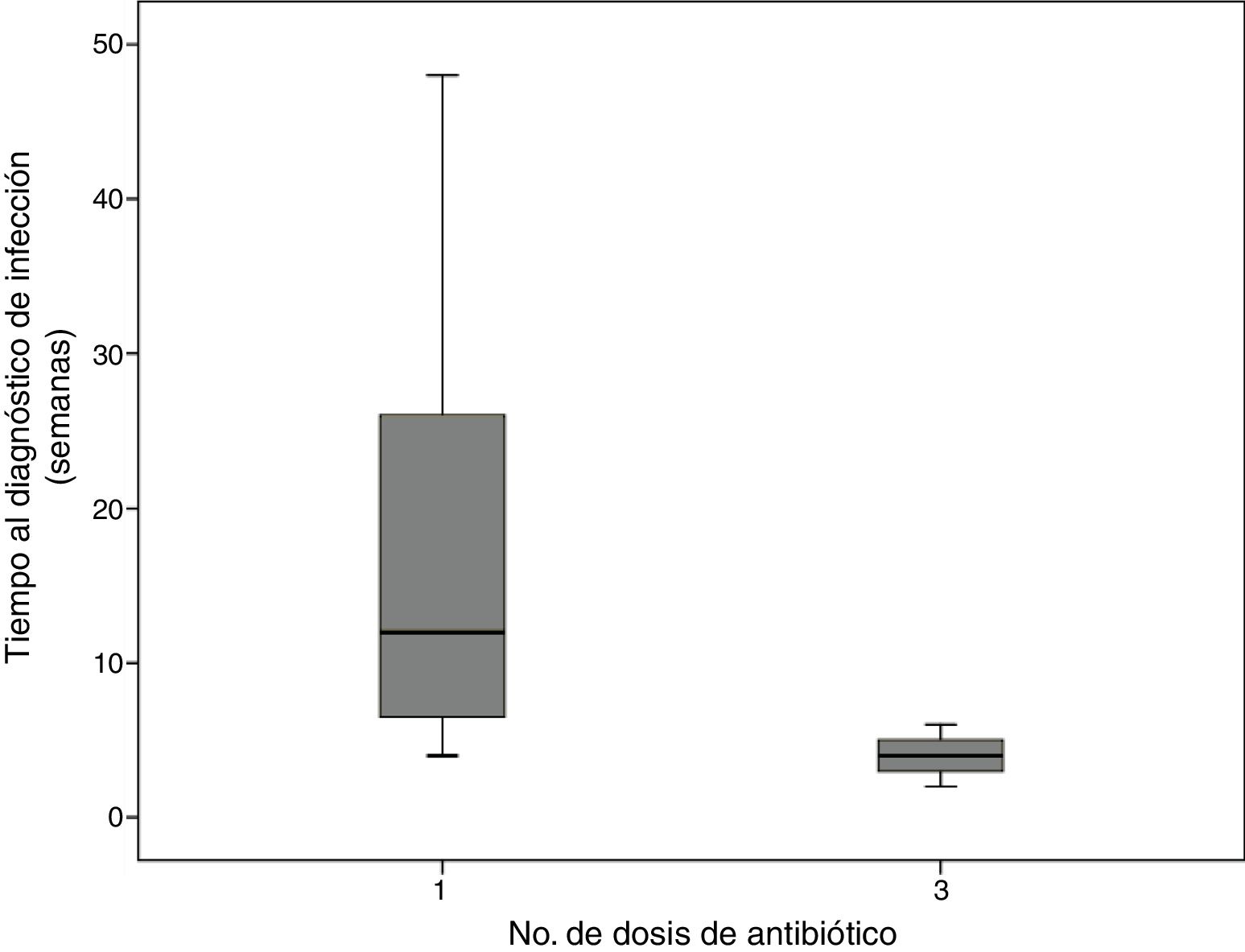
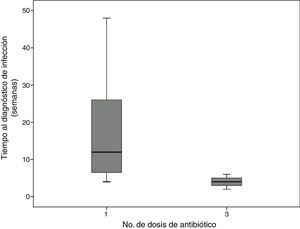
No se observó una diferencia significativa entre la incidencia de infección postoperatoria en los dos grupos (tres dosis vs. una dosis: OR crudo 0.92; IC95% 0.23 - 3.64; p 0.912), con una tasa del 2.9% (7/238) en el grupo de una dosis y del 2.7% (3/110) en el grupo de tres dosis. El promedio de tiempo de aparición de la infección varió de acuerdo con el grupo de intervención, siendo de 18,4 semanas (con un mínimo de 4 semanas y un máximo de 48 semanas) en el grupo de una dosis y de 4 semanas (con un mínimo de 2 semanas y un máximo de 6 semanas) en el grupo de tres dosis (fig. 2).
De las siete infecciones que se presentaron en el grupo de una dosis, cinco correspondieron a infecciones del sitio operatorio, dos de ellas secundarias a hematoma relacionado con anticoagulación. Se presentaron dos infecciones sistémicas con hemocultivos positivos para Staphylococcus aureus sin criterios para endocarditis; en uno de ellos la infección fue secundaria a un catéter subclavio insertado para el manejo de falla; el otro paciente estuvo sometido a reintervención por desalojo de electrodo atrial. A los dos pacientes se les explantó el dispositivo y a uno de ellos se le realizó reimplante tardío mas no al otro debido a que fue remitido a otra institución para su manejo.
Las tres infecciones que se presentaron en el grupo de tres dosis fueron localizadas, una en relación con hematoma. Los tres se reimplantaron de 7 a 10 días después.
No se presentaron muertes en relación con complicaciones infecciosas del implante de dispositivos cardíacos.
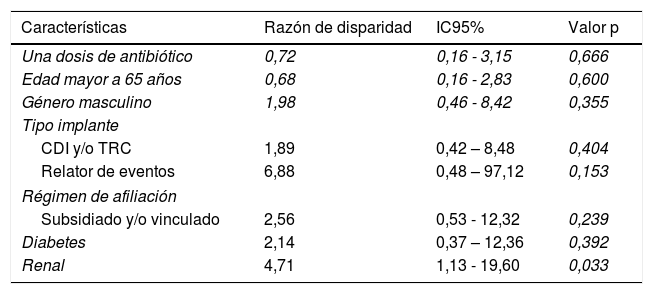
Se realizó un análisis de regresión logística multivariada para determinar si el uso de una o tres dosis de antibiótico y otras características de los pacientes y la intervención, eran factores independientes relacionados con el desarrollo de complicaciones infecciosas. Como se observa en la tabla 2, ni la edad, el sexo, el régimen de afiliación, el tipo de dispositivo implantado, la presencia o no de diabetes o la dosis de antibiótico profiláctico se relacionaron con el desarrollo de infecciones postoperatorias. Sin embargo, sí se encontró relación con la presencia de enfermedad renal crónica que aumenta el riesgo de complicaciones infecciosas. La tasa de infección en los pacientes sin enfermedad renal crónica fue del 2% comparada con 8.3% en los pacientes que padecen esta condición (OR ajustado 4.71; IC95% 1,13 - 19,60) (tabla 2).
Análisis de regresión logística multivariado para el desarrollo de complicaciones infecciosas
| Características | Razón de disparidad | IC95% | Valor p |
|---|---|---|---|
| Una dosis de antibiótico | 0,72 | 0,16 - 3,15 | 0,666 |
| Edad mayor a 65 años | 0,68 | 0,16 - 2,83 | 0,600 |
| Género masculino | 1,98 | 0,46 - 8,42 | 0,355 |
| Tipo implante | |||
| CDI y/o TRC | 1,89 | 0,42 – 8,48 | 0,404 |
| Relator de eventos | 6,88 | 0,48 – 97,12 | 0,153 |
| Régimen de afiliación | |||
| Subsidiado y/o vinculado | 2,56 | 0,53 - 12,32 | 0,239 |
| Diabetes | 2,14 | 0,37 – 12,36 | 0,392 |
| Renal | 4,71 | 1,13 - 19,60 | 0,033 |
Se realizó un análisis de subgrupos de acuerdo con la presencia o no de enfermedad renal crónica, en el que no se observaron diferencias en la incidencia de complicaciones infecciosas de acuerdo con la dosis de antibiótico usada.
No se identificaron eventos adversos en la población estudiada.
DiscusiónMúltiples estudios realizados previamente han demostrado que el uso de profilaxis antibiótica reduce la incidencia de infecciones relacionadas con el implante de dispositivos cardíacos10–12, por lo que es ampliamente usada. Sin embargo, aún no existe claridad respecto al uso óptimo de los agentes antimicrobianos en cuanto a dosis, vía y tiempo de administración4.
Hasta la fecha, con base en nuestro conocimiento, no se habían diseñado ensayos clínicos dirigidos exclusivamente a evaluar diferentes dosis de antibiótico profiláctico. Aunque los cursos prolongados de antibióticos pueden ser útiles en ciertas circunstancias, un estudio realizado por Dwivedi et al. no encontró diferencias en la tasa de infecciones asociadas al dispositivo con antibiótico profiláctico postoperatorio por 7 días vs. 2 días13.
En el presente estudio se comparó la incidencia de infecciones postoperatorias en pacientes con implante de dispositivos cardíacos en dos regímenes de antibiótico distintos, una dosis vs. tres dosis, y se halló una tasa general de infección del 2.8%, la cual es relativamente alta respecto a lo reportado en otros ensayos clínicos, en los que fue cercana al 0.63%5. Esto puede deberse a diferencias en las características de la población estudiada; por ejemplo, en nuestro estudio se incluyó una alta proporción de pacientes con enfermedad renal crónica (13.8%) comparado con 1,1% en el ensayo clínico de Oliveira et al.5. Adicionalmente, el estudio fue realizado en una institución que atiende pacientes de bajos ingresos, población proveniente de zonas apartadas con regulares condiciones nutricionales e higiénicas, lo que sugiere mayor propensión a enfermedades infecciosas. Es de suponer que si el protocolo es eficaz en un grupo de alto riesgo para desarrollar infecciones, lo sería también en todos los grupos.
No se encontraron diferencias significativas respecto a la dosis de antibiótico usada y el riesgo de complicaciones infecciosas. Al realizar un análisis multivariado para explorar otros factores que podrían estar contribuyendo a la infección se evidenció que la enfermedad renal crónica aumenta dramáticamente el riesgo de una complicación infecciosa en pacientes sometidos a implantes de dispositivos cardíacos, hallazgo que concuerda con lo reportado por Bloom et al. varios años atrás14.
A diferencia de lo reportado en el metaanálisis realizado por Polyzos et al.15, la diabetes mellitus no fue un factor que predispusiera al desarrollo de infecciones postoperatorias.
Es importante señalar que todos los procedimientos fueron realizados por el mismo electrofisiólogo y un equipo de enfermería de baja rotación, y que en todos los casos se hicieron en una sala que se comparte con otros servicios, como hemodinamia, cirugía vascular periférica y neurointervencionismo.
Como se ha mostrado en estudio previos7,16 entre las medidas más importantes para disminuir el riesgo de infección está la preparación de la piel mediante un lavado riguroso y exhaustivo del área quirúrgica. Adicionalmente, la evaluación de factores de riesgo para infección, como la presencia de enfermedad renal crónica, debe tenerse en consideración al momento de decidir el cuidado perioperatorio de estos pacientes. Es necesario realizar más estudios en esta población específica para determinar la terapia profiláctica óptima y su utilidad.
No se registraron casos de mortalidad ni de endocarditis bacteriana, lo cual tal vez obedezca al mismo seguimiento estrecho y sugiera que el diagnóstico precoz de la infección podría prevenir la aparición de endocarditis.
Tres de los pacientes infectados tenían antecedente de hematoma, asociación que es ampliamente relacionada con la aparición de infección de sitio operatorio. Los protocolos de manejo de pacientes anticoagulados han logrado disminuir la aparición de hematoma postoperatorio y, por ende, de la infección perioperatoria.
Por otra parte, este estudio fue realizado en un grupo poblacional definido, lo que hace que las conclusiones probablemente no sean aplicables a la población general, por las mismas características de la misma, pacientes con baja escolaridad, múltiples comorbilidades, desnutridos, con pobres condiciones socioeconómicas, que tendrían mayores probabilidades de infección. Se podría afirmar, por consiguiente, que el uso de una sola dosis de profilaxis antibiótica comparado con tres dosis no aumenta el riesgo de complicaciones infecciosas y podría ser una estrategia útil que permitiría reducir los costos de la atención.
Se recomienda realizar más estudios con el fin de confirmar estos hallazgos en otras poblaciones de pacientes a quienes se les implanten dispositivos cardíacos.
ConclusionesEs indiscutible el beneficio del uso de profilaxis antibiótica en el implante de dispositivos de estimulación cardiaca.
El uso de un protocolo de única dosis de antibiótico profiláctico una hora antes del implante de dispositivos de estimulación cardiaca es efectivo, no inferior, al protocolo de tres dosis perioperatorias.
FinanciaciónNinguna.
Conflicto de interesesNinguno.