La miocardiopatía de estrés o síndrome de takotsubo, son variantes de una forma aguda y reversible de compromiso funcional cardiaco caracterizado por un inicio abrupto, usualmente relacionado con un evento emocional o físico estresante, acompañado de dolor torácico o disnea, y signos de lesión miocárdica (síntomas o signos compatibles con falla cardiaca, miocarditis, anormalidades electrocardiográficas y elevación de biomarcadores como troponina y péptidos natriuréticos), que hacen indistinguible la miocardiopatía de estrés del usual síndrome coronario agudo (SCA) en cualquier variedad o síndrome de falla cardiaca aguda (SFCA). Su diagnóstico, requiere alta sospecha clínica y el uso racional de diferentes ayudas imagenológicas, conocido como abordaje multimodal, en cuyo caso, el ecocardiograma transtorácico es la herramienta de mayor uso y facilidad para la aproximación inicial e identificación del patrón típico de compromiso apical y transitorio de esta entidad; sin embargo, se hace necesaria la combinación con otros métodos diagnósticos para completar los criterios diagnósticos, realizar seguimiento hemodinámico en la fase aguda, detectar complicaciones y evaluar la recuperación durante el seguimiento ambulatorio, convirtiéndose en un gran reto diagnóstico y terapéutico.
Stress cardiomyopathy or Takotsubo syndrome are variants of an acute and reversible form of compromised cardiac function, characterised by an acute onset, usually related to a stressful emotional or physical event, accompanied by chest pain or dyspnoea, and signs of myocardial injury (signs or symptoms compatible with heart failure, myocarditis, anomalies in the electrocardiogram, and an increase in biomarkers, such as troponin and natriuretic peptides). These make stress cardiomyopathy indistinguishable from the usual acute coronary syndrome (ACS) in any variation or acute heart failure syndromes (AHFS). Its diagnosis requires high clinical suspicion and the rational use of imaging aids, known as the multimodal approach. In this case transthoracic cardiac ultrasound is the most used tool for the initial approach and identification of the typical pattern of apical and transient compromise of this condition. However, it needs to be combined with other diagnostic methods in order to complete the diagnostic criteria, to carry out a haemodynamic follow-up, and to detect complications. They are also required to evaluate recovery during out-patient follow-up, becoming a great diagnostic and therapeutic challenge.
Desde la perspectiva histórica y social, múltiples disciplinas han evaluado el impacto cardiovascular del estrés emocional, en algunos casos enmarcado en discursos culturales y folclóricos, que confluyen inicialmente en el término “corazón roto” (del inglés: broken heart), como una entidad sindromática que tiene en común eventos psicológicos, traumáticos o emocionales, asociados con desenlaces cardiovasculares adversos e incluso la muerte. La relación con los eventos psicológicos inicialmente no pudo ser explicada desde el punto de vista fisiopatológico; sin embargo, gracias al entusiasmo de médicos alrededor del mundo, variedades de este síndrome (por ejemplo: takotsubo), fueron ganando terreno en revistas y publicaciones científicas, reconociéndose posteriormente aspectos etiológicos, vías fisiopatológicas, proceso diagnóstico y pronóstico, aceptando el termino de miocardiopatía de estrés, como aquel que engloba estas afecciones1.
Históricamente, existen algunos reportes en los años 50, que de forma amplia sugerían una conexión entre el estrés emocional y la muerte de posible origen cardiovascular; sin embargo, solo hasta 1967 Rees y Lutkins2, publicaron la relación entre mortalidad y duelo en una población en Gales, en la que demostraron un incremento de la mortalidad durante el primer año del duelo en comparación con el grupo control (mortalidad no relacionada con el duelo), de 4,8%, en comparación con 0,68%. En 1969, Parkes et al.3, confirmaron dichos hallazgos y demostraron un incremento del riesgo de muerte de hasta diez veces en personas durante el primer año de duelo o de divorcio. Usualmente, se ha relacionado esta entidad con “malas” emociones o situaciones relacionadas con tristeza y desesperanza; no obstante, existen reportes anecdóticos4, que sugieren su relación con emociones placenteras o momentos de felicidad extrema como nacimientos, cumpleaños, matrimonios, sin diferencias en su presentación clínica, acuñándose el termino de síndrome de Diagoras, en honor a la historia ancestral griega de Diagoras de Rodas, en el siglo V a.C.
El síndrome de corazón roto, representa un proceso de disfunción ventricular izquierdo transitorio que fue descrito de forma detallada en Japón hace más de 25 años por Sato et al.1,5, quienes relacionaron la forma que adquiere el ventrículo izquierdo durante la fase de estrés agudo, con una tradicional trampa japonesa para cazar pulpos (takotsubo), por lo que inicialmente se denominó, cardiopatía de takotsubo. Con el tiempo, aparecieron otras alternativas de denominación en relación con aspectos fisiopatológicos o forma de presentación como fueron: síndrome de “baloneo” apical transitorio (transient apical ballooning syndrome), síndrome ampular (ampullar syndrome) y miocardiopatía de estrés agudo (acute stress cardiomyopathy), convirtiéndose este último en el más aceptado y conocido globalmente como miocardiopatía de estrés. Este último también ha sido criticado porque el término miocardiopatía implica compromiso muscular debido a enfermedad primaria del músculo cardiaco, por enfermedad muscular propia, alteración genética asociada u origen desconocido, sin embargo, para efectos de esta revisión se denominará miocardiopatía de estrés6.
Definición, presentación clínica y epidemiologíaLa miocardiopatía de estrés o síndrome de takotsubo, son variantes de una forma aguda y reversible, que tiene presentación clínica similar al síndrome coronario agudo (SCA), al síndrome de falla cardiaca aguda (SFCA) o a la miocarditis; en general, se acepta un alto influjo de catecolaminas y ausencia de enfermedad coronaria obstructiva. Sus criterios han sido modificados y actualizados en múltiples ocasiones desde su primera publicación en 1990; sin embargo, la Sociedad Europea de Cardiología (ESC, su sigla en inglés) presentó una propuesta en el año 2015 que ha sido ampliamente aceptada (tabla 1). Si bien no son absolutos y se han reportado excepciones a cada uno de los criterios, en general son aceptados como una guía en el proceso diagnóstico.
Criterios diagnósticos
| Anormalidades transitorias de la contractilidad del miocardio del ventrículo izquierdo o ventrículo derecho, las cuales con frecuencia están precedidas de un gatillo emocional o físico identificable. |
| Las anormalidades de la contractilidad usualmente se extienden a más de una sola distribución vascular epicárdica y a menudo se traducen en disfunción circunferencial de los segmentos comprometidos. |
| Ausencia de enfermedad arterial coronaria aterosclerótica culpable, incluida ruptura aguda de la placa, formación de trombos y disección coronaria u otras condiciones patológicas que puedan explicar el patrón de disfunción ventricular temporal observada (por ejemplo: miocardiopatía hipertrófica, miocarditis viral). |
| Anomalías nuevas y reversibles en el ECG como: elevación del segmento ST, depresión del segmento ST, bloqueo completo de rama izquierda, alteraciones en la onda T y/o prolongación QTc durante la fase aguda (3 meses). |
| Elevación de péptidos natriuréticos (BNP o NT-proBNP) durante la fase aguda. |
| Elevación discreta de troponina, medida con un método convencional (disparidad entre el nivel de troponina y la cantidad de miocardio disfuncional). |
| Recuperación de la función sistólica ventricular en las imágenes cardíacas durante el seguimiento (3-6 meses). |
ECG: electrocardiograma. QTc: intervalo QT corregido. BNP: péptido natriurético cerebral. NT-proBNP: fragmento N-terminal del péptido natriurético cerebral.
Su presentación clínica es de inicio abrupto, relacionado con un evento emocional o físico estresante y fácilmente identificable por las personas, consistente en dolor torácico o disnea, asociado a signos de lesión miocárdica (FC, miocarditis, anormalidades electrocardiográficas y elevación de troponina), que lo hacen indistinguible de la presentación usual de SCA o SFCA. Puede iniciar en el ámbito ambulatorio (más frecuente) o en el escenario de actividades relacionadas con el cuidado de la salud (aproximadamente 10% de los casos), por ejemplo: procedimientos quirúrgicos (cardiovasculares, abdominales, ortopédicos o estéticos), condiciones médicas agudas (sepsis, accidente cerebrovascular, trauma), o durante procedimientos ambulatorios (procedimientos endoscópicos, biopsias, pruebas de estrés o quimioterapia), estas diferencias se denominan síndrome de takotsubo primario y secundario7.
Usualmente, el síndrome de takotsubo primario ocurre en mujeres en edad postmenopáusica, quienes han experimentado un estrés físico o emocional severo, niveles elevados de estrés o ansiedad, dolor torácico, disnea o arritmias (generalmente taquiarritmias), que puede acompañarse de cefalea global, sensación de calor facial, presíncope, síncope, diaforesis y, en algunos casos, paro cardiorrespiratorio y choque.
Se estima que la miocardiopatía de estrés es la responsable del 0,02% de las hospitalizaciones y 1 a 2% de todos los SCA sin lesiones coronarias epicárdicas obstructivas5,6,8; 90% corresponden a mujeres postmenopáusicas; sin embargo, el 10% restante incluye hombres, jóvenes e incluso niños. Se han descrito algunas analogías en los aspectos cronobiológicos de su aparición: pico de presentación en horas de la mañana y en los días lunes, y diferencias en la frecuencia según la estación (SCA más frecuente en el invierno, miocardiopatía de estrés más común en verano), posiblemente relacionados con los aspectos fisiopatológicos que comparten estas entidades9.
FisiopatologíaEl conocimiento de los aspectos fisiopatológicos de la miocardiopatía de estrés, proviene de estudios observacionales y modelos de laboratorio. En general, existen cuatro hipótesis sobre la etiología de la miocardiopatía de estrés: toxicidad catecolaminérgica, anormalidades de la microcirculación, alteración/daño del sistema nervioso central y alteraciones hormonales10.
Toxicidad catecolaminérgica cardíacaEn este proceso se reconocen dos fases: la fase inicial, en la que se encuentran altos niveles de epinefrina y norepinefrina con activación del eje tálamo – hipófisis - glándulas adrenales (THGA), como respuesta al estrés y de presentación similar al SCA, de hecho, considerados como pacientes con un tono simpático aumentado o con hiperactividad del eje THGA11,12, y una segunda fase relacionada con el daño y respuesta cardiovascular al elevado influjo hormonal, debido a aturdimiento del miocardio, la presencia de un gradiente de inervación simpático en el ventrículo izquierdo o disfunción microvascular, que podría explicar la forma de presentación clínica e imagenológica de la miocardiopatía de estrés: gradiente de receptor β de apical a basal en mamíferos, diferencias en la densidad de la inervación simpática, sobrecarga “por toxicidad” del calcio relacionada con el sobreuso y máxima actividad de AMPc, lo que genera la formación de radicales libres de oxígeno, que posteriormente generan disfunción de los canales de sodio, calcio y disfunción celular.
Anormalidades de la microcirculaciónSe han detectado anormalidades en la microvasculatura en pacientes con miocardiopatía de estrés, debidos principalmente a niveles elevados o en exceso de endotelina-1 y “down-regulation” (regulación a la baja), del mecanismo de vasodilatación dependientes de endotelio, principalmente la regulación del receptor de endotelina a través de ácido micro-ribonucleico 125a-5p. Así mismo, se han encontrado niveles elevados de factor activador del plasminógeno 1 y de factor de Von Willebrand, que a su vez, disminuyen la capacidad de deformación de los eritrocitos y favorecen los procesos de trombosis microvascular12,12. De hecho, se conoce adicionalmente que el influjo hormonal de los estrógenos tiene un efecto protector para el desarrollo de miocardiopatía de estrés, por sus conocidos beneficios de la regulación vasomotora y efectos anti-inflamatorios, lo que podría explicar algo de los aspectos clínicos de su presentación (edad postmenopáusica)10.
Alteración/daño del sistema nervioso centralHistóricamente, se conoce que las alteraciones en el sistema nervioso central pueden provocar anormalidades cardiovasculares, incluyendo la miocardiopatía de estrés. Ejemplos de la interacción entre cerebro y corazón se encuentran a diario: hemorragia subaracnoidea, eventos vasculares cerebrales agudos, epilepsia e hipertensión endocraneana, tanto así, en el pasado, se encontraban términos que describían esta relación como miocardiopatía de estrés neurológico o aturdimiento neurocardiogénico, usualmente relacionados con compromiso severo del neocortex, principalmente en la región insular, donde confluyen vías y sistemas de activación entre la amígdala, el hipocampo, la hipófisis y los centros autonómicos, que generan cuando existe sobreestimulación o daño, liberación de catecolaminas y aumento de la liberación adrenal de epinefrina, que posteriormente actúa a nivel cardiovascular como se explicó previamente10,13.
Alteraciones hormonalesSe ha demostrado que las mujeres mayores de 55 años tienen mayor riesgo de presentar miocardiopatía de estrés (4.8 veces en comparación con mujeres menores y 10.7 veces con hombre de la misma edad), por lo que se considera que los estrógenos, tienen un papel fundamental en la miocardiopatía de estrés. Los estrógenos, tienen un efecto cardioprotector mediado por el incremento de la actividad de la proteína G, asociada con los receptores adrenérgicos β2, que reduce las concentraciones de catecolaminas en plasma y aumenta la actividad de la óxido nítrico sintetasa, lo cual se traduce en un beneficio clínico al favorecer la vasodilatación y reducir el riesgo de trombosis vascular10.
Aspectos genéticosLa miocardiopatía de estrés no se considera una miocardiopatía primaria; sin embargo, se han reportado polimorfismos específicos asociados con la presentación clínica de miocardiopatía de estrés, como GRK5 (G-protein–coupled receptor kinase 5), polimorfismos de receptores adrenérgicos β1-2 y de estrógenos, incluso, reportes de síndrome de takotsubo familiar, los cuales no han sido consecuentes para ser aceptados como una entidad nosológica diferente.
DiagnósticoEl proceso diagnóstico se enmarca en tres aspectos fundamentales: sospecha clínica, multimodalidad diagnóstica y reversibilidad, por lo que el éxito en el proceso de abordaje diagnóstico incluye el uso racional e integrado de los diferentes métodos.
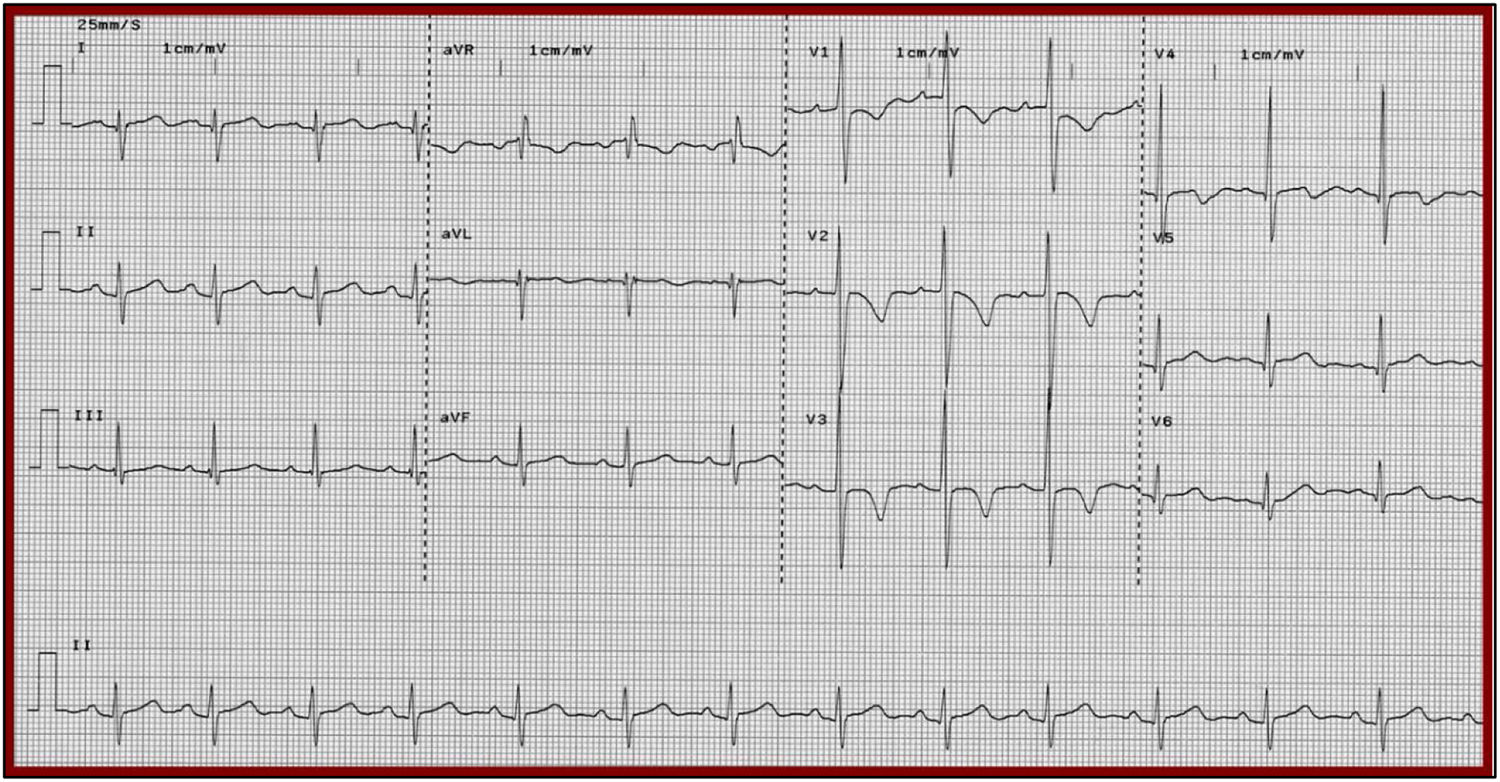
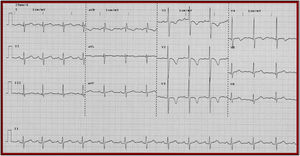
ElectrocardiogramaNo existe una característica específica que permita diferenciar a los pacientes con miocardiopatía de estrés y SCA; se sabe que en el 95% de los casos, los pacientes con miocardiopatía de estrés cursan con algún tipo de anormalidad electrocardiográfica que incluye: anormalidad del segmento ST y onda T similares a las originadas por causas isquémicas (40-50% de los casos), bloqueo de rama, principalmente de rama izquierda (10-20% de los casos), infradesnivel del segmento ST (10% de los casos), inversión difusa de la onda T y prolongación del QTc; este último factor de riesgo para muerte por asociarse con el desarrollo de arritmias ventriculares malignas5,11. En la figura 1 se ejemplifican estas anormalidades.
BiomarcadoresEn el 90% de los casos, los pacientes con miocardiopatía de estrés cursan con elevación ligera de la troponina (menor a 1 ng/dl o menos de tres veces el valor de referencia normal), o con elevaciones discordantes de la troponina en relación con la afectación del tejido miocárdico, sin un patrón específico, que permita diferenciar la miocardiopatía de estrés de entidades como SCA y miocarditis. Adicionalmente, se han descrito elevaciones de creatinina kinasa total (CK total) y picos de liberación durante el proceso de recuperación de la función ventricular izquierda7.
Adicionalmente, se ha documentado elevación de péptidos natriuréticos con un pico a las 48 horas de sucedido el cuadro y niveles progresivamente en descenso hasta la fase de recuperación. Algunos estudios sugieren que no existe asociación entre los niveles de péptidos natriuréticos y edema pulmonar; sin embargo, es un factor pronóstico de mortalidad5,7,10.
EcocardiografíaEl ecocardiograma transtorácico es la modalidad de imagen más utilizada y quizás de primera línea en el abordaje diagnóstico de un paciente ante sospecha de miocardiopatía de estrés dado que permite evaluar las características anatómicas del compromiso ventricular, el grado de daño o lesión miocárdica, el seguimiento hemodinámico en la fase aguda, así como en la de recuperación, con alto grado de comparabilidad y, adicionalmente, puede usarse en diferentes escenarios clínicos.
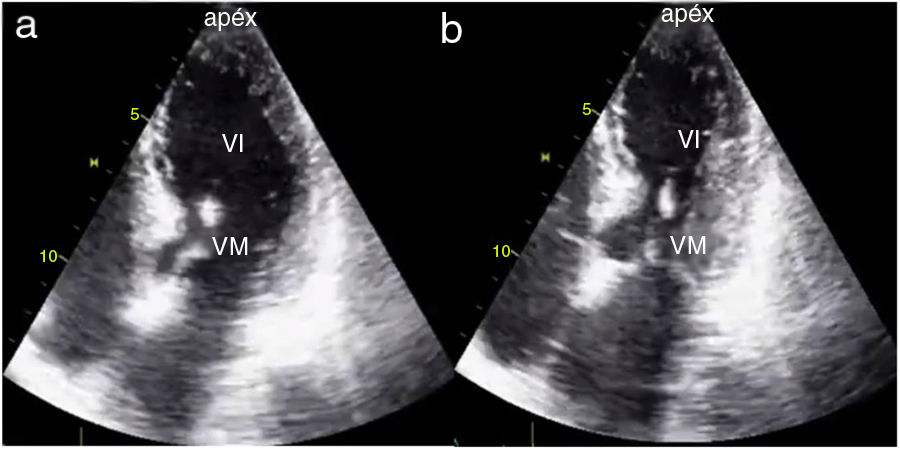
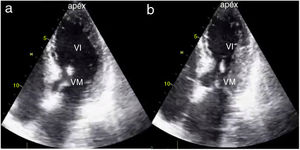
Las anormalidades de la contracción segmentaria muestran una distribución típica en pacientes con miocardiopatía de estrés. Comprometen principalmente los segmentos apicales y medioventriculares de forma circunferencial, sin seguir estrictamente un territorio vascular; en tal sentido el compromiso circunferencial es una característica distintiva de la miocardiopatía de estrés y que permite en gran medida diferenciarlo de la presentación de pacientes con SCA14–16 (fig. 2).
Compromiso apical por cardiopatía de estrés. A. Proyección apical 4 cámaras en diástole. B. Proyección apical 4 cámaras en sístole; obsérvese el compromiso de los segmentos apicales y mesiales del ventrículo izquierdo. Forma típica de discinesia apical transtoria. VI: ventrículo izquierdo. VM: válvula mitral.
Fuente: archivo docente. Hospital Universitario San Ignacio. Pontificia Universidad Javeriana.
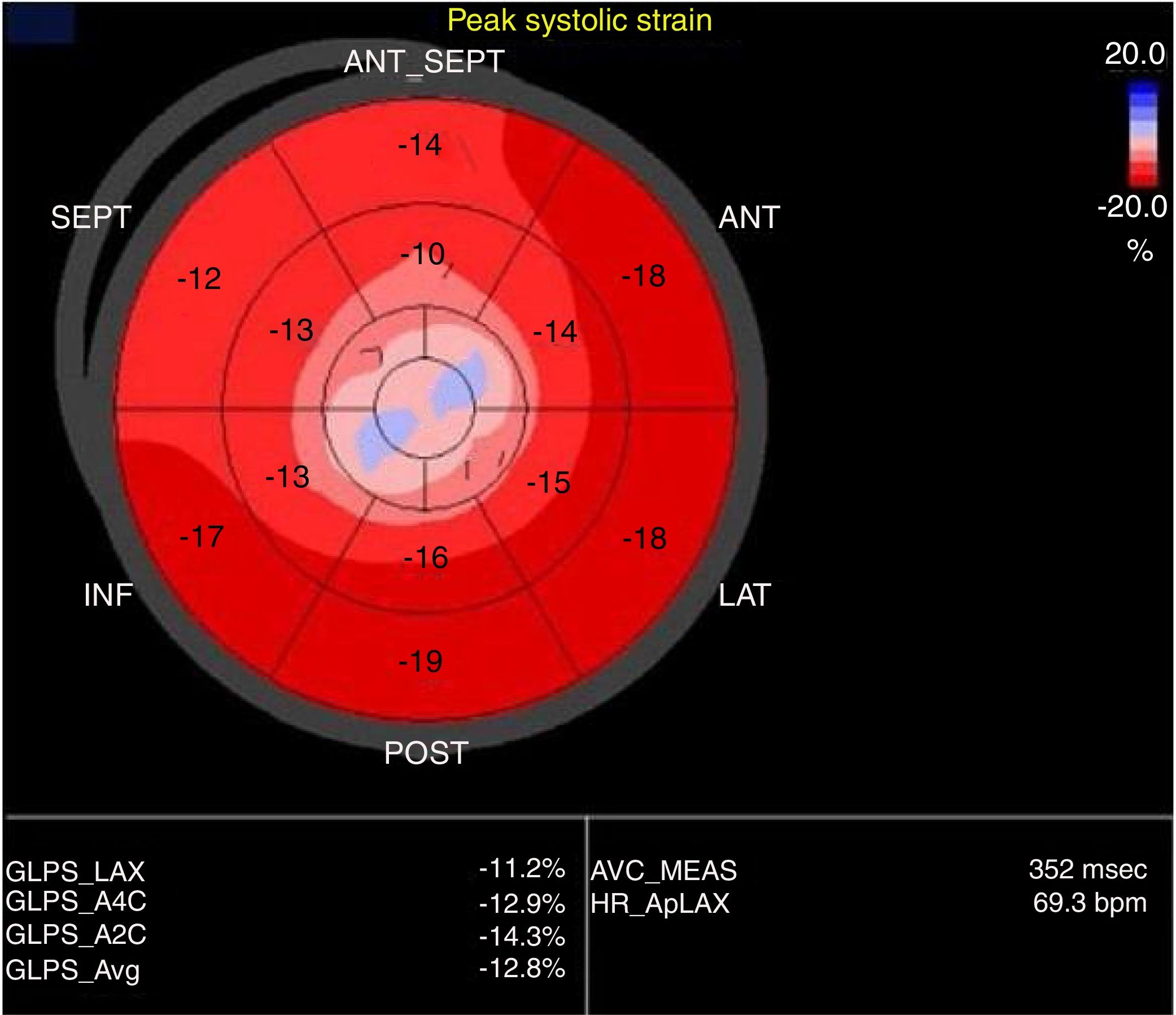
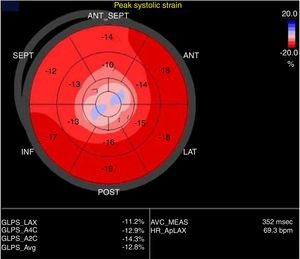
El uso de strain global longitudinal (SGL), para evaluación de pacientes con sospecha de miocardiopatía de estrés, ha sido de utilidad dado que presenta un patrón de compromiso apical, no típico de enfermedad coronaria, siendo extremadamente útil en casos de compromiso apical exclusivo (apical ballooning). Durante la evaluación y diagnóstico diferencial con SCA, el uso de strain global radial (SGR), demuestra un compromiso circunferencial, fácilmente identificable en los casos de compromiso medio ventricular, característica única de la miocardiopatía de estrés. Así mismo, se observa compromiso progresivo de la contractilidad desde los segmentos basales hasta el ápex, en forma de gradiente, explicado por el compromiso de la miocardiopatía de estrés y el gradiente de distribución de los receptores β, como se explicó previamente (GLS base 15.9 ± 6.1% al ápex 1.7 ± 7.6, p<0.001)15-17 (fig. 3).
En pacientes con miocardiopatía de estrés se observa compromiso de los segmentos apicales y mesiales (apical ballooning) entre un 70 a 80%, los cuales pueden encontrarse hipoquinéticos, disquinéticos o aquinéticos, situación que contrasta con la hipercontractilidad de los segmentos basales (fig. 2). Pueden encontrarse de forma menos frecuente dos variedades adicionales: la forma medio ventricular (10-20%), en la que se aprecia compromiso circunferencial de los segmentos mesiales, principalmente dados por hipoquinesia, con contractilidad normal de los segmentos apicales e hipercontractilidad de los segmentos basales y la forma invertida (1-2%) que tiene dos subtipos: el primero muestra una contractilidad apical preservada con compromiso severo de la contractilidad de los demás segmentos y el segundo, conocido como basal o reverso, el cual muestra compromiso único de los segmentos basales, respetando los segmentos mesiales y apicales14,16.
La evaluación del ventrículo derecho en el ecocardiograma permite identificar el compromiso de la función sistólica, que principalmente involucra la pared libre y el ápex; se han reportado casos de compromiso apical puro (apical ballooning) o medio ventricular, solo (excepcional) o en combinación con el compromiso a nivel del ventrículo derecho, y, así mismo, puede presentarse el signo de McConnell reverso (biventricular apical ballooning). El compromiso de la función ventricular derecha se relaciona con aumento del riesgo de complicaciones y muerte en pacientes con miocardiopatía de estrés o takotsubo6.
De otra parte, la ecocardiografía es útil para detectar complicaciones relacionadas con miocardiopatía de estrés, que incluyen obstrucción del tracto de salida del ventrículo izquierdo, insuficiencia mitral, compromiso ventricular derecho, formación de trombos intracavitarios, ruptura cardiaca espontánea y derrame pericárdico, así como en el seguimiento hemodinámico de presiones intracavitarias, edema pulmonar, disfunción ventricular y estados de choque6.
La función ventricular izquierda usualmente se encuentra comprometida de forma variable y en estrecha relación con la edad y las comorbilidades del paciente; por consiguiente, la fracción de eyección del ventrículo izquierdo (FEVI) menor al 40%, constituye un marcador de mal pronóstico, en particular en pacientes mayores de 75 años. La evaluación de la función diastólica del ventrículo izquierdo muestra patrones variables de severidad; sin embargo, se describe alteración cambiante en la relajación y relaciones E/e’ inicialmente elevadas, que posteriormente en la fase de recuperación tienden a normalizarse. La red italiana de takotsubo (Takotsubo Italian Network), describió factores independientes para desenlaces adversos (falla cardiaca, choque cardiogénico y muerte intrahospitalaria), FEVI menor a 40%, relación E/e’ elevada, insuficiencia mitral moderada a severa reversible y edad mayor a 75 años18.
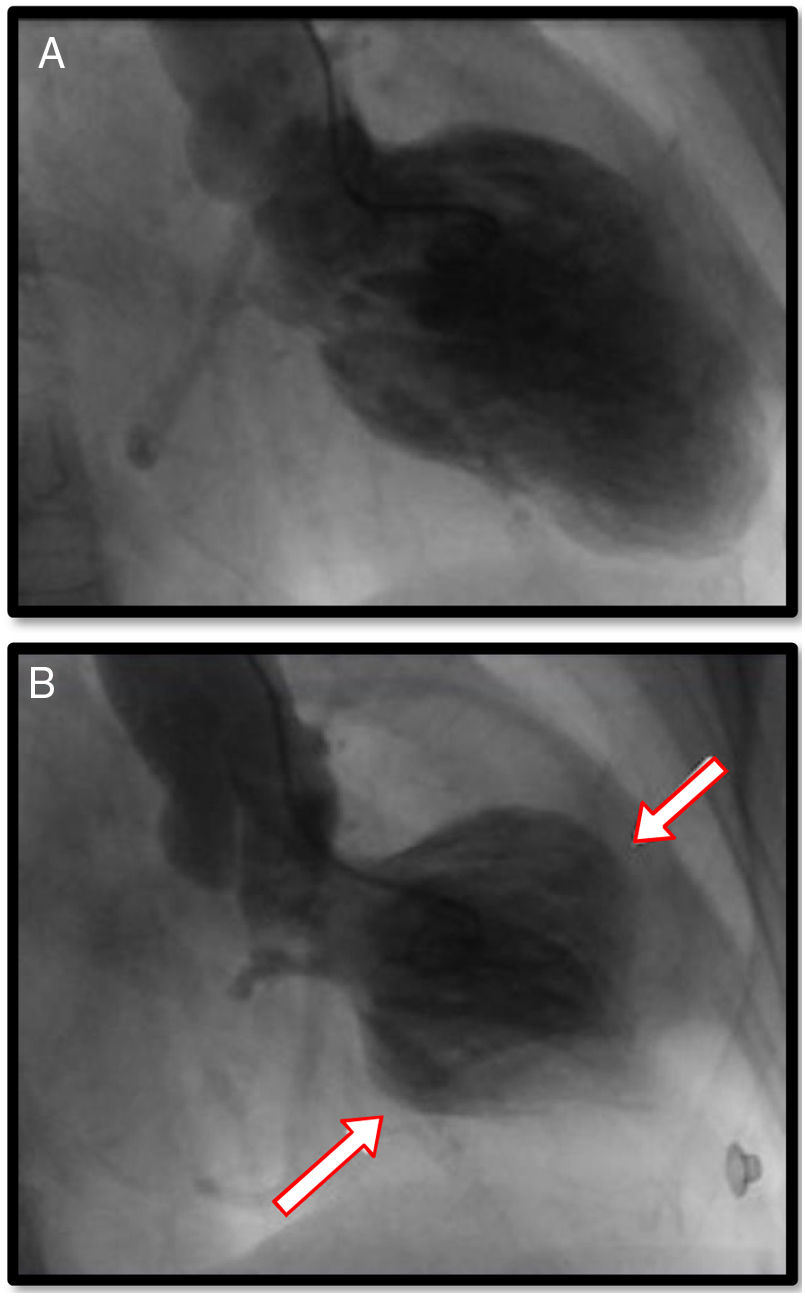
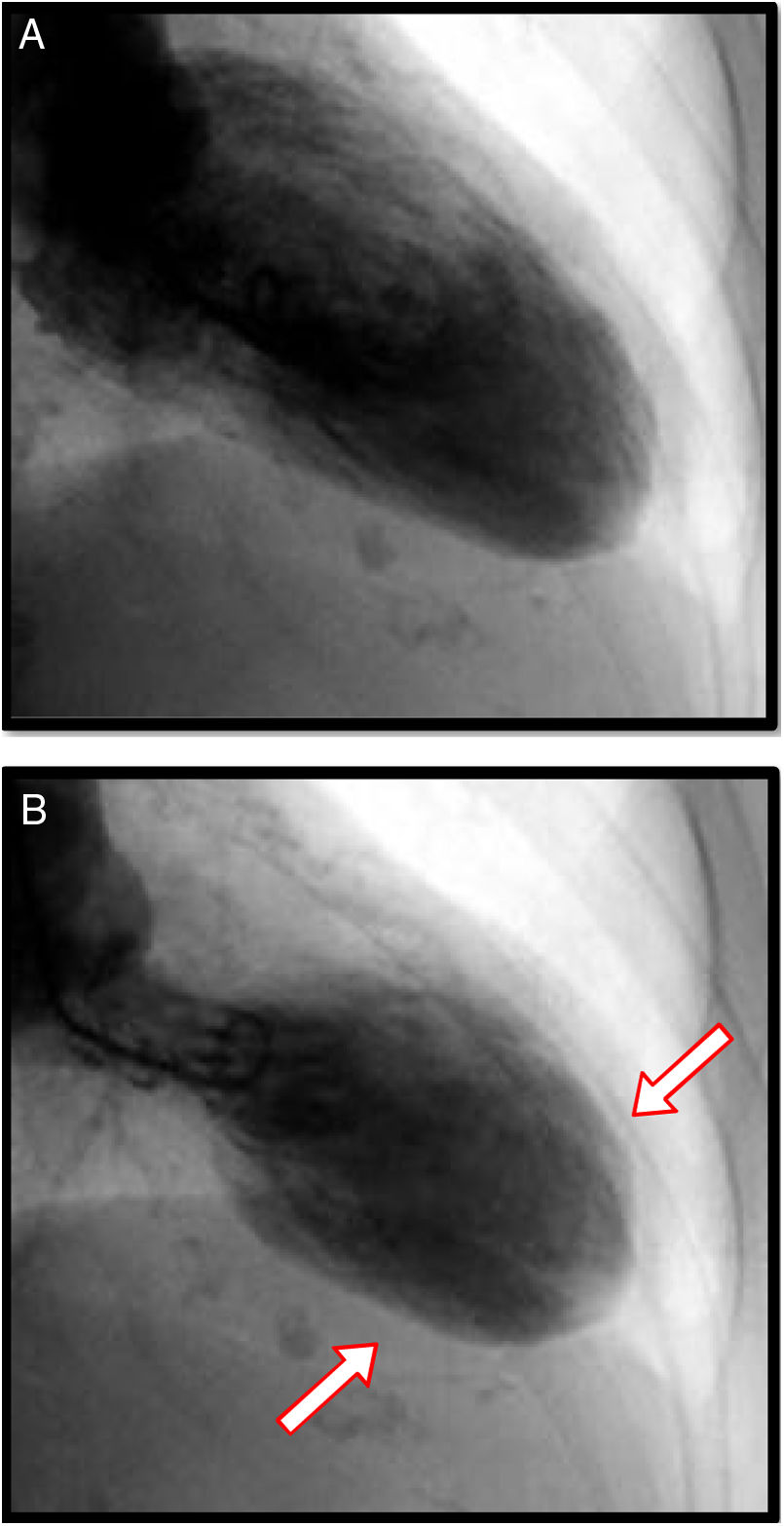
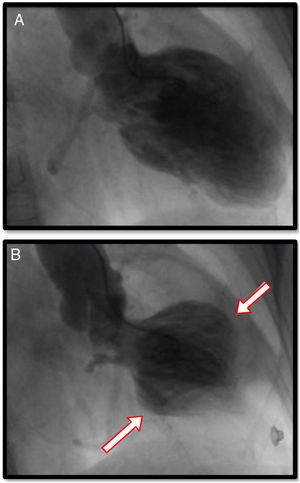
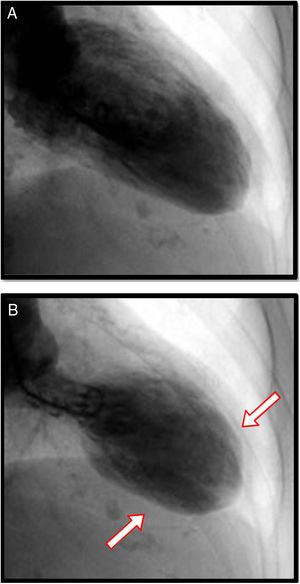
Angiografía coronaria y ventriculografíaSin duda, el papel de la angiografía coronaria se encuentra relacionado con la imperiosa necesidad de descartar enfermedad arterial obstructiva coronaria en escenarios clínicos en los que se hace indistinguible la miocardiopatía de estrés de las diferentes variedades de SCA. Usualmente, en pacientes con miocardiopatía de estrés, aproximadamente en el 90% de los casos, no se encuentra enfermedad ateroesclerótica obstructiva en los vasos epicárdicos; sin embargo, existe un 10% de coexistencia de enfermedad coronaria obstructiva y miocardiopatía de estrés, principalmente en pacientes mayores de 75 años y con múltiples factores de riesgo para enfermedad coronaria y comorbilidades. Pese a ello, el avance en técnicas de ultrasonido intravascular y reserva de flujo fraccional, ha permitido hacer diagnósticos diferenciales relevantes que incluyen ruptura de placas ateroscleróticas, trombosis coronaria y disección coronaria. Cuando se encuentra enfermedad coronaria, usualmente no se correlaciona con el grado de disfunción ventricular, caso en el cual es de gran utilidad el ventriculograma ya que tiene patrones y características similares a los hallazgos ya explicados en la evaluación ecocardiográfica del ventrículo izquierdo6 (figs. 4 y 5).
La tomografía axial computarizada de coronarias ofrece una alternativa no invasiva en la evaluación de pacientes con dolor torácico y disnea en los servicios de urgencias, usualmente con inicio de síntomas mayor a 48 horas de evolución. Puede efectuar diagnósticos relacionados con enfermedad coronaria obstructiva de vasos epicárdicos y complicaciones vasculares, al igual que mostrar patrones morfológicos de disfunción ventricular izquierda típicos de miocardiopatía de estrés; sin embargo, tiene la alta carga de radiación asociada al procedimiento5.
Pese a que el papel de las imágenes nucleares en la miocardiopatía de estrés no es claro, es útil hacer perfusión miocárdica en los casos no conclusivos de infarto, situación que es inusual; no obstante, se ha reportado, disminución de la perfusión que sigue un patrón de compromiso funcional típico de miocardiopatía de estrés. La metayodobencilguanidina mIBG (Iodine-123 meta-iodo-benzyl-guanidine) se usa en el diagnóstico de ectopia adrenal o feocromocitoma, que en algunos casos pueden ser causa secundaria de miocardiopatía de estrés. En los casos de compromiso por miocardiopatía de estrés se ha descrito disfunción de la actividad neuronal simpática en los segmentos comprometidos de forma típica por miocardiopatía de estrés; sin embargo, para realizar diagnóstico diferencial de infarto agudo de miocardio es necesario acompañarla de perfusión miocárdica6.
Resonancia magnética cardiacaEs un estudio de gran utilidad para la evaluación de los pacientes con sospecha de miocardiopatía de estrés. Permite evaluar función ventricular derecha e izquierda, características del miocardio y complicaciones como trombos intracavitarios, derrame pericárdico o pleural, entre otras. Si bien el ecocardiograma transtorácico es la primera línea de estudio de imágenes, la resonancia magnética cardiaca está indicada en aquellos pacientes con mala ventana acústica y sospecha de compromiso ventricular derecho, en quienes se debe tener una caracterización tisular para evaluar diagnósticos diferenciales como infarto de miocardio o miocarditis y cuando se sospechan trombos intracavitarios. Es, además, un estudio seguro y con pocas contraindicaciones, que aporta información de alta calidad, con excelente precisión diagnóstica, siendo útil para el diagnóstico y el seguimiento de la miocardiopatía de estrés.
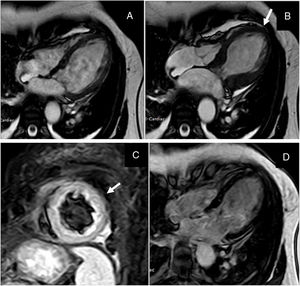
El estudio inicia con la evaluación de la función ventricular en los cines, analizando la contractilidad global y segmentaria de ambos ventrículos, para posteriormente cuantificar la fracción de eyección. La mayoría de pacientes con miocardiopatía de estrés presentan una reducción de la fracción de eyección con una alteración de la contractilidad segmentaria típica que no respeta territorios coronarios, con aquinesia o hipoquinesia de los segmentos apicales y medios del ventrículo izquierdo y contractilidad normal o hiperquinesia de los segmentos basales19. En el estudio multicéntrico publicado por Eitel et al., se analizaron las características clínicas y de resonancia en la población con miocardiopatía de estrés encontrando un promedio de FEVI del 47%. Se encontró prevalencia del 82% del patrón típico con compromiso apical, 17% con compromiso medio ventricular y con menor frecuencia el takotsubo invertido con aquinesia de los segmentos basales (1% de la población)20. La miocardiopatía de estrés también puede tener compromiso del ventrículo derecho, generando zonas de aquinesia, hipoquinesia o disquinesia; el estudio de Haghi et al. fue el primero en describir los hallazgos en resonancia magnética cardiaca21. La prevalencia del compromiso ventricular derecho oscila entre 26 a 34% según el estudio22-25. La resonancia magnética cardiaca es ideal para evaluar la contractilidad del ventrículo derecho por su capacidad de tomar imágenes en múltiples planos sin limitaciones de ventana acústica.
El edema miocárdico es un hallazgo característico de la miocardiopatía de estrés que se evidencia como una zona hipertensa en las secuencias T2. Se presenta en el 96% de los pacientes con miocardiopatía de estrés y generalmente está localizado en las zonas con alteración de la contractilidad. El infarto agudo de miocardio y la miocarditis son los principales diagnósticos diferenciales de la miocardiopatía de estrés; también presentan edema miocárdico. En la mayoría de pacientes con miocardiopatía de estrés, el edema tiende a resolverse en las primeras dos semanas a diferencia del infarto y la miocarditis en cuyo caso puede perdurar hasta por tres meses; sin embargo, el edema como único parámetro no es suficiente para el diagnóstico27.
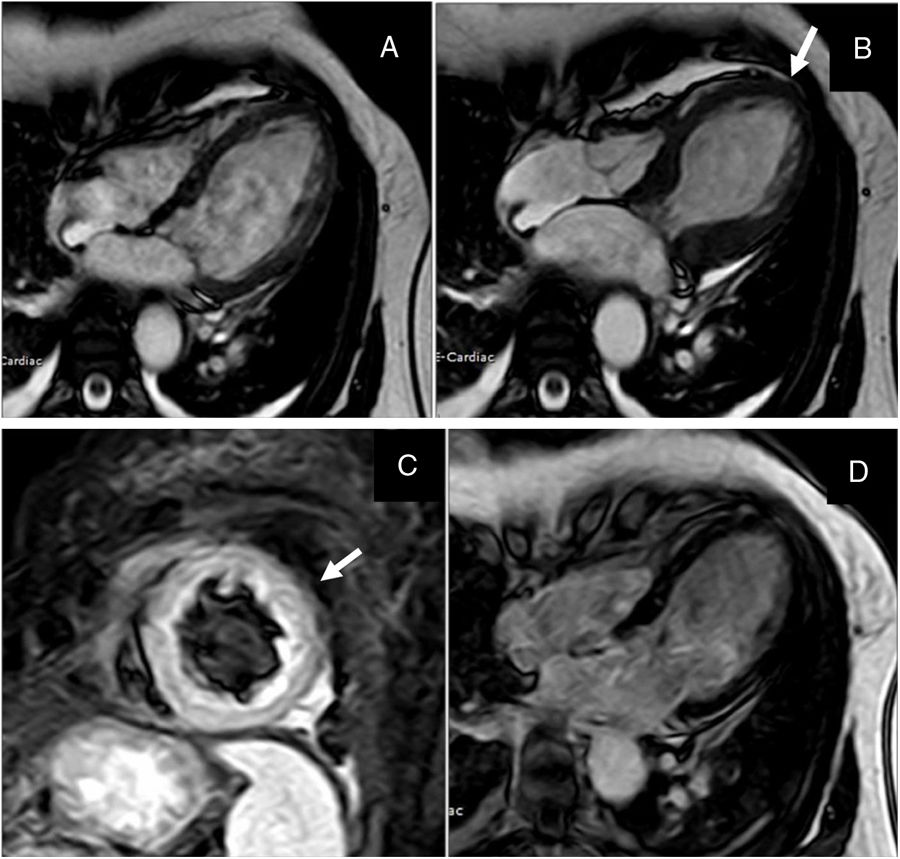
El estudio de realce tardío posterior a la inyección de contraste paramagnético se emplea para detectar zonas de fibrosis o con aumento del espacio intersticial. Los pacientes con miocardiopatía de estrés característicamente no tienen realce tardío, definido como una intensidad de señal mayor a 5 desviaciones estándar (DE)20. En algunos estudios se ha descrito realce tardío de pequeño tamaño y focal, localizado en las zonas con alteraciones de la contractilidad; en general, es de baja intensidad, y se detecta cuando se analiza con un umbral de tres desviaciones estándar en comparación con el miocardio normal26,27. El realce tardío en los pacientes con infarto agudo de miocardio tiene una distribución subendocárdica o transmural que respeta los territorios coronarios26. En contraste, en la miocarditis, no se respetan los territorios coronarios y el realce puede ser subepicárdico o mesocárdico28. En los casos de miocarditis e infarto el realce tardío siempre tiene una intensidad de señal mayor a 5 desviaciones estándar. Naruse et al. evaluaron el valor pronóstico del realce tardío de baja intensidad y observaron que esta alteración fue más frecuente en los pacientes con choque cardiogénico29 (fig. 6).
Imágenes de resonancia cardiaca de un paciente con cardiopatía de estrés. En el panel A y B se presentan las proyecciones de cine, secuencia SSFP en las que se demuestra la alteración de la contractilidad de la cardiopatía de estrés con aquinesia de los segmentos medios y apicales (Panel A en diástole; panel B en sístole y flecha que señala la zona aquinética). En el panel C se presenta el eje corto en secuencia STIR para evaluación de edema, en la que se demuestra aumento de la intensidad de señal compatible con edema (flecha). En el panel D, secuencia PSIR para la evaluación de realce tardío en la que se muestra ausencia de depósito de gadolinio.
Fuente: archivo docente. Hospital Universitario San Ignacio. Pontificia Universidad Javeriana.
Con la resonancia magnética cardiaca también es posible observar complicaciones de la miocardiopatía de estrés. En primer lugar se puede detectar obstrucción del tracto de salida del ventrículo izquierdo y movimiento sistólico anterior de la valva anterior de la válvula mitral secundario a hiperquinesia basal, alteración que generalmente es reversible en la medida en que mejora la miocardiopatía. Por otro lado, es el estudio óptimo para evaluar trombos intracavitarios, descritos aproximadamente en el 2% de los casos. Por último, se pueden valorar hallazgos adicionales como derrame pericárdico y/o pleural19,28.
La resonancia magnética cardiaca es de gran utilidad para el seguimiento de la miocardiopatía de estrés y se recomienda hacer un estudio de control después de los primeros tres meses del evento ya que la resolución de los trastornos de la contractilidad y de los cambios tisulares como el edema y el realce tardío permiten confirmar el diagnóstico29. La mayoría de los trastornos se resuelve luego de tres meses del evento29.
Pronóstico y tratamientoEl pronóstico de la miocardiopatía de estrés muestra una probabilidad de muerte intrahospitalaria alrededor del 5%, usualmente, debida a choque cardiogénico refractario o arritmias malignas. Su probabilidad de recurrencia oscila entre el 5 al 22%, en los siguientes tres y hasta los siguientes diez años del diagnóstico. En términos generales, la sobrevida de los pacientes se comporta de manera similar que controles con diagnóstico de SCA en los primeros tres años luego del evento. Sin embargo, de forma reciente el registro INTER-TAK (Takotsubo International Registry. http://www.takotsubo-registry.com), mostró aumento de carga de la enfermedad y mortalidad no relacionadas con enfermedades cardiovasculares, entre ellas las más comunes fueron las neoplasias, situación que presupone un alto índice de sospecha y estrecho seguimiento en la población. A largo plazo, la información sobre el pronóstico de miocardiopatía de estrés es limitada y la forma de seguimiento clínico e imagenológico se deriva del consenso de expertos y hallazgos en estudios observacionales. En términos generales se recomienda la evaluación clínica, bioquímica e imagenológica al menos durante los primeros tres a doce meses.
El tratamiento de esta entidad, usualmente, es de soporte, muy similar a los cuadros de falla cardiaca de etiología no clara, resaltándose el papel de los betabloqueadores por su acción sobre los receptores betaadrenérgicos y la disminución del umbral arrítmico.
ConclusionesLa miocardiopatía de estrés, sin duda, es una fascinante muestra de la complejidad e interrelaciones de los diferentes sistemas en mamíferos y seres humanos, con una connotación social y cultural especial, que ha cautivado a diferentes disciplinas en la búsqueda de una explicación completa a su comportamiento clínico. Sin embargo, pese a los avances en aspectos fisiopatológicos y abordaje imagenológico multimodal, que es esencial para el diagnóstico y seguimiento de esta entidad, aún quedan grandes vacíos en el conocimiento de esta entidad, situación que requiere de parte del grupo médico, alta sospecha diagnóstica e integralidad de conocimiento y esfuerzos multidisciplinarios, con miras a lograr un abordaje racional y seguro para el paciente, que permita un diagnóstico preciso y temprano, a fin de proponer un plan de tratamiento y seguimiento adecuados.
Conflictos de interésNinguno.
FinanciaciónAutores.