Determinar cambios en el perfil lipídico y seguridad del tratamiento con atorvastatina en dosis altas (mayor o igual a 40 mg/día) en pacientes con enfermedad renal crónica estadio 5.
Pacientes, materiales y métodosPacientes con enfermedad renal crónica estadio 5 en terapia de diálisis peritoneal e hipercolesterolemia, refractarios a terapia con lovastatina en dosis de 40mg al día y atorvastatina (menos de 40 mg/día), a quienes se les asignó terapia con atorvastatina en dosis altas.
Análisis estadísticoEstudio longitudinal, retroprospectivo, correlacional, unicéntrico con análisis univariado y bivariado.
ResultadosVeinte pacientes cumplieron con los criterios de inclusión. El tiempo con atorvastatina en dosis altas fue en promedio de 27 meses. La dosis promedio utilizada fue 60,4 mg/día. La tendencia beneficiosa a lograr metas terapéuticas con las variables en el tiempo se logró en el 65% de los pacientes para colesterol total, 50% para colesterol LDL, 40% para colesterol no-HDL y 45% para triglicéridos. Para las variables colesterol LDL y colesterol HDL se encontró diferencia estadísticamente significativa entre los valores iniciales y finales (p<0,05). Se documentaron 26 complicaciones, ninguna de ellas considerada un evento adverso relacionado con la administración de la atorvastatina en dosis altas.
ConclusionesEn pacientes con enfermedad renal crónica estadio 5, mayores de 50 años, en terapia de diálisis peritoneal e hipercolesterolemia, la atorvastatina en dosis altas logra obtener niveles de LDL en metas en el 50% de los pacientes tratados, sin que su administración dé lugar a eventos adversos importantes.
To determine changes in lipid profile and safety of treatment with atorvastatin at high doses (greater than or equal to 40 mg/day) in patients with stage 5 chronic kidney disease.
Patients, materials and methodsPatients with stage 5 chronic kidney disease in peritoneal dialysis therapy and hypercholesterolemia refractory to therapy with lovastatin at a dose of 40mg daily and atorvastatin (less than 40mg/day) that were assigned to atorvastatin therapy at high doses.
Statistical analysisA longitudinal study, retroprospective, correlational, single center with univariate and bivariate analysis.
ResultsTwenty met the inclusion criteria. Time with high-dose atorvastatin averaged 27 months. The average dose used 60.4 mg/day. The beneficial tendency to achieve therapeutic goals with time-varying was achieved in 65% of patients for total cholesterol, 50% LDL cholesterol, 40% non-HDL cholesterol and 45% for triglycerides. For variables LDL cholesterol and HDL cholesterol a statistically significant (p<0.05) difference was found between the initial and final values. Twenty six complications were documented, none of them considered adverse events related to the administration of high-dose atorvastatin.
ConclusionsIn patients with stage 5 chronic kidney disease over 50 years, peritoneal dialysis therapy and hypercholesterolemia, high-dose atorvastatin achieved LDL levels get goals in 50% of patients without significant adverse events.
La prevalencia e incidencia de la enfermedad renal crónica va en aumento progresivo, principalmente por incremento en las dos patologías que la generan: diabetes mellitus e hipertensión arterial crónica1,2. La mortalidad se genera en mayor forma por patologías cardiovasculares tipo cardiopatía isquémica, aconteciendo para el 40% de las muertes de pacientes en diálisis3–5; para esta última la dislipidemia constituye un factor de riesgo importante y modificable6,7.
En pacientes con enfermedad renal crónica estadio 5 (tasa de filtración glomerular - GFR su sigla en Inglés - menor a 15 mL/min) en terapia de diálisis, se ha observado mayor mortalidad por causas cardiovasculares (principalmente infarto de miocardio) en el programa de diálisis peritoneal que en el de hemodiálisis8.
La enfermedad renal crónica se caracteriza por la aparición progresiva de dislipidemia, producto del metabolismo anormal de las apolipoproteínas, presentándose reducción en las concentraciones de lipoproteínas que contienen apoA (HDL), pocos cambios en las concentraciones de lipoproteínas que contienen apoB ricas en colesterol (LDL e IDL) y aumento en las concentraciones de lipoproteínas intactas y parcialmente metabolizadas que contienen apoB ricas en triglicéridos (VLDL). Ello ocurre como resultado de disminución en su catabolismo (por reducción en la actividad de enzimas lipolíticas) y depuración por reducción en la captación mediada por receptores de lipoproteínas9.
La hemodiálisis puede atenuar moderadamente la dislipidemia renal, cuya principal característica es la elevación en triglicéridos, pero contrariamente la diálisis peritoneal se asocia con mayor agravamiento de la misma con incremento de las lipoproteínas que contienen apoB ricas en colesterol.
El tratamiento de la dislipidemia, principalmente aquella con un perfil aterogénico franco, como la que presentan los pacientes en diálisis peritoneal, debe convertirse en una alternativa importante que pueda modificar los factores de riesgo cardiovascular. Las estatinas representan el grupo terapéutico más importante para intervenir el perfil aterogénico, y la atorvastatina por su perfil de seguridad en teoría representaría el medicamento de elección en pacientes con enfermedad renal crónica10. Este trabajo de investigación buscó aclarar si la atorvastatina en dosis más altas que las convencionales puede mejorar de manera significativa el perfil lipídico de los pacientes con enfermedad renal crónica estadio 5 en diálisis peritoneal, sin generar efectos colaterales importantes.
Pacientes, materiales y métodosPara la evaluación inicial se seleccionaron pacientes con enfermedad renal crónica estadio 5, mayores de 18 años, que se encontraran en terapia de diálisis peritoneal, con hipercolesterolemia refractaria a la terapia con lovastatina 40 mg/día o en dosis bajas de atorvastatina (menores a 40 mg/día) y con persistencia de colesterol LDL fuera de metas (>100 mg/dL) a pesar de la terapia, y en quienes se había formulado previamente una dosis alta de atorvastatina mayor o igual a 40 mg/día y asistían a control mensual por Nefrología. En ellos fueron criterios de exclusión para participar en el estudio: historia de reacción de hipersensibilidad a atorvastatina u otras estatinas, hepatopatía conocida, AST y/o ALT o CK total ≥3 veces el límite superior de normalidad, antecedente de rabdomiólisis o miopatía por estatinas, historia de alcoholismo o consumo de sustancias psicoactivas, neoplasia activa en manejo y terapia con atorvastatina en dosis altas por un periodo de tiempo menor a 12 meses. En este grupo de pacientes se evaluaron, desde el inicio de la atorvastatina, perfil lipídico, pruebas de funcion hepática, glucemia en ayunas, HbA1c, albúmina sérica, entre otras variables, de manera periódica cada 4 meses según los controles habituales establecidos por Nefrología, siendo determinados por los métodos de laboratorio rutinarios.
Se consideró meta terapéutica valores de colesterol total, LDL, no-HDL y triglicéridos menores a 200, 100, 130 y 150 mg/dL, respectivamente.
El trabajo de investigación fue aprobado por docentes del Departamento Clínico de la Facultad de Ciencias para la Salud y el Comité de Bioética de la Facultad de Ciencias para la Salud de la Universidad de Caldas.
Todos los pacientes firmaron consentimiento pleno e informado en el cual autorizaron revisar su historia clínica y la toma de los datos necesarios para obtener los resultados del estudio, a pesar de que el estudio era solo observacional, descriptivo, no experimental, longitudinal, retroprospectivo, correlacional, dado que el uso de atorvastatina en dosis altas (hasta 80 mg/día) está aprobado en el mundo para pacientes con enfermedad renal crónica estadio 53, considerándose, por tanto, como un estudio con riesgo mínimo (inherente a la investigación).
La recolección de la información se hizo mediante una base de datos diseñada en Excel la cual fue diligenciada por los investigadores del proyecto y después fue leída y procesada en el programa SPSS versión 17.0.
Para el análisis estadístico las variables cuantitativas se definieron con medias y desviación estándar. Las variables cualitativas se describieron con proporciones y frecuencias absolutas. A las variables se les aplicó la prueba de normalidad de Shapiro-Wilk; cuando la distribución fue normal se aplicó la prueba de t de Student para muestras relacionadas y cuando la distribución no lo fue, la prueba no paramétrica de Wilcoxon. Para estimar las diferencias entre las categorías de las variables cualitativas se usó la prueba de chi cuadrado (χ2) y se utilizó como nivel de significación estadística p≤0,05. Los resultados se presentaron en tablas uni- y bivariadas, y en gráficos de acuerdo con las variables estudiadas.
ResultadosSe evaluaron 138 historias clínicas de pacientes en programa de diálisis peritoneal; 28 de ellos cumplieron con la mayoría de los criterios de inclusión, pero 7 llevaban un periodo de terapia con atorvastatina en dosis altas menor a 12 meses, y un paciente fue excluido por mieloma múltiple.
En total se incluyeron 20 pacientes en el estudio. Las características generales se muestran en la tabla 1.
Características de base de los pacientes
| Característica | Participantes (n=20) |
|---|---|
| Edad (años) —¬¬ media —¬¬ DE | 58,7±11,49 |
| Sexo femenino — no. (%) | 15 (75) |
| Sexo masculino — no. (%) | 5 (25) |
| Raza mestiza — no. (%) | 20 (100) |
| Tasa de filtración glomerular (mL/min) – media-¬¬ DE | 10,03±3,19 |
| Tipo de diálisis peritoneal — no. (%) | |
| CAPD | 13 (65) |
| APD | 7 (35) |
| Tiempo en diálisis (meses) —¬¬ media — DE | 72±45,8 |
| Etiología de la enfermedad renal crónica-G5 — no. (%) | |
| Nefropatía hipertensiva | 8 (40) |
| Nefropatía diabética | 7 (35) |
| Desconocida | 2 (10) |
| Nefritis intersticial crónica secundaria a AINE | 1 (5) |
| Glomeruloesclerosis focal y segmentaria primaria | 1 (5) |
| Nefropatía obstructiva | 1 (5) |
| Comorbilidades al inicio de atorvastatina — no. (%) | |
| Hipertensión arterial crónica | 20 (100) |
| Diabetes mellitus tipo 2 | 8 (40) |
| Hipotiroidismo tratado adecuadamente | 7 (35) |
| Hiperuricemia | 5 (25) |
| Enfermedad coronaria | 5 (25) |
| Enfermedad arterial periférica | 3 (15) |
| Enfermedad cerebrovascular | 2 (10) |
| Colesterol total de base (mg/dL) — media —¬¬ DE | 241±29,8 |
| Colesterol LDL de base (mg/dL) — media —¬¬ DE | 153±25,2 |
| Colesterol HDL de base (mg/dL) — media —¬¬ DE | 48,1±9,2 |
| Colesterol no-HDL de base (mg/dL) —media —¬¬ DE | 192,8±29,8 |
| Triglicéridos de base (mg/dL) — media —¬¬ DE | 197,6±71,7 |
| PTHi (pg/mL) de base —¬¬ media —¬¬DE | 222±84,4 |
| Calcio sérico total (mg/dL) de base —¬¬media —¬¬DE | 9,2±0,74 |
| Fosforo sérico (mg/dL) de base —¬¬media —¬¬DE | 4,9±1,15 |
| Hemoglobina (g/dL) de base —¬¬media —¬¬ DE | 12,2±1,4 |
| Albúmina (g/dL) de base —¬¬media —¬¬DE | 3,6±0,47 |
| Glucemia (mg/dL) de base —¬¬media —¬¬DE | 119±54,8 |
| Fosfatasa alcalina (U/l) de base —¬¬media —¬¬DE | 173,8±111,5 |
En el momento de inicio de la administración de atorvastatina 19 pacientes (95%) presentaron cifras de colesterol total mayores de 200 mg/dL y 20 (100%) cifras de colesterol LDL mayores de 100. Además, 5 pacientes (25%) tenían colesterol HDL menor de 40 mg/dL, 20 pacientes tenían colesterol no-HDL mayor de 130 mg/dL y 14 (70%) cifras de triglicéridos mayores de 150 mg/dL.
En la medicación concomitante relevante para la atorvastatina los medicamentos más comunes fueron calcioantagonistas dihidropiridínicos en 16 pacientes (80%), betabloqueadores en 13 (65%) y calcioantagonistas no dihidropiridínicos en 3 (15%).
El tiempo en terapia con atorvastatina fue en promedio de 27 meses (12-51; DE 10,53). La dosis promedio de atorvastatina utilizada a los 8, 12, 24, 36 y 44 meses fue de: 68, 64, 64, 66 y 40 mg/día respectivamente.
Las variables: colesterol total, LDL, HDL, no-HDL y triglicéridos se evaluaron cada 4 meses desde el momento 0 (inicio de la terapia) hasta que finalizó el seguimiento. Se establecieron los cambios en las variables lipídicas entre 0-12 meses, 0-24 meses y 0-36 meses. Además, según el comportamiento de las variables en el tiempo se establecieron tendencias.
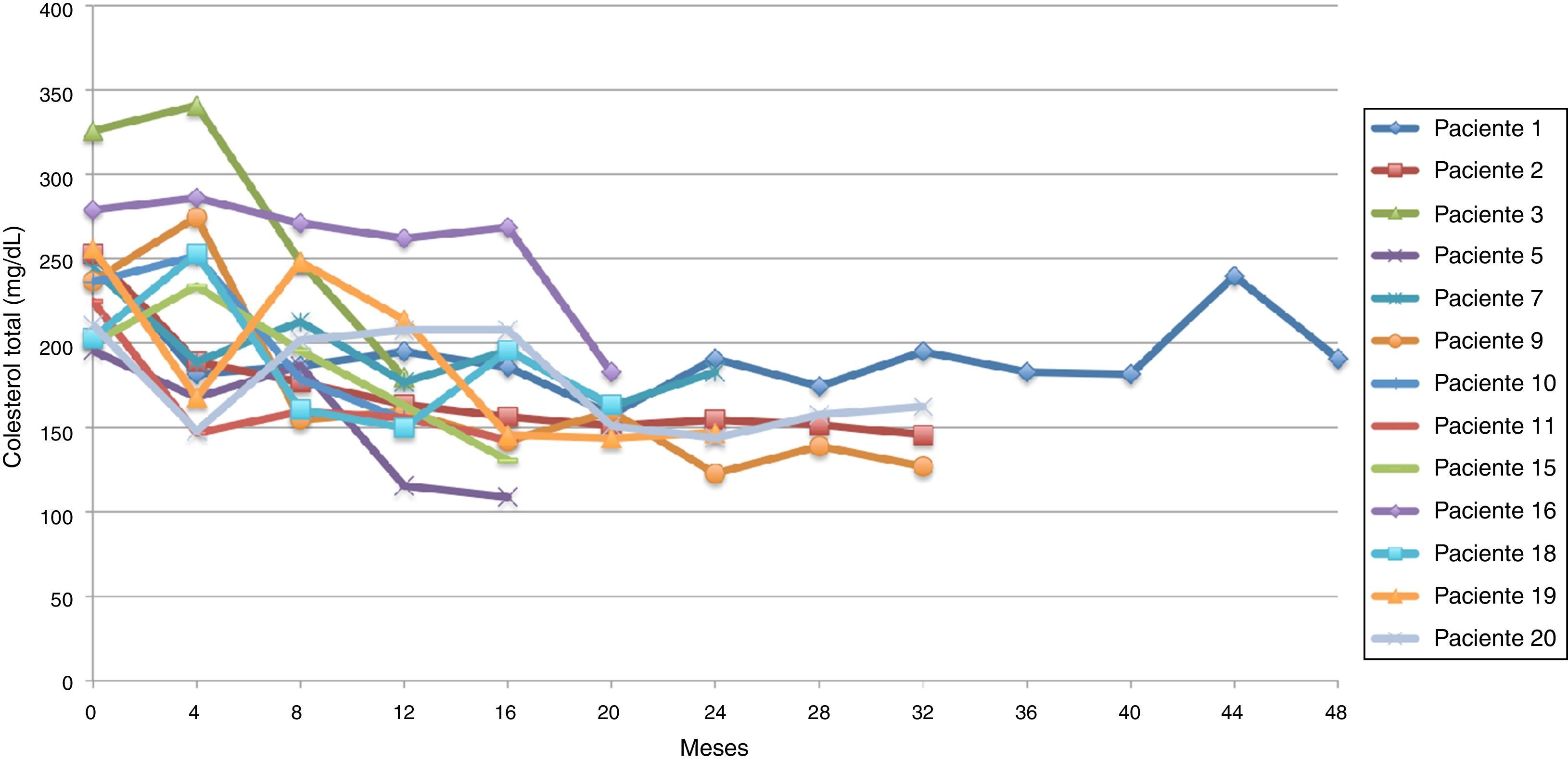
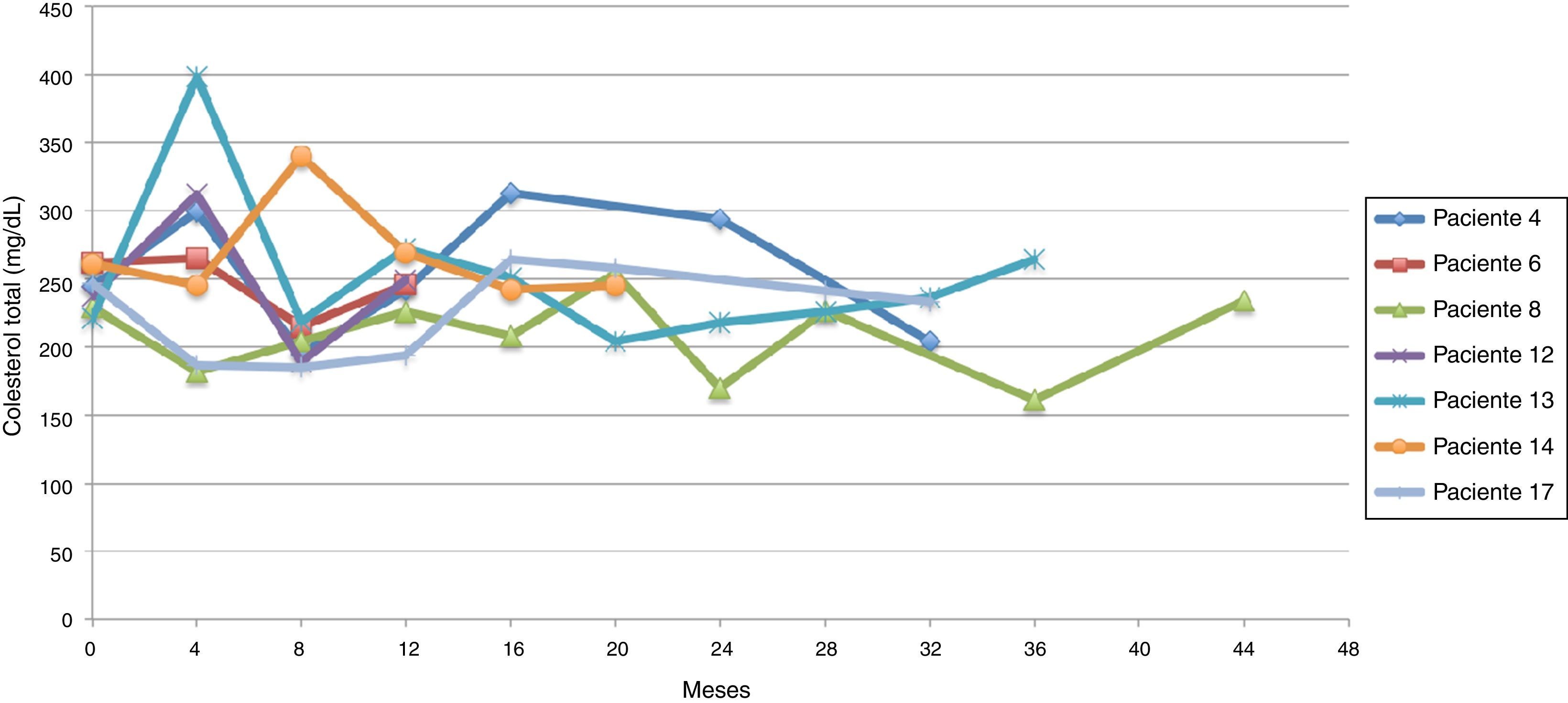
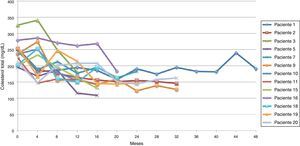
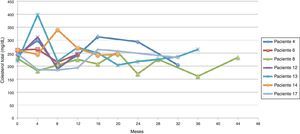
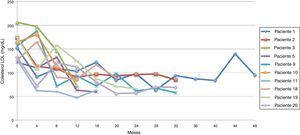
El promedio de cambio de colesterol total entre 0-12 meses fue de 46,5 mg/dL (± 38,5 mg/dL), entre 0-24 meses 69,2 mg/dL (± 34,2 mg/dL) y entre 0-36 meses 60,3 mg/dL (± 15 mg/dL). Se establecieron dos tendencias: la tendencia uno finalizando seguimiento con colesterol total en metas (menor de 200 mg/dL) se encontró en 13 pacientes (65%), y la tendencia 2 con colesterol total fuera de metas, en 7 (figs. 1 y 2).
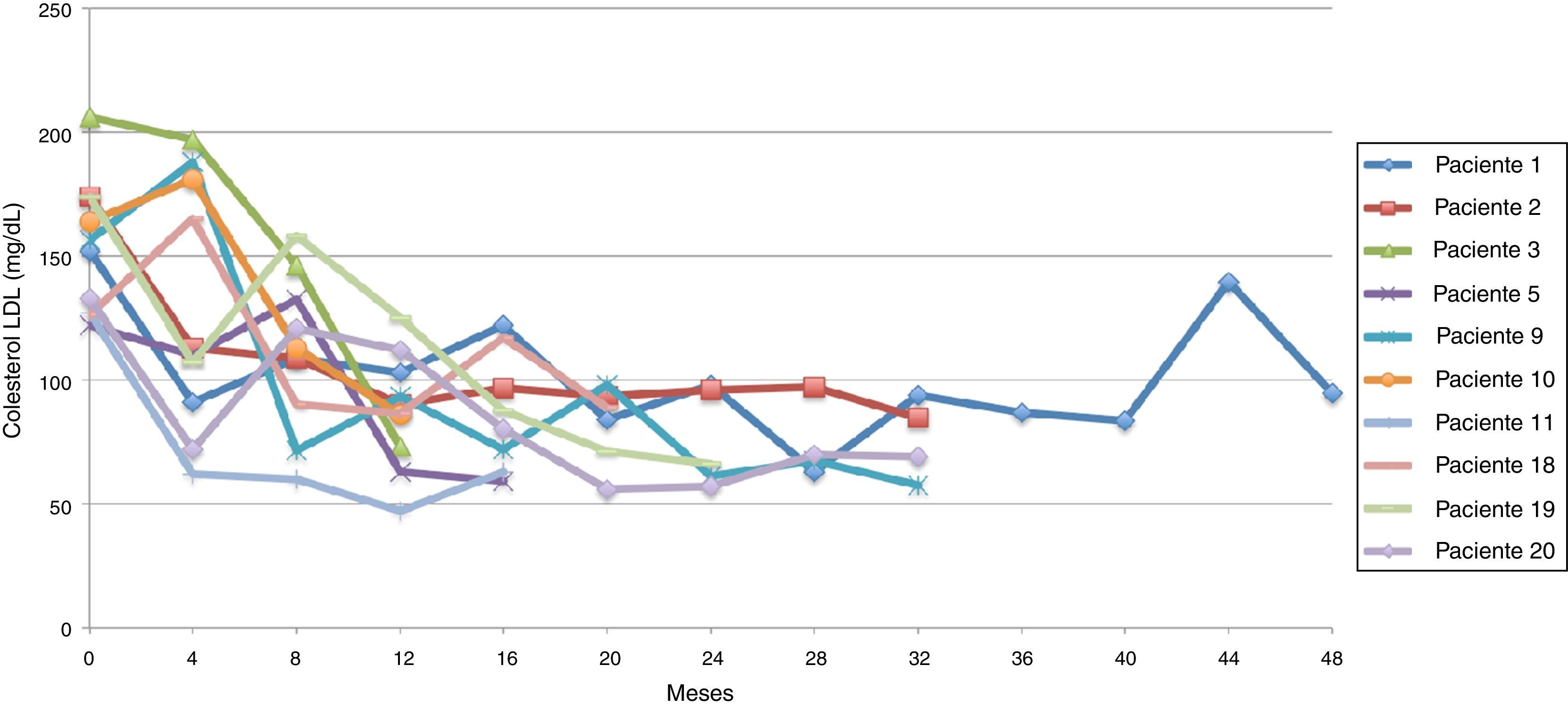
El promedio de cambio de colesterol LDL entre 0-12 meses fue de 34,5 mg/dL (± 42,6 mg/dL), entre 0-24 meses 42,3 mg/dL (± 74,2 mg/dL) y entre 0-36 meses 27,6 mg/dL (± 62,9 mg/dL).
Al evaluar el colesterol LDL al final del seguimiento se encontraron 10 pacientes (50%) en metas (LDL < 100 mg/dL); de estos, 5 (50%) con LDL menor a 70 mg/dL. En los pacientes con colesterol LDL fuera de metas se encontraron 4 (20%) con cifras de colesterol LDL entre 100-150 mg/dL y 6 (30%) con cifras de colesterol LDL mayores a 150 mg/dL.
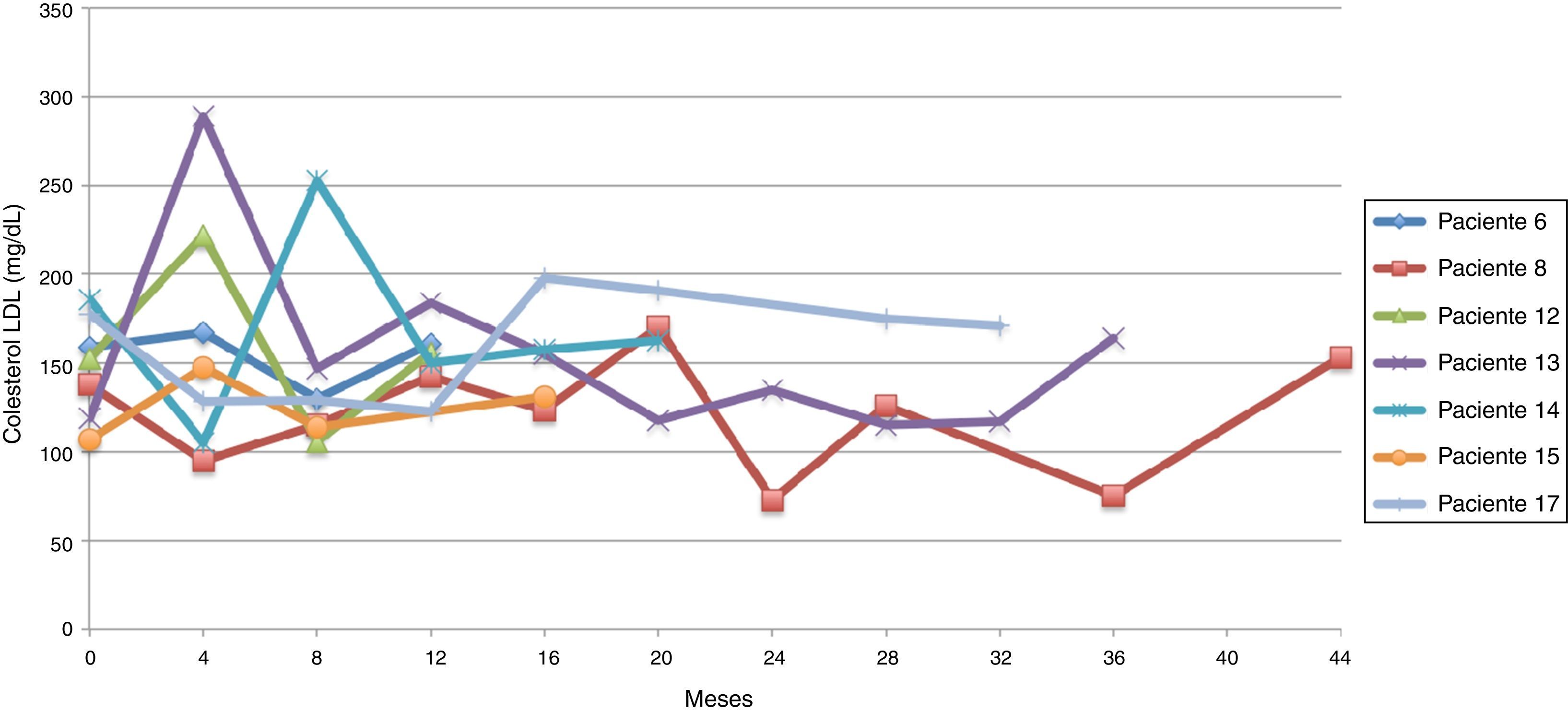
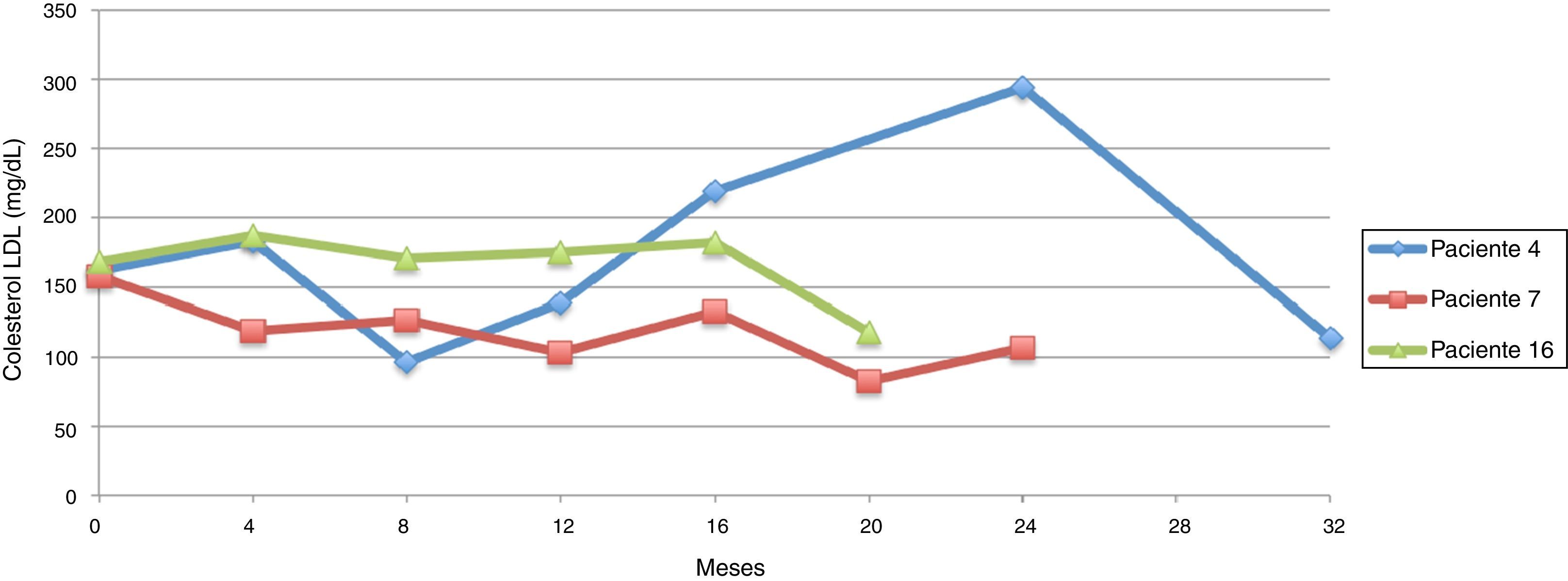
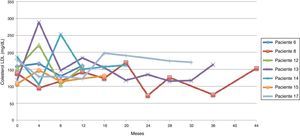
Siguiendo la tendencia uno (colesterol LDL en ascenso, fuera de metas) se encontraron 7 pacientes (35%), bajo la tendencia 2 (colesterol LDL en descenso o cerca de metas) 3 pacientes (15%) y bajo la tendencia 3 (colesterol LDL en metas) 10 pacientes (50%) (figs. 3-5). La reducción del colesterol LDL en la tendencia 3 fue en promedio 79,2 mg/dL (37-133 mg/dL).
El promedio de cambio de colesterol no-HDL entre 0-12 meses fue de 44,8 mg/dL (± 48,3 mg/dL), entre 0-24 meses 51,4 mg/dL (± 60,2 mg/dL) y entre 0-36 meses 23,6 mg/dL (± 80,3 mg/dL). Al evaluar el colesterol no-HDL, al final del seguimiento se lograron metas (no-HDL < 130 mg/dL) en 8 pacientes (40%), 6 casos (30%) de colesterol no-HDL entre 130-160 mg/dL y 6 (30%) colesterol no-HDL mayor a 160 mg/dL. Siguiendo la tendencia uno (colesterol no-HDL en metas) se encontraron 8 pacientes (40%), bajo la tendencia 2 (colesterol no-HDL con tendencia a metas, pero fuera de metas) 6 pacientes (30%), y siguiendo la tendencia 3 (colesterol no-HDL en ascenso fuera de metas), 6 pacientes (30%). La reducción del colesterol no-HDL en la tendencia uno fue en promedio 78 mg/dL (39-110 mg/dL).
El promedio de cambio de colesterol HDL entre 0-12 meses fue de 2,1 mg/dL (± 10,7 mg/dL), entre 0-24 meses 6,7 mg/dL (± 13,1 mg/dL) y entre 0-36 meses 7,8 mg/dL (± 16,6 mg/dL). Al valorar el comportamiento del colesterol HDL al final del seguimiento se lograron metas (HDL ≥ 60 mg/dL) solo en uno de los pacientes (5%); 8 pacientes (40%) tuvieron colesterol HDL entre 40-59 mg/dL y los 11 restantes (55%) colesterol HDL menor a 40 mg/dL.
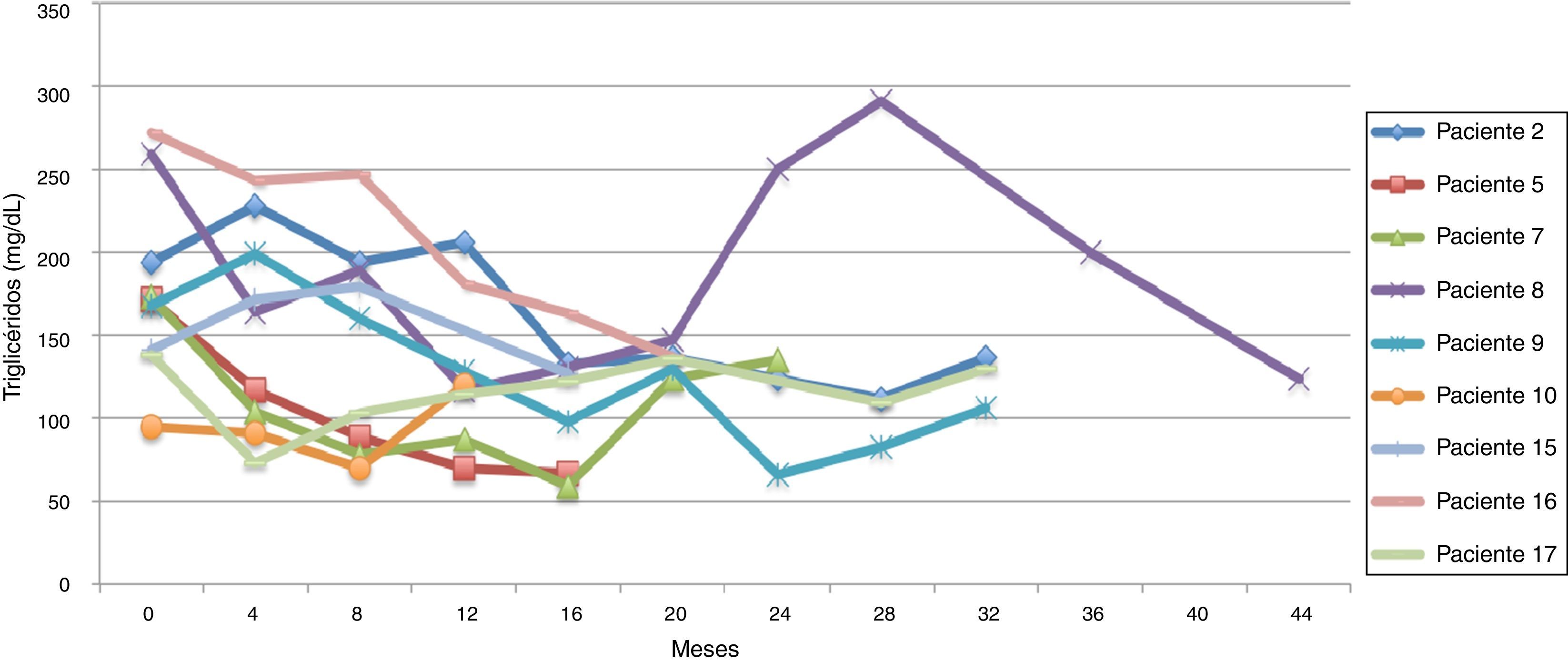
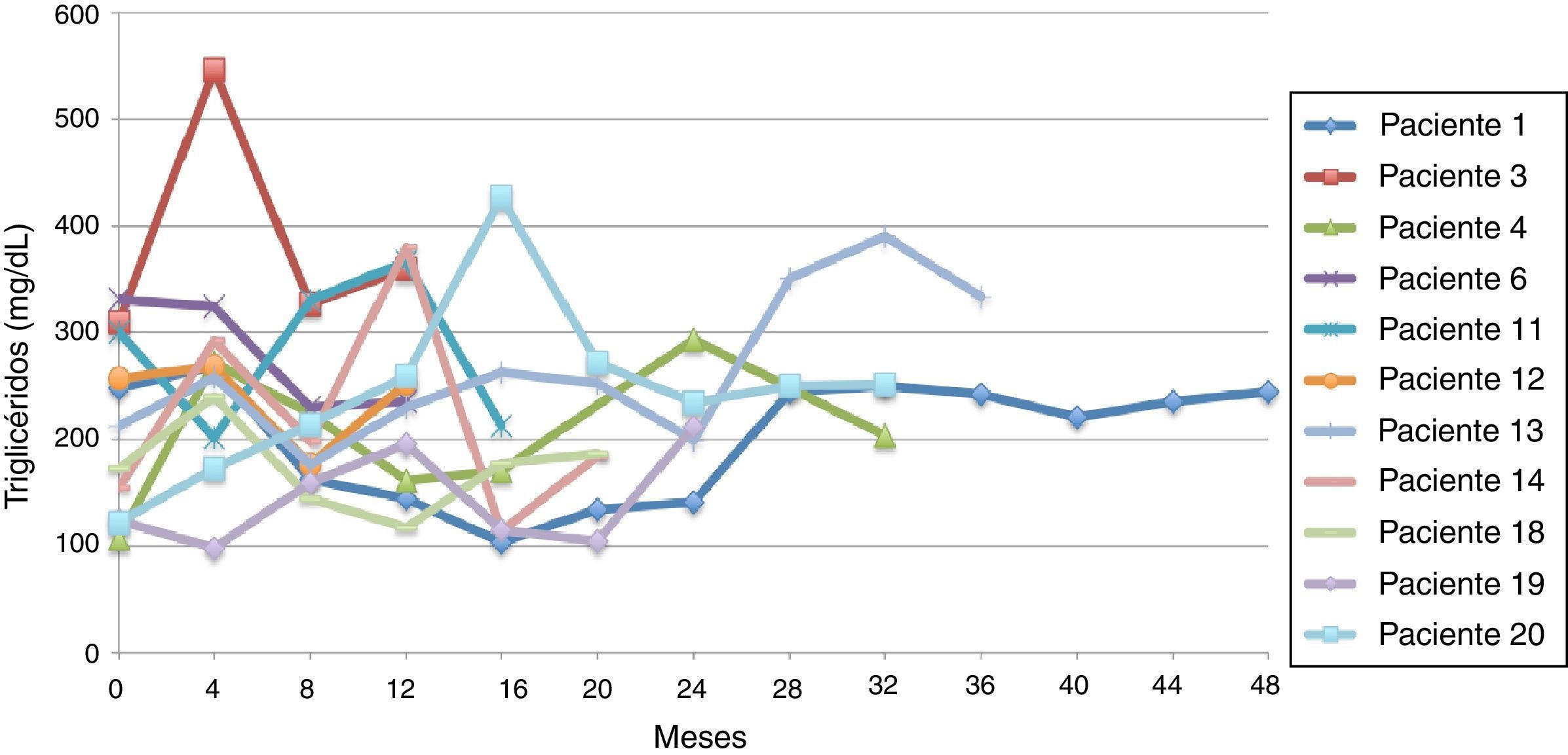
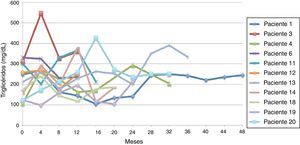
El promedio de cambio de triglicéridos entre 0-12 meses fue de 11,3 mg/dL (± 95,7 mg/dL), entre 0-24 meses 5,2 mg/dL (± 102,1 mg/dL) y entre 0-36 meses 18,3 mg/dL (± 91,9 mg/dL). Cuando se evaluaron las cifras de triglicéridos al final del seguimiento se encontraron 9 pacientes (45%) con triglicéridos menores a 150 mg/dl, y los 11 restantes (55%) con cifras de triglicéridos mayores o iguales a 150 mg/dL. Ninguno presentó cifras de hipertrigliceridemia severa (triglicéridos > 500 mg/dL).
Siguiendo la tendencia uno (triglicéridos < 150 mg/dL) se encontraron 9 pacientes (45%), y bajo la tendencia 2 (triglicéridos ≥ 150 mg/dL) los 11 restantes (55%) (figs. 6 y 7).
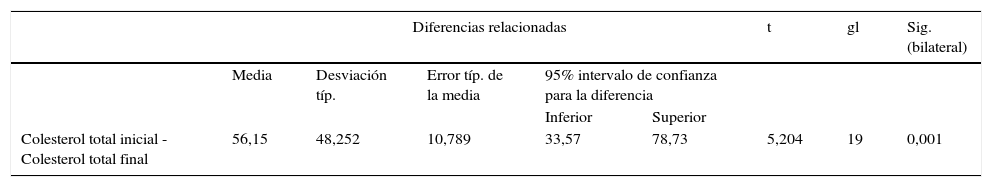
En el análisis bivariado a las variables colesterol total, LDL, HDL, no-HDL y triglicéridos de los 20 pacientes participantes en el estudio (en sus valores iniciales y finales) se aplicó la prueba de normalidad de Shapiro-Wilk por ser un número menor de 30 sujetos. A estas tres variables se les aplicó la prueba t de Student para muestras relacionadas; los resultados obtenidos en este análisis evidencian que no existe diferencia estadísticamente significativa entre valores iniciales y valores finales de colesterol no-HDL y triglicéridos (p>0,05), pero sí hubo diferencia estadísticamente significativa entre valores iniciales y valores finales de colesterol total (p<0,05).
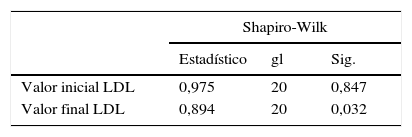
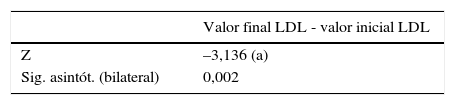
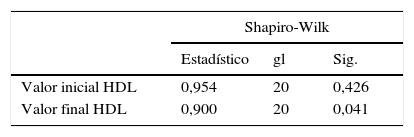
A las variables colesterol LDL y colesterol HDL que no se distribuyeron normalmente en la prueba de Shapiro-Wilk, se les aplicó la prueba no paramétrica de Wilcoxon y se encontró diferencia estadísticamente significativa entre los valores iniciales y finales obtenidos en los 20 pacientes participantes en el estudio en estas dos variables (p<0,05), (tablas 2-6).
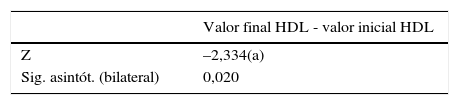
Prueba t de Student para muestras relacionadas, colesterol total
| Diferencias relacionadas | t | gl | Sig. (bilateral) | |||||
|---|---|---|---|---|---|---|---|---|
| Media | Desviación típ. | Error típ. de la media | 95% intervalo de confianza para la diferencia | |||||
| Inferior | Superior | |||||||
| Colesterol total inicial - Colesterol total final | 56,15 | 48,252 | 10,789 | 33,57 | 78,73 | 5,204 | 19 | 0,001 |
Durante el tiempo de seguimiento se presentaron 4 desenlaces fatales. Todas las muertes se presentaron después de quince meses de seguimiento, 3 de los 4 pacientes recibían dosis de atorvastatina de 40 mg/día y solo un paciente recibía 80 mg/día. Hubo un caso de hemorragia subaracnoidea espontánea por rotura de aneurisma cerebral en mujer anticoagulada por accidente cerebrovascular cardioembólico previo.
Se detectaron 11 eventos cardiovasculares no fatales en 8 pacientes. En 3 pacientes enfermedad arterial oclusiva de miembros inferiores, 2 casos de infarto agudo de miocardio sin elevación del ST, 4 casos de accidente cerebrovascular y 2 ataques isquémicos transitorios.
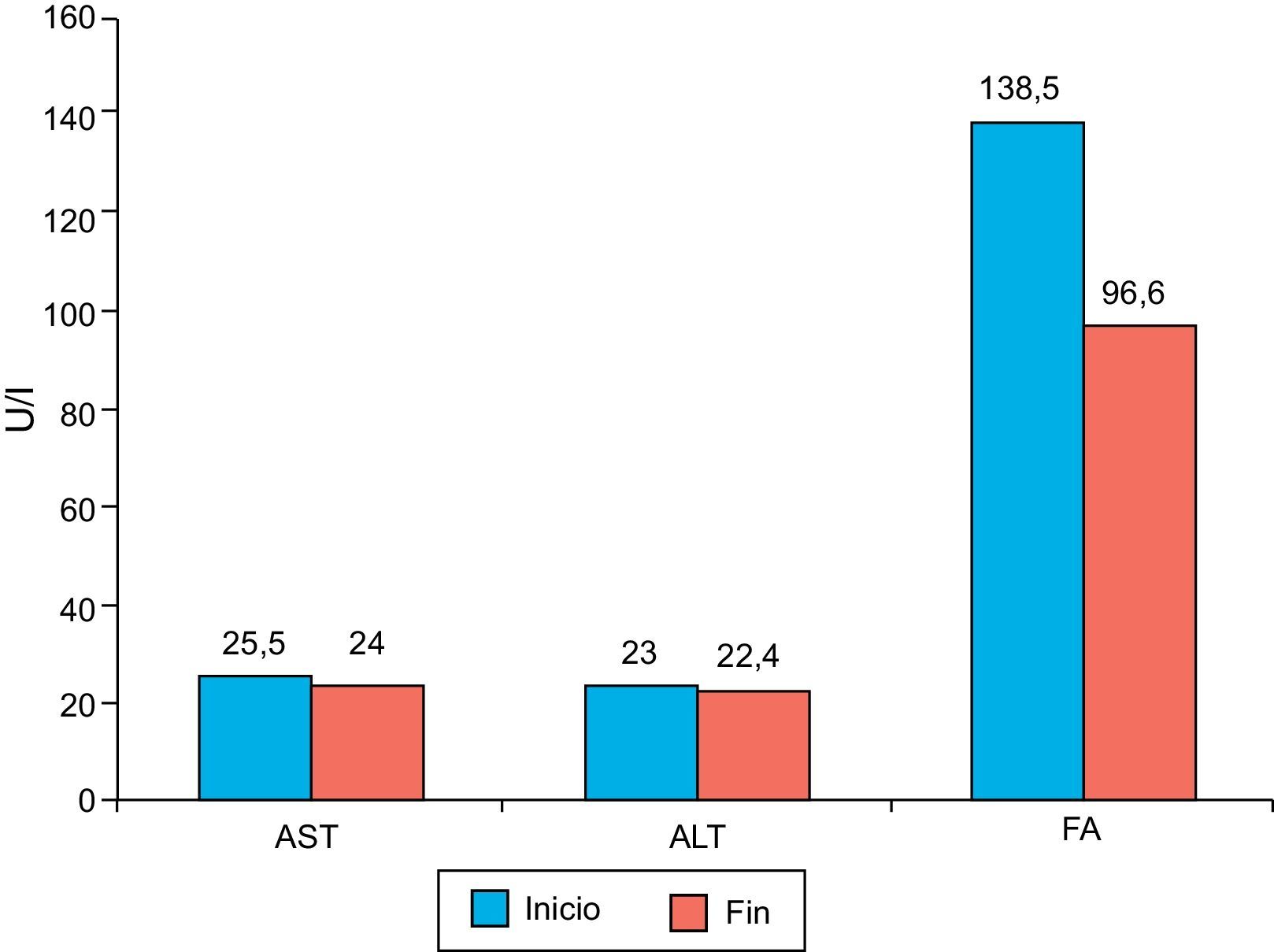
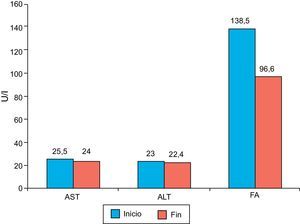
En relación con la seguridad de la administración de la atorvastatina, no se encontraron en el seguimiento modificaciones importantes relacionadas con la medicación, en los valores de las enzimas hepáticas ni fosfatasa alcalina (fig. 8). Seis pacientes (30%) presentaron síntomas musculares, todos con niveles de CPK normales; ninguno requirió suspensión de atorvastatina para resolución de los síntomas.
DiscusiónLa dislipidemia renal tiene características diferentes en pacientes con enfermedad renal crónica estadio 5 en terapia dialítica. Los pacientes en hemodiálisis presentan principalmente hipertrigliceridemia con incrementos en las apoB ricas en triglicéridos, VLDL e IDL, niveles bajos de apoAI y apoAII, con disminución en los niveles de HDL, moderada elevación de apoB y apoE, aumento significativo de apoC-III, con pocos cambios en los niveles de lipoproteínas ricas en colesterol (LDL)11.
En pacientes en diálisis peritoneal es más común la dislipidemia, y además de la hipertrigliceridemia se detecta elevación en los valores de lipoproteínas que contienen apoB ricas en colesterol, lo cual se refleja en valores altos de ambas IDL y LDL, con mayor incremento en los niveles de apoB, apoC-III y apoE que en los pacientes en hemodiálisis, generándose en ellos un perfil más aterogénico12–15.
La diálisis peritoneal es un tratamiento que aporta gran cantidad de glucosa, parte de la cual se absorbe, aportando un sustrato, que puede aumentar la síntesis de lipoproteínas, agravando la dislipidemia14. A favor de ello está la utilización nocturna de solución de diálisis con icodextrin (libre de glucosa) que puede traducirse en una reducción moderada en el colesterol plasmático16. También es posible que la pérdida de proteínas en el líquido de diálisis peritoneal, incluidas albúmina, apolipoproteínas y HDL, pueda disparar mecanismos semejantes a los que ocurren en el síndrome nefrótico con incremento en lipoproteínas ricas en colesterol17.
La mayor mortalidad por causa cardiovascular, principalmente por infarto de miocardio, más vista en pacientes en diálisis peritoneal que en hemodiálisis, podría obedecer al perfil más aterogénico que ostentan8,18–20.
Existe controversia en relación con el tratamiento de la dislipidemia en pacientes con enfermedad renal crónica estadio 5.
Las guías de 2013 del American College of Cardiology/American Heart Association para el tratamiento del colesterol sanguíneo y la reducción del riesgo cardiovascular aterosclerótico en adultos, concluyen que las modificaciones en el estilo de vida son un componente crítico para reducir el riesgo por enfermedad cardiovascular aterosclerótica (ECVAS). Indican, además, que se encontró evidencia extensa y contundente que avala el uso de estatinas para la prevención de ECVAS en individuos con alto riesgo primario, y en prevención secundaria, pero sin falla cardíaca NYHA II-IV, ni en aquellos que se encuentren en hemodiálisis. Con los estudios analizados se concluyó que no había información suficiente con base en la cual se estuviera a favor o en contra del uso de estatinas; por tanto no se generaron recomendaciones con relación al inicio o la continuación de la terapia con estatinas en esos dos grupos. De igual forma, no se hallaron comentarios en cuanto a intervenciones en pacientes en terapia de diálisis peritoneal. Se resalta que la terapia con estatinas de moderada a alta intensidad para reducir el valor de colesterol LDL entre un 30 a 50%, o más del 50% respectivamente, es un factor crítico para reducir la ECVAS, en forma tal que a mayor dosis de estatinas más beneficios en reducción del riesgo, al igual que a mayor presencia de factores de riesgo para ECVAS, mayor beneficio terapéutico de las estatinas sobre un periodo de 5 a 10 años. Otro aspecto destacable de las guías es la identificación de pacientes diabéticos tipo 1 o 2 entre 40 a 75 años y con colesterol LDL de 70 a 189 mg/dL, o con un riesgo de ECVAS mayor al 7,5% entre los 4 grupos de mayor beneficio en terapia con estatinas, dato relevante si se tiene en cuenta que un 30 a 40% de los pacientes con enfermedad renal crónica en terapia dialítica son diabéticos. En relación con la terapia con estatinas de alta intensidad, se recomiendan, dado su perfil de seguridad, atorvastatina 40 a 80mg al día o rosuvastatina 20 a 40 mg/día.
Concluye la guía que en individuos con enfermedad renal crónica en terapia de hemodiálisis y dislipidemia el beneficio potencial de reducir el riesgo de ECVAS, efectos adversos, interacción de medicamentos, cuidados y contraindicaciones, y elección de la dosis de estatinas son factores que orientan la decisión del clínico sobre el inicio y la continuación de la terapia con dichos medicamentos21.
Las Guías de la Sociedad Cardiovascular Canadiense para el diagnóstico y tratamiento de la dislipidemia y para la prevención de la enfermedad cardiovascular en adultos, actualizadas en 2012, y publicadas en 201322, consideran que todo paciente adulto, independientemente de su edad, con la presencia del factor de riesgo de enfermedad renal crónica debe ser evaluado para dislipidemia. La aplicación del score de riesgo Framingham en dichos pacientes, permite estimar el riesgo a 10 años de desarrollar eventos cardiovasculares totales. Aquellos con enfermedad renal crónica y tasa de filtración glomerular menor a 45 mL/min/1,73 m2 se consideran de alto riesgo para mayores eventos cardiovasculares, lo cual sugiere que este grupo se beneficia con la utilización de estatinas, recomendándose la meta terapéutica de un valor de LDL colesterol menor a 2,0 mmol/L (80 mg/dL), o una reducción mayor del 50% en relación con su valor inicial.
Las guías KDIGO de 2013, para el manejo de lípidos en enfermedad renal crónica23, establecen que a todo adulto con diagnóstico reciente de enfermedad renal crónica, incluidos aquellos en diálisis crónica, se le debe practicar perfil lipídico, aunque indican que no se requiere seguimiento del mismo. Para adultos mayores de 50 años, con enfermedad renal crónica (TFG menor a 60 mL/min) estadio G3 a G5 no tratados por diálisis crónica, con dislipidemia y riesgo cardiovascular, se recomienda el tratamiento con estatinas o la asociación ezetimibe/estatina. No obstante, en pacientes con enfermedad renal crónica dependientes de diálisis (no indican la variedad) sugieren no iniciar las estatinas o la combinación ezetimibe/estatina, aunque deberían continuarse en aquellos que recibían alguno de estos tipos de tratamientos previos al inicio de la diálisis. En cuanto al seguimiento y la dosificación de las estatinas de manera escalonada para obtener un blanco terapéutico (LDL menor a 100 mg/dL), consideran que no hay suficiente evidencia para recomendar este proceso puesto que sus resultados poco darían lugar a cambios en el tratamiento; por tanto, sugieren la alternativa «dispare y olvide» («fire and forget»), aunque aclaran que el médico es quien debe definir la necesidad de practicar un seguimiento considerando que el mismo mejora la adherencia al tratamiento y otros procesos de atención. Es probable que los pacientes con muy altos valores de colesterol LDL en terapia de diálisis, tengan mayores beneficios de la terapia con estatinas, lo cual puede llevar al médico y al paciente a optar por la terapia con estatinas a pesar de los resultados no concluyentes de las pruebas expuestas24.
Existen varios estudios que han analizado los diversos trabajos de investigación llevados a cabo interviniendo pacientes con enfermedad renal crónica estadio 5 en terapia dialítica. Recientemente en Cochrane se revisaron 25 estudios al respecto, en los que concluyen que las estatinas tienen poco o ningún efecto benéfico en la mortalidad o en eventos cardiovasculares a pesar de lograr reducción en los niveles del colesterol sérico. Sin embargo, aclaran que existe poca información para pacientes tratados en diálisis peritoneal, hecho que sugiere la necesidad de más investigaciones en este grupo de pacientes25.
Tres metaanálisis recientes analizan los resultados de la terapia con estatinas en pacientes con enfermedad renal crónica, y generan más controversia al respecto. En el primero de ellos, el grupo de Upadhyay et al.26 concluyó que la terapia para disminuir lípidos decrece el riesgo para mortalidad cardiaca, eventos cardiovasculares e infarto de miocardio, aunque el beneficio de reducción de mortalidad para todas las causas solo ocurrió en pacientes que no se encontraban en terapia dialítica. En el segundo, de Palmer et al.27 las estatinas solo redujeron la mortalidad de todas las causas, mortalidad cardiovascular y eventos cardiovasculares en pacientes con enfermedad renal crónica que no estaban en terapia dialítica.
El tercero, último y más reciente, de Hou et al.28 concluyó que la terapia con estatinas sí produce una reducción significativa de eventos cardiovasculares mayores, eventos coronarios, muerte cardiovascular y por todas las causas a través de todo el rango de función renal, incluidos los pacientes en diálisis.
Cabe resaltar que en la discusión de estos se anota que la población de pacientes en diálisis no puede mezclarse, y que no hay suficientes estudios de pacientes en diálisis peritoneal con un perfil lipídico más aterogénico para analizarlos de manera individual. Sin embargo un estudio reciente de Lee et al.29 evaluó 1.024 pacientes incidentes a programas de diálisis peritoneal en 7 centros en Korea; a 37,8% (387 pacientes) se le prescribió una estatina, y fueron comparados con igual número de pacientes sin la prescripción y con la misma etiología de enfermedad renal crónica. Se practicó seguimiento durante un promedio de 2,7 años, detectándose que la probabilidad de sobrevida para usuarios de estatinas vs. no usuarios fue del 87 vs. 80%, y 76 vs. 69% a 3 y 5 años, respectivamente.
Otros factores que también pueden influir la decisión de iniciar tratamiento con estatinas en pacientes con enfermedad renal crónica estadio 5 en terapia dialítica son: infarto de miocardio reciente, mayor expectativa de vida y comorbilidad más severa, esta última representada por la concomitancia de otros factores de riesgo cardiovascular como la diabetes mellitus.
A favor de la elección individualizada de iniciar terapia de acuerdo con la presencia de factores de riesgo cardiovasculares en pacientes con enfermedad renal crónica estadio 5, están los subanálisis del 4D y del AURORA. En el análisis post hoc 4D se pudo observar que la administración de atorvastatina en pacientes con enfermedad renal crónica y diabetes mellitus en terapia hemodialítica con un alto cuartil de elevación del colesterol LDL (mayor a 145 mg/dL), sí redujo significativamente eventos cardiovasculares como muerte cardíaca, muerte cardíaca súbita, infarto de miocardio no fatal y todos los eventos cardíacos combinados24,30,31. En otro análisis post hoc del estudio AURORA, que incluyó diabéticos y no diabéticos en hemodiálisis, se optó por analizar solo el grupo de pacientes diabéticos tratados con rosuvastatina y se encontró que la tasa de eventos cardíacos fatales y no fatales se redujo en un 32%32.
ConclusionesEn pacientes con enfermedad renal crónica estadio 5, mayores de 18 años, en terapia de diálisis peritoneal e hipercolesterolemia, la atorvastatina en dosis altas logra obtener niveles de LDL en metas en el 50% de los pacientes tratados, sin que su administración dé lugar a eventos adversos significativos.
Este trabajo no pretende controvertir las guías actuales, sino demostrar que la atorvastatina en dosis altas (terapia de alta intensidad) es bien tolerada por pacientes con enfermedad renal crónica en terapia de diálisis peritoneal, y que el médico puede tomar la determinación de usarla o no según su criterio, con base en el perfil de riesgo cardiovascular que porta su paciente. La dosis y preocupación por la aparición de efectos colaterales, no debe, por tanto, constituir una limitación para la prescripción de atorvastatina de alta intensidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.