La diabetes es un trastorno metabólico que se ha incrementado en Latinoamérica y Venezuela en la última década. Ejerce una influencia considerable en la morbimortalidad de las enfermedades cardiovasculares debido al desequilibrio hidrocarbonado y a los pacientes fuera de los objetivos de la Asociación americana de diabetes 2012, con factores de riesgo como hipertensión y dislipidemia.
Es, igualmente, un estado de estrés oxidativo en el que hay un desequilibrio entre la formación excesiva y la eliminación insuficiente de moléculas altamente reactivas, como las especies reactivas de oxígeno y las de nitrógeno. El estrés oxidativo desempeña un papel importante en el desarrollo de complicaciones de la diabetes debido a la actividad oxidativa excesiva.
La disfunción endotelial se define como alteraciones que afectan la síntesis, liberación, difusión o degradación de los factores sintetizados por el endotelio. El mecanismo intrínseco que impulsa a las células endoteliales para cambiar su fenotipo fisiológico es un estado de activación, conocido erróneamente como disfunción en la capacidad de expresar los sistemas enzimáticos de producción de oxígeno.
Los fármacos que modulan la vía de la incretina (GLP-1 y los inhibidores de la DPP-4) se caracterizan por la baja incidencia de su efecto hipoglucemiante, fenómeno que aumenta su seguridad. Estudios recientes con GLP-1 demuestran su capacidad para revertir el estrés oxidativo producido por la hiperglucemia, la hipoglucemia y la transición de esta última y la primera.
Diabetes is a metabolic disorder that has increased in Latin America and Venezuela over the last decade. It exerts an important influence on cardiovascular diseases morbi-mortality because of the hydrocarbonate imbalance and on patients outside ADA's 2012 goals, with risk factors such as hypertension and dyslipidemia.
Diabetes is a state of oxidative stress where there is an imbalance between excessive formation and insufficient removal of highly reactive molecules such as reactive oxygen species (ROS) and reactive nitrogen species (RNS). Oxidative stress plays an important role in developing diabetes complications because excessive oxidative activity.
Endothelial dysfunction is defined as alterations affecting synthesis, liberation, diffusion or degradation of the factors synthesized by the endothelium. The intrinsic mechanism that drives endothelial cells to switch their physiologic phenotype into an activation state mistakenly known as dysfunction is the ability to express O2 production enzymatic systems.
Drugs that modulate incretin pathway (GLP-1 and DPP4 inhibitors) are characterized by their low incidence of hypoglycemic effect, which increases their safety. Recent studies with GLP-1 have shown its ability to reverse oxidative stress produced by hyperglycemia, hypoglycemia and the transition from hypo to hyperglycemia.
La diabetes mellitus es un desorden metabólico con gran incidencia mundial, del que se ha registrado un incremento en la última década en Latinoamérica y Venezuela, como lo demuestran Schargrodsky et al.1 en su trabajo sobre «Factores de Riesgo Cardiovascular en América Latina” (estudio CARMELA), donde alcanza una prevalencia del 7% en general, si bien al analizar solo la información recolectada en Barquisimeto, del mismo grupo de investigación, se obtiene una prevalencia del 6%1 (tabla 1).
Factores de riesgo cardiovascular en Venezuela (Estudio CARMELA)
| Prevalencia (%) de los factores de riesgo cardiovascular (media e intervalo) | |
|---|---|
| Hipertensión2 | 25 |
| Dislipidemia3 | 70 |
| Diabetes o AGA4 | 6 |
| Síndrome metabólico5 | 26 |
| Obesidad abdominal (h/m) | 57/84 |
| Hipertrigliceridemia (h(m) | 90/79 |
| Reducción c-HDL (h/m) | 93/96 |
| Hipertensión (h/m) | 82/64 |
| Diabetes o AGA (h/m) | 23/19 |
Fuente: Barquisimeto 1.848 sujetos; edad media 45±11 años, 61% varones, 39% mujeres. Tomada de Schargrodsky et al.1.
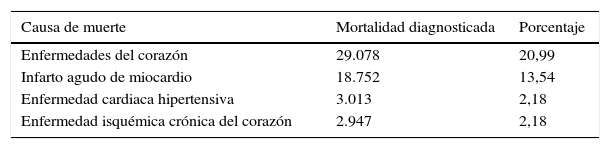
Sin embargo, el problema no solo está en la prevalencia de la enfermedad sino en el alto número de pacientes que viven con la patología y que están fuera de las metas de hemoglobina glucosilada (HbA1c), como se expresa en el trabajo de Moreira et al.6 donde el promedio de la HbA1c en 4.096 pacientes con diabetes fue de 9,11% en Venezuela6, hecho que aporta una perspectiva de cómo puede influir la diabetes mellitus en el incremento de la morbimortalidad por enfermedades cardiovasculares (tabla 2), ya que no son solo factores de riesgo la hipertensión o dislipidemia, sino también el desorden hidrocarbonado y los pacientes muy fuera de las metas establecidas por la Asociación americana de diabetes del 20127.
Mortalidad por enfermedades del corazón en Venezuela. Año 2010
| Causa de muerte | Mortalidad diagnosticada | Porcentaje |
|---|---|---|
| Enfermedades del corazón | 29.078 | 20,99 |
| Infarto agudo de miocardio | 18.752 | 13,54 |
| Enfermedad cardiaca hipertensiva | 3.013 | 2,18 |
| Enfermedad isquémica crónica del corazón | 2.947 | 2,18 |
Fuente: Gobierno Bolivariano de Venezuela4.
De otra parte, la diabetes no es solo un trastorno hidrocarbonado, pues también se conoce como un estado de estrés oxidativo3, en el que se da un disbalance entre la formación excesiva y la remoción insuficiente de moléculas altamente reactivas como las especies reactivas de oxígeno (ROS) y las especies reactivas de nitrógeno (RNS). En este grupo se incluyen, además, dos especies muy conocidas por su relación con el endotelio: el ion superóxido (O2-) y su contraparte, el óxido nítrico (NO-), las cuales se abordarán en esta revisión3.
Efecto de la oxidación en el endotelioLas células del endotelio vascular cumplen un papel decisivo para mantener la homeostasis cardiovascular. Además de proveer una barrera física en la pared vascular y el lumen8, el endotelio se considera en la actualidad un órgano perteneciente al sistema neuroendocrino difuso, cuyas células ejercen funciones vasodilatadoras y vasoconstrictoras, anticoagulantes y procoagulantes, antiinflamatorias y proinflamatorias, proliferativas y antiproliferativas, angiogénicas y antiangiogénicas, inmunes y autoinmunes, y autocrinas, paracrinas y endocrinas; y sintetizan disímiles moléculas con funciones vasoactivas y hormonales, neuropéptidos, neurotransmisores, citoquinas, factores de crecimiento, factores quimioatrayentes, moléculas de adhesión celular y receptores de membrana, lo que contribuye a convertirlo en el órgano más versátil del organismo humano9,10.
La disfunción endotelial cumple un papel preponderante en la génesis de las complicaciones vasculares de la diabetes y precede a las evidencias anatómicas más tempranas de aterosclerosis11.
El concepto de disfunción endotelial implica un daño funcional, el cual puede evolucionar hacia estructural12, si bien en otras literaturas se considera como un trastorno en el cual este pierde sus propiedades fisiológicas: la tendencia a favorecer la vasodilatación, la fibrinólisis y la antiagregación8. Sin embargo, la disfunción endotelial debe diferenciarse de la activación endotelial, la cual es una respuesta fisiológica cuyo objetivo es compensar y/o anular los efectos nocivos de un estímulo potencialmente lesivo a los tejidos12.
De forma general, se puede definir la disfunción endotelial (DE) como la serie de alteraciones que afectan la síntesis, la liberación, la difusión o la degradación de los factores que se sintetizan por el endotelio9. La DE no es homogénea en sus características ni en su distribución; estos aspectos varían a expensas de la enfermedad que esté presente, así como del lecho vascular afectado9,10,13.
La etapa inicial de la disfunción endotelial involucra el reclutamiento de células inflamatorias y su migración a través del endotelio. Este proceso está regulado por moléculas de adhesión que se expresan en la superficie de leucocitos y células endoteliales, y que tendrían un papel trascendental en la predicción de los eventos cardiovasculares11. El mecanismo intrínseco que le permite a la célula endotelial «switchear» su fenotipo fisiológico en uno de activación mal conocido como disfunción, es la capacidad de expresión de sistemas enzimáticos productores de oxígeno, incluyendo a la eNOS desacoplada o «uncoupled» NOS-uNOS- y la puesta en marcha de factores de transcripción inflamatorios como el NFkB12.
Entre las moléculas de adhesión que intervienen están las selectinas (E-selectina [E-S] y P-selectina), las moléculas de adhesión intracelular (ICAM-1) y las moléculas de adhesión vásculo-celular (VCAM-1). La E-S es una glicoproteína que, a diferencia de ICAM-1 y VCAM-1, se expresa exclusivamente en las células endoteliales activadas, en respuesta a citoquinas inflamatorias como la interleuquina-1 beta (IL-1β), y/o el factor de necrosis tumoral alfa (TNF-α). Se ha sugerido que niveles aumentados de formas solubles de E-S (sE-S) podrían ser marcadores específicos y precoces de endotelio vascular dañado11.
La célula endotelial expresa en su membrana receptores específicos para colesterol-LDL oxidado o LOX-R, angiotensina II o AT1-R y productos de glucosilación avanzada o RAGEs. La unión de los diferentes ligandos a sus receptores, activa a los sustratos de membrana asociados en su mayoría de proteínas G y proteínas G pequeñas –smg–. Así, las interacciones ligando-receptor, inician cascadas enzimáticas cuya vía final común es la producción de radicales superóxido, especialmente oxígeno. El sistema de la NADPH oxidasa y la eNOS desacoplada –uNOS– son los sistemas productores de radicales superóxido en la célula endotelial más importantes; estas moléculas son el indicador intracelular de una lesión extracelular. El incremento citoplasmático de oxígeno hace que estos reaccionen con el óxido nítrico y lo transformen en peroxinitrito, induzcan proteólisis por ubiquitinación del IkB y rompan el «secuestro» de la familia de factores de transcripción incluidos en el NFkB, cada uno de los cuales iniciará la transcripción, síntesis y expresión de diversas moléculas inflamatorias. De esta manera, la célula endotelial activada en su genotipo inflamatorio producirá decenas de moléculas, cuyo efecto biológico reflejará las diferentes facetas de lo que se ha denominado «fenotipo de disfunción endotelial»12.
La interacción de los productos finales de la glucosilación avanzada con sus receptores celulares promueve la producción intracelular de RL y contribuye a disminuir los niveles intracelulares de antioxidantes. Asimismo, el glioxal, especie derivada de la oxidación de la glucosa, puede generar citotoxicidad mediada por incremento de la generación de EROs y disminución del GSH intracelular. Por otro lado, la glucación de las proteínas antioxidantes puede disminuir la actividad de estas mientras que la hemoglobina glucada puede constituir una fuente donadora de radical O2 – a la pared vascular en los diabéticos14–16.
En el estado diabético, la acumulación excesiva de O2¿- y el incremento consiguiente de la actividad de la proteína quinasa C y del flujo de las hexosaminas provocan disfunción celular progresiva14.
Velarde et al., realizaron un estudio en el que determinaron los niveles de sE-S y ET-1 en diabéticos tipo 2 y relacionaron la posible asociación de dichas moléculas con otros factores de riesgo cardiovascular como índice de masa corporal elevado, hipertensión arterial, hipercolesterolemia y grado de control glucémico. Determinaron que estos pacientes presentaron niveles elevados de sE-S y ET-1 y moléculas marcadoras de activación endotelial. Los diabéticos con índice de masa corporal alto presentaron un incremento significativo de sE-S y ET-1, que potenciaba la disfunción endotelial en estos. El grado de control glucémico se asoció con niveles elevados de ET-1, lo que confirmaría que la hiperglucemia crónica afecta la vasodilatación dependiente del endotelio. Estos resultados sugieren que la detección temprana de marcadores bioquímicos de disfunción endotelial contribuiría a la prevención de enfermedad cardiovascular en pacientes de alto riesgo11.
Por otra parte, existen varios mecanismos implicados en el incremento del estrés oxidativo en la diabetes mellitus, entre los cuales se encuentran: la autooxidación de la glucosa, la glucación de proteínas, la activación de la vía de los polioles y la disminución de las defensas antioxidantes. La glucosa, al igual que otros alfahidroxialdehídos, es capaz de autooxidarse a enedioles (enolizarse) en solución acuosa y en presencia de metales de transición, como el Fe+3, reacción en la cual se producen citoaldehídos intermediarios oxidados y RL, con alto poder oxidante como el O2¿-14,17,18.
En términos generales, la modificación oxidativa de las proteínas incrementa su degradabilidad y susceptibilidad a la proteólisis, probablemente por el aumento de su hidrofobicidad, lo cual implica, específicamente, una más rápida ubiquitinización y degradación por la vía lisosomal14. La retina es el tejido neurosensorial del ojo y es extremadamente rica en membranas con lípidos poliinsaturados, característica que la hace especialmente sensible a la acción deletérea de los RL derivados del oxígeno y el nitrógeno14. Un blanco frecuente del ataque de los RL en el riñón son los lípidos de las membranas de las células renales, lo cual provoca su peroxidación y altera la integridad y la función de estas membranas14,19.
El contenido de carbonilos proteicos es el marcador más utilizado para medir la modificación oxidativa de las proteínas y se ha sugerido que es un marcador confiable de estrés oxidativo.Asimismo, el contenido de carbonilos proteicos se correlaciona positivamente con las complicaciones de la diabetes14,20,21.
Kowluru estudió ratas en las que se indujo diabetes mediante la inyección de aloxano, y demostró que en la retina de estas había un aumento de la concentración de sustancias reactivas al ácido tiobarbitúrico y de óxido nítrico (ON), y un incremento de la actividad de la proteína quinasa C, además de una disminución de la concentración de GSH. Por su parte, Du et al. demostraron que la hiperglucemia incrementa la producción de ON en las células retinianas, lo que se debe al aumento de la actividad de la ON sintetasa. Este aumento de ON se acompaña de la generación de peroxinitrito, el cual está implicado en la aparición de apoptosis en las células nerviosas de la retina14,22.
En los nervios, esta confluencia de alteraciones metabólicas y vasculares produce trastornos en la función neuronal y favorece la pérdida del soporte neurotrófico y, a largo plazo, la aparición de la apoptosis de las neuronas, de las células de Schwann y de las células gliales14,23,24.
Muchos han sido los intentos por encontrar un marcador universal lo suficientemente preciso y específico de DE. Así, trató de considerarse como tal a la elevación de las células endoteliales maduras circulantes y de las micropartículas endoteliales, pequeñas vesículas formadas por la membrana celular, que son liberadas por las células endoteliales activadas o dañadas, y a la disminución de las células endoteliales progenitoras circulantes, pero hasta el momento esto no puede considerarse ciencia constituida. En la actualidad, para identificar la presencia de DE, se utilizan la medición de sustancias reguladoras de biofunciones sintetizadas por el endotelio y de otras reconocidas como marcadores de DE, y pruebas indirectas, cuyos métodos se fundamentan en la respuesta vasoactiva a drogas (vasodilatación con acetilcolina) o a estímulos mecánicos, y para la realización de las cuales es preciso auxiliarse, en algunos casos, de técnicas invasivas como la coronariografía. Por otro lado, entre estas pruebas hay algunas que utilizan métodos no invasivos, como la ultrasonografía de alta resolución (eco doppler vascular) y la tomografía por emisión de positrones9,13,25.
Implicaciones sistémicas del estrés oxidativo en la hiperglucemiaUna de las formas de poder entender este punto, es asociar las diferentes complicaciones crónicas de la diabetes, sobre todo cuando existe un estado de hiperglucemia, y relacionarlas con los diferentes estados de estrés oxidativo que se están dando a lugar. El estrés oxidativo ejerce un rol determinante en el desarrollo de complicaciones de la diabetes mellitus4. La actividad excesiva de oxidante está mecánicamente relacionada con diversas etiologías de la resistencia a la insulina y el desarrollo de diabetes mellitus tipo 25. Hay muchas fuentes de estrés oxidativo en diabetes mellitus, incluida la enzimática, las vías no enzimáticas y la mitocondrial. El aumento de estrés oxidativo en la diabetes mellitus se produce debido a diversos factores26. El factor más dominante múltiple es la glucosa autooxidación que resulta en el desarrollo de los radicales libres27.
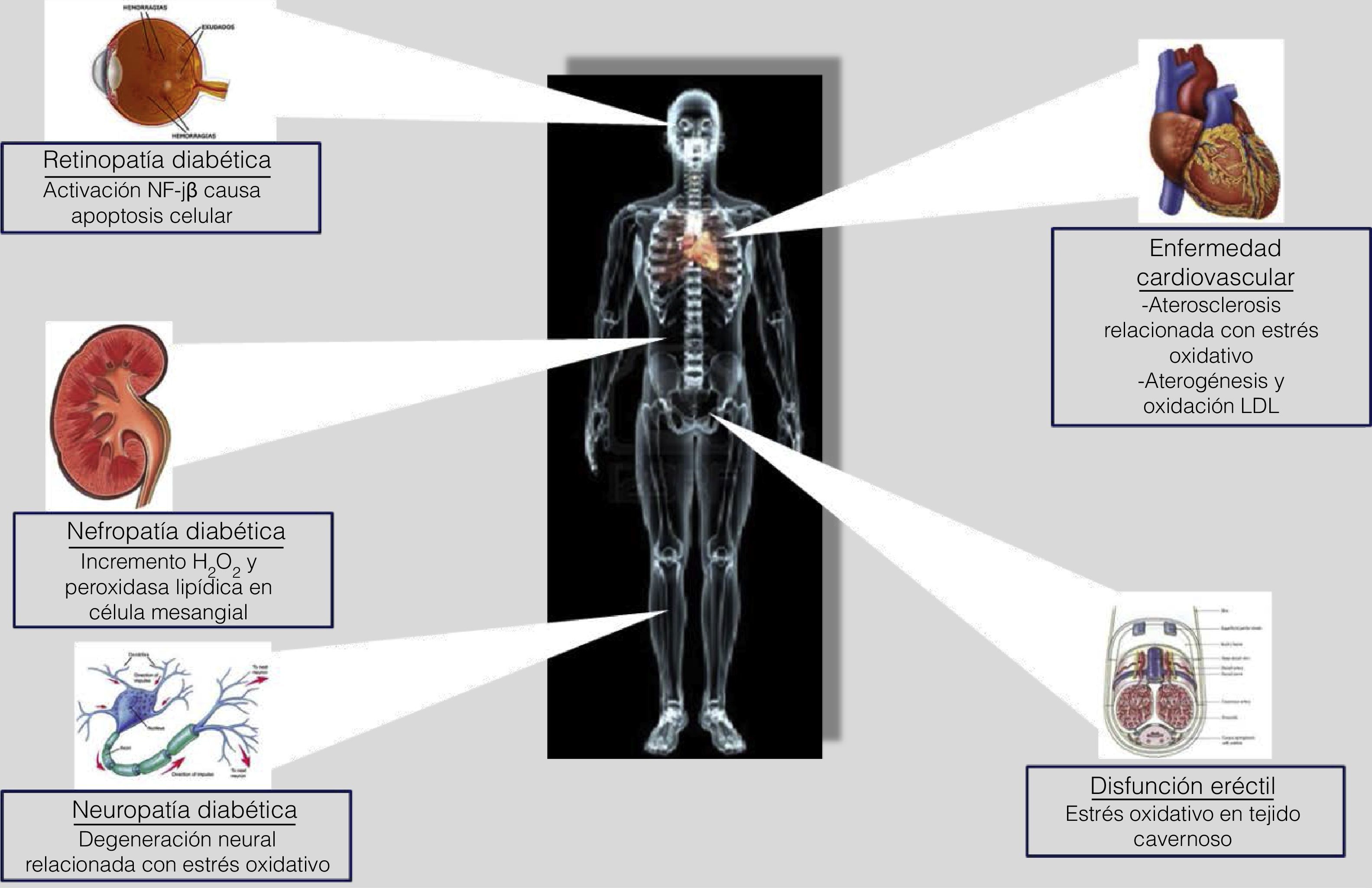
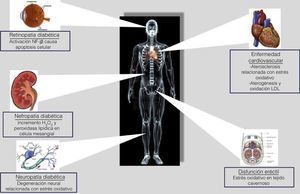
La diabetes mellitus también se caracteriza por complicaciones de microangiopatía, tales como retinopatía, nefropatía y neuropatía28. Varios estudios demuestran que la neutralización de moléculas reactivas ha sido capaz de inhibir significativamente el desarrollo de disfunción endotelial, miocardiopatía, retinopatía, nefropatía y neuropatía en pacientes con diabetes mellitus29 (fig. 1).
En este punto se introduce el papel de las plaquetas en el esquema oxidativo, y el término de alta reactividad plaquetaria (HPR) y su relación con la diabetes mellitus30. Al respecto, sobresalen los trabajos de Rosiak et al.30 quienes estudiaron pacientes diabéticos expuestos a antiagregación con aspirina (AAS) a dosis simple (75 mg) y duplicada (150 mg) más medición de HPR, entre otros parámetros como el trombaxano A2 (TXB2); es un subanálisis del estudio AVOCADO30. En resumen, la duplicación de la dosis de AAS en pacientes que presentan HPR se asoció con mejoría significativa en la reactividad de las plaquetas30.
La hipoglucemia y su relación con el estrés oxidativoLa hipoglucemia, al igual que la hiperglucemia, se ha asociado, de forma cada vez más frecuente, con enfermedad cardiovascular independientemente de que se presente en forma aguda o crónica. Dicha hipoglucemia forma parte de las complicaciones del tratamiento de la diabetes, tanto con el uso de insulina, como de hipoglucemiantes orales, y su incidencia aumenta de forma exponencial después de ocho a diez años de evolución de la enfermedad31.
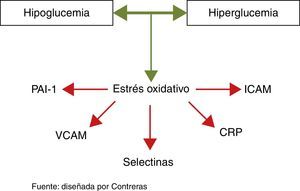
Los estudios más recientes que evaluaron el efecto sobre la morbimortalidad cardiovascular del tratamiento intensivo de la diabetes, han detectado efectos muy modestos, o aún más, efectos negativos de esta estrategia, hecho que podría reflejar el efecto negativo de la hipoglucemia sobre el sistema cardiovascular31 (fig. 2).
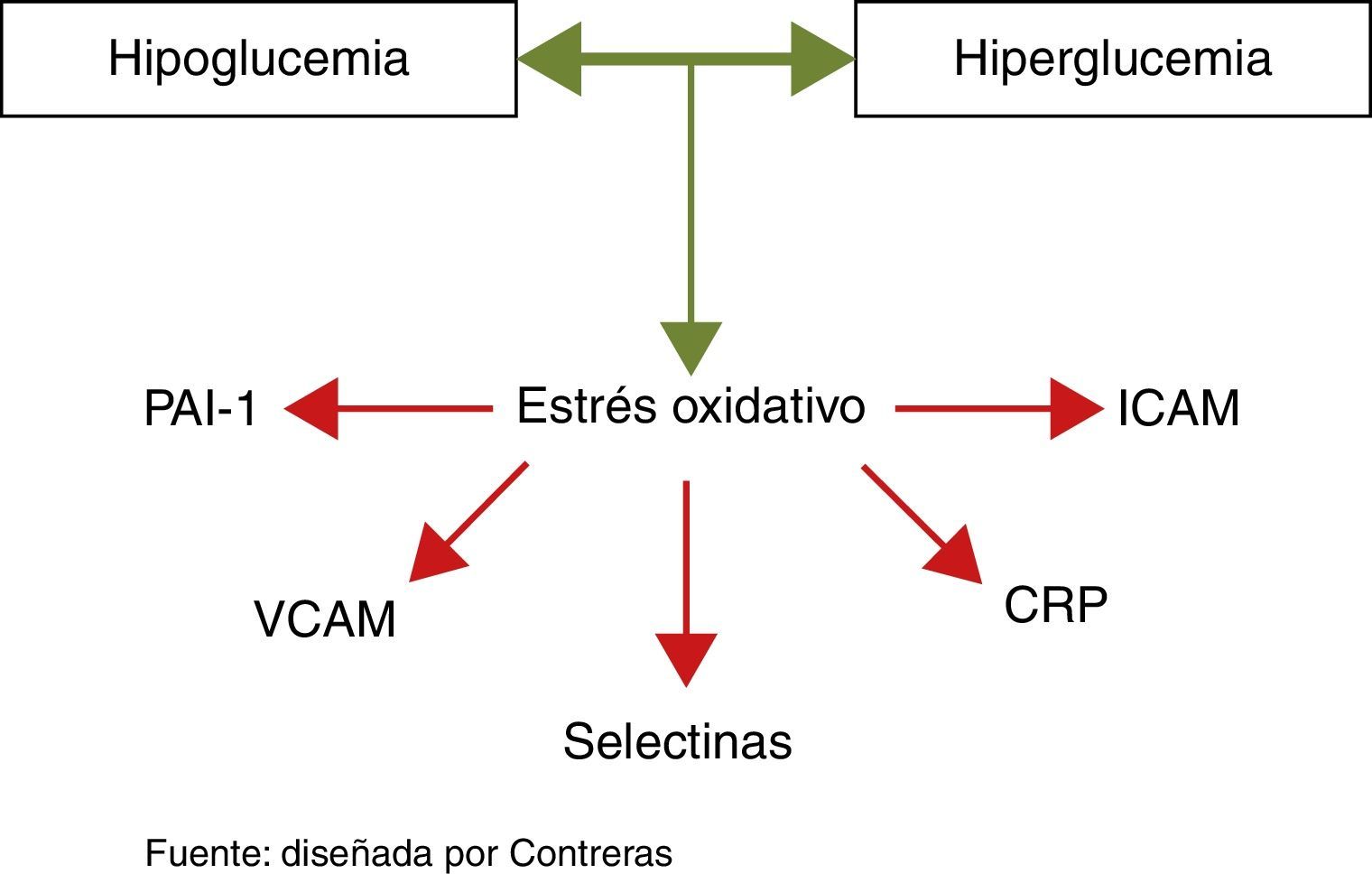
Llama la atención que la hipoglucemia ejerce efectos muy similares a los que produce la hiperglucemia sobre el endotelio32 (fig. 3):
- a.
Aumenta la producción de radicales libres (estrés oxidativo) y biomarcadores inflamatorios como la proteína C reactiva y las interleucinas 6 y 833.
- b.
Favorece la agregación plaquetaria, la producción del factor VIII, el factor de Von Willebrand y los procesos implicados en la aterotrombosis31.
- c.
Potencia la vasoconstricción y la producción de endotelina34.
- d.
De forma aguda, potencia la respuesta simpático-adrenérgica con aumento de la incidencia de arritmias y muerte cardiaca súbita31.
Ahora bien, con base en lo anterior ¿cuáles son los mecanismos por medio de los cuales se producen dichos efectos?
En primer lugar, debe tenerse en cuenta que la hipoglucemia favorece la liberación de mediadores adrenérgicos, cortisol y ácidos grasos libres que, de forma paradójica, potencian la insulinorresistencia y la inflamación concomitante35–37.
Por otra parte, la hiper e hipoglucemia generan estrés oxidativo con liberación de radicales libres y disfunción endotelial. Aún más, la situación que produce mayor generación de radicales libres es el paso brusco de hipo a hiperglucemia, lo cual revela un mecanismo etiopatológico común para las diferentes situaciones características de la disglucemia.
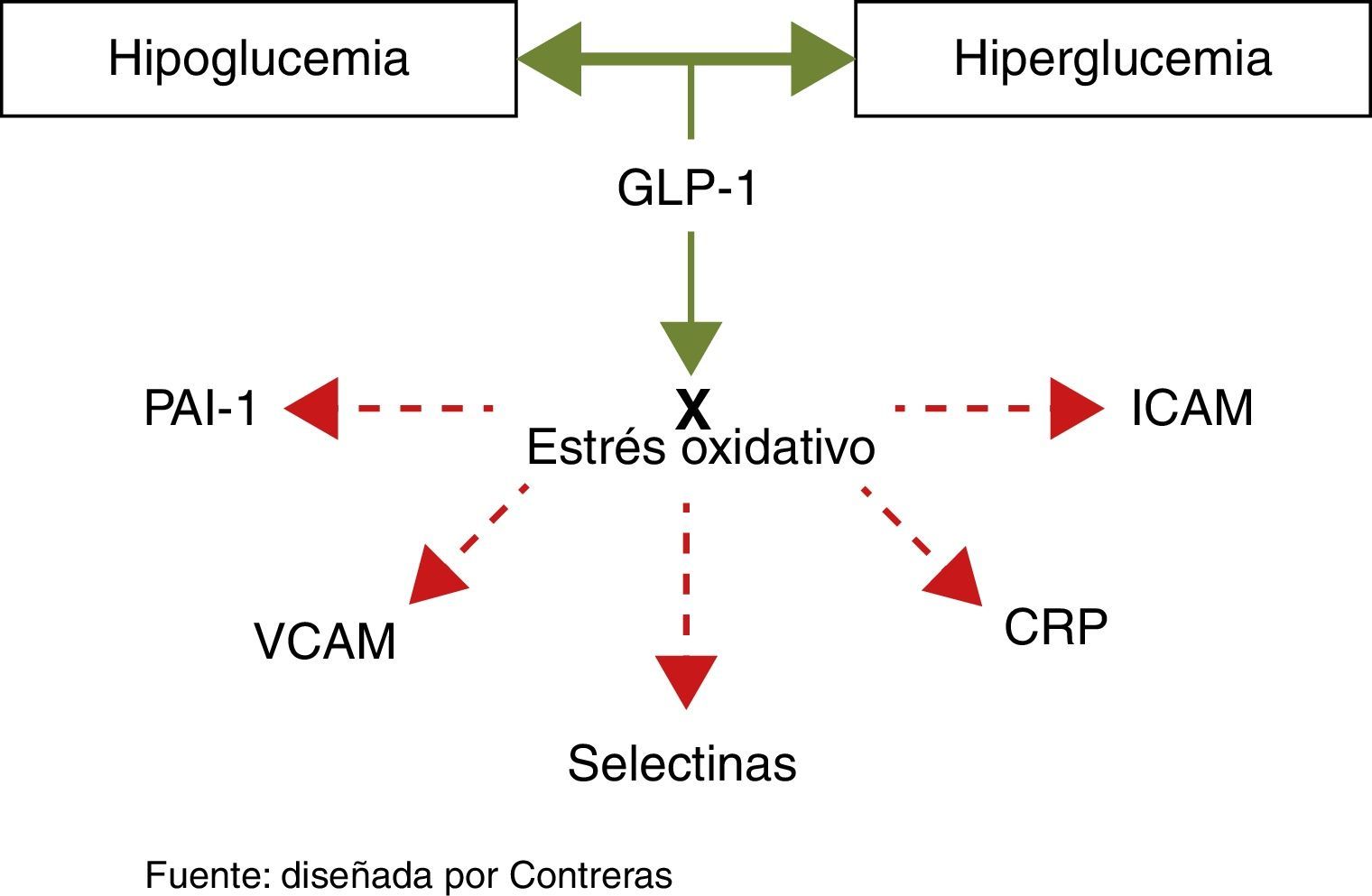
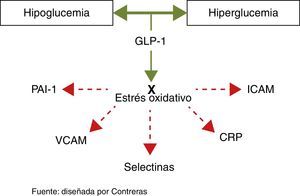
Los medicamentos que modulan la vía de las incretinas (GLP-1 e inhibidores DPP4) se caracterizan por su baja incidencia de hipoglucemia, lo cual incrementa la seguridad de su manejo. Pero, como efecto añadido, los estudios más recientes con GLP-1 han demostrado que es capaz de revertir el estrés oxidativo producido por la hiper y la hipoglucemia y por el paso de hipo a hiperglucemia38–40. Este mecanismo podría ayudar a explicar el efecto cardioprotector demostrado en los más recientes metaanálisis de esta línea de medicamentos.
Como puede observarse, la hipoglucemia constituye la «otra cara de la moneda» del efecto aterotrombótico de la glucosa y, de no tomarse en cuenta este punto, no se estará cubriendo el espectro completo del daño vascular.
Conflicto de interesesMarcelo Storino es Asesor Médico de AstraZeneca de Venezuela.