La gestación en presencia de una válvula mecánica es un reto terapéutico tanto para el ginecólogo como para el cardiólogo, en vista de las complicaciones materno-fetales y mayor el riesgo de trombosis valvular. Medio siglo después del primer reporte de una gestación a término en este contexto, mucho se ha aprendido, pero persisten controversias importantes, de ahí que conocerlas sea fundamental para encontrar el tratamiento más balanceado.
Pregnancy and mechanical valves are a therapeutic challenge both for the gynaecologist and the cardiologist in view of the maternal-foetal complications, and the higher risk of valvular thrombosis. Half a century after the first report of a full term pregnancy in this context, much has been learned, but there are still significant controversies, which are essential to know about, in order to find the most balanced treatment.
Ha pasado medio siglo desde la primera descripción de una gestación a término en una portadora de válvula mecánica1 y aunque se ha aprendido mucho desde entonces, continúan las controversias y la variabilidad en los protocolos de manejo en estos complejos casos. Su asidero está en que por razones éticas, la realización de estudios clínicos de alta calidad metodológica, como se recomienda por la medicina basada en la evidencia, que comparen diferentes alternativas de anticoagulación no se han llevado a cabo y es poco probable que se hagan, así que los datos y recomendaciones que guían el actuar clínico se sustentan en estudios observacionales, de casos y controles, cohortes históricas y registros poblacionales, con las reconocidas limitaciones y sesgos que genera cada diseño. Por tanto, los metaanálisis derivados de estos estudios y las recomendaciones de expertos deben usarse con precaución y solo como una guía para orientar el manejo, que dependerá de diversas circunstancias.
Qué se ha aprendidoRiesgo gestacionalDiversos metaanálisis han coincido en mostrar que la mortalidad materna está entre el 1 a 4%2, lo cual puede ser casi 400 veces mayor que la presente en población sana3; la principal causa de esto es la trombosis valvular que se presenta hasta en el 5% de los casos. Además, la posibilidad de un evento adverso para la madre o el hijo es casi del 50%4, hecho reconocido en diferentes modelos de riesgo gestacional como el ZAHARA y el OMS modificado5,6 n las que se indica que tener una válvula mecánica ubica a esta gestante en grupos de alto riesgo y aunque esta condición no contraindica la gestación, algunos autores desaconsejan el embarazo si no es posible mantener una anticoagulación efectiva7. En Latinoamérica el trabajo pionero del grupo de Salazar et al.8 en su serie de 72 gestaciones, mostró una mortalidad materna del 4,3% y de eventos trombóticos relacionado con la válvula de 11,4%. El mismo grupo publicó en 20019 su experiencia de más de tres décadas, con seguimiento de 304 gestantes portadoras de prótesis valvulares, en la que se halló una 1% de mortalidad y 5,2% de trombosis valvular. En 2001 se publicó en Colombia una serie de cinco casos de gestantes portadoras de válvulas mecánicas, en la que registraron dos muertes maternas asociadas al cambio de esquema de anticoagulación de warfarina a heparina no fraccionada subcutánea y heparina de bajo peso molecular, respectivamente10.
En registros recientes como el ROPAC (Registro de Gestación y Enfermedad Cardiaca de la Sociedad Europea de Cardiología) se encontró que la mortalidad materna fue similar entre los países desarrollados y los que están en vía de desarrollo (1 a 4%), pero en los primeros hubo más admisiones hospitalarias y complicaciones hemorrágicas, explicadas en parte por el mayor número de cesáreas4.
Riesgo del tratamiento con warfarina para el producto de la gestaciónDesde el primer reporte de la literatura quedo claro que la anticoagulación a causa de una válvula mecánica en una gestante, puede traer desenlaces diferentes tanto para la madre como para el producto1. En dicho reporte la gestante estuvo anticoagulada durante toda la gestación con warfarina y aunque su válvula mecánica no tuvo complicaciones, en el recién nacido hubo hallazgos teratogénicos que posteriormente se conocerían como embriopatía por cumarínicos.
Dado su peso molecular, la warfarina atraviesa la placenta y puede generar daño al producto de la gestación que se puede catalogar de la siguiente forma:
- a.
Embriopatía: se produce cuando se da entre el periodo de la organogénesis del primer trimestre. Se describen hallazgos como hipoplasia del puente nasal, obstrucción de coanas y condrodisplasia punteada. La patogenia se relaciona posiblemente con la alteración en la síntesis de la osteocalcina y la proteína de matriz GIa que modulan el depósito de calcio11,12.
- b.
Alteraciones en el sistema nervioso central: ocurren cuando se da más allá del primer trimestre. Se describen agenesia del cuerpo calloso, atrofia óptica y cerebral, ceguera, microcefalia, malformación tipo Dandy-Walker y bajo coeficiente intelectual13.
- c.
Efectos hemorrágicos: en la vida intrauterina hay disminución de los niveles de factores de coagulación vitamina k dependientes, inmadurez hepática y disminución de la unión de warfarina a la albúmina (desplazada por la bilirrubina)14, efectos que en conjunto aumentan el efecto anticoagulante de la warfarina en el feto. Este hecho explica que a pesar de un INR adecuado materno, el efecto fetal no se correlacione con este y la alta posibilidad de sangrados fetales, en especial si el parto es vaginal.
Salazar et al.8 reportaron efectos sobre el producto de la gestación casi hasta del 30% cuando se usó warfarina, bien desde el segundo trimestre o durante toda la gestación. Posteriormente, con el refinamiento y el análisis genético de los casos, en 2001 el mismo grupo9 reportó un porcentaje de embriopatía del 4,1%, el cual sería aún más bajo según los datos de los registros más recientes como el ROPAC, en el que sitúan la frecuencia de embriopatía y fetopatía en 2% y 1,4%, respectivamente4.
Pero la warfarina no solo se asocia a efectos teratogénicos, fetopáticos o hemorrágicos, sino que las pérdidas gestacionales tempranas (aborto) y tardías (mortinato) son mayores que las reportadas con tratamientos basados en heparina2,4,9, lo cual concuerda en la mayoría de las series. En 1986 y posteriormente en 2001 Salazar et al.8,9 documentaron aborto hasta en el 26% de las gestaciones que usaron warfarina vs. 15% en aquellas que no lo hicieron. El registro ROPAC documentó que el uso de warfarina en el primer trimestre se asoció a aborto en 28% de los casos, casi tres veces mayor que la asociada al uso de heparina. Igualmente, el reporte de mortinatos fue del 7% para warfarina vs. 0,7% para heparina4.
Riesgo del tratamiento con heparina para la madreLa trombosis valvular es la principal complicación materna relacionada con una inadecuada anticoagulación con alta morbimortalidad2,4. Dos metaanálisis publicados en 2017, concuerdan en que los protocolos con heparina no fraccionada (HNF) o de bajo peso molecular (HBPM), se asocian con mayor trombosis valvular (8%) y mortalidad materna (5%) que los tratamientos que usan warfarina en la gestación, bien sea durante toda la gestación con presencia de trombosis valvular del 2,7% y de mortalidad materna del 0,9% o como parte de tratamiento secuencial con heparina en el primer trimestre y warfarina en el segundo y tercer trimestre, con mortalidad materna del 2% y trombosis del 5%15,16.
Los cambios fisiológicos de la gestación como aumento de la filtración glomerular, volumen sanguíneo y depuración renal, hacen que aumente la excreción de las HBPM, lo que modifica su farmacocinética y su efecto anticoagulante al compararse con un estado no grávido, de tal forma que es necesario monitorizar sus efectos a través de la actividad del factor Xa17. Estudios experimentales han mostrado que para mantener niveles terapéuticos de actividad del factor Xa, a las 4 horas de aplicación de la heparina (niveles pico) durante la gestación, la dosis debe incrementarse casi un 54% (dosis final de 1,6mg/kg cada 12 horas) cuando se compara con una dosis estándar fija de 1mg/kg cada 12 horas18. Igualmente, se ha mostrado que a las 8 horas de aplicación de la HBPM los niveles de actividad del factor Xa pueden ser subterapéuticos hasta en 20% de los pacientes, por lo que algunos proponen dividir la dosis cada 8 horas19. Ciertos estudios que han usado HBPM durante la gestación, han mostrado trombosis valvular y mortalidad materna secundaria, a pesar de monitorizar los niveles pico de actividad Xa20. Esto llevó a una advertencia por parte de la FDA sobre el uso de esta medicación en anticoagulación de válvula mecánica en la gestación21. Una posible razón del porqué a pesar de la monitorización de la actividad pico del factor Xa se presenta trombosis valvular, proviene de estudios que muestran que no hay relación entres los niveles pico de actividad y los niveles valle (medidos 1 a 2 horas antes de la siguiente dosis), los cuales pueden ser inadecuados hasta en un 70% de los pacientes pese a niveles pico adecuados; por consiguiente podría ser necesario no solo monitorizar los niveles pico, sino también los valle22
Con base en esta evidencia la Sociedad Europea de Cardiología emite una recomendación en contra (recomendación III, nivel de evidencia C) del uso de heparina de bajo peso molecular en presencia de válvula mecánica en la gestación a menos que se monitorice la actividad del factor Xa6.
Con relación a la HNF, esta muestra una alteración en la biodisponibilidad durante el embarazo, de ahí que se necesiten mayores dosis y sea más difícil mantener el efecto anticoagulante cuando se administra por vía subcutánea; esto se debe al aumento en la unión a proteínas -factor de Von Willebrand-, alteraciones en el volumen plasmático, en la depuración renal y en la degradación placentaria de la heparina, por lo que pueden llegar a necesitarse dosis mayores a 35.000 U/día2,10. Salazar et al.9 reportaron que el uso de HNF subcutanéa se asoció con abortos en el 37% de los casos, hecho similar al hallado con warfarina y que se explica por la posibilidad de hemorragias en la unión uteroplacentaria. Lo anterior sumado a la posibilidad de osteoporosis ̈cuando se usa por más de 1 mes, y de desarrollar trombocitopenia inducida por heparina, hace que en la actualidad la heparina no fraccionada solo se use como terapia intravenosa por periodos cortos, bien sea durante el primer trimestre como parte de protocolos secuenciales o en el periodo periparto23.
Áreas de controversiaDosis bajas de warfarina – (menor o igual a 5mg)- vs. dosis alta de warfarina- > 5 mg- y los efectos sobre el producto de la gestaciónEn 1999, Vítale et al.24 sugirieron que los efectos nocivos de la warfarina sobre el producto de la gestación dependían de la dosis usada. En un registro de 58 gestaciones en 43 pacientes con válvulas mecánicas a los largo de 10 años se compararon aquellas gestaciones que usaron warfarina 5mg o menos al día durante toda la gestación (bajas dosis) con las que usaron warfarina a una dosis > 5mg al día (alta dosis) para lograr INR terapéutico. Se encontró ausencia de embriopatía, 12% de abortos y ningún mortinato en el grupo de bajas dosis vs. 8% de embriopatía, 72% de abortos y 4% de mortinatos en el grupo de alta dosis. El mismo grupo publicó tres años después25 otro estudio que mostró que la variable que se relacionaba con un desenlace gestacional adverso (aborto, mortinato, embriopatía o fetopatía) era el uso de warfarina a altas dosis (> 5mg), sin importar si era primigestante o multípara.
Estos estudios han sido la base para que se recomiende en las guías americanas y europeas (recomendación II, nivel de evidencia A)6,26 el uso de warfarina a bajas dosis durante toda la gestación. Sin embargo, no todos los estudios han mostrado ausencia de riesgo con dosis bajas de warfarina. Pillay et al.27 en su estudio de 62 gestaciones en portadoras de válvula mecánica, encontraron embriopatía por warfarina en 5% de las madres expuestas durante el primer trimestre a este medicamento con una dosis diaria inferior o igual a 5mg. Igualmente, el registro ROPAC no encontró diferencias en el número de abortos o mortinatos en pacientes que recibieron dosis altas o bajas4. Por tal razón los metaanálisis publicados recientemente hacen un llamado a ser cautos con el uso de warfarina (aún a bajas dosis) en la gestación, dado que no hay una dosis mínima libre de riesgos y que su uso en todos los casos debe hacerse luego de una asesoría adecuada y del consentimiento escrito de la paciente15,16.
Monitorización pico y valle de la actividad factor XaLa monitorización de la actividad del factor Xa es imperativa si se desea usar HBPM. Dado que los niveles pico no se relacionan con los niveles valle, los cuales puede ser subterapéuticos hasta en 70% de los casos22 hecho que podría explicar los casos de trombosis valvular a pesar de niveles pico adecuados20, algunos expertos recomiendan la mediciones de niveles picos y valle de forma obligatoria cuando se usa HBPM y no solo los niveles pico22. Sin embargo, no hay estudios que comparen las dos estrategias de monitoreo por lo que la recomendación emitida por las sociedades científicas se limita a recomendar la medición de niveles pico6,26.
Protocolos de anticoagulaciónSe describen tres protocolos de anticoagulación en la actualidad que podrían ser usados:
- a.
Warfarina dosis baja (5mg/día) durante toda la gestación y cambio a heparina al término.
- b.
HBPM durante toda la gestación con medición obligatoria de actividad del factor Xa.
- c.
Secuencial: uso de heparina (HBPM o HNF IV) durante el primer trimestre, con posterior uso de warfarina durante el segundo y tercer trimestre y cambio a heparina al término.
El protocolo de warfarina a dosis baja (5mg /día) busca reducir las complicaciones tromboembólicas maternas, minimizando la posibilidad de efectos adversos fetales, sin que en la actualidad exista una dosis mínima 100% segura para el producto de la gestación. Con este esquema el riesgo combinado de complicaciones materno-fetales está alrededor del 20%16. En este esquema la warfarina se usa durante toda la gestación y solo en el momento del parto se cambia a heparina en infusión.
Un protocolo que solo usa HBPM durante todo el embarazo, busca primordialmente la seguridad del producto de la gestación, dado que al no cruzar la placenta no produce efectos teratogénicos. Sin embargo, el riesgo de complicaciones tromboembolicas es más alto, y existe posibilidad de muerte materna y fetal de forma secundaria, así que el riesgo combinado de complicaciones materno-fetales está alrededor del 25%16. Como se ha mencionado previamente, es obligatoria la monitorización de actividad del factor Xa 4 horas luego de su aplicación –niveles pico- y sería ideal también monitorizar los niveles 1-2 horas antes de la siguiente aplicación –niveles valle22.
Un protocolo secuencial es aquel que usa heparina ya sea fraccionada intravenosa o HBPM durante el primer trimestre, con miras a evitar los riesgos teratogénicos, con posterior uso de warfarina durante el segundo y tercer trimestre para reducir así las complicaciones tromboembólicas. Se ha descrito que casi el 40% de los eventos de trombosis valvular se producen durante el periodo de transición de un esquema a otro28, tal como ocurrió en 2 de los 5 casos de la serie colombiana10, con un riesgo combinado de desenlaces adversos materno –fetales del 30%16, de modo que se recomienda que se haga de forma intrahospitalaria. En países de bajos o medianos ingresos un protocolo secuencial podría balancear mejor tanto los riesgos maternos-fetales como las restricciones económicas, por lo que sería recomendable, como se sugiere en publicaciones recientes15, pese a que no existan estudios que comparen los diferentes protocolos en esos escenarios.
Sin embargo, en la actualidad no hay ningún protocolo que se asocie a un riesgo nulo para la madre o el producto de la gestación de forma simultánea y al no existir estudios que comparen estas diferentes modalidades, la elección depende de diversas variables (Ej. geográficas, económicas, de infraestructura del hospital) que hagan más o menos difícil el acceso a la monitorización de la anticoagulación. En este contexto (evidencia no concluyente a favor de alguna intervención) cobra importancia la percepción subjetiva que tanto la madre como el médico tengan sobre cuál riesgo es más aceptable (trombosis valvular vs. pérdida gestacional vs. embriopatía y/o fetopatía), lo cual puede estar influenciado por factores no medibles (experiencia previa del médico o la paciente, pérdidas gestacionales previas, temor del médico, temor de la madre) pero que inclinarán la balanza hacia algún protocolo en particular, efecto conocido como Rashomon29.
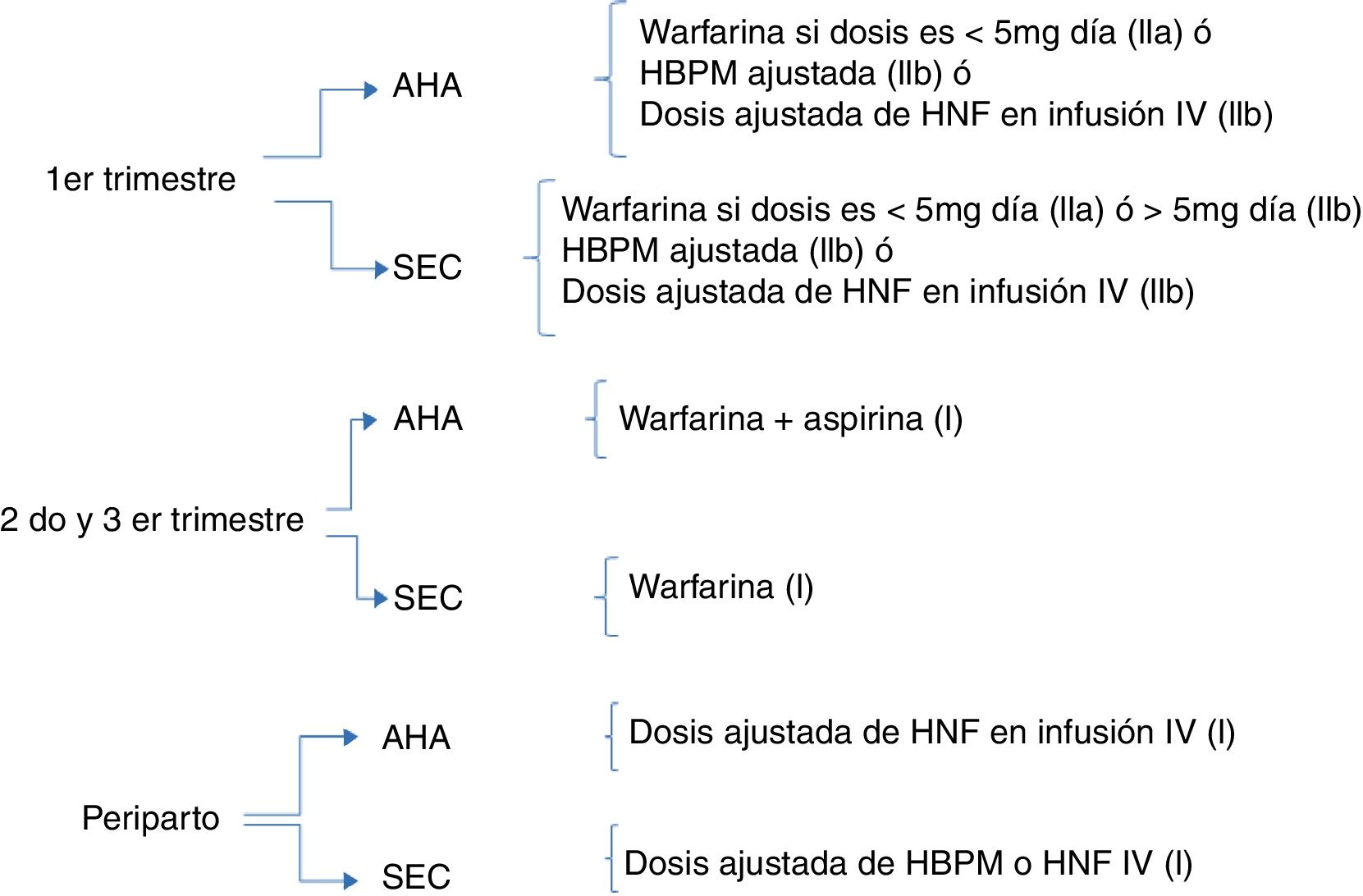
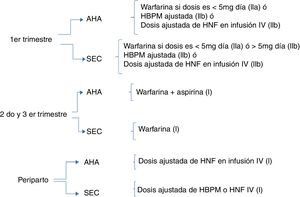
Recomendación de las guías y los expertosEn la figura 1se presenta la recomendación comparativa que da la Sociedad Europea de Cardiología (SEC) y la Asociación Americana del Corazón (AHA).
Se destaca que la mayor posibilidad de variación está en los protocolos durante el primer trimestre. Ambas sociedades dan a las dosis bajas de warfarina una recomendación mayor (IIa) que al uso de heparina no fraccionada o de bajo peso molecular (IIb) durante el primer trimestre disminuyendo los desenlaces adversos maternos, pero como se ha mencionado previamente aún las dosis bajas de warfarina se han asociado a efectos embriopáticos, hecho que siempre deberá ser explicado de forma clara a la madre.
En el segundo y tercer trimestre hay acuerdo en el uso de warfarina asociado o no con aspirina, la cual podría usarse en condiciones de alto riesgo trombótico (ej: válvulas de primera-segunda generación, trombosis valvular previa, doble cambio valvular, válvulas en posición derecha).
En el periodo periparto es necesario tener en cuenta junto con la paciente y el grupo obstétrico variables como el modo de parto (cesárea o vaginal), el método de inducción y el uso de analgesia o anestesia regional. Si se planea la vía vaginal deberá suspenderse la warfarina en la semana 36 de gestación17 y reemplazarse con un protocolo de heparina (HNF o HBPM) con adecuada monitorización. La HBPM debería cambiarse a HNF al menos 12-24 horas antes del parto. La heparina no fraccionada deberá suspenderse 4-6 horas antes del parto y reiniciarse 4–6 posteriores si no hay complicaciones de sangrado. En caso de anticipación del trabajo de parto en una paciente bajo efectos con warfarina, se debe recordar que el feto está anticoagulado de ahí que existe riesgo de hemorragia intracraneal en caso de un parto vaginal y por tanto debería realizarse una cesárea electiva9.
Expertos como el Dr. Elkayam de la Universidad del Sur de California han implementado protocolos de anticoagulación basados en el riesgo trombótico valvular22 (fig. 2).
Se consideran pacientes de alto riesgo trombótico aquellas que tienen válvulas de primera generación en posición mitral, válvulas en posiciones derechas, historia de eventos trombóticos previos y fibrilación atrial. En estos casos se recomienda el uso de warfarina durante toda la gestación o un protocolo secuencial de heparina en el primer trimestre seguido de warfarina en el segundo y tercer trimestre30. Se consideran pacientes de bajo riesgo aquellas con válvulas mecánicas de segunda y tercera generación en cualquier posición, en cuyos casos puede usarse heparina de bajo peso molecular durante toda la gestación, siempre y cuando se monitoricen los niveles de actividad pico y valle del factor Xa30.
Aunque esta aproximación resulta atractiva, en especial para los grupos de bajo riesgo, no ha sido estudiada y comparada con otros protocolos, enfatizando que es necesaria la medición estricta de los niveles pico y valle de la actividad del factor Xa, hecho que por razones económicas puede no ser aplicable en todas las instituciones o en sitios de baja complejidad.
Elección valvularLa elección del mejor tipo de prótesis valvular en una mujer en edad reproductiva es compleja. Si bien las prótesis valvulares biológicas obvian la necesidad de anticoagular, estas tienen mayor riesgo de deterioro estructural, visto hasta en el 50% de las mujeres entre 16-39 años de edad al final de la primera década de la cirugía31 y que es mayor para las prótesis mitrales –siete veces más- que las aórticas o tricúspides32. De otra parte, la necesidad de una reintervención puede tener un incremento de la mortalidad hasta del 9%32. Una prótesis mecánica tiene la ventaja de una mayor durabilidad pero obliga a estar anticoagulado, lo cual adquiere más relevancia en el estado hipercoagulable del embarazo. Las prótesis de nueva generación (doble disco móvil) constituyen un gran avance ya que son menos trombogénicas que las iniciales y como se mencionó previamente en el protocolo del Dr. Elkayam30 podrían ser manejadas con heparina de bajo peso molecular siempre que se monitoricen los niveles pico y valle.
Una estrategia para orientar hacia la elección valvular, fue la propuesta por De Santo et al.33, en su estudio piloto con 22 mujeres en edad reproductiva que no estaban embarazadas y tenían valvulopatía aórtica no susceptible de reparación. Se realizó un protocolo de anticoagulación con warfarina y se evaluó quienes lograban un INR en metas (se eligió 1,5-2,5) con dosis bajas – 5mg o menos- y para quienes requerían dosis altas – más de 5mg día. En aquellas que se anticoagularon con dosis bajas (17 pacientes) se implantó una válvula mecánica y para aquellas que necesitaron dosis altas (5 pacientes) se propuso una válvula biológica. En las portadoras de válvula mecánica anticoaguladas con warfarina a bajas dosis no se registraron complicaciones materno-fetales en la gestación.
Este trabajo es pionero al intentar guiar la elección valvular en mujeres en edad reproductiva con base en la dosis de warfarina, pero solo se debe considerar como generador de hipótesis dado que únicamente aplicó para valvulopatía aórtica y además se escogió una meta de INR baja, que no es la recomendada en las guías de manejo de valvulopatía26.
ConclusionesLa gestación en presencia de una válvula mecánica, debe ser considerada siempre de alto riesgo y ser tratada de forma multidisciplinaria en instituciones de alto nivel de complejidad. No hay ningún régimen de tratamiento seguro 100% para la madre o el producto de la gestación de forma simultánea, aunque está claro que no se debe usar HBPM sin adecuada medición de los niveles de actividad del factor Xa en el pico (4 horas post aplicación) e idealmente también de niveles valle (1-2 horas antes de la siguiente dosis). Ante la ausencia de estudios comparativos entre los diferentes protocolos de anticoagulación, la elección que encuentre el mejor balance de riesgo materno-fetal, dependerá de variables económicas, geográficas, de infraestructura de las instituciones además de la subjetividad que tanto el médico como la paciente tengan sobre los beneficios y riesgos de cada uno.
Conflicto de interesesNinguno.
Al Grupo de Cardiología y Hemodinamia de la Clínica Colombia.