El cierre percutáneo de la orejuela izquierda se ha desarrollado como una alternativa terapéutica en pacientes con fibrilación auricular que tienen contraindicaciones para anticoagulación prolongada; también para aquellos que no logran anticoagulación adecuada ya sea por deserción, percepción de alto riesgo para sangrado, intolerancia a los anticoagulantes orales o anticoagulación difícil de controlar, pero también, cuando hay de riesgo alto de hemorragia como en la concurrencia de stent coronarios y cuando existen contraindicaciones racionales como riesgo elevado de caídas. Las imágenes de ecocardiografía algunas veces complementadas con tomografía computarizada, son las más importantes para las precisiones anatómicas necesarias al seleccionar el dispositivo correcto y guiar su instalación endovascular.
The percutaneous closure of the left atrial appendage has been developed as a therapeutic alternative in patients with atrial fibrillation and have contraindications for prolonged anticoagulation. It can also be for those that do not achieve adequate anticoagulation, not only due to abandonment, a perception of high risk of bleeding, an intolerance to oral anticoagulants, or difficult to control anticoagulant, but also when there is a high risk of haemorrhage, as can occur in coronary stents, and when there are rational contraindications, such as a high risk of falls. The echocardiography images, sometimes complemented with computed tomography, are most important for the anatomical precision required for choosing the correct equipment and as guide for endovascular implantation.
La fibrilación auricular es la arritmia cardíaca más común y clínicamente relevante, cuya incidencia global es cercana al 2% en la población general, con tendencia a aumentar con la edad, dato que es similar en nuestro medio1,2. En 2010, la prevalencia global de fibrilación auricular se estimó en 33,5 millones de personas, cifra que se espera se duplique para el año 2050. Además, en las personas mayores de 40 años hay un 25% de riesgo de desarrollar fibrilación auricular durante el resto de la vida, lo que contribuye a que la prevalencia de fibrilación auricular aumente3. Ya sea paroxística, persistente o permanente, la fibrilación auricular aumenta cinco veces la incidencia de accidentes cerebrovasculares y la mortalidad4. Puede ser responsable del 15% de los infartos cerebrales y hasta del 30% de ellos en mayores de 80 años. En cifras concretas, al comparar los accidentes cerebrovasculares relacionados y no relacionados con fibrilación auricular, se estima que en los primeros hay un 30% más de mortalidad a 12 meses y mayor discapacidad neurológica permanente5,6.
El uso de la anticoagulación oral en pacientes con fibrilación auricular ha reducido la incidencia de accidentes cerebrovasculares en un 64%7 y la mortalidad en un 26% en pacientes tratados con warfarina8; sin embargo, el 40% de los pacientes que califican para anticoagulación no la reciben ya sea por deserción o por la percepción de alto riesgo de sangrado9, y los que reciben warfarina permanecen en rango terapéutico solamente entre el 50 y el 60% del tiempo, cuando se espera que lo estén en más del 70% del tiempo10. Recientemente, los anticoagulantes orales directos han ganado popularidad debido a su facilidad de uso y efectos anticoagulantes predecibles; sin embargo, tienen una tasa importante de interrupción a lo largo de 20 meses de seguimiento siendo tan alta como del 37%10,11. En pacientes anticoagulados correctamente persiste un riesgo residual de 2 a 5% de eventos cerebrovasculares tromboembólicos12.
El tratamiento a largo plazo con warfarina y anticoagulantes orales directos se asocia con riesgos de hemorragia mayor de 2,1 a 3,6% por año en ensayos clínicos recientes13,14. Aunque la hemorragia intracraneal es consistentemente más baja con los anticoagulantes orales directos, el riesgo general de hemorragia mayor no disminuye con dabigatrán o rivaroxabán en comparación con la warfarina14,15 pero con apixabán hubo menor tasa de sangrado mayor13.
Las escalas de riesgo CHADS2 y CH2DS2-VASC16 predicen bien el de riesgo de accidente cerebrovascular, en tanto que la HAS-BLED17 predice el riesgo de sangrado, permitiendo claras decisiones cuando hay escala alta de uno y baja del otro, pero en los balances intermedios y especialmente cuando los índices son altos en ambas el “beneficio neto” se pierde18 y el riesgo de sangrado puede ser no asumible.
Las contraindicaciones para anticoagulación formal son en general sangrado activo, historia de sangrado intracerebral, falla hepática, deficiencia cognitiva severa. En particular para warfarina es contraindicación relativa la necesidad concurrente de asociar antiplaquetarios cuando hay stent coronarios. Adicionalmente, los anticoagulantes orales directos se contraindican también en insuficiencia renal avanzada con ClCr<15ml/min y no han sido validados para uso en prótesis valvular mecánica ni en estenosis mitral severa. Racionalmente se contraindica la anticoagulación en pacientes con alto riesgo de caídas y de trauma pero también si hay reiterada falla de adherencia al tratamiento medicado.
Hay evidencia que el 90% de los trombos que conllevan a embolia cerebrovascular en pacientes con fibrilación auricular se forman en la orejuela izquierda19,20; Por este motivo, la oclusión o exclusión percutánea de la auriculilla izquierda en pacientes con fibrilación auricular no valvular con alto riesgo de sangrado, surge como alternativa terapéutica.
Desarrollo de dispositivos para oclusión de la orejuela izquierdaEn 1996, Blackshear et al.21,22 revisaron 23 estudios separados de pacientes con fibrilación auricular y encontraron que en 222 de 1.288 pacientes con fibrilación auricular no reumática se habían documentado trombos en el atrio izquierdo, 91% de los cuales estaban en la auriculilla.
Posteriormente, en 2003, publicaron sus experiencias de la exclusión mecánica de la auriculilla sin invasión cardíaca, hechas en un grupo de pacientes con riesgo alto de ictus y con contraindicación absoluta para anticoagulación: Ocluyeron la auriculilla izquierda, exitosamente, en 14 de 15 pacientes, a través de toracoscopia y pericardiostomía, con “cinchado” del cuello del apéndice auricular mediante un asa o alternativamente con grapadora. El seguimiento por 8 a 60 meses mostró una tasa de 5,2% de ictus por año.
De otra parte, García-Fernández et al.23, estudiaron de manera retrospectiva 205 pacientes con cambio mitral por prótesis mecánica o biológica, anticoagulados o antiagregados, y hallaron un 85% de reducción de riesgo de embolia en aquellos 58 pacientes a quienes, durante el procedimiento de reemplazo mitral, se les había hecho también exclusión quirúrgica de la auriculilla.
Por otro lado, Nakai et al.24 comprobaron la seguridad de los primeros procedimientos de cierre de orejuela izquierda en modelos caninos por vía endovascular, pasando a través del septum interauricular y evidenciaron endotelización total del dispositivo después de tres meses. Posteriormente, Sievert et al.25, realizaron el primer ensayo clínico en humanos (n=15) con el dispositivo PLAATO®, con una tasa de éxito de implante del 100%. En 4 casos se cambió medida del dispositivo y se reportó un solo paciente con complicaciones (hemopericardio).
En el estudio multicéntrico de Ostermayer et al.26 en 111 pacientes, se reportó una tasa de éxito de implante del 97,3% y se describieron algunas complicaciones asociadas al procedimiento como taponamiento cardíaco posterior a la punción transeptal, trombos en la auriculilla al momento del implante, complicaciones en la vía de acceso, cierre incompleto de la auriculilla y accidentes cerebrovasculares transitorios. Otras complicaciones reportadas han sido la trombosis del catéter al momento de liberar el dispositivo, así como perforación de la auriculilla y de la pared posterior de la aurícula derecha, además de eventos cerebrovasculares e incluso migración del dispositivo27,28.
De estos primeros ensayos clínicos se pudo concluir que el procedimiento de cierre de orejuela izquierda por vía percutánea era factible con alto éxito en el implante aunque pudieran presentarse complicaciones. Además, se entendió que eran necesarias una mejor aproximación imagenológica, con mediciones exhaustivas de la auriculilla y planificación multimodal para evitar el sobre o infradimensionamiento de los dispositivos.
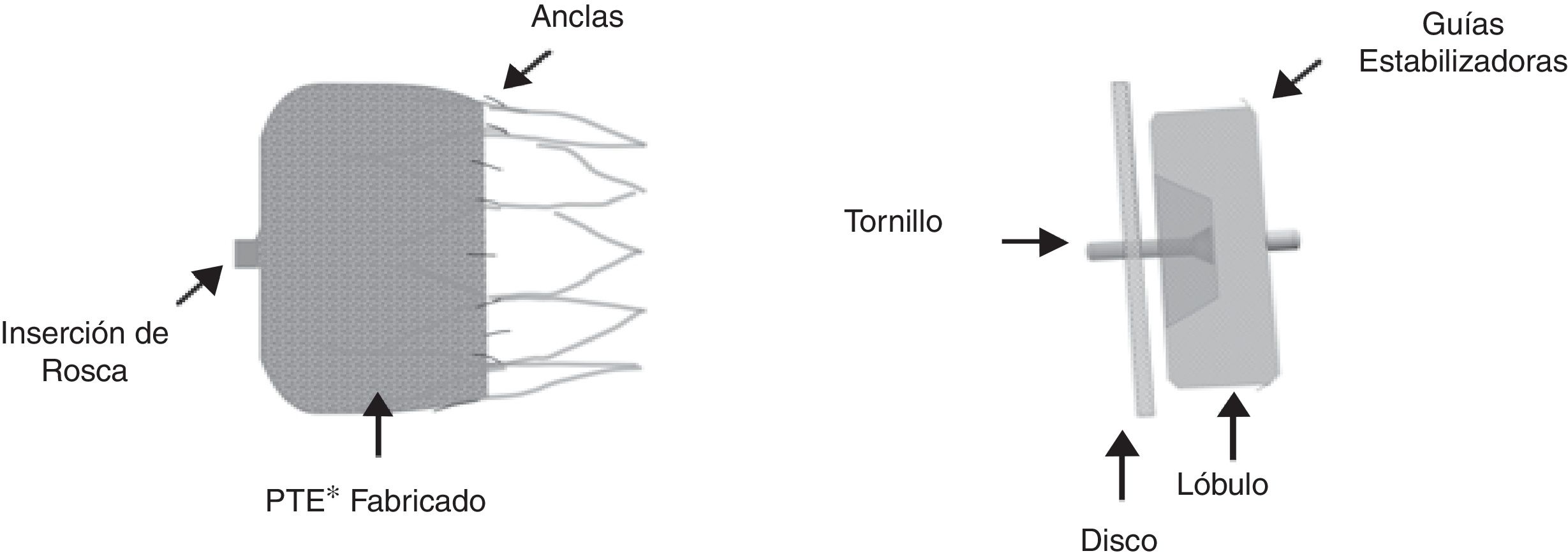
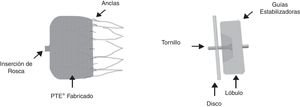
El PLAATO® (de Appriva Medical Inc., Sunnyvale, California) introducido en la práctica médica en 2001, fue retirado del mercado en 2006 al parecer por razones comerciales. Actualmente, en Colombia se cuenta con los dispositivos WATCHMAN® (Boston Scientific, Maple Grove, MN) que recibió la CE Mark en 2005 y fue aprobado por la FDA desde marzo 2015, y el Amplatzer Cardiac Plug® (ACP) (St. Jude Medical, Minneapolis, MN) con CE Mark en 2005 y su sucesor, el AMULET® con CE Mark 2013 (fig. 1).
El dispositivo WATCHMAN® tiene evidencia avalada por dos estudios aleatorizados: el PREVENT fibrilación auricular29 y el PREVAIL30. Agrega valor el estudio observacional ASAP31, porque provee evidencia de bajo riesgo de tromboembolia y sangrado pese a que los pacientes fueron medicados únicamente con antiplaquetarios después de instalado el oclusor. El estudio EWOLUTION32, evidenció éxito de instalación cercana al 95% y una disminución favorable de la tasa de eventos adversos relacionados con el procedimiento, que finalmente llevó al WATCHMAN® a ser aprobado en 2015 por la FDA para su comercialización.
Un metaanálisis publicado por Holmes et al.33 que incluyó 2.406 pacientes de seguimiento de los estudios PRoTECT fibrilación auricular y PREVAIL, así como de los registros CAP1 y CAP2 con seguimiento promedio de 2,69 años, encontró que los pacientes con fibrilación auricular no valvular tratados con WATCHMAN® y su protocolo, tenían menos tasa de accidentes cerebrovasculares hemorrágicos (0,15 vs. 0,96/100 pacientes/año), menor tasa de muerte cardiovascular, y así como menor tasa de hemorragias mayores (las no relacionadas con el procedimiento) comparado con los tratados únicamente con warfarina. El conjunto de todas las causas de accidente cerebrovascular o embolia sistémica fue similar al del grupo de warfarina. Hubo más accidentes cerebrovasculares isquémicos en el grupo de WATCHMAN® (1,6 vs. 0,9 eventos/100 pacientes/año), lo cual puede reflejar la etiología variada de la tromboembolia.
Por otro lado, el Amplatzer Cardiac Plug® (ACP) (St. Jude Medical) y su evolución hacia el AMULET®, están fundamentados por los estudios retrospectivos no aleatorizados de 1.047 pacientes, llevado a cabo en 22 centros europeos y canadienses (The ACP Registry Study Group)34 que muestran éxito de implante comparable (97%) y perfil de seguridad similar con 5% de eventos mayores agudos. La tasa anual de tromboembolia sistémica y hemorragia mayor fue de 2,3 y 2,1% respectivamente con reducción de riesgo de 59 y 61%, con pretendida ventaja por menor tasa de parafugas.
Varias patologías embolígenas quedarían por fuera del beneficio de la oclusión de la auriculilla, entre otras los ateromas protruyentes del cayado aórtico; los ateromas y las placas ulceradas en el árbol arterial cerebral; la calcifiación del anillo mitral; las prótesis valvulares; la estenosis mitral severa; los trombos y masas intracavitarios atriales y ventriculares; la dilatación ventricular con bajo gasto; las cicatrices aneurismáticas del ventriculo izquerdo; el foramen oval permeable y la comunicación interauricular (que permitan embolia paradójica) sin dejar de mencionar las condiciones con trombofilia. Muchas de estas enfermedades se tratan con anticoagulación.
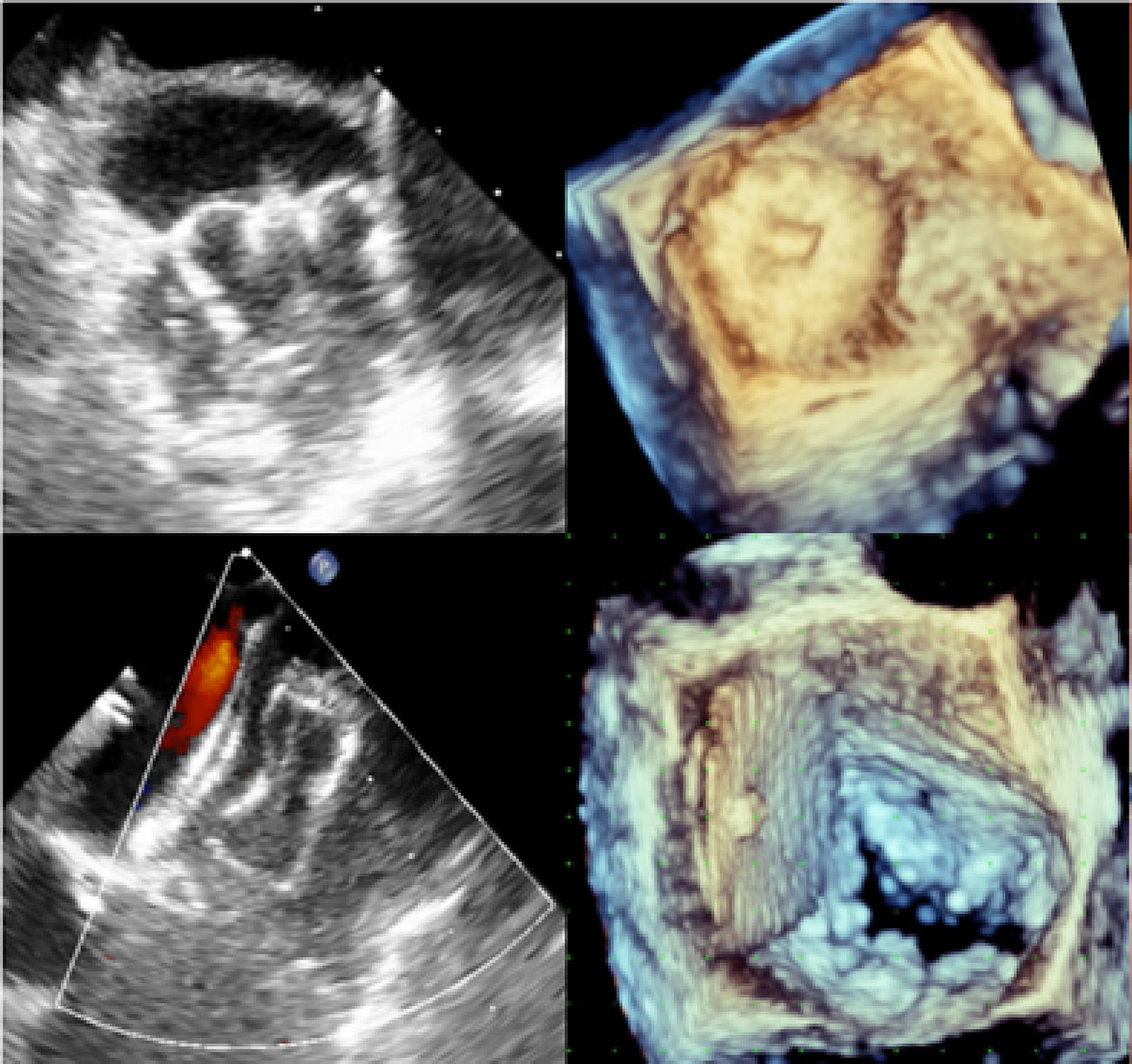
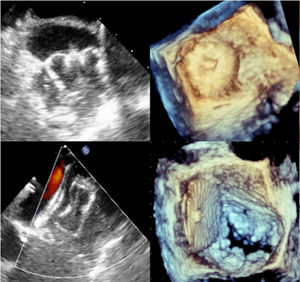
Evaluación imagenológica multimodalLa pregunta sobre qué imagen usar antes de realizar cierre percutáneo de la orejuela izquierda, fue respondida por 24 centros: 19 (79%) recomendaron la ecocardiografía transesofágica (ETE), 12 (50%) la ecocardiografía transtorácica, 8 (33%) la tomografía computarizada y 1 (4%) la resonancia magnética cardiaca35. En un estudio realizado por Nucifora et al., donde compararon el desempeño del ETE 2D y ETE 3D vs. TAC multicorte de 64X, evidenciaron superioridad del ETE 3D para medir las dimensiones de la LAA y el tamaño del orificio36. Sin embargo, el ecocardiograma transesofágico 2D sigue siendo la técnica de referencia para la pesquisa de trombos de LAA antes de su oclusión y para evaluar las dimensiones y morfología de LAA, así como también durante el procedimiento para realizar la punción transeptal.
Evaluación imagenológica previa al procedimientoAmbos dispositivos se instalan vía punción transeptal. El WATCHMAN® tiene forma de pera con un esqueleto de nitinol y cubierta parcial con tejido de tereftalato de polietileno que deja libres las barbas de fijación. Está disponible en tamaños de 21, 24, 27, 30 y 33mm de diámetro e iguales medidas en su profundidad. El Amplatzer ACP® tiene lóbulo y disco conectados por una cintura corta y flexible y estructura de nitinol cubiertos, ambos de poliéster (fig. 1).
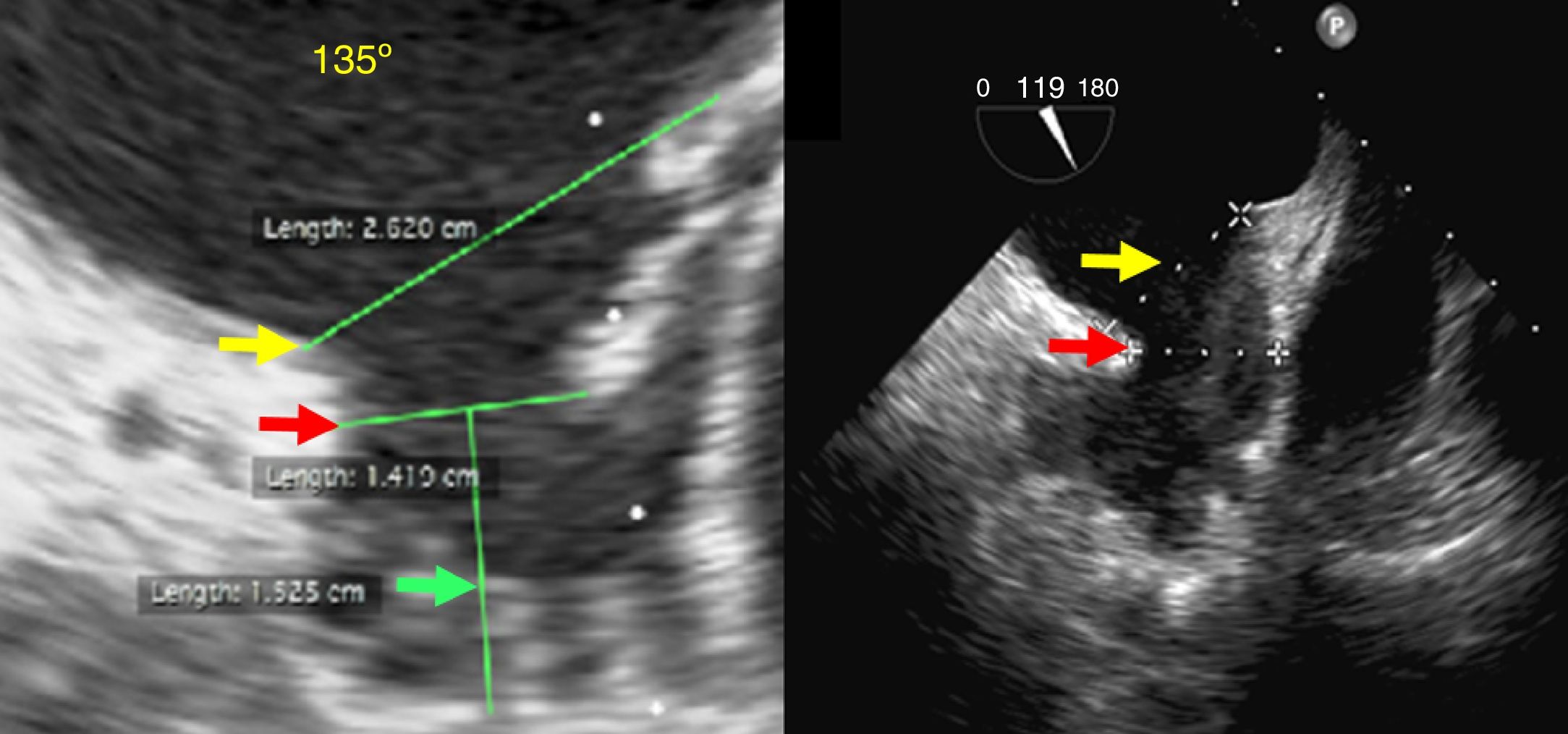
En el ecocardiograma diagnóstico se debe realizar una valoración anatómica en la que se determine el tipo de morfología que presenta la auriculilla (saco de viento, ala de pollo o brócoli) (fig. 2), definir las relaciones con la vena pulmonar superior izquierda y la arteria coronaria circunfleja, descartar trombos, realizar las mediciones correspondientes de su “ostium” o boca, así como la profundidad y distribución de los “lóbulos” (de gran importancia para el WATCHMAN®) y complementariamente las dimensiones del “anillo externo” o anillo de warfarina (enmarcado por el limbo mitral y por el ligamento externo o de Marshall); apreciar las particularidades del “cuello” (recinto entre el anillo externo y el ostium) y proponer una “zona de aterrizaje” (landing zone) de gran importancia para el dispositivo ACP/Amulet.
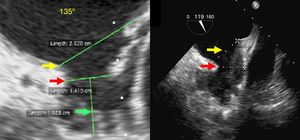
Formas de la auriculilla: (Izq) ala de pollo, (Der) brócoli: las más desafiantes para el implante de los dispositivos. Flecha amarilla: plano del anillo externo. Flecha roja: diámetro del ostium. Flecha verde: profundidad de la auriculilla (Grupo de Ecocardiografía de Occidente S.A.).
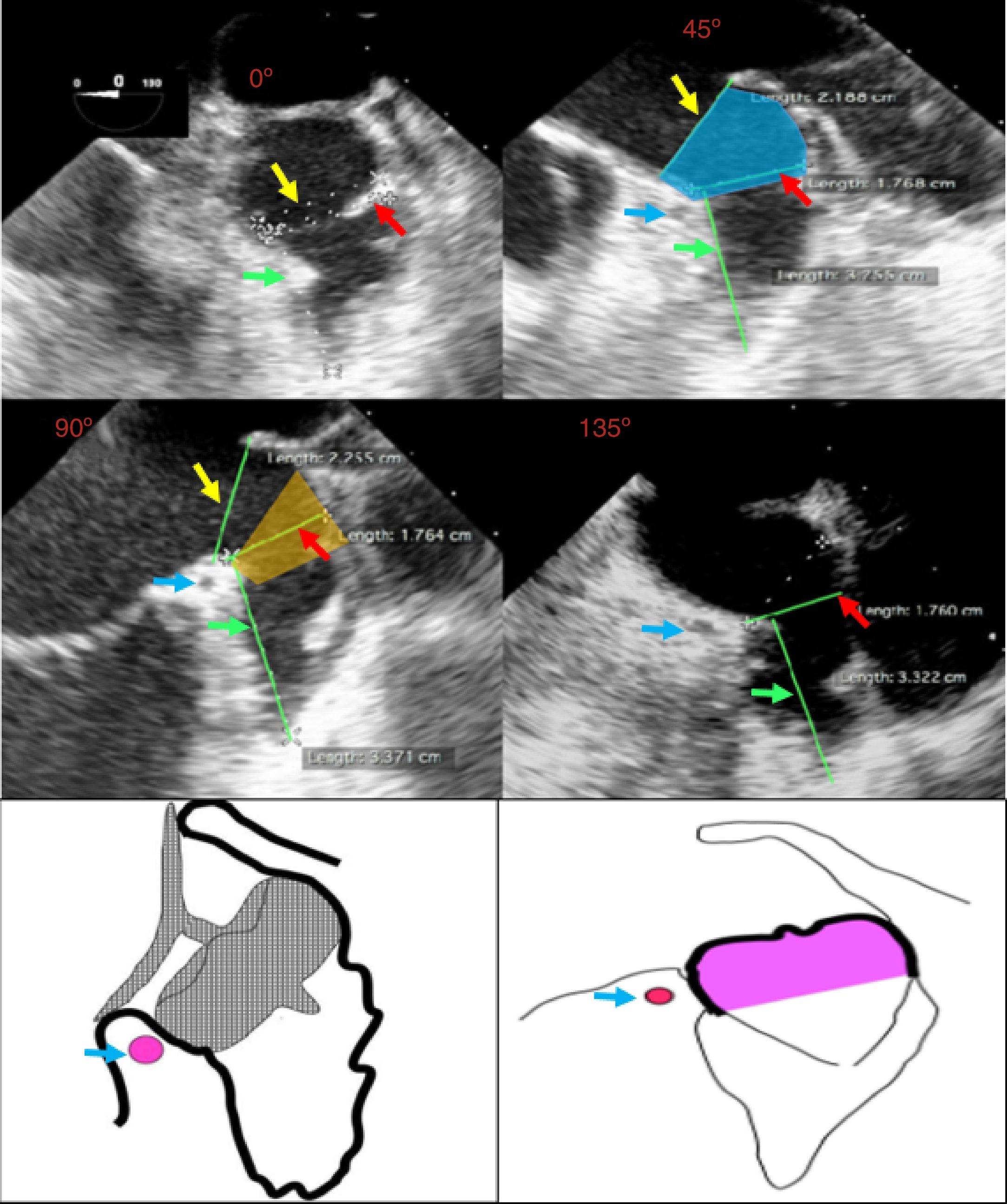
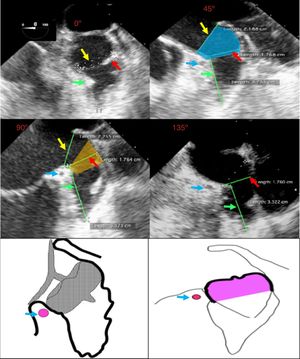
El ostium de la auriculilla puede tener diversas formas: circular, oval o elíptica. Se miden los diámetros de su plano, tomando como referencia la posición de la coronaria circunfleja proximal, y desde ese plano, se mide la profundidad. Se procura un barrido por múltiples ángulos (0°, 45°, 90° y 135°). El tamaño, la forma, el número y la disposición de lóbulos deben ser definidos (fig. 3). El mayor diámetro del ostium se obtiene por lo general en 135°, agulación en la que también se define mejor la variedad anatómica. La profundidad de la auriculilla se define mejor en angulaciones de 0°, 45° y 90°. En el evento de que sea insatisfactoria la caracterización anatómica por ecocardiograma transesofágico, se conseguirá con escanografía, procurando imágenes que correspondan a las usuales proyecciones de fluoroscopia.
Flecha amarilla: plano del anillo externo. Flecha roja: diámetro del ostium. Flecha verde: profundidad de la auriculilla. Flecha azul: arteria coronaria circunfleja. Proyección de 0°, 45°, 90° y 135°, que muestra las diferentes mediciones en las respectivas proyecciones. En la imagen de 45° se ilustra la localización del “cuello” (sombreado azul). En la imagen de 90° se ilustra la zona de aterrizaje (sombreado amarillo). En la parte inferior: esquemas de la posición de implante de los dispositivos Amulet (izq) y WATCHMAN® (der). (Grupo de Ecocardiografía de Occidente S.A.) (dibujos esquemáticos: cortesía Dr. Náder).
Se intenta demostrar la complejidad individual diversa de cada auriculilla (algunas con múltiples lóbulos), la profundidad axial, su orientación y disposición respecto a la silueta cardiaca buscando, con dedicación, imágenes de posibles trombos.
Es importante reconocer las formas de “ala de pollo” y brócoli” que son las más desafiantes para el trabajo del hemodinamista.
Con el dispositivo WATCHMAN® (fig. 4) la profundidad del lóbulo medido desde el ostium debe ser al menos igual a la dimensión transversal del dispositivo y éste se escoge sobredimensionando la medida en un 20%.
En el uso del ACP o Amulet, la profundidad de la auriculilla puede ser menor que el diámetro de la “zona de aterrizaje”. El “lóbulo de anclaje” del dispositivo debería quedar perpendicular al eje del “cuello” procurando que dos tercios de su aspecto medial queden distales a la arteria circunfleja y el aspecto lateral 10 - 12mm distante del ligamento de Marshall, ligamento que, junto al limbo mitral, enmarca el plano del anillo externo donde debe reposar el disco del dispositivo.
Ecocardiograma intraprocedimiento y criterios de liberación del dispositivoLa mejoría en las tasas de éxito de la oclusión y la disminución de los eventos adversos agudos se lograron perfeccionando las técnicas de punción transeptal, evitando embolia aérea, observando un escrupuloso manejo de la anticoagulación (ACT superior a 250 segundos) y obviando perforar estructuras especialmente vulnerables como la delgada pared de la auriculilla y estructuras contiguas, para lo cual es crucial la vigilancia del ecocardiografista.
Es conveniente recordar la correspondencia de la visualización del dispositivo mediante la técnica fluoroscópica y la técnica ecocardiográfica:
Angulación Eco 0°=fluro AP craneal; Eco 45°=ROA 30° craneal 20°;
Eco 90°=ROA 30°. Eco 135°=ROA 30° caudal 20°
La punción transeptal debe ser orientada por ecocardiografía en la vista bicava y en eje corto (a nivel de la válvula aórtica). Por lo general, el ecocardiografista espera que el hemodinamista retorne el catéter desde la vena cava superior procurando visualizar un “tenting”, deformación que cause en la fosa ovalis, donde el septum es usualmente delgado y avascular. Deben evitarse punciones en proximidades del borde aórtico anterior, relacionado con el seno transverso, al igual que cerca del borde posterior en el techo auricular donde hay pliegues del espacio pericárdico, para evitar así accidentes que pueden terminar en taponamiento pericárdico. Se prefiere una punción posterior e inferior, que facilita un acceso axial a la auriculilla. Llegar por un foramen oval permeable puede funcionar bien en algunos casos que tengan disposición favorable de la auriculilla, pero en general esto puede entorpecer y alargar el tiempo de procedimiento.
Durante el avance del WATCHMAN®, precedido por una guía cola de cerdo, se debe interrogar la auriculilla permanentemente. La angulación de 45°- 90° es útil para verificar la profundidad del catéter; las angulaciones alrededor de los 100-135° servirán para precisar en cuál lobulación se ha posicionado (se prefiere posición en lóbulos anteriores que facilitan la axialidad de implante).
Cuando el WATCHMAN® se posiciona en la auriculilla, se debe verificar su axialidad y antes de liberarlo se sigue la mnemotecnia PASS: Posición: adecuada en referencia a la arteria circunfleja y que su borde superior (hombro), no sobresalgan más de 5mm; Anclaje: se verifica haciendo una ligera tracción del dispositivo para asegurar que esté bien expandido y adosado a las paredes de la orejuela; Tamaño (Size): que el dispositivo se encuentre comprimido entre un 8 - 20% respecto al tamaño original; Sellado: evaluar ampliamente los bordes del dispositivo (0°, 45°, 90°, 135°) y verificar que todos los lóbulos de la auriculilla se encuentren excluidos. También se deben buscar parafugas (las que tienen menos de 3mm no se asocian con protrombosis y se pueden tolerar)37. De ser necesario, el dispositivo puede ser re-capturado de forma parcial o completa para ser reposicionado.
Con el ACP / Amulet, la profundidad de la auriculilla es menos exigente por cuanto el lóbulo de anclaje mide 10 - 12mm de fondo. El implante se califica como adecuado si cumple estos cinco signos:
- 1)
El lóbulo de anclaje debe tener forma de neumático con ligera compresión (no se debe ver suelto, flojo, ni en exceso deformado ya que estas dos situaciones condicionan el desplazamiento y la embolización del dispositivo).
- 2)
Debe haber separación entre el lóbulo y el disco.
- 3)
Se debe apreciar una deformación cóncava del disco.
- 4)
El lóbulo de anclaje en la zona de aterrizaje debe estar perpendicular al eje del cuello.
- 5)
El lóbulo de anclaje debe estar en zona de aterrizaje con su fondo dos tercios distal a la arteria circunfleja. Al igual que con el dispositivo WATCHMAN®, se debe evaluar la presencia de parafugas. Además, se debe confirmar que la posición del dispositivo, en particular el disco, no interfiera con estructuras vecinas como la válvula mitral o las venas pulmonares izquierdas. Se recomienda verificar que no haya derrame pericárdico al finalizar el procedimiento.
En general se indica, como protocolo, realizar seguimiento con ecocardiograma transesofágico a las 12 o 24 horas, 45 días y después a los 3 y 6 meses post-procedimiento para evaluar la posición del dispositivo, confirmar la ausencia de trombos intracardiacos y evaluar la afectación del septum interatrial. Además, se debe comprobar nuevamente por medio de doppler color (0°, 45°, 90° y 135°) la presencia de flujos residuales.
ConclusiónLa experiencia, la evolución del diseño y el perfeccionamiento de la técnica de oclusión con los dispositivos percutáneos de la auriculilla izquierda, han logrado reducir los eventos adversos agudos y mejorar los resultados a corto y largo plazo, ofreciendo una alternativa con beneficio positivo neto para pacientes con fibrilación auricular no valvular con indicación para anticoagulación, que por una u otra razón tienen contraindicaciones para la anticoagulación a largo plazo.
En particular, el ecocardiograma transesofágico resulta de vital importancia para definir la conformación del apéndice auricular (complementando en algunas ocasiones con tomografía computarizada), para planear y guiar la punción transeptal, la oclusión de la auriculilla y también para su seguimiento ulterior. Las conformaciones de “brócoli” y “ala de pollo” son las más desafiantes.
Conflictos de interésNinguno.