El ultrasonido intravascular en una herramienta de imagen complementaria a la angiografía coronaria para la evaluación de la enfermedad coronaria, que permite una visualización global de la placa aterosclerótica y tiene una aplicación clínica de suma importancia, pues ayuda a definir qué lesiones ameritan o no intervención cuando la angiografía coronaria por sí sola no es clara. De igual manera, permite optimizar las intervenciones coronarias, incluidas intervenciones en tronco, bifurcaciones y oclusiones crónicas, con el fin de disminuir la subexpansión o la malaposición de los stent y de esta manera minimizar eventos clínicos futuros como la trombosis y la restenosis de los stents. De forma adicional, permite realizar un análisis de la composición histológica de la placa aterosclerótica pudiendo identificar características de riesgo para eventos coronarios relacionados con esta.
Intravascular ultrasound (IVUS) is a complementary imaging tool to coronary angiography for the evaluation of coronary disease. It provides an overview of the atherosclerotic plaque and has a clinical application of considerable importance, as it helps to define whether or not lesions merit an intervention when coronary angiography on its own is not clear. Similarly, it helps to optimise coronary interventions, including those in the trunk, bifurcations, and chronic occlusions, with aim of decreasing the sub-expansion or poor positioning of the stent, and thus minimises future clinical events like thrombosis and the restenosis of the stents. Additionally, it helps to perform an analysis of the histological composition of the atherosclerotic plaque, on being able to identify risk characteristics for coronary events associated with the plaque.
La enfermedad coronaria sigue siendo la principal causa de muerte en el mundo1, hecho que ha llevado a un crecimiento del interés en la caracterización de la placa aterosclerótica por ser el substrato anatómico que da origen a las manifestaciones clínicas de la enfermedad coronaria. La angiografía coronaria tiene sus limitaciones ya que solo ofrece visualización en dos dimensiones y no de la pared vascular, subestimando así la extensión de la enfermedad; además, sufre de variabilidad interobservador. El ultrasonido intravascular (IVUS) es la primera modalidad de imagen para caracterización de la pared vascular y la placa aterosclerótica2,3.
Principios básicos del ultrasonido intravascularEl IVUS facilita la visualización de la pared arterial mediante un transductor miniatura en la punta de un catéter flexible, el cual emite una onda de ultrasonido entre los 10 y 40MHz, delineando la morfología de la placa y la distribución de esta, permitiendo así racionalizar y guiar las intervenciones coronarias percutáneas4.
Existen dos clases de catéteres: los de apertura mecánica y electrónica. El catéter mecánico tiene un solo transductor montado en la punta de un cuerpo flexible que rota a 1.800rpm y se puede avanzar y retirar para escanear la arteria; estos catéteres tienen frecuencia de ultrasonido hasta 40MHz, mientras que los de alta definición hasta de 60MHz. Los catéteres de apertura electrónica tienen 64 transductores pequeños, fijos en la circunferencia de la punta del catéter, que emiten una señal de baja frecuencia (20MHz), lo cual produce una baja resolución temporal y espacial pero sí mayor profundidad y no sufren la distorsión causada por una rotación no uniforme. Los catéteres actuales tienen una resolución axial de 100 micras y una resolución lateral de 250-300 micras aproximadamente5.
Para la interpretación de la imagen del IVUS se deben conocer las capas del vaso:
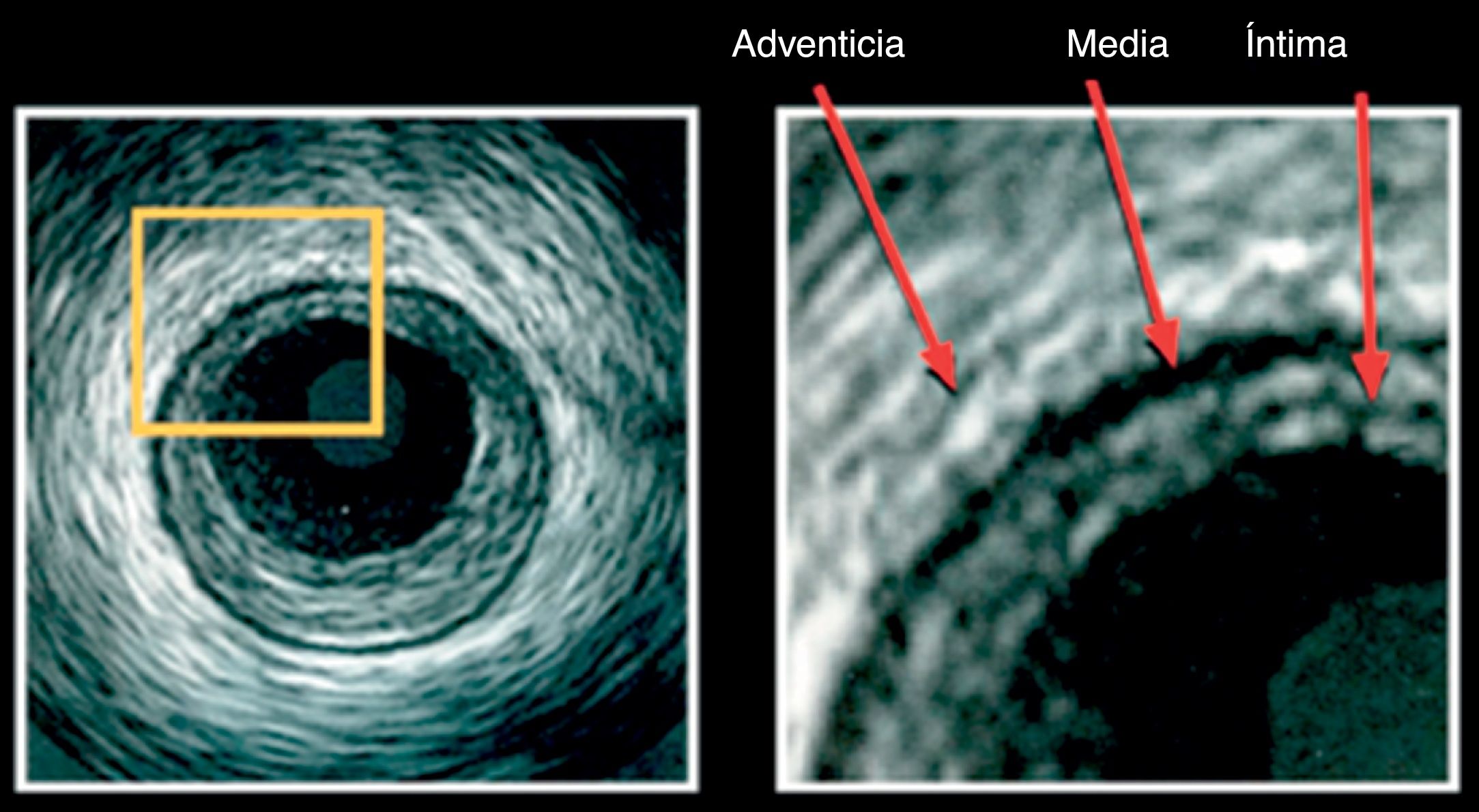
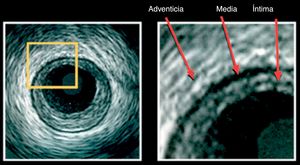
La íntima es la capa más interna que está en contacto directo con la luz; normalmente no tiene más de dos capas de células de grosor, es ecorreflectiva (color blanco) debido a la lámina elástica interna, pero adquiere importancia cuando la formación de la placa la separa de la capa media y se hace visible la lámina elástica interna (fig. 1).
En esta imagen se pueden observar las tres estructuras básicas en la imagen por IVUS “tres capas”. La capa en contacto con el lumen es la íntima; la media es la menos ecogénica y la adventicia es la capa más externa que la de mayor ecogenicidad.
Tomado de: Tools and Techniques: Intravascular ultrasound and optical coherence tomography. Eurointervention. 2012;7.
La capa media es la más gruesa, ecolúcida (color negro), compuesta principalmente por músculo liso y separada de la adventicia por la lámina elástica externa (fig. 1).
La adventicia está compuesta por tejido fibroso y da soporte al vaso (fig. 1).
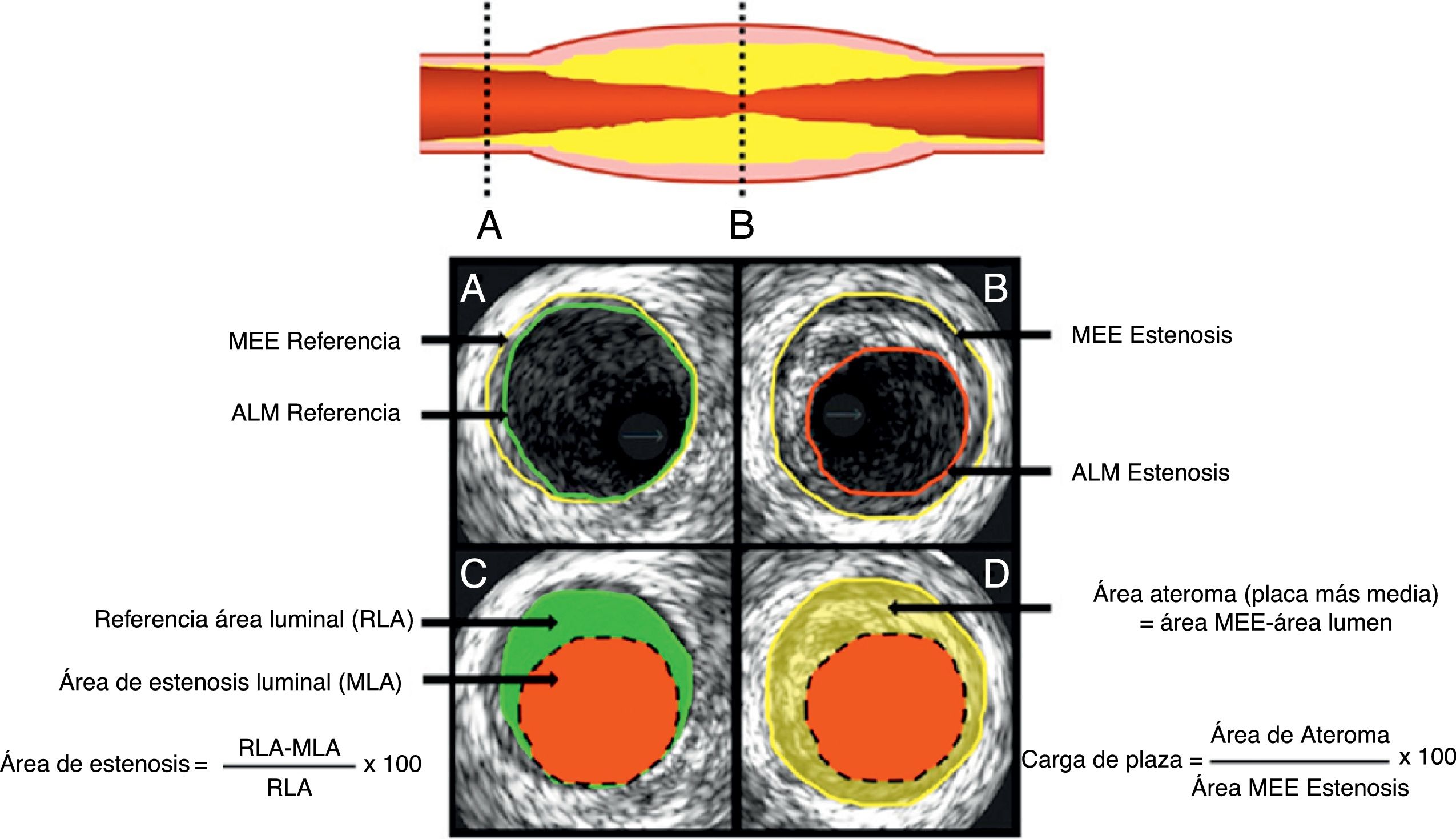
Medidas básicas en ultrasonido intravascularLas medidas en ultrasonido se toman con un sistema de planimetría computarizado, en diástole y en tres lugares distintos (fig. 2).
- -
Lugar de la lesión: lugar más crítico de la lesión coronaria, es decir la menor área luminal encontrada.
- -
Referencia proximal: lugar de mayor área luminal proximal a la lesión, en el mismo segmento arterial, distante hasta 10mm de la estenosis.
- -
Referencia distal: lugar de mayor área luminal distal a la lesión en el mismo segmento arterial, distante hasta 10mm de la estenosis.
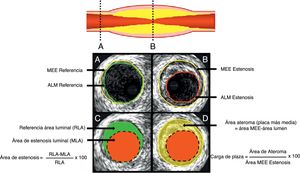
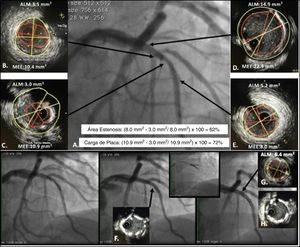
A. Segmento de referencia proximal. B, sitio de mayor estenosis Área luminal mínima (ALM). C, representa el cálculo del área de estenosis la cual compara el lumen de la estenosis con el lumen de referencia. D, representa la carga de placa que compara la estenosis del lumen con la lámina elástica externa MEE.
Tomado de: J Am Coll Cardiol Int. 2011;4:1155– 67.
Para cada uno de los tres lugares distintos se deben medir las áreas del vaso representadas por el área de la lámina elástica externa y las áreas del lumen arterial (fig. 2).
- -
Área total del vaso o área de la membrana elástica externa (MEE): área obtenida a partir del delineamiento de la transición entre las capas media y la adventicia en mm2.
- -
Área del lumen arterial: área obtenida a partir del delineamiento entre la sangre y la capa íntima; medida tanto en las referencias proximal y distal como en el sitio de la lesión.
- -
Área luminal de referencia (ALR): resultado del promedio de las áreas de referencias luminal proximal y distal.
- -
Área luminal mínima (ALM): obtenida a partir del delineamiento entre la sangre y la capa íntima en el sitio más estrecho de la lesión.
- -
Área de la placa más promedio: diferencia entre el área de la MEE y el área luminal.
- -
Carga de placa (%): área de la placa más promedio dividido en el área de la MEE multiplicado por 100.
- -
Área de estenosis: se obtiene de restar el ALM en la estenosis al ALR y dividirla por este.
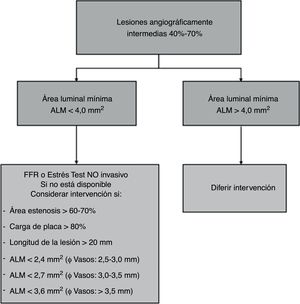
El IVUS permite caracterizar lesiones angiográficas intermedias (40 a 70%) para definir si requiere o no intervención, optimizar el implante de stents coronarios y determinar las causas por las cuales falló un stent (restenosis o trombosis); su uso ha demostrado reducir desenlaces clínicos de importancia.
Ultrasonido intravascular en lesiones angiográficas intermedias diferentes al tronco coronario izquierdoDe forma rutinaria se ha utilizado el IVUS para evaluar la lesiones intermedias y definir si requieren o no intervención, decisión que se basa en la medición del ALM. El método invasivo ideal para evaluar el significado hemodinámico de una lesión intermedia, es el flujo de reserva fraccional (FFR)6,7. En nuestro medio la disponibilidad del FFR es más limitada que la del IVUS, herramienta que aún desempeña un papel importante en la toma de decisiones en lesiones intermedias, de ahí la importancia de plantear un esquema de interpretación de los hallazgos para una decisión de intervención más acertada.
El punto de corte establecido para intervención en lesiones intermedias en coronarias epicárdicas que no sean el tronco coronario izquierdo ha sido < 4mm2 con base en dos estudios: en uno se correlacionaba el ALM < 4mm2 con isquemia en estudios de perfusión miocárdica y con FFR < 0,758 (sensibilidad 92% y especificidad 56%)9 y en otro el ALM > 4mm2 mostró baja tasa de eventos cuando se difería la intervención10.
El ALM por sí sola es un parámetro con varias limitantes porque el efecto hemodinámico de una lesión intermedia depende adicionalmente de la longitud de la lesión, la excentricidad, los diámetros de referencia proximales y distales y la cantidad de miocardio a riesgo dependiente de la lesión11. Por esta razón, se han correlacionado otros hallazgos por IVUS que puedan reflejar el impacto hemodinámico de la lesión. Es así como las lesiones intermedias con ALM < 3mm2, área de estenosis > 60%, carga de placa > 80% y longitud de la lesión >20mm que predicen mucho mejor un FFR < 0,7512, ALM<2,8mm2 y <3,2mm2 se correlacionaron con FFR< 0,75 y < 0,80 respectivamente; no obstante, la mejor ALM para predecir un FFR < 0,80 es 2,4mm2 (sensibilidad 90% y especificidad 60%)13-15.
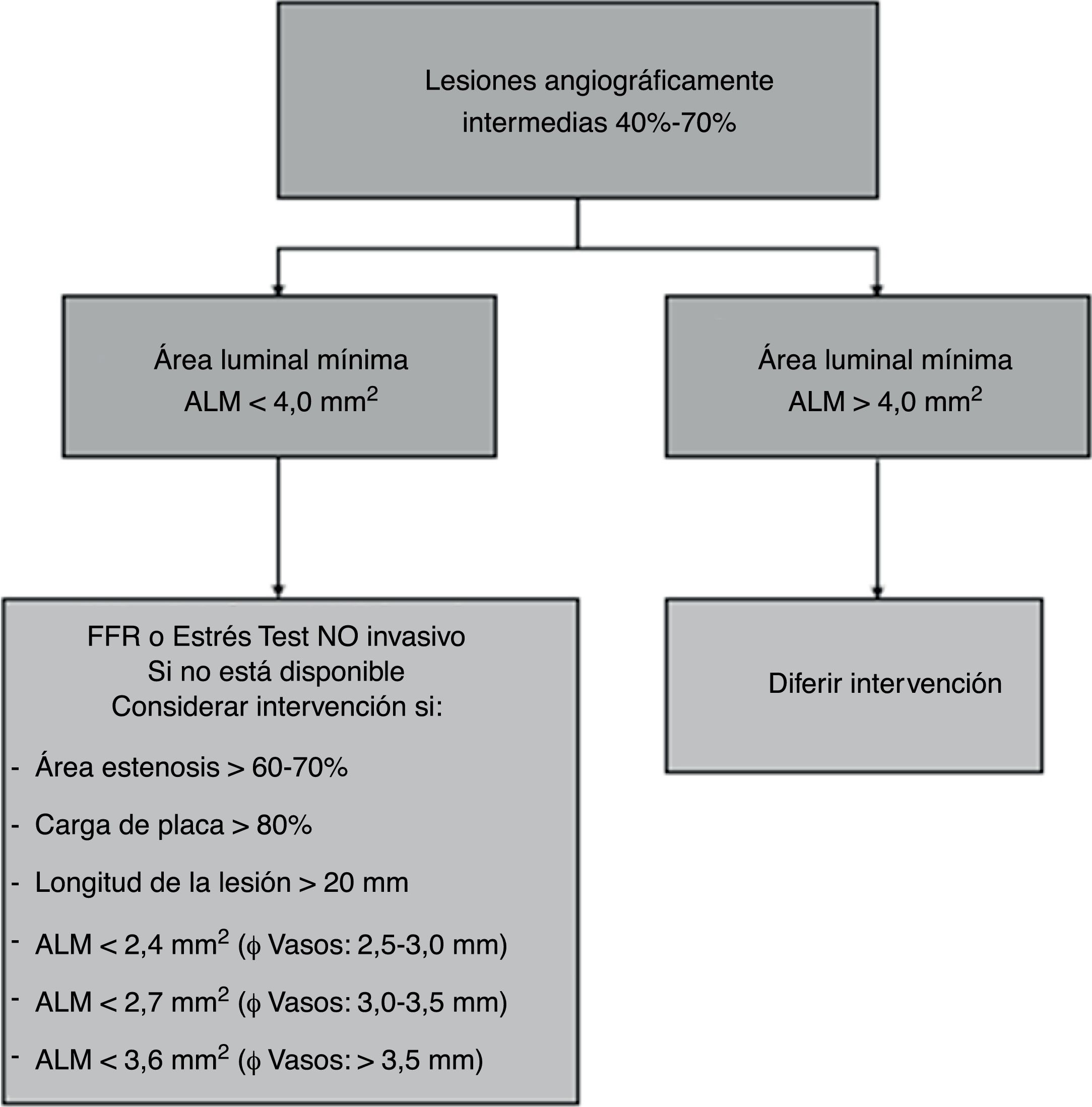
En conclusión, en una lesión intermedia con ALM > 4,0mm2 se puede diferir la intervención y en caso de ALM < 4,0mm2, esta por sí sola no es suficiente para justificarla, de tal forma que se deben tener en cuenta otros parámetros (fig. 3).
El ALM crítica para definir intervención depende del diámetro del vaso: ALM < 2,4mm2 para vasos con diámetro de referencia entre 2,5-3,0mm, < 2,7mm2 para diámetros de referencia entre 3,0 y 3,5mm y < 3,6mm2 para vasos mayores de 3,5mm de diámetro.
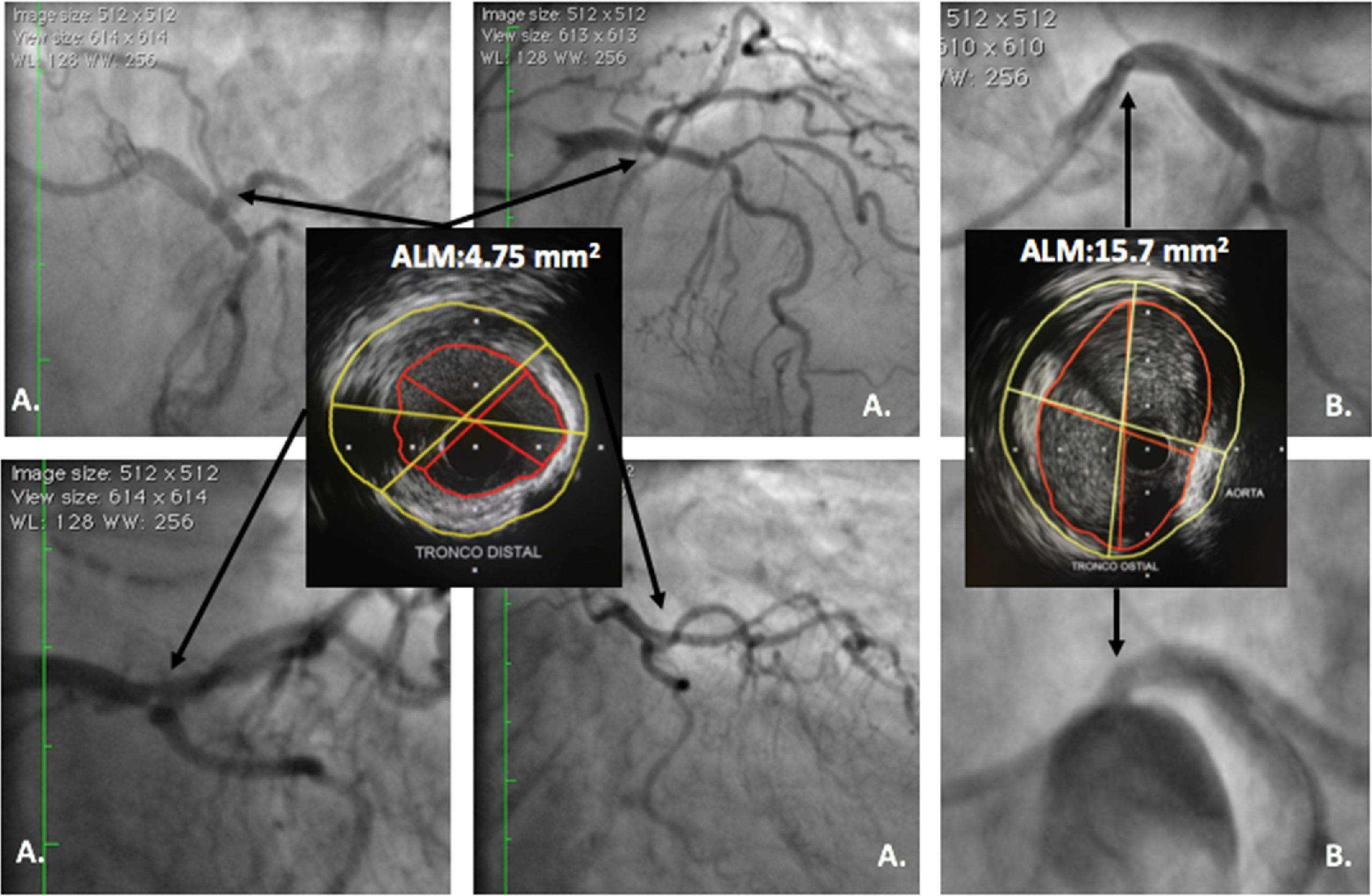
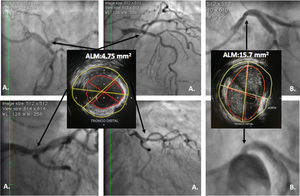
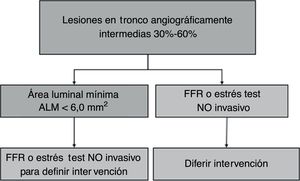
Ultrasonido intravascular en lesiones angiográficas intermedias en tronco coronario izquierdoLas lesiones intermedias en el tronco representan un reto para su evaluación angiográfica, ya que generalmente están ubicadas sobre un segmento corto, calcificado, que puede comprometer el ostium o la bifurcación (fig. 4).
A. Lesión ambigua de tronco; en las diferentes vistas angiográficas, el IVUS evidencia lesión focal corta con ALM de 4,7mm2 en el tronco distal la cual se consideró severa. B. Lesión ambigua de tronco ostial; el IVUS evidencia ALM amplia de 15,7mm2 que descarta estenosis severa. La imagen angiográfica se consideró secundaria a la curva inicial del tronco en su origen.
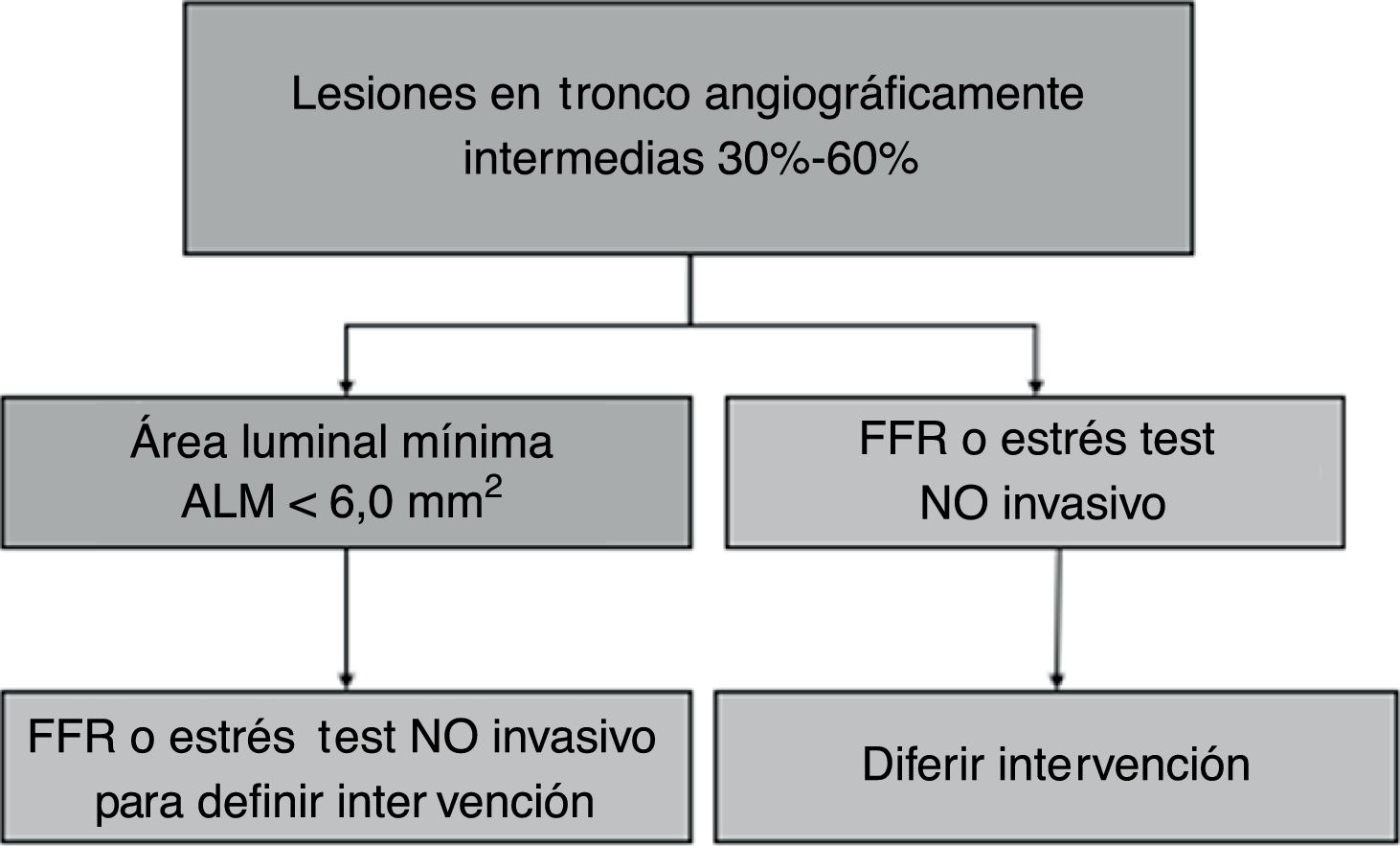
Se consideran como severas las lesiones con ALM < 6mm2 con base en un estudio en el cual un ALM < 5,9mm2 (sensibilidad 95% y especificidad 95%) y un diámetro del lumen < 2,8mm (sensibilidad 93% y especificidad 98%), se correlacionaban con un FFR < 0,7516; adicionalmente, en otro estudio un ALM > 6,0mm2 discriminó pacientes con bajo riesgo de eventos isquémicos17, en tanto que un estudio reciente en población asiática encontró que un ALM < 4,8mm2 se correlaciona de mejor manera con un FFR < 0,8018. Este último es un parámetro para tener en cuenta en nuestro medio ya que la población asiática se asemeja más a la nuestra en cuestiones antropométricas. En conclusión, si se obtiene un ALM > 6, 0mm2 se puede diferir la intervención, pero si el ALM es < 6,0mm2 se debe complementar el estudio con una prueba detectora de isquemia o realizar FFR o decidir la intervención de forma directa si el ALM es < 4,8mm2 (fig. 5).
Ultrasonido intravascular como guía en angioplastia coronaria con stentEl ultrasonido permite verificar, de manera rápida y exacta, las dimensiones del vaso, la longitud y la extensión o carga de la placa, así como su composición y remodelación. Una vez identificadas estas características es posible que el operador planee y realice la intervención acorde con estas para obtener el mejor resultado.
Los estudios iniciales de angioplastias fallidas (restenosis y trombosis) se realizaron con IVUS, lo cual arrojó información valiosa que explicaba la aparición de estos eventos19 y sentó las bases para introducir mejoras sustanciales en las técnicas de implante20, específicamente Colombo et al. en 1995 lograron demostrar que con el implante de los stents a alta presión (14-16 atmósferas) y no al 70% de la presión nominal (como lo indicaba la industria), se obtenía una mejor expansión y aposición de los stents demostrado por IVUS, y se lograba disminuir la trombosis aguda y subaguda utilizando solo antiagregación sin necesidad de esquemas de anticoagulación que obviamente acarreaban complicaciones hemorrágicas. Esto abrió la puerta para el uso de los stents en casi todas las lesiones coronarias y no solo para “bailout” en angioplastia con balón con resultados subóptimos.
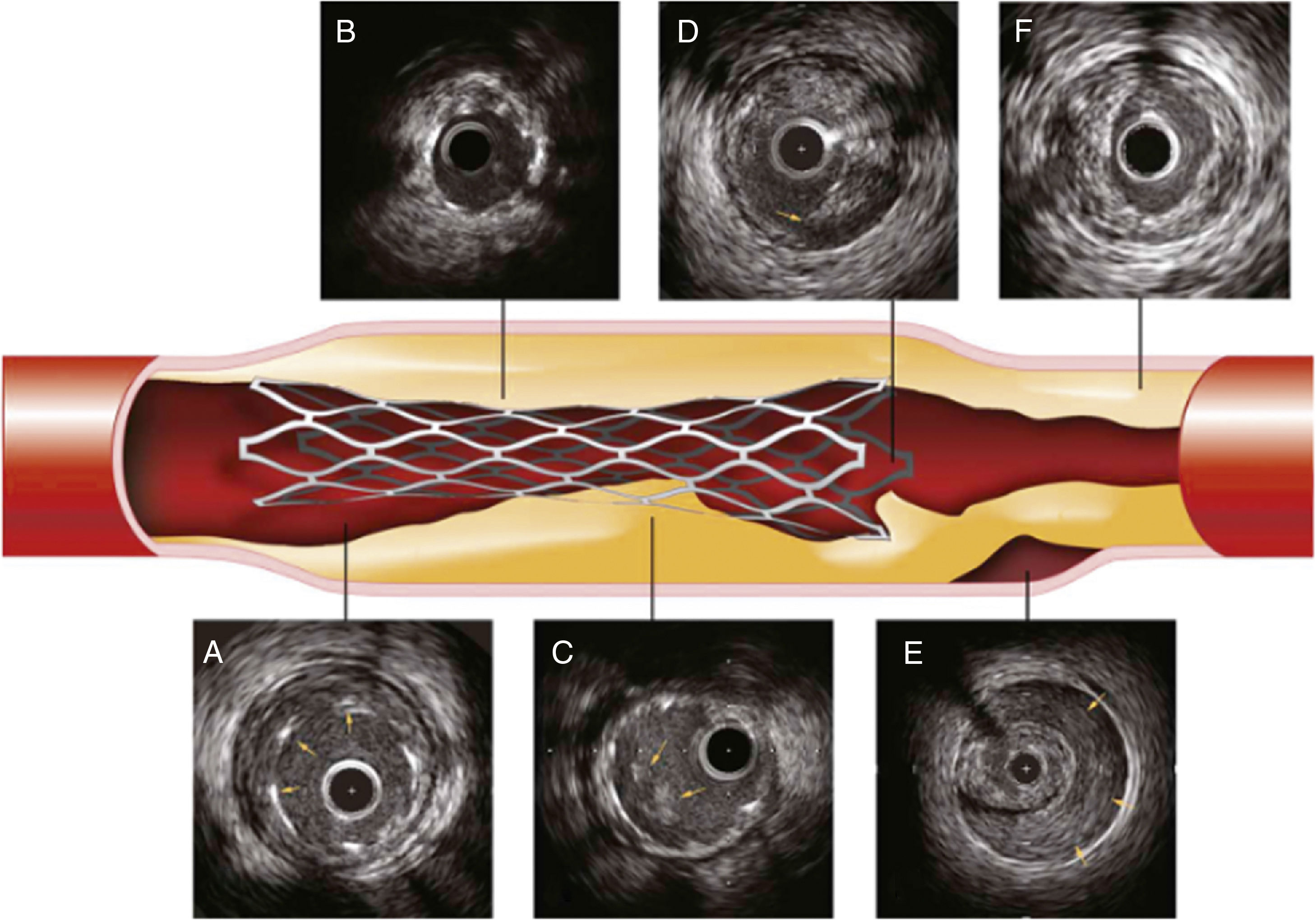
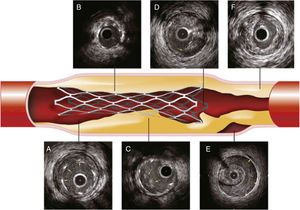
Es así como se utiliza el IVUS en todas las fases de la angioplastia con stent: en la planeación permite evaluar las dimensiones de la luz tanto en el segmento sano proximal como distal a la lesión, escoger el tamaño del stent a implantar y determinar la longitud y extensión de la placa, mientras que en el análisis postimplante permite detectar anormalidades corregibles como malaposición, subexpansión, disección de los bordes o placa aterosclerótica no cubierta y protrusión de la placa, así como factores que pueden dar origen a restenosis y/o trombosis del stent11 (figs. 5 y 6).
Problemas con el implante de stent detectados por IVUS.
A, Malaposición en la que se evidencia un espacio entre el borde del stent (flechas) y la pared del vaso. B, Subexpansión del stent en comparación con diámetros de referencia. C, Proloapso de tejido (trombo, placa o ambos) dentro del stent. D, Disección del borde, disrupción de la placa (flecha) en el borde. E, Hematoma intramural, sangre en la media de la arteria (flechas). F, Carga de placa residual significativa. Tomado de: Intravascular Ultrasound: Textbook of Interventional Cardiology. 6th. edition.
En la era de los stents convencionales la angioplastia guiada por IVUS demostró reducción de la restenosis y bajó la tasa de reintervenciones sin lograr disminuir la mortalidad21. Con los stents medicados la evidencia inicial no logró demostrar beneficio con el IVUS a pesar de obtener buenas dimensiones en el stent postimplante, lo cual sugiere que el beneficio y la eficacia de los stent liberadores de medicamentos superaba la utilidad de la guía de implante con IVUS22-24. Recientemente, la superioridad del IVUS como guía en intervención coronaria percutánea con stent liberadores de medicamentos en comparación con solo guía angiográfica, se comprobó en el estudio IVUS-XPL el cual arrojó una disminución significativa de la necesidad de reintervención de la lesión tratada (TLR)25. Adicionalmente, un metanálisis de los principales estudios observacionales con más de 25.000 pacientes, mostró disminución de la trombosis del stent, mortalidad, infarto y reintervención en la angioplastia guiada por IVUS26.
La definición de un implante óptimo de un stent varía entre los diferentes estudios. Comúnmente se ha considerado como un implante óptimo la aposición completa de los struts del stent, la ausencia de disecciones en el borde y la expansión adecuada que se define como un ALM > 5mm2 o > 90% del área del lumen de referencia distal11. De igual forma, se han descrito otros criterios de implante óptimo en dos estudios diferentes, MUSIC27 y AVIO28 (tabla 1, figs. 5 y 6).
Criterios MUSIC y AVIO utilizados para definir por criterios por IVUS sobre la expansión adecuada de un stent
| Criterios MUSIC | Criterios AVIO |
|---|---|
| Aposición completa del stent | Área mínima post-stent >70% del área del balón utilizado para la post-dilatación del stent |
| Expansión adecuada del stentALM intra-stent >90% del promedio del área luminal de referencia o >100% del segmento de referencia con la menor área cuando el ALM es <9mm2ALM intra-stent >80% del promedio del área luminal de referencia o >90% del segmento de referencia con la menor área cuando el ALM es >9mm2 | El balón no complaciente para la post-dilatación debe ser seleccionado con el promedio de los diámetros máximo y mínimo de los siguientes puntosSegmento distal intra-stentSegmento proximal intra-stentMáximo estrechamiento intra-stent |
| Expansión del stent simétrica definida por el diámetro luminal mínimo dividido por el diámetro luminal máximo >0,7 |
En cuanto a la prevención de la trombosis de stent en intervención coronaria percutánea con stent liberadores de medicamentos, el IVUS parece tener un papel más importante por su capacidad para detectar implantes subóptimos (disección de los extremos, subexpansión, protrusión de placa, placa no cubierta, etc.) y corregirlos de inmediato. Es así que en un estudio de intervención coronaria percutánea con stent liberadores de medicamentos guiada con IVUS, se logra disminuir la trombosis del stent a 30 días (0,5% vs. 1,4% p 0,0046) y a 12 meses (0,7% vs. 2,0% p 0,014)29 (fig. 6).
Disección del bordeSu incidencia por IVUS después del implante de un stent medicado es del 10% y solo el 40% es visible mediante angiografía. Se clasifica como disección de alto grado por IVUS el área luminal que se estrecha por debajo de los 4mm2, factor considerado como predictor de trombosis del stent, cuyo manejo usual es la dilatación prolongada con balón o el implante de un segundo stent30.
Subexpansión del stentSe relaciona con la presencia de trombosis de stent liberadores de medicamentos generalmente cuando existe un ALM < 5mm2, lo cual se demostró en un estudio en pacientes con trombosis temprana donde el ALM baja fue un factor de riesgo independiente para ALM (4,3±1,6mm2 vs. 6,2±1,9mm2, p<0,001) y la expansión óptima del stent (65± 18% vs. 85±14% del lumen de referencia, p<0,001)31 fue un factor protector.
Por los datos anteriores y la falta de otros estudios, la expansión ideal de un stent sea convencional o medicado, se da cuando se alcanza al menos el 80% del ALM del segmento de referencia.
Malaposición del stentSe define como la ausencia de contacto entre los struts del stent y la pared del vaso y tiene una incidencia del 10%. Esto se puede presentar de forma aguda o desarrollarse con el tiempo (malaposición adquirida); la aguda responde a mala técnica en el implante del stent y la adquirida a malaposición aguda persistente, remodelación positiva, resolución del trombo presente al momento del implante o reacción de hipersensibilidad. La malaposición tardía es cuatro veces más frecuente con stent liberadores de medicamentos que con BMS11. En un metanálisis de 5 estudios con un total de 228 pacientes con malaposición comparado con pacientes sin ésta, se asoció con riesgo de trombosis del stent con razón de disparidad de 6,51 (IC 95% 1,34 a 34,91 p 0,02).
Ultrasonido intravascular como guía en angioplastia del troncoLa literatura reciente avala la intervención coronaria percutánea con los estudios EXCEL y NOBEL32,33, demostrando resultados comparables con la cirugía de revascularización, hecho que resalta la optimización de este tipo de angioplastia con IVUS. El estudio MAIN-COMPARE34 mostró tendencia a presentar menor mortalidad cuando se realizaba angioplastia del tronco con guía por IVUS vs. guía angiográfica (6,0 vs. 13,6% p 0,063) principalmente por disminución de la muerte súbita secundaria a trombosis del stent.
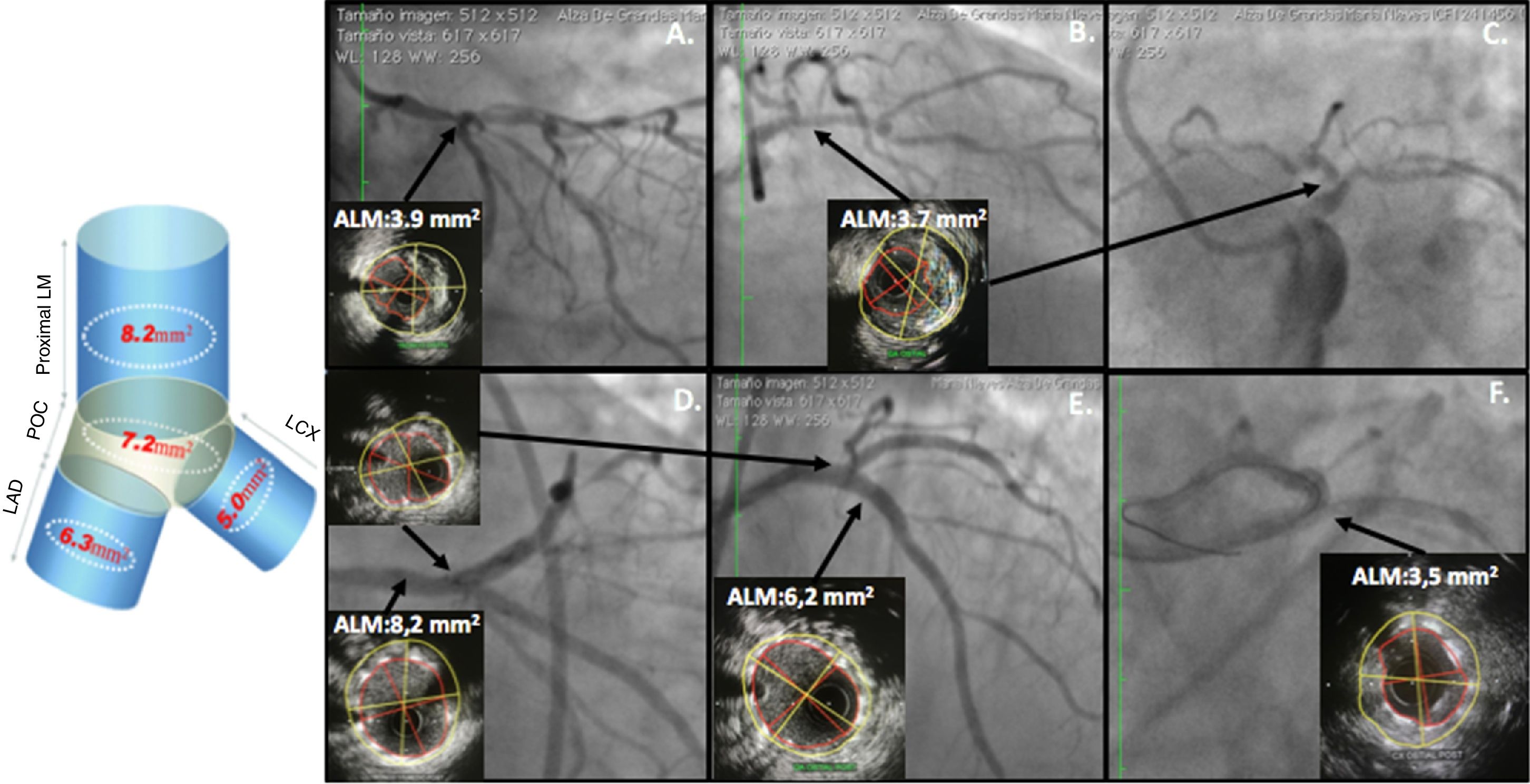
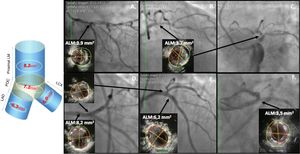
El IVUS en tronco, como en cualquier otra angioplastia, permite planear la intervención al detectar la cantidad de calcio que obligue a utilizar dispositivos (rotablador), así como a evaluar el tamaño real del vaso y el compromiso con placa de la rama lateral (ostium de la circunfleja). Pero lo más importante es la optimización de la angioplastia y para esto los parámetros más utilizados son el ALM en cuatro diferentes puntos: tronco ALM > 8,2mm2, polígono de confluencia > 7,2mm2, descendente anterior ostial 6,3mm2 y Cx ostial > 5mm20,35 (figs. 7 y 8).
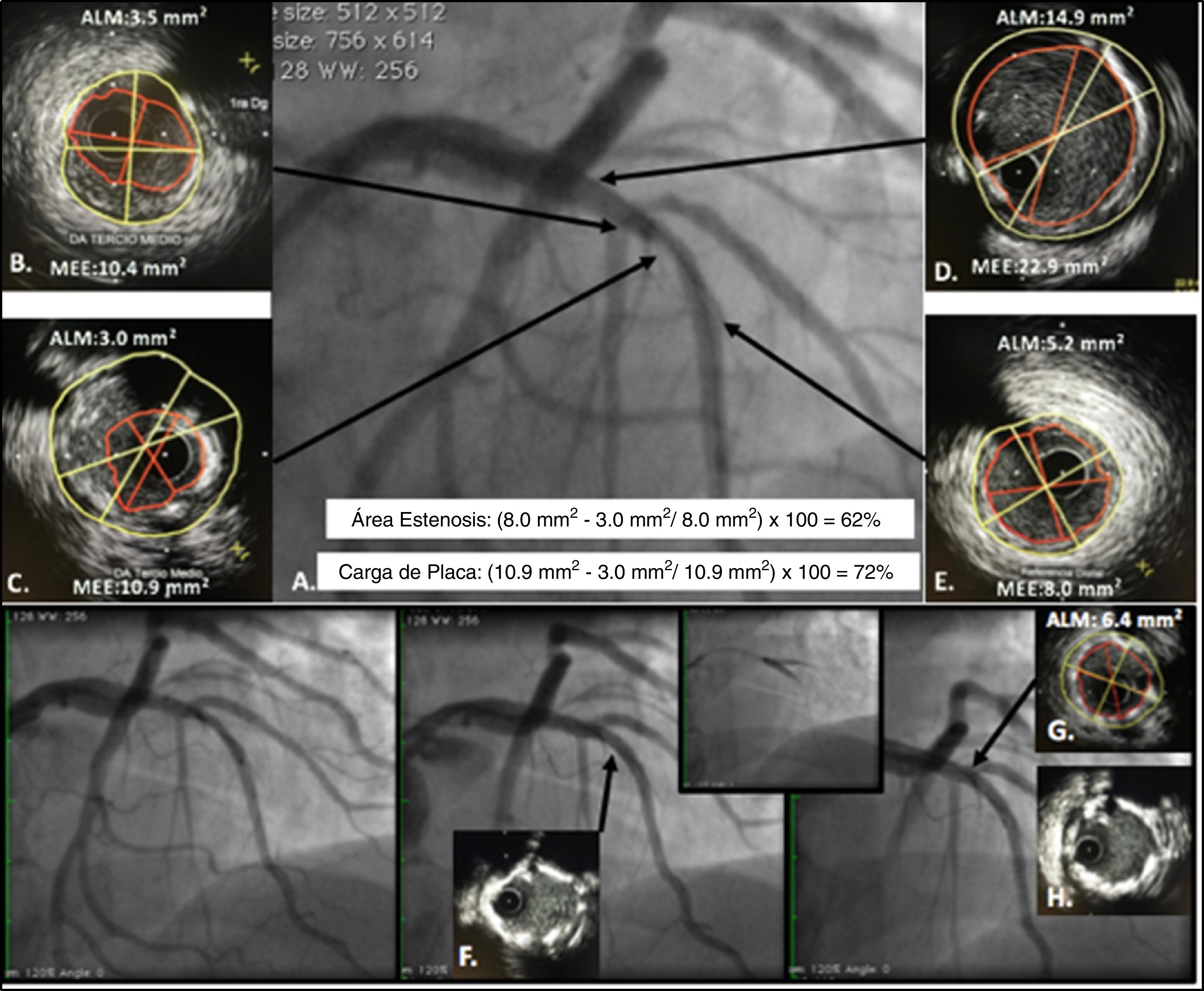
IVUS para decidir y guiar intervención en lesión intermedia en bifurcación entre la DA y primera Dg. A. Lesión intermedia en la DA con lesión severa en la primera Dg. Se realiza estudio con IVUS; B. Evidencia de placa en la bifurcación con la primera Dg con ALM de 3,5mm2, C. Evidencia lesión más severa en la DA con ALM de 3,0mm2. Teniendo en cuenta los segmentos de referencia proximal y distal D y E, se calculó un área de estenosis de 62% y carga de placa de 72% y una longitud aproximada de la lesión de 21mm. Se decide realizar angioplastia con dos stents utilizando técnica de doble kissing crush. Los recuadros inferiores muestran el implante inicial del stent de la primera Dg y posteriormente el stent de la DA, el IVUS post angioplastia F. evidencia malaposición del stent hacia las 5, la cual corrige después del kissing balón H. En el sitio de mayor estenosis se logra conseguir un ALM de 6,4mm2. G. que es mayor al 80% del ALM del segmento de referencia distal considerando adecuada expansión del stent.
IVUS en angioplastia de tronco. Los recuadros superiores muestran una lesión severa de tronco distal que se extiende hacia el ramus intermedio y la DA proximal. Los tres recuadros inferiores muestran el resultado postangioplastia con las medidas del ALM en tronco proximal, carina, DA ostial y Cx ostial; todos con un resultado aceptable excepto en el ostium de la Cx donde el ALM ideal es 5,0mm2 y se obtuvo un ALM de solo 3,5mm2.
La restenosis y las trombosis de los stents son las manifestaciones clínicas del fallo de un stent. No existe una causa única de trombosis o restenosis del stent. Por su impacto clínico ambos escenarios han sido estudiados de forma extensa con IVUS36.
Restenosis intrastentLas causas de restenosis intrastent identificadas pueden ser hiperplasia neointimal, subexpansión tardía del stent, neoaterosclerosis y fractura del stent. La causa más común de restenosis es la subexpansión del stent, específicamente cuando se tiene un ALM en el stent menor a 5,5mm2 y también el uso de stents largos o longitudes cubiertas por stent mayores a 40mm37.
Trombosis del stentPor otro lado, la trombosis temprana (< 30 días después del implante) se relaciona con factores del procedimiento, incluidos subexpansión del stent, disección del borde, hematoma intramural y protrusión de placa38,39. En los casos de trombosis tardía de stent la causa más común es la malaposición (puede ser adquirida o generarse desde el implante), la neoaterosclerosis y los struts no endotelizados40.
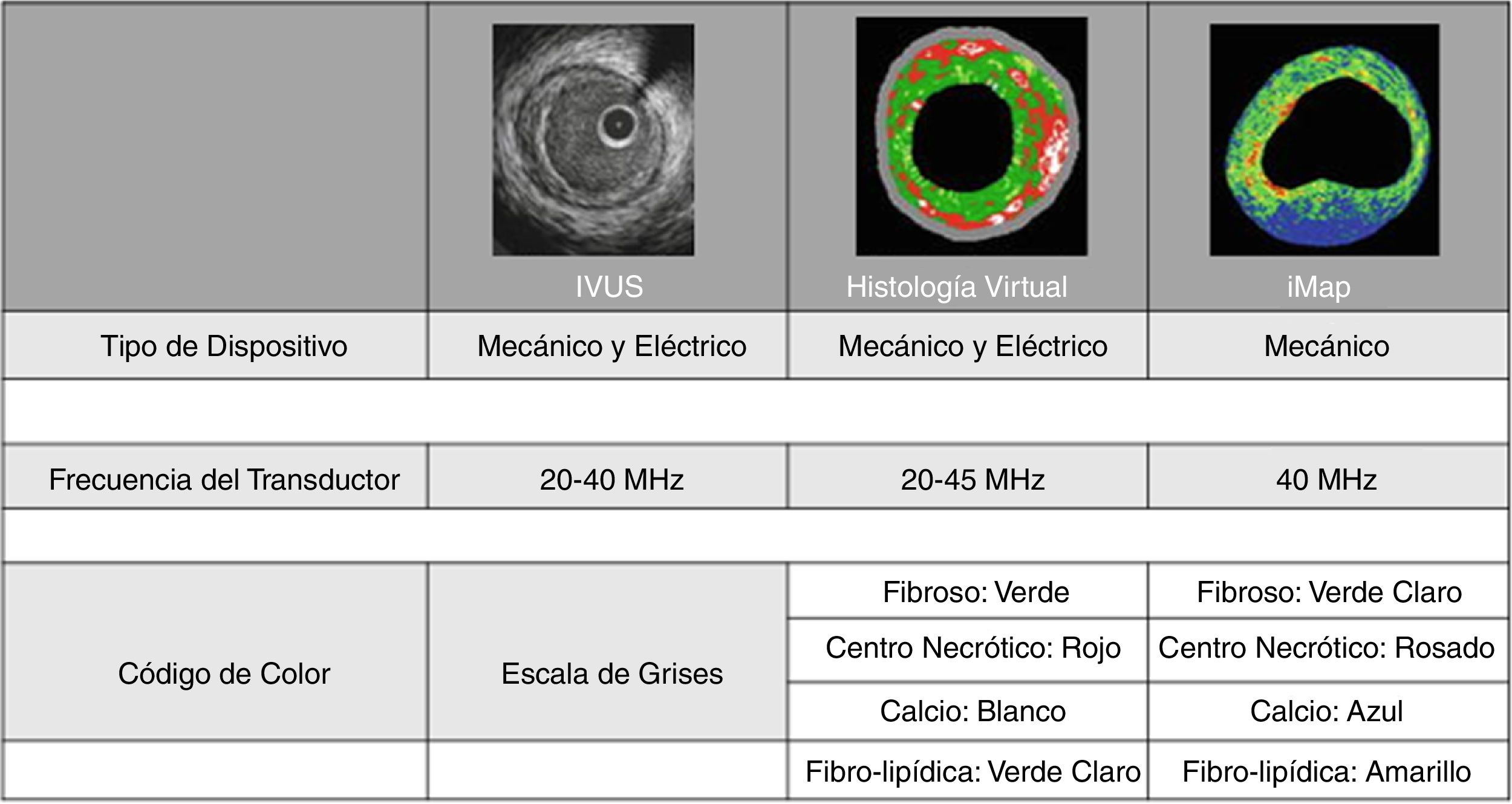
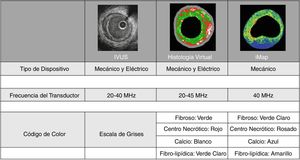
Ultrasonido intravascular para la caracterización de la placa (histología virtual) y la detección de placa vulnerableEn vista de la capacidad del IVUS para delinear el lumen, la capa media y el borde de la adventicia, al realizar un análisis espectral de la onda de radiofrecuencia emitida por el transductor, es posible caracterizar diferentes componentes en la pared del vaso. Para este propósito se usan distintos software, entre ellos, la histología virtual (IVUS-HV) (Volcano Corp, Rancho Cordoba, CA) y el iMAP (Boston Scientific) (fig. 9).
En IVUS-HV, los principales componentes de la placa son el centro necrótico (CN), el tejido fibrolipídico (TFL), el tejido fibroso (TF) o el calcio denso (CD) y según la concentración o predominio de estos en la placa dan origen a cuatro tipos de placas: engrosamiento intimal adaptativo, patológico, fibrótico y fibrocalcificado, y fibroateromas con capa delgada o gruesa41.
La caracterización de la placa tiene relevancia clínica ya que aquella que más se correlaciona con síndromes coronarios es la de capa fibrosa delgada (TCFA por su sigla en inglés), la cual se reconoce por un gran centro necrótico y contenido lipídico separados de la luz por una capa muy delgada (<60 micras). Esto último no puede ser identificado por el IVUS ya que este solo tiene una resolución entre 100 y 200 micras. Para detectar este tipo de placa de forma indirecta se debe recurrir a otras características como placa con más de 20% de contenido necrótico y en contacto con la luz en más del 30% de la circunferencia, más de 5% de contenido de calcio y carga de placa mayor a 50%42.
Ultrasonido intravascular en la predicción de eventos coronariosEl estudio PROSPECT, en el que se realizó IVUS de los tres vasos en pacientes con síndrome coronario agudo, mostró que las lesiones no culpables que tenían una carga de placa mayor al 70%, ALM < 4mm2 y características de ateroma de capa fibrosa delgada (TCFA), tuvieron once veces más riesgo de desencadenar un evento adverso cardiovascular mayor (MACE) en comparación con lesiones que no tenían esta característica; solo la presencia de TCFA determinó tres veces más riesgo de MACE43,44. Estas características de la placa, aunque fueron altamente prevalentes, casi 40-50% de la población, tuvieron bajo valor predictivo positivo y alto valor predictivo negativo, de modo que su presencia no justifica la intervención preventiva de estas lesiones, aunque sí la optimización de manejo médico intensivo, principalmente con estatinas.
Estudios con IVUS-HV han mostrado estabilización de la placa por reversión de las características de alto riesgo, sin disminución significativa del CN, pero sí engrosamiento de la capa fibrosa45 (fig. 10).
Utilidad del ultrasonido intravascular en la vasculopatía postrasplanteLa vasculopatía postrasplante cardíaco (rechazo crónico), es una de las principales causas de muerte después del primer año entre este tipo de pacientes.
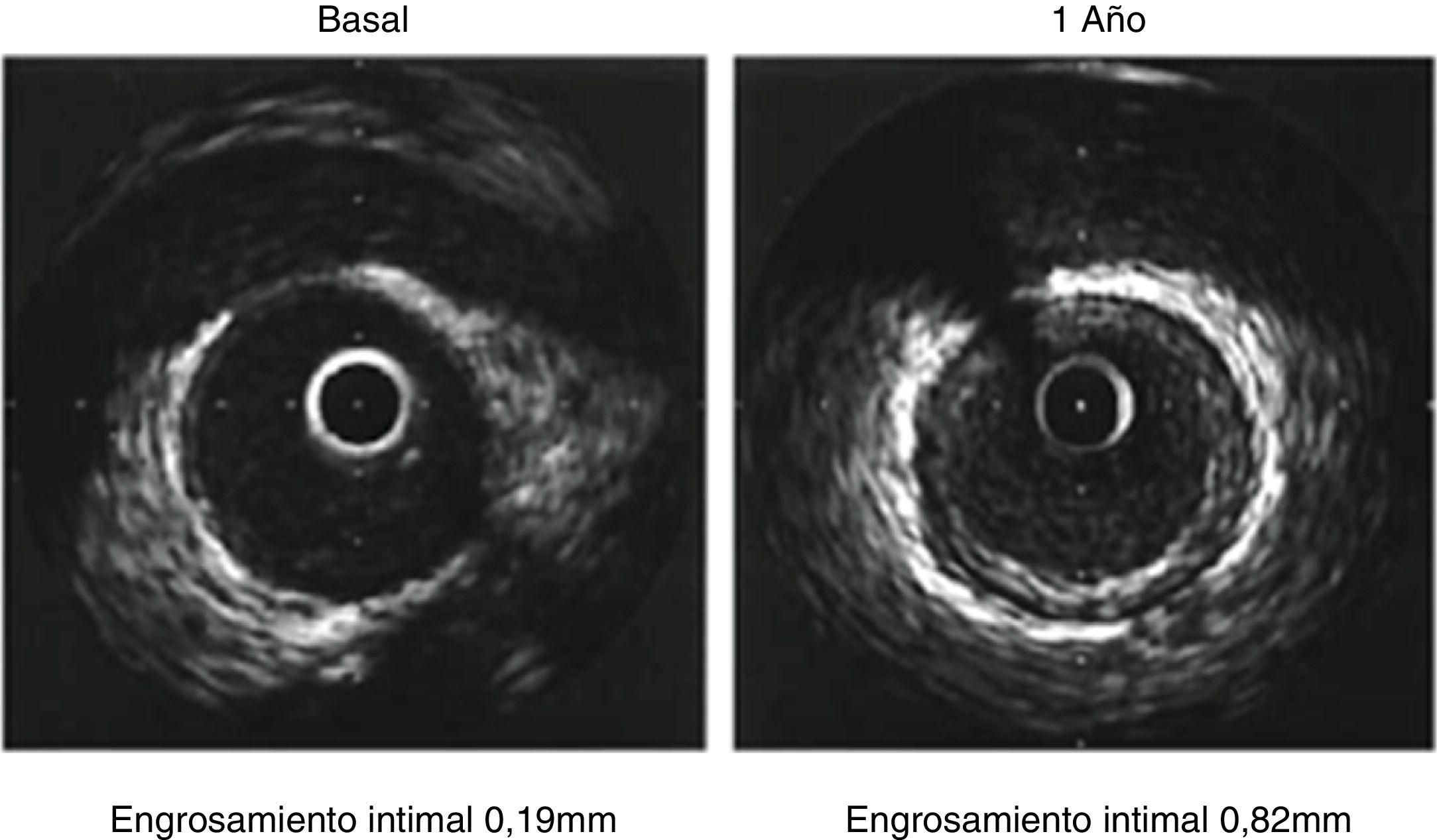
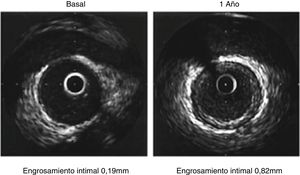
La angiografía convencional es incapaz de detectar las fases iniciales de esta enfermedad, caracterizada por engrosamiento homogéneo de la íntima sin afectación de la luz arterial. Por esta razón, en estos pacientes es fundamental el seguimiento rutinario y protocolizado con IVUS para la toma de decisiones (fig. 9).
Se considera un predictor de mortalidad un incremento del grosor intimal ≥ 0,5mm en los primeros años postrasplante cardiaco. La vasculopatía postrasplante se ha clasificado en cuatro clases según el grado de engrosamiento intimal y los grados de la circunferencia del vaso comprometidos46 (tabla 2).
ConclusiónEl IVUS es una herramienta invaluable en la angioplastia coronaria con stents, ya que permite evaluar adecuadamente las lesiones, planear la intervención y verificar el resultado del implante de los mismos. Se considera casi imperativo cuando se interviene el tronco de la coronaria izquierda y en la restenosis o trombosis de los stents.
A pesar de prolongar el tiempo de procedimiento ha demostrado disminuir las complicaciones y mejorar los resultados a corto y largo plazo.
Conflicto de interesesNinguno.