El implante aórtico transcatéter es uno de los avances más importantes en la cardiología contemporánea. Su uso es ampliamente aceptado en aquellos pacientes con estenosis aórtica calcificada con riesgo quirúrgico alto o prohibitorio y ha sido expandido a la población de riesgo intermedio. Otra indicación aprobada es en pacientes con degeneración valvular bio-protésica. El éxito de esta tecnología ha dependido y dependerá en gran parte del avance y la utilización apropiada de las técnicas multi-imágenes. El uso de técnicas de imágenes deberá ser adaptado a las tecnologías emergentes y tendrá siempre un papel fundamental en la selección de los pacientes, apoyo y dirección durante el procedimiento, diagnóstico y manejo oportuno de complicaciones y seguimiento a largo plazo. El entrenamiento de nuevas generaciones de cardiólogos deberá incluir estos aspectos.
Transcatheter aortic implant is one of the most important advances in contemporary cardiology. Its use is widely accepted in those patients with calcified aortic stenosis with a high or prohibitive surgical risk, and has been expanded to the population of intermediate risk. Another approved indication is in patients with bioprosthetic valve degeneration. The success of this technique has largely depended, and will depend, in the advance and appropriate use of multi-imaging techniques. The use of imaging techniques will have to be adapted to the emerging technologies, and will always have a fundamental role in patient selection, support, and direction during the procedure, diagnosis and timely management of complications and long-term follow-up. The training of new generations of cardiologists must include these aspects.
La estenosis valvular aórtica calcificada actualmente afecta al 7% de la población mayor de 65 años y se espera que el número de pacientes se triplique en los próximos 50 años1,2. Pese a que el paciente con estenosis aórtica y síntomas asociados (Grado D) tiene indicación para reemplazo valvular3, un tercio de ellos no son referidos para intervención quirúrgica, en su mayoría debido a un riesgo quirúrgico alto o prohibitivo1. Sin intervención, el pronóstico es pobre, pues se estima una mortalidad del 50% a dos años1,4.
El uso del implante aórtico transcatéter ha revolucionado el manejo de estos pacientes de alto riesgo o inoperables4,5. La utilización de esta tecnología transformativa se ha ampliado recientemente a aquellos con riesgo quirúrgico moderado6. Hasta la fecha, más de 300.000 pacientes ya han sido tratados con esta tecnología y se estima que el 94 al 98% de los procedimientos han sido completados de manera satisfactoria7, éxito que en parte se debe al uso de imágenes cardiovasculares en la planificación y el seguimiento de los casos8.
En este capítulo se expondrá la evidencia detrás del implante aórtico transcatéter y se describirá en profundidad el rol de la técnica multi-imágenes en la valoración del paciente con indicación para implante aórtico transcatéter.
MetodologíaSe efectuó una revisión bibliográfica no estructurada en PubMed/Medline de trabajos relacionados con la utilidad clínica del implante aórtico transcatéter y el uso de la técnica multi-imágenes en la evaluación del paciente con indicación de implante aórtico percutáneo. Se incluyeron artículos en cualquier idioma, hechos en humanos y publicados hasta la fecha, y con acceso a texto completo. Se revisaron e incluyeron aquellos artículos de revisión y artículos originales relacionados directamente con el objetivo de esta revisión. Por su parte, se excluyeron cartas al editor, resúmenes, presentaciones de casos, así como artículos no relacionados con el tema de interés. Los artículos incluidos fueron leídos y analizados con el fin de ofrecer un resumen conciso de la evidencia que avala el uso clínico del implante aórtico transcatéter, así como de precisar la utilidad cada una de las técnicas de imágenes cardiovasculares por separado en la valoración del candidato a implante aórtico transcatéter.
Evidencia en favor de esta tecnologíaEl estudio PARTNER (Placement of AoRTic TraNscathetER Valve Trial) determinó la utilidad del implante aórtico transcatéter mediante la válvula expandible con balón Edwards-SAPIEN en el manejo de pacientes con estenosis aórtica calcificada de grado severo (gradientes medio > 40mm Hg, velocidad máxima > 4 m/s o área valvular < 0,8cm2) con síntomas asociados (NYHA clase funcional ≥ II)4,5. En la cohorte A (PARTNER A), el implante aórtico transcatéter en pacientes con alto riesgo quirúrgico (STS score >10% o mortalidad post-operatoria basada en comorbilidades estimada en >15%) resultó comparable a la cirugía de reemplazo aórtico en cuanto a mortalidad, readmisiones hospitalarias y calidad de vida. Mientras tanto en la cohorte B (PARTNER B), el implante aórtico transcatéter en pacientes inoperables (riesgo de muerte o complicación irreversible series > 50% en 30 días) ofreció un beneficio marcado en la mortalidad comparado con el seguimiento médico5. Los beneficios del implante aórtico transcatéter en estos grupos persisten luego de cinco años de seguimiento9,10. La utilidad del implante aórtico transcatéter establecida en PARTNER se obtuvo a expensas de un incremento en el número de eventos cerebro-vasculares (principalmente menores) y complicaciones vasculares4,. Seguidamente, el uso de válvulas auto-expandibles CoreValve, en pacientes de alto riesgo quirúrgico fue establecido por el estudio CoreValve US Pivotal Trial High Risk11. Hasta la fecha este ha sido el único estudio que ha reportado una reducción en mortalidad, así como en la incidencia de eventos cardiovasculares y cerebrovasculares con implante aórtico transcatéter en comparación con el reemplazo valvular quirúrgico11.
Posteriormente, los estudios clínicos PARTNER 2 y SURTAVI (SURgical or Transcatheter Aortic-Valve replacement in Intermediate-risk patients) respaldaron el uso del implante aórtico transcatéter en la población de riesgo intermedio (STS 4-8%), con válvula expandible por balón o auto-expandible respectivamente6,12. Luego de dos años de seguimiento, el implante aórtico transcatéter resultó comparable con el reemplazo valvular quirúrgico en cuanto a mortalidad y mejoría sintomática pero también en relación con la incidencia del accidentes cerebrovasculares isquémicos incapacitantes y durabilidad del implante valvular6,12. El implante aórtico transcatéter ofreció una mejoría más expedita de los síntomas con menos transfusiones de sangre y menor frecuencia de fibrilación auricular, pero estuvo asociado a una mayor frecuencia de insuficiencia aórtica residual e implantación de marcapasos6. La insuficiencia aórtica residual, aun en grados relativamente leves, tuvo un impacto negativo en la sobrevida de estos pacientes, hecho que llevó a modificaciones en el diseño de las válvulas percutáneas.
Finalmente, evidencia derivada del estudio NOTION (Nordic Arotic Valve Intevention) sugiere que el implante aórtico transcatéter en pacientes con menor riesgo (STS <4%) es comparable al reemplazo quirúrgico en cuanto a mortalidad, accidentes cerebrovasculares e infartos al miocardio al cabo de cinco años, al consabido costo de un mayor número de fugas paravalvulares y marcapasos insertados13. Se espera que nuevos estudios validen estos resultados en el futuro cercano.
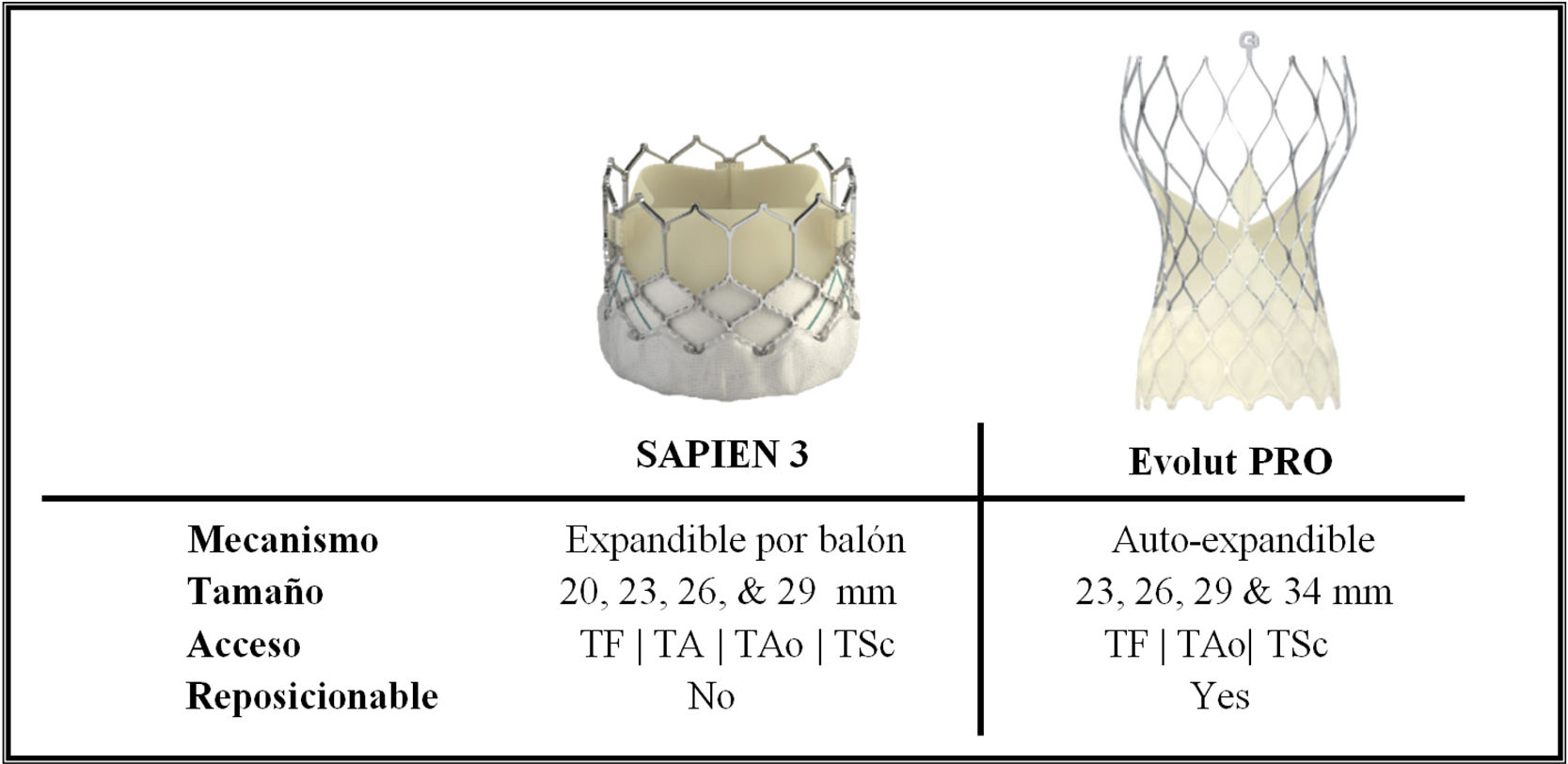
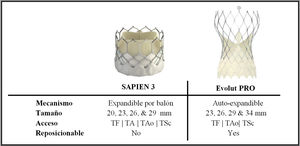
En los últimos años se ha reportado una mejoría en los resultados operacionales y clínicos del implante aórtico transcatéter14,15, lo cual responde a una mejor selección de pacientes y mayor experiencia operativa, unidos a nuevos avances en el diseño de las válvulas y sistemas de implantación. En este sentido, la evidencia favorece el acceso femoral sobre accesos alternativos, debido a una interacción favorable con mortalidad y menor número de complicaciones peri-procedimiento y recuperación más expedita12,14,16. De igual manera, la nueva generación de válvulas (SAPIEN 3 y Evolut PRO) se asocia con muy baja mortalidad, así como con incidencia reducida de regurgitación paravalvular y otras complicaciones, al menos comparables con los mejores resultados quirúrgicos14,17,18. Algunos estudios no aleatorizados incluso reportan al implante aórtico transcatéter como superior a la intervención quirúrgica en tiempos actuales14.
Se han llevado a cabo múltiples evaluaciones comparativas entre válvulas expandibles por balón y autoexpandibles de primera generación, con resultados de éxito clínicos similares incluyendo porcentajes de mortalidad, pero con menor porcentaje de éxito técnico y mayor frecuencia de fuga paravalvular y bloqueos atrio-ventriculares avanzados en válvulas autoexpandibles19,20. En contraste, comparaciones más recientes entre las valvulas SAPIEN 3 y Evolut R han demostrado un éxito procedural equiparable a la incidencia de fugas paravalvulares. Sin embargo, la válvula auto-expandible Evolut R continúa asociándose a un mayor número de marcapasos insertados21. Finalmente, es importante acotar que debido a la escasa información acerca de las válvulas de última generación (SAPIEN 3 y Evolut PRO) aún no se ha completado una comparación formal cara a cara (fig. 1).
Utilidad de la técnica multi-imágenes en el implante aórtico transcatéterEl uso de técnicas de multi-imágenes es de importancia crítica en la valoración del paciente considerado para implante aórtico transcatéter pues mejora la selección del paciente, reduce las probabilidades de una implantación subóptima y, en consecuencia, disminuye la aparición de complicaciones8,22.
En términos generales, la ecocardiografía transtorácica es el estudio de elección en la evaluación de la estenosis aórtica y las lesiones asociadas. También se usa inmediatamente después del implante para la detección temprana de complicaciones y finalmente es la técnica para seguimiento a largo plazo. El uso integrado de tomografía cardíaca con contraste permite medir con precisión el tamaño del anillo aórtico, la determinación del acceso y la planificación del procedimiento facilitando la toma de decisiones durante la implantación22. La tomografía computarizada también ayuda en la selección de planos angiográficos. La angiografía coronaria se obtiene en todos los pacientes, mientras que el ultrasonido carotídeo puede ser considerado caso por caso22. La resonancia magnética nuclear tiene un papel limitado en estos pacientes pero puede usarse para la medición del anillo aórtico en casos con insuficiencia renal severa o anafilaxis al contraste yodado.
A continuación se describen la utilidad y los usos alternos de la ecocardiografía, la tomografía y la resonancia magnética durante la selección del paciente, la ejecución del procedimiento y en el seguimiento postimplante aórtico transcatéter.
Selección del paciente con indicación para implante aórtico transcatéterTodo paciente considerado para el implante transcatéter debe atravesar una evaluación clínica rigurosa. El paciente debe referir síntomas que indudablemente se originen de la estenosis aórtica calcificada severa y tener un riesgo quirúrgico medio, alto o prohibitorio.
Hasta la fecha el uso del implante aórtico transcatéter en enfermedad valvular reumática, valvulopatía congénita o insuficiencia aórtica aislada no está avalado por estudios clínicos aleatorizados22. Sin embargo, algunos reportes recientes postulan resultados alentadores mediante el uso de implante aórtico transcatéter en casos selectos con insuficiencia aórtica aislada23. De igual manera los resultados no pueden generalizarse a aquellos con fracción de eyección menor al 20%, válvulas bicúspide o unicúspides, insuficiencia aórtica asociada mayor a 3+ y en hemodiálisis ya que estos pacientes fueron excluidos de los estudios aleatorizados de referencia4,5.
La técnica multi-imágenes busca satisfacer los siguientes objetivos durante la fase de selección del paciente: 1) severidad y mecanismo de la estenosis aórtica; 2) confirmación del sitio de acceso periférico para la implantación; 3) certeza de que el implante puede colocarse de manera segura con base en las características del dispositivo y la relación espacial entre válvula aórtica, raíz aórtica, ventrículo izquierdo y origen de las arterias coronarias; 4) determinación del tamaño adecuado del implante mediante la medición del anillo aórtico 5) detección de factores que aumenten el riesgo del implante y 6) contribución con la planificación del procedimiento24.
EcocardiografíaLa ecocardiografía transtorácica es la técnica de elección en la valoración de la severidad de la estenosis aórtica2. La medición de gradientes valvulares es la principal modalidad diagnóstica, pero debe ser considerada junto con la estimación del área valvular aórtica, el volumen latido indexado, el grado de calcificación valvular, la función ventricular, la hipertrofia cardíaca, la presión arterial y la capacidad funcional2. Además de servir como método diagnóstico, la medición de gradientes tiene valor pronóstico dado que los gradientes valvulares bajos son uno de los parámetros de pobre pronóstico luego del implante aórtico transcatéter25. Cuando existe duda respecto a la severidad de la estenosis aórtica en pacientes con gradientes valvulares bajos y función ventricular izquierda reducida (fracción de eyección <50%), la ecografía de estrés con dobutamina ayuda a diferenciar la pseudoestenosis por bajo flujo aórtico de la estenosis aórtica severa de bajo gradiente, así como a evaluar la presencia de reserva miocárdica. Igualmente, en casos seleccionados, la prueba de esfuerzo con valoración ecocardiográfica permite evaluar de modo objetivo la presencia de síntomas o la reducción en la capacidad funcional en el paciente con quejas vagas y equívocas2. En pacientes con síntomas claros de estenosis aórtica severa la prueba de esfuerzo continúa siendo contraindicada.
En el caso del implante valvular transcatéter, el área del anillo aórtico es de importancia crítica para la determinación del tamaño de la prótesis. Al igual que el anillo aórtico, el tamaño de los senos de Valsalva y de la aorta ascendente es importante para determinar el tamaño del implante a utilizar26. La medición ecocardiográfica del anillo aórtico es un área de debate ya que primero no es posible capturar en la misma imagen los puntos más bajos de anclaje valvular. Segundo, el cálculo tradicional asume una geometría circular, y se obtiene mediante el diámetro anteroposterior en el eje largo paraesternal durante sístole ventricular. La forma más común del anillo aórtico es ovalada, con un diámetro menor antero-posterior24,26; por tanto, el uso de un diámetro único lleva a subestimaciones del área del anillo26. El uso de eco-3D ayuda a obtener mejores imágenes del tracto de salida del ventrículo izquierdo incluyendo el anillo aórtico con la posibilidad de reproducir la forma oval del anillo y medir sus diámetros24,27. Sin embargo, el uso de eco transtorácico con sus limitaciones inherentes a la calidad de imágenes, conlleva discrepancias significativas cuando se compara con un diámetro similar obtenido por eco transesofágico o tomografía computarizada27.
El estudio ecocardiográfico también provee información importante sobre la morfología valvular (tricúspide, bicúspide o unicúspide), calcificación valvular y grado de restricción de la apertura aórtica28. La morfología valvular es importante debido a que los estudios iniciales solo incluyeron pacientes con válvulas aórticas trivalvas calcificadas. Los pacientes con válvulas bicúspides fueron excluidos debido a que pueden expandirse en forma asimétrica o no completamente durante el implante aórtico transcatéter29. Evidencia recientemente publicada reportó una disminución en el éxito técnico y un aumento en el porcentaje de complicación cuando el implante aórtico transcatéter se hizo en válvulas bicúspides tipo 1 en comparación con válvulas tricuspides30. Sin embargo, esto no debe considerarse una contraindicación absoluta. De forma similar, la distribución y el grado de calcificación valvular puede impactar los resultados del implante aórtico con reportes de fuga paravalvular, así como un incremento en el riesgo de oclusión coronaria o daño aórtico debido al desplazamiento de la placa calcificada durante la implantación26.
Otros datos útiles que aporta la ecocardiografía para la selección de pacientes incluyen fracción de eyección, volumen latido indexado, presión pulmonar estimada, severidad de la insuficiencia aórtica, severidad de la calcificación del anillo mitral y grado de insuficiencia o estenosis mitral22,28. La disfunción ventricular severa, la hipertensión pulmonar, así como la estenosis o la regurgitación mitral severa pueden incrementar el riesgo del procedimiento o disminuir el beneficio del implante aórtico22. Pacientes con estenosis subvalvular aórtica dinámica por movimiento anterior de la válvula mitral se identifican fácilmente con eco transtorácico.
Es relevante acotar que existe una creciente preocupación en relación a la coexistencia de amiloidosis cardíaca (ATTR) y estenosis aórtica severa, especialmente ante la presencia de hallazgos ecocardiográficos como engrosamiento del tabique interatrial, pared libre del ventrículo derecho o valvular, efusión pericárdica y apariencia granular del miocardio31,32. De igual forma, el volumen latido indexado debe ser calculado dada la alta prevalencia de amiloidosis cardíaca reportada en presencia de estenosis severa de bajo flujo con fracción de eyección conservada31,32. Adicionalmente, el uso de ecocardiografía transtorácica para la evaluación de deformidad miocárdica “strain” es un método que puede ser útil en la discriminación entre estenosis aórtica y amiloidosis cardíaca33, hecho de importancia crítica ya que ésta es el mayor determinante del pronóstico pobre en estos pacientes34.
Finalmente, durante la fase de selección del paciente el uso del eco transesofágico (ETE) aunque limitado, es importante. Esta técnica es útil cuando las imágenes transtorácicas son subóptimas o cuando existe sospecha de membranas subaórticas o endocarditis infecciosa. Adicionalmente, el ETE en eje mayor a nivel esofágico medio puede usarse para la obtención de las medidas del anillo aórtico como método alternativo a la tomografía cuando esta no está disponible, cuando el contraste no pueda ser posible o cuando sus imágenes no son óptimas22,26. Conviene resaltar que aunque las mediciones del anillo aórtico vía ETE-3D son superiores al ETE-2D o ecocardiografía transtorácica, la correlación con tomografía es solo moderada subvalorando las dimensiones anulares en un 10 y un 12%35. El eco transesofágico es superior en la evaluación de la morfología valvular y sigue siendo de gran utilidad en pacientes con bajo gradiente y para evaluar el mecanismo y la severidad cuando hay insuficiencia mitral asociada.
Tomografía cardíaca computarizadaSu uso se ha convertido en rutina en la evaluación del paciente considerado para implante aórtico transcatéter22. Su utilidad se expande desde la medición del anillo valvular y selección del tamaño del implante, hasta la valoración del acceso vascular y la determinación de planos angiográficos a utilizar durante la colocación del implante aórtico24.
La reconstrucción de múltiples fases permite también obtener imágenes en movimiento con visualización de la apertura aórtica22. Aunque la resolución temporal es subóptima, en muchos de los casos es posible obtener planimetría del área válvular aórtica. También es viable determinar la anatomía valvular aórtica en pacientes con vistas ecocardiográficas limitadas22. La severidad, distribución y extensión de las calcificaciones valvulares por tomografía, junto a la valoración ecocardiográfica, pueden identificar con mayor precisión aquellos pacientes con riesgo de implantación subóptima o complicaciones como fuga paravalvular, bloqueo atrioventricular avanzado, ruptura anular u oclusión coronaria por desplazamiento de la placa calcificada durante el implante valvular22,26.
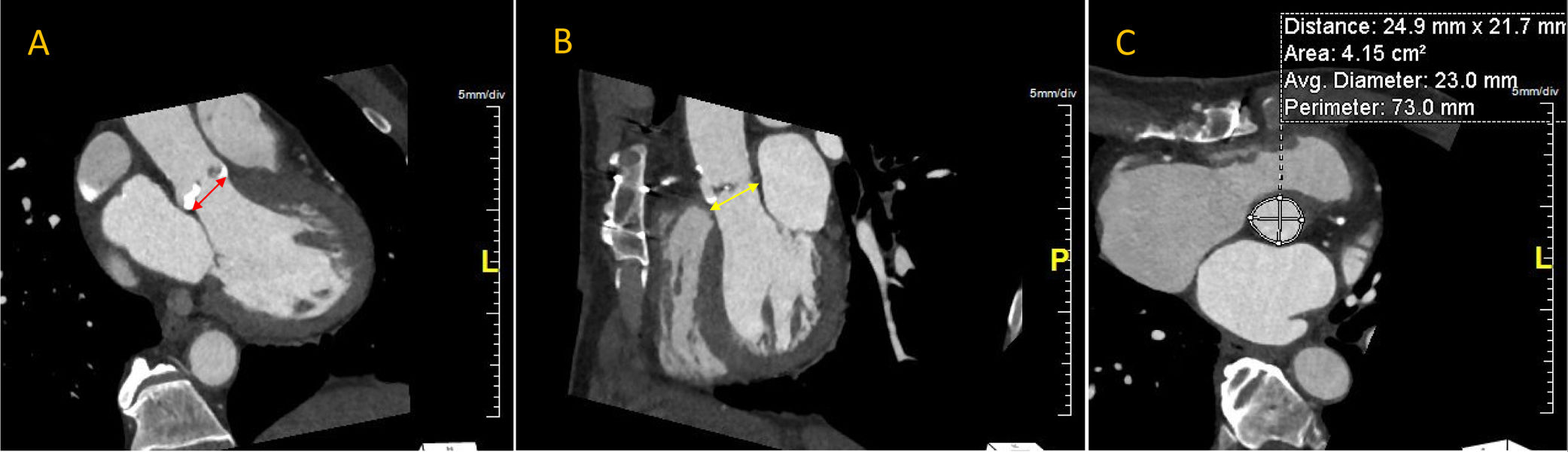
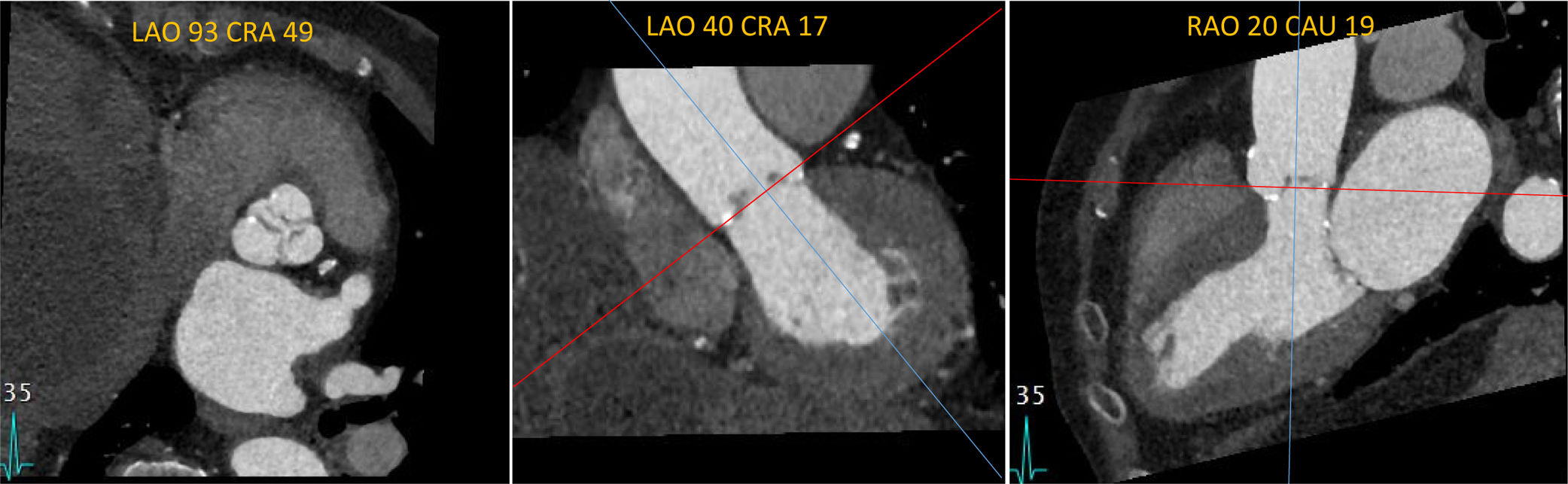
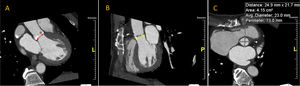
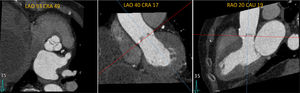
Debido a que la tomografía adquiere información volumétrica 3D, es posible la reconstrucción precisa del tracto de salida del ventrículo izquierdo, del anillo aórtico y del complejo aorto-anular (fig. 2)24,36. La deformación pulsátil del anillo aórtico durante el ciclo cardíaco no altera las mediciones por tomografía debido a la sincronización por electrocardiograma22. La tomografía cardíaca es la técnica de elección para la medición del anillo aórtico, y la selección del tamaño de la válvula protésica con esta modalidad se ha correlacionado con una incidencia de fuga paravalvular37,38. El reporte final de la tomografía debe incluir los diámetros, el área y el perímetro o circunferencia del anillo aórtico.
Imágenes del anillo aórtico por tomografía computarizada. (A) Plano coronal a través del eje mayor del tracto de salida del ventrículo izquierdo. El eje mayor antero-posterior se indica con la flecha roja. (B) Plano sagital a través del eje mayor del tracto de salida del ventrículo izquierdo; con la flecha amarilla se indica el eje menor del anillo aórtico. (C) Plano transverso con reconstrucción multi-planar. Note la forma oval con un diámetro menor antero posterior y un eje mayor latero-medial.
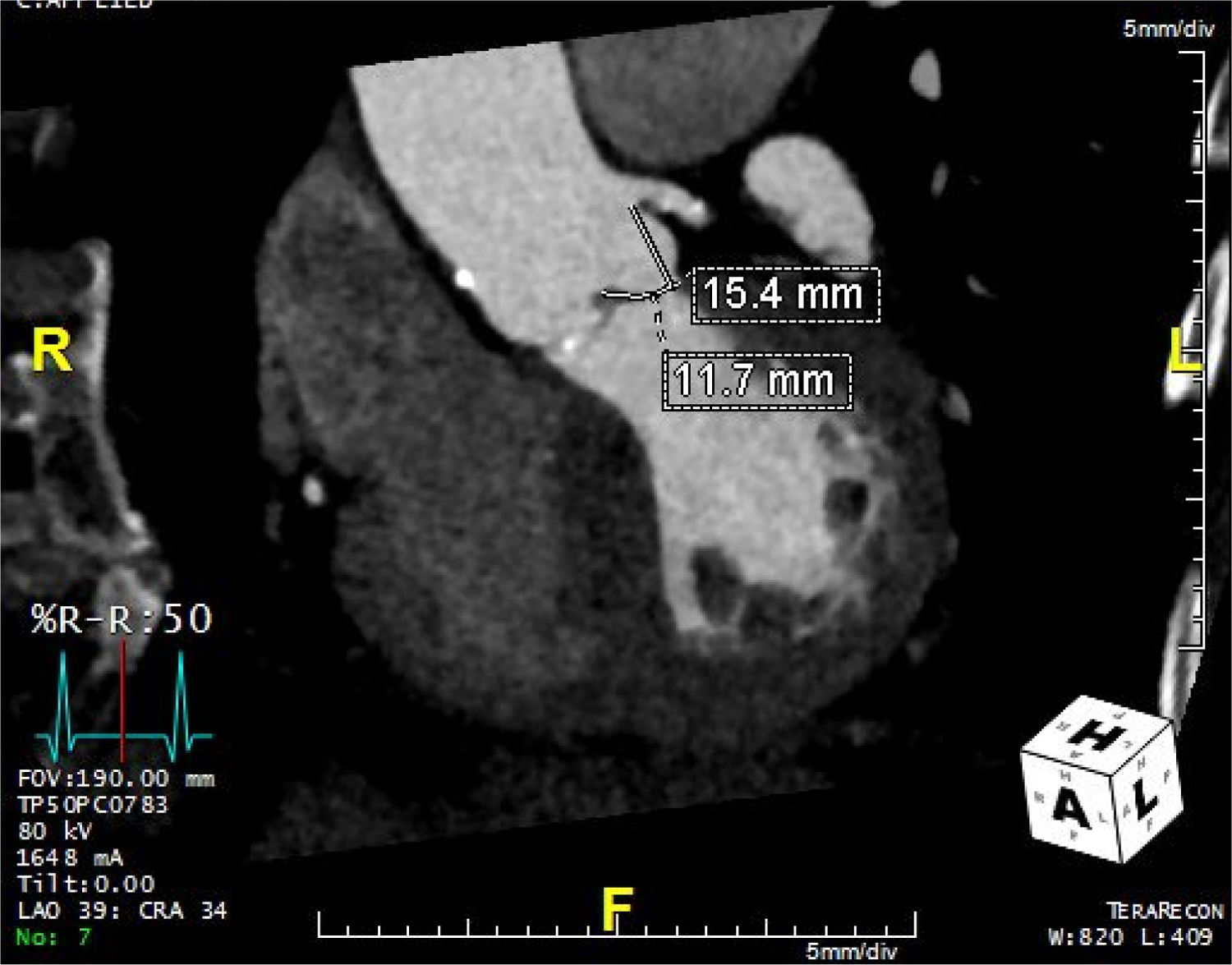
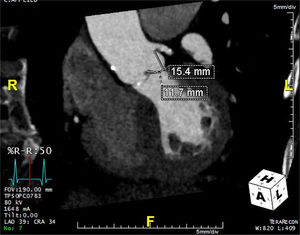
La tomografía además ofrece una medición de alta fidelidad del complejo aorto-anular incluyendo la raíz aórtica, los senos de Valsalva, la altura del ostium de las arterias coronarias y su relación espacial con el anillo aórtico y las valvas aórticas22. Las dimensiones de los senos de Valsalva son importantes para asegurar que pueden contener el implante aórtico sin complicaciones como la oclusión coronaria39. De igual relevancia es la altura de los ostium coronarios, ya que la implantación valvular en un paciente con una posición baja del ostium coronario en relación con la longitud de las valvas, puede conducir a una oclusión coronaria40 (fig. 3). En este escenario, cuando la prótesis abre y levanta la válvula nativa es posible que esta ocluya total o parcialmente el ostium. Si el ostium coronario está a más de 10-14mm del anillo el riesgo se considera bajo39,41. En algunos pacientes con dimensiones limítrofes puede considerarse la colocación profiláctica de una guía de angioplastia en el tronco de la coronaria izquierda cuando esta no se encuentra protegida por puentes aorto-coronarios22.
Tomografía computarizada que muestra los ostium de las coronarias y la distancia desde el anillo aórtico. Nótese el origen alto de la coronaria izquierda a nivel de la unión sino-tubular. Las medidas representan la longitud de la valva y la distancia entre el anillo aórtico y el orificio del tronco de la coronaria izquierda.
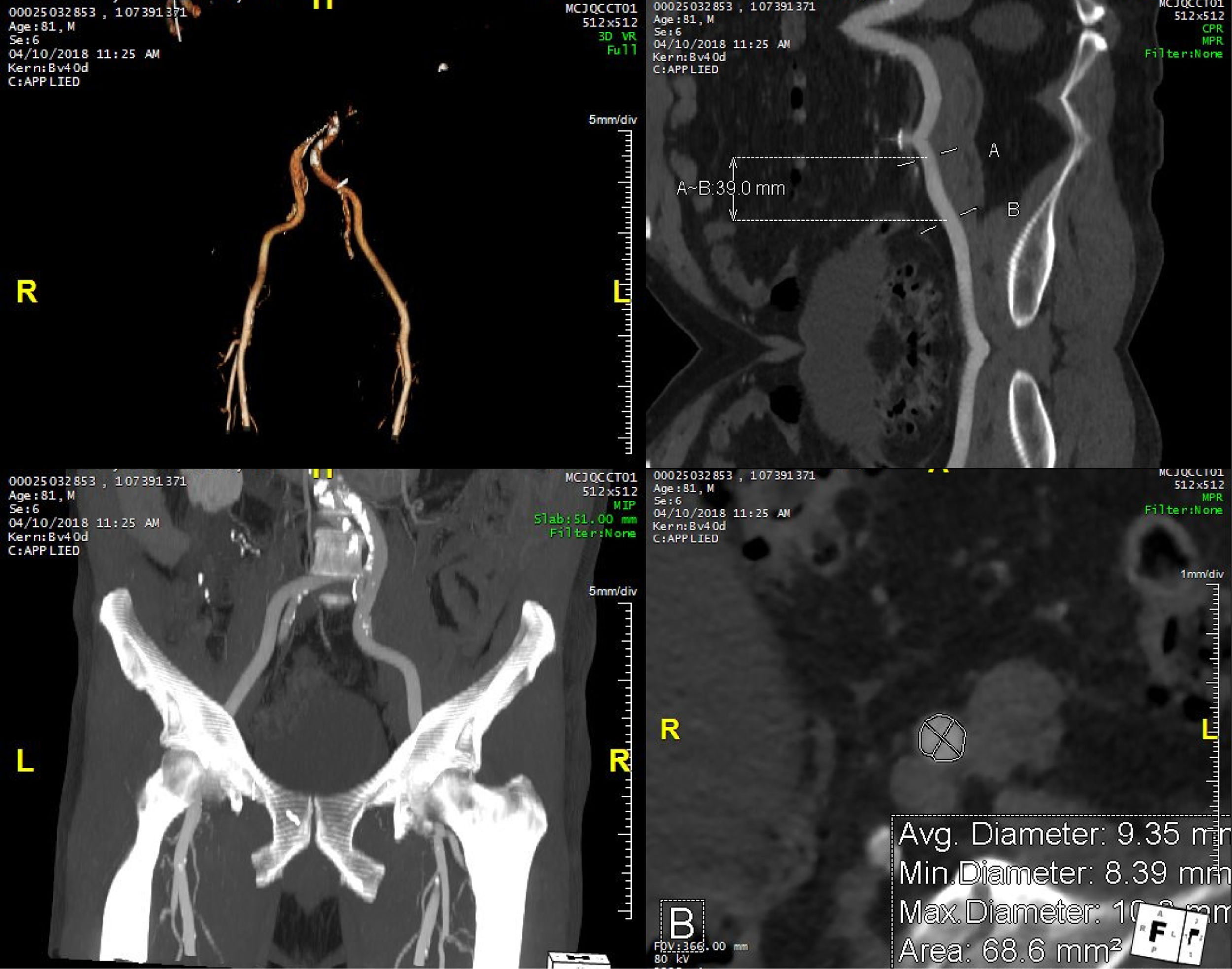
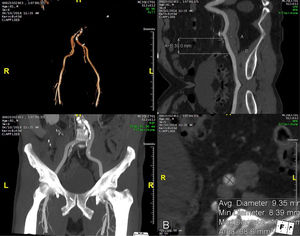
La tomografía permite evaluar la aorta desde la raíz hasta la bifurcación y los vasos pélvicos. Es el método de elección para determinar el acceso vascular óptimo y excluir la presencia de aorta en porcelana en caso de acceso transaórtico24,42. El uso rutinario de la tomografía en la valoración del acceso vascular ha conducido a una reducción en morbilidad y mortalidad debido a una disminución en el número de daños vasculares24. Hallazgos como tamaño del vaso, diámetro luminal menor, tortuosidad y grado de calcificación y aterosclerosis pueden ser evaluados con detalle, al igual que lo son la identificación de hallazgos de alto riesgo como disecciones o ateromas complejos. Esto es particularmente útil en la evaluación de los vasos pélvicos para acceso vascular (fig. 4) 24. La aterosclerosis severa, el diámetro luminal reducido y las angulaciones mayores a 90° pueden contraindicar el implante de catéteres de gran diámetro. Se ha establecido que una proporción catéter/arteria femoral mayor a 1,05 esté asociado a daño vascular y mortalidad43. Con el progreso tecnológico y el menor calibre de catéteres y dispositivos, es posible que estos aspectos sean menos críticos, incluyendo el diámetro luminal menor requerido, pero siempre serán relevantes.
Valoración de los vasos pélvicos mediante el uso de la tomografía computarizada. Ejemplos de vasos pélvicos en paciente en consideración para implante aórtico transcatéter permitiendo la medición de diámetros luminales, así como la determinación del grado de aterosclerosis y calcificación.
Finalmente, la tomografía se ha usado para hallar el plano angiográfico más adecuado a fin de obtener un plano perpendicular a la raíz aórtica con el beneficio agregado de una reducción del tiempo de fluoroscopia y el uso de contraste44,45 (fig. 5). De igual manera, esta modalidad ofrece una descripción detallada de la relación espacial entre las estructuras cardíacas incluyendo puentes aortocoronarios preexistentes y la caja torácica en caso de requerir acceso de emergencia vía estereotomía o toracotomía22.
Resonancia magnética cardíacaLa resonancia magnética en la valoración del paciente con indicación para implante aórtico transcatéter puede ser utilizada para la determinación de la severidad de la estenosis aórtica, la evaluación de la función ventricular, así como en la medición del anillo aórtico22,42. La experiencia de esta modalidad en la valoración del paciente con indicación para implante aórtico transcatéter es limitada.
Mediante el uso de la resonancia magnética es posible determinar la severidad de la estenosis aórtica a través de la medición de flujo y la ecuación de continuidad o el cálculo del orificio valvular menor usando planimetría42. Se debe resaltar que la medición de velocidades en imágenes de flujo por resonancia subestima sistemáticamente la velocidad máxima a través de la valvular aórtica46. Por tanto, esta técnica solo debe usarse como modalidad alternativa al ecocardiograma cuando este ofrece información poco concluyente46.
De igual forma, la resonancia magnética es útil en la determinación de la geometría (diámetros y volúmenes) y función ventricular derecha e izquierda como técnica alternativa a la ecocardiografía transtorácica en presencia de ventanas acústicas subóptimas42. El beneficio añadido del uso de gadolinio permite también la identificación de miocardiopatías infiltrativas coexistentes o el grado de fibrosis miocárdica en la miocardiopatía isquémica22. Esto es importante ya que la presencia de fibrosis cardíaca predice el riesgo de muerte por causa cardiovascular luego del implante aórtico percutáneo47,48. De igual manera, la resonancia es útil en la valoración del paciente con estenosis aórtica de gradiente paradójico bajo dada una prevalencia significativa de enfermedades infiltrativas como amiloidosis cardíaca48. La resonancia, contrario a la ecocardiografía, no estima la presión pulmonar de importancia pronóstica en el paciente considerado para implante aórtico transcatéter42.
La medición de anillo aórtico por resonancia magnética se acerca más a la medida real que las dimensiones obtenidas por tomografía o ecocardiografía49. Mientras unos reportan que en promedio el anillo aórtico medido por ETE-3D es 1,3mm más pequeño que la resonancia, el anillo aórtico por tomografía tiende a ser 1,3mm más grande49. Otros han reportado una excelente correlación con medida de anillo aórtico similar entre la tomografía y la resonancia magnética22,42. Esta técnica también puede utilizarse para la obtención total de las medidas del complejo aorto-anular22. El uso de la resonancia magnética 3D sincronizada sin contraste es una opción para aquellos pacientes con disfunción renal severa con contraindicación para el uso de contraste necesario para la tomografía cardíaca22,42.
Debido a la pobre identificación de calcificaciones, el uso de la resonancia magnética en la valoración del acceso vascular es limitado. Cuando la resonancia se utiliza para este propósito el gadolinio permite determinar las dimensiones del vaso en estudio. La resonancia magnética 3D sin contraste puede ser una alternativa a la tomografía, cuando no puede usarse contraste, para la valoración de la aorta torácica en caso de acceso apical o transaórtico. Sin embargo, esta modalidad no puede excluir aorta en porcelana y requiere la obtención conjunta de una tomografía de tórax sin contraste42.
Angiografía coronariaLa enfermedad coronaria es prevalente (50-75%) en el paciente con indicación de implante aórtico transcatéter, de tal forma que la angiografía coronaria se recomienda como rutinaria. El beneficio de la revascularización coronaria rutinaria en pacientes sin angina sugiere la revascularización de estenosis proximales mayores al 70% o estenosis en el tronco de la coronaria izquierda mayores al 50%. Sin embargo, su indicación y el tiempo óptimo deben determinarse caso por caso50. Adicionalmente, la medición hemodinámica invasiva del gasto cardíaco y de los gradientes transvalvulares durante la angiografía es útil cuando la valoración de estenosis aórtica por ecografía no es concluyente.
Imágenes cardiovasculares durante el implante aórtico transcatéterEntre los objetivos de las imágenes cardiovasculares durante la implantación de la prótesis aórtica trans-catéter se incluyen determinar el mejor implante valvular para el paciente, valorar posición y función valvular luego de su colocación e identificar complicaciones inmediatas24.
El implante aórtico trans-catéter en la actualidad es guiado primariamente mediante fluoroscopia, máxime ahora que hay una larga experiencia acumulada22. Las guías y los catéteres pueden ser visualizados desde el punto de acceso hasta la válvula aórtica. Desde el punto de vista angiográfico, la calcificación de la válvula aórtica sirve como referencia para la colocación del dispositivo. Los ángulos óptimos de implantación se obtienen mediante fluoroscopia facilitados por las imágenes tomográficas obtenidas en la valoración inicial del paciente22. Durante la expansión lenta del implante, inyecciones pequeñas de contraste permiten ajustar la posición final del implante antes de que sea totalmente expandido24.
Otras modalidades propuestas como guía durante el implante aórtico transcatéter incluyen ecocardiografía, resonancia magnética y fusión de tomografía con angiografía.
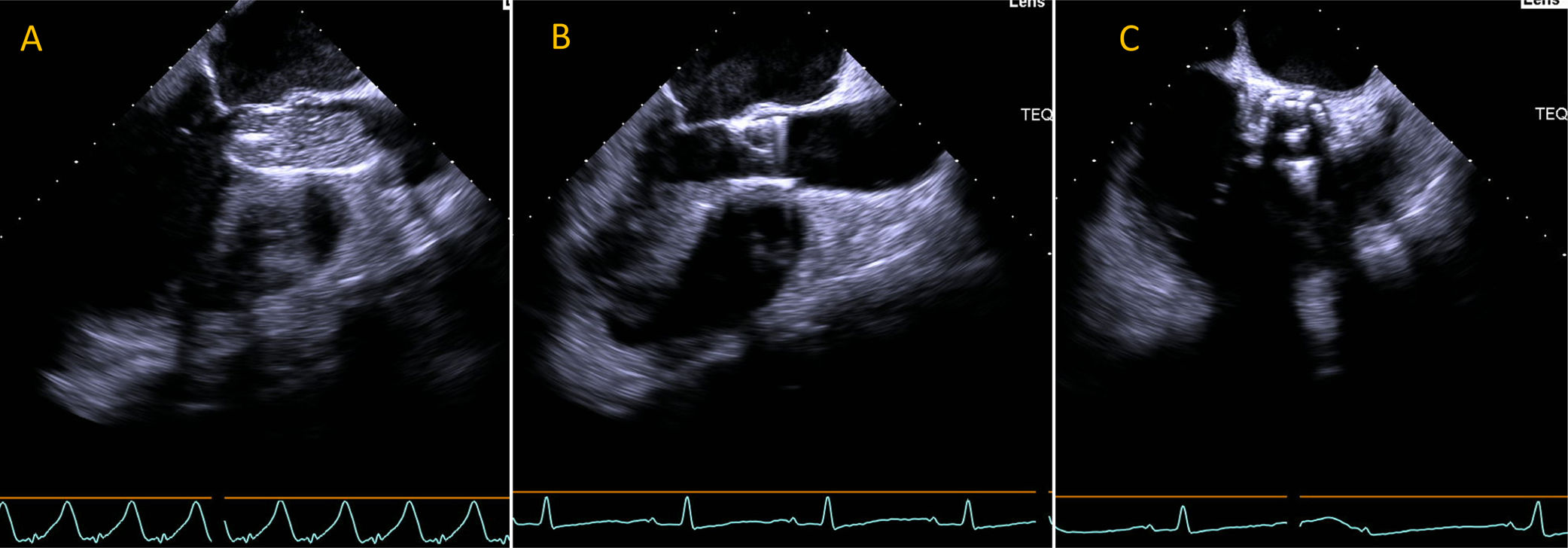
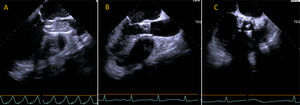
EcocardiografíaEl ETE se usó como guía auxiliar para la implantación de la prótesis valvular (fig. 6). La visualización en tiempo real del anillo aórtico, el tracto de salida del ventrículo izquierdo y el dispositivo valvular permite asegurar una posición perpendicular del dispositivo en relación con el tracto de salida y ajustar la posición de la válvula durante la expansion24. Para evitar fuga paravalvular, la válvula debe cubrir las valvas nativas con el límite valvular inferior sobrepasando escasamente el anillo aórtico24.
Expansión por balón de válvula percutánea visualizada con ecocardiograma transesofágico. (A) Imagen en plano que muestra eje sagital durante la expansión del balón para la colocación de la válvula percutánea. (B) Imagen luego del implante valvular en el mismo plano y transversal (C).
El ETE es útil para la confirmación de la dimensión del anillo aórtico durante el procedimiento en pacientes que han recibido anestesia general22,51. Cuando las medidas obtenidas por métodos no invasivos previas son discordantes, existen calcificaciones asimétricas o válvulas excéntricas, la valvuloplastia aórtica por balón calibrado puede ser útil para la medición del anillo aórtico y la selección de la prótesis adecuada durante el procedimiento36. Mientras se realiza el implante puede ser difícil visualizar con precisión el borde ventricular de la prótesis. Con la válvula colapsada es fácil confundirla con el catéter balón.
De igual forma, el ETE inmediatamente después de expandida la válvula es útil para corroborar el nivel de colocación, determinar el movimiento de las valvas protésicas e identificar insuficiencia aórtica y descartar derrame pericárdico22,24. El eje largo permite evaluar la aposición de estas prótesis y su relación con el anillo aórtico y el tracto de salida del ventrículo izquierdo. Se requieren múltiples planos ecocardiográficos en la valoración de una fuga paravalvular ya que el origen puede no ser evidente inicialmente. Mientras catéteres y guías estén cruzando la válvula, siempre existirá algún grado de regurgitación transvalvular y por ello la presencia de insuficiencia valvular debe evaluarse una vez todas las guías y catéteres han sido retirados. Es común observar que la severidad de la regurgitación aórtica luego del implante disminuya al cabo de 30 minutos. La detección de una fuga paravalvular de severidad superior a solo mínima debe generar una consideración inmediata para dilatación con balón por segunda vez, ya que en muchos casos resulta en una mejoría significativa del grado de regurgitación24.
Aunque el implante aórtico transcatéter es un procedimiento relativamente seguro, se ven complicaciones severas en alrededor del 8% de los casos, 1% de los cuales requieren cirugía de emergencia52. El uso combinado del fluoroscopia y ETE permite la detección temprana de complicaciones que incluyen oclusión coronaria, taponamiento cardíaco, migración ventricular o sistémica del implante valvular, perforación anular o disección aórtica24. Nuevas tecnologías facilitan el corregistro de las imágenes del ETE con la fluoroscopia y mostrar una sobrepuesta a la otra en tiempo real.
Recientemente, en muchos laboratorios el uso de ETE ha disminuido de manera significativa y ha sido reemplazado por el ecocardiografía transtorácica fundamentalemente para la evaluación de insuficiencia aórtica postimplante y para descartar derrame pericárdico. Sin embargo, en programas que estén iniciando su experiencia con implante aórtico transcatéter el uso de ETE sigue teniendo valor.
Fusión de tomografía y angiografíaExiste un gran interés en la fusión de diferentes modalidades en una imagen híbrida para la guía de procedimientos estructurales percutáneos, y el implante aórtico transcatéter no es la excepción. La fusión de imágenes tomográficas y fluoroscópicas permite la visualización en alta definición del anillo aórtico y otras estructuras anatómicas importantes sin el uso de contraste. Esta podría ser una solución para el paciente con insuficiencia renal severa cuando pueda lograrse la fusión en vivo de las imágenes53.
Resonancia magnética cardíacaRecientemente se ha descrito el uso de la resonancia magnética en vivo para la guía durante la implantación del implante aórtico transcatéter en modelos animales42. Este procedimiento necesitaría catéteres compatibles con la resonancia magnética. Hasta la fecha, este modo de guía permanece como modelo netamente experimental. El beneficio técnico y clínico de este método con mejor definición de tejidos blandos sin uso de contraste no ha sido determinado42.
Imágenes cardiovasculares en seguimiento postimplante aórtico transcatéterLos objetivos de las imágenes cardiovascular en el seguimiento del paciente con implante aórtico transcatéter incluyen evaluación seriada de la hemodinámica valvular, cuantificación de la regurgitación valvular y paravalvular, determinación del impacto del implante en la remodelación cardíaca, detección de complicaciones tardías y valoración rutinaria de otras enfermedades24.
La ecocardiografía es el método de elección para el seguimiento a largo plazo del paciente con implante aórtico transcatéter22,54. Se recomienda realizar ecocardiografía transtorácica de seguimiento antes del alta hospitalaria, a los 6 y 12 meses y luego cada año54. Sin embargo, existe un interés creciente en el uso adjunto de otras modalidades en el seguimiento de estos pacientes incluyendo la tomografía y la resonancia cardíaca.
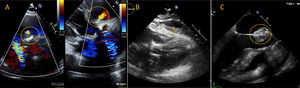
EcocardiografíaEn primer lugar, el estudio ecocardiográfico debe valorar la apariencia de la prótesis valvular, el grosor y la movilidad de sus valvas, así como su posición en relación con el anillo aórtico (2-4mm por debajo para válvulas de expansión por balón y 3-5mm para válvulas autoexpandibles)54. El Doppler color es el siguiente paso para la detección de regurgitación, la cual es usualmente paravalvular y con frecuencia difícil de detectar. La extensión circunferencial en el eje corto paraesternal se sugiere como medida de severidad: <10% leve, 10-20% moderada y >20% severa (fig. 7). El ecocardiograma tiende a subestimar la fuga paravalvular pero por fortuna con las nuevas generaciones de válvulas, raras veces se observa insuficiencia aórtica significativa. El uso subsecuente de Doppler espectral permite una valoración hemodinámica de la prótesis en forma cuantitativa mediante la obtención de parámetros dependientes (gradientes máximo y medio) e independientes de flujo (área del orificio efectivo e índice de velocidad Doppler). Estas medidas deben obtenerse en límite inferior de la prótesis ya que existe aceleración de flujo por debajo de la válvula y por encima de las valvas. Los rangos normales para cada una de estos parámetros dependen del tipo y tamaño de la prótesis, válvula aórtica nativa y detalles del procedimiento. Estos valores deben ser consistentes en diferentes modos de medición y deben ser analizados en serie más que en valores absolutos54. Esta modalidad también permite valorar las dimensiones y función ventricular tanto izquierda como derecha54. Normalmente al implante aórtico transcatéter le siguen una mejora en la fracción de eyección y función diastólica, así como una reducción de la masa del ventrículo izquierdo y regurgitación mitral24.
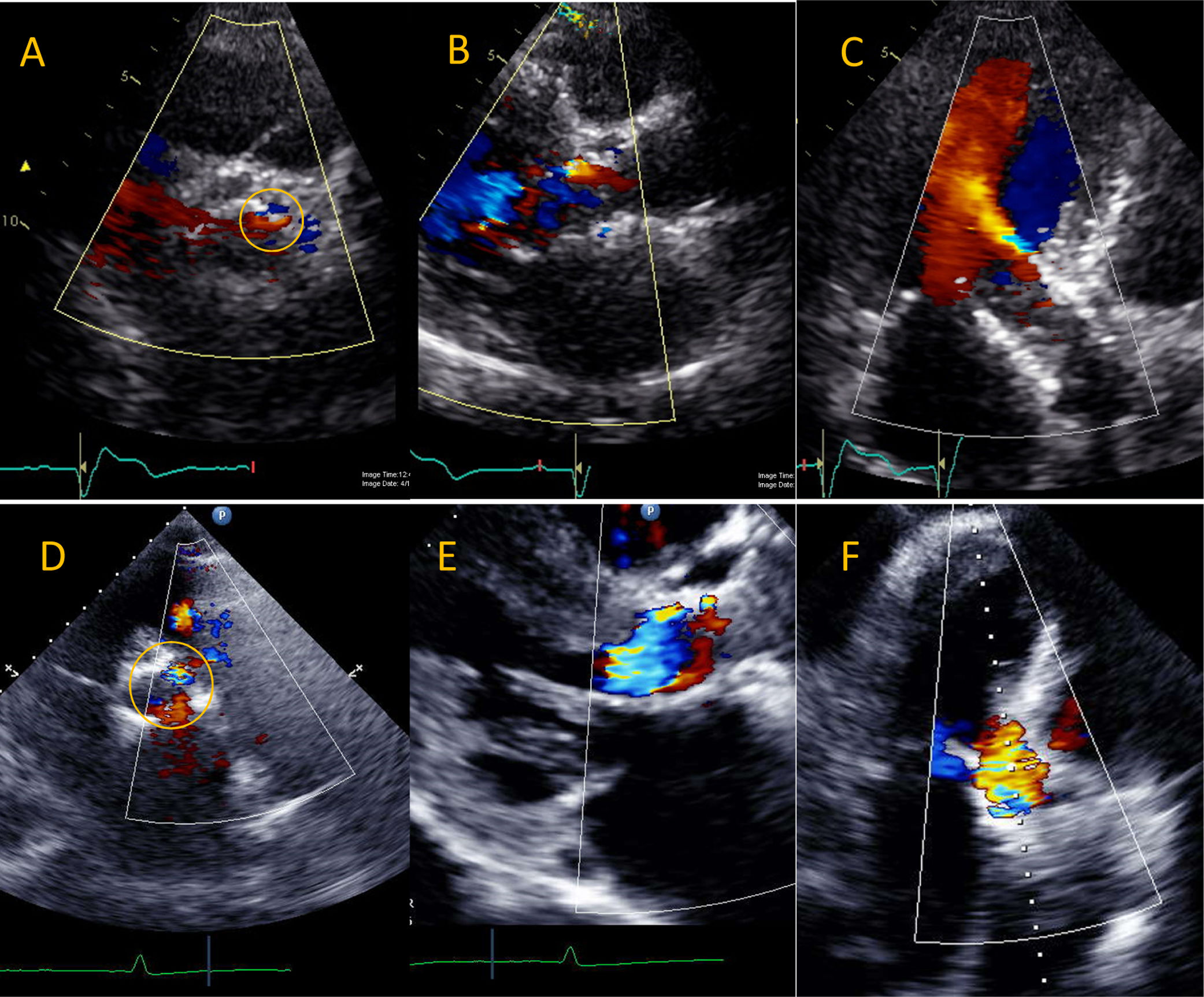
Ejemplos de insuficiencia aórtica paravalvular después de implante aórtico transcatéter. El panel superior muestra un origen anterior de la fuga paravalvular en válvula expandida por balón (círculo). La fuga parece trivial en el eje transversal (A) pero en un plano paraesternal largo (B) y apical de 5 cámaras se detecta fuga de grado moderado (C). El Panel inferior muestra fuga paravalvular severa en válvula autoexpandible en plano transverso (D), longitudinal (E) y apical de 5 cámaras (F).
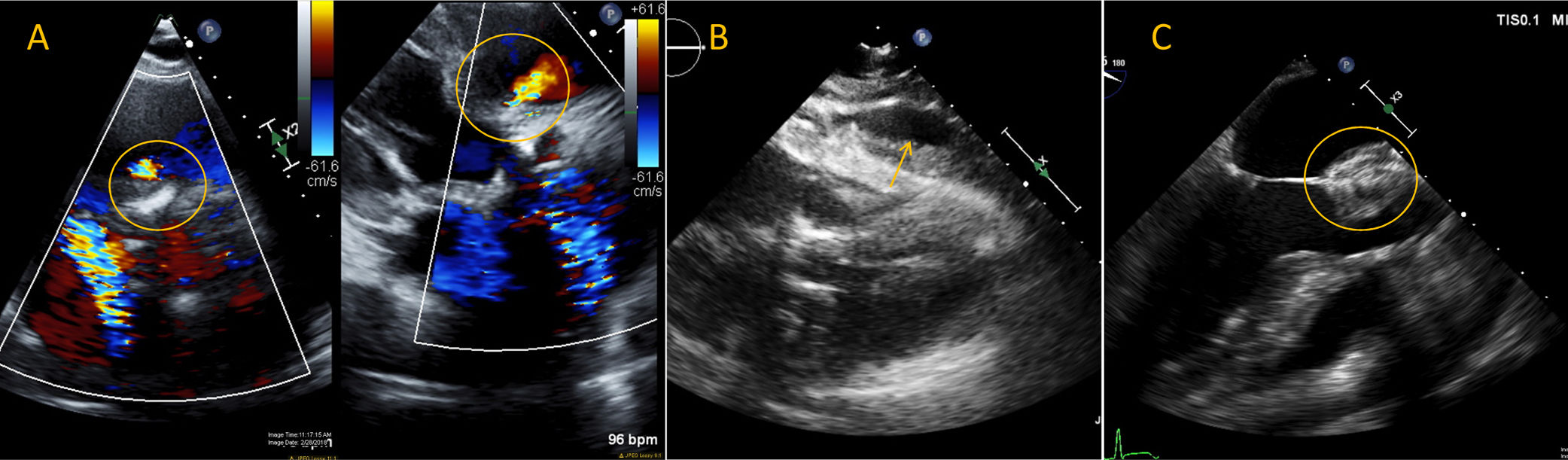
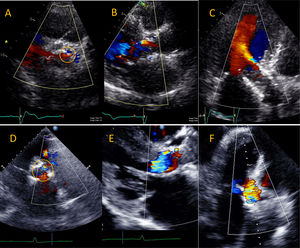
El ecocardiograma transtorácico es útil en la detección de complicaciones tempranas y tardías como la trombosis valvular, la migración distal o proximal de la próstesis, el desajuste paciente-prótesis, la fuga paravalvular y la disfunción valvular. Adicionalmente, esta modalidad es útil en la detección de efusión pericárdica y de la ruptura anular incipiente, así como de la identificación de endocarditis infecciosa protésica y de disfunción mitral debido a la compresión de la valva anterior como consecuencia de la migración proximal de la próstesis54 (fig. 8).
Complicaciones tempranas y tardías del implante aórtico transcatéter: ruptura anular con comunicación interventricular, derrame pericárdico y endocarditis infecciosa con absceso. En el panel A, nótese la presencia de señal Doppler (círculos) entre el tracto de salida del ventrículo izquierdo y el ventrículo derecho (A) en plano transverso a la derecha y apical a la derecha. Esto concuerda con ruptura anular durante el implante con creación de una comunicación interventricular. En el panel B se observa derrame pericárdico (flecha) pinmediatamente postimplante en paciente en taponamiento cardíaco. El panel C muestra un engrosamiento valvular posterior con evidencia de formación de absceso (círculo) en paciente con endocarditis infecciosa luego de implante aórtico percutáneo.
Esta técnica es útil en la evaluación estructural del implante aórtico cuando existe sospecha de trombosis valvular. De igual forma, la tomografía es la técnica de elección para confirmar fractura del stent54.
En un porcentaje importante de pacientes (13-40%) con valoración hemodinámica normal vía ecocardiografía transtorácica, la tomografía cardíaca 4D revela hallazgos valvulares compatibles con trombosis valvular subclínica incluyendo engrosamiento hipoatenuado de valvas con o sin reducción de movilidad valvular asociada54,55. Pacientes con trombosis subclínica más frecuentemente tienen un gradiente transvalvular de más de 20mm Hg y experimentan mayor número de eventos isquémicos transitorios durante el seguimiento clínico55. Estudios recientes sugieren que el engrosamiento hipoatenuado de valvas tiene una presentación a mediano plazo meramente subclínica lo cual es respaldado por la discordancia entre la alta prevalencia de estos hallazgos y la baja incidencia de accidente cerebrovascular isquémico en los estudios aleatorizados iniciales56. En la actualidad se desconoce la significancia clínica de estos hallazgos a largo plazo y su impacto en la longevidad de la válvula. Aunque el uso de anticoagulación conlleva la resolución de la trombosis valvular subclínica, se desconoce si la tomografía cardíaca 4D de rutina para la detección de trombosis subclínica con el uso subsecuente de anticoagulación se traduce en un mejor pronóstico luego del implante aórtico transcatéter55. En la práctica, el engrosamiento hipoatenuado con reducción de la excursión de la valva usualmente es una indicación para anticoagulación.
Resonancia magnética cardíacaAlgunos abogan por el uso de la resonancia magnética cardíaca como tecnología útil en el seguimiento de pacientes luego de implante aórtico transcatéter. Esta tecnología ofrece mayor precisión en la detección de fuga paravalvular con menor variabilidad interobservador. Se estima que la resonancia magnética reclasifica la mitad de los pacientes con fuga paravalvular, en su mayoría incrementado un grado de severidad en comparación con la ecocardiografía transtorácica hecho que tiene importantes implicaciones pronósticas42,48. Como se expresó anteriormente la fuga paravalvular constituye un problema menor con la última generación de válvulas.
La resonancia también ofrece una evaluación del remodelado cardíaco de alta fidelidad, técnica que no solo evalúa al ventrículo izquierdo, sino que también informa sobre cambios morfológicos y funcionales del ventrículo derecho. El uso de gadolinio permite determinar el posible impacto del implante aórtico transcatéter sobre el grado de fibrosis cardíaca basal generado por la estenosis aórtica severa42.
Finalmente, la resonancia magnética permite determinar el grado de daño miocárdico durante el implante aórtico transcatéter debido a isquemia subendocárdica. Se estima que en el 99% de los pacientes luego del implante aórtico se detecta una elevación en los niveles de troponina, pero solo un 20% tiene una nueva área con retención de gadolinio en distribución coronaria42. Estos pacientes experimentan una reducción en la fracción de eyección comparado con aquellos en quienes no se observa una nueva área de retención de gadolinio48.
Perspectivas futuras y conclusionesEl desarrollo de esta tecnología avanza rápidamente en tiempos actuales de la mano de nuevos modelos valvulares y sistemas de implantación. Esto ha simplificado el implante aórtico transcatéter con mayor éxito procedural y clínico reduciendo el número de complicaciones. En el futuro, se espera que esta tecnología se expanda a pacientes con bajo riesgo quirúrgico dependiendo de ensayos clínicos en curso. Adicionalmente, nuevas indicaciones tales como el uso en válvulas biológicas degeneradas o en pacientes con insuficiencia aórtica predominante serán potencialmente consolidadas. El uso de técnicas de imágenes deberá ser adaptado a las tecnologías emergentes, pero siempre tendrán un papel fundamental en la selección de los pacientes, apoyo y dirección durante el procedimiento y para el seguimiento. El entrenamiento de nuevas generaciones de cardiólogos debe incluir estos aspectos.
Conflicto de interesesNinguno.