La isquemia miocárdica es el conjunto de una serie de fenómenos fisiológicos que se manifiesta por condiciones clínicas como isquemia silente, angina estable y síndromes coronarios agudos. Diversos mecanismos de la regulación del flujo sanguíneo, la demanda miocárdica, la liberación de adenosina y la función del endotelio en las arterias coronarias son claves para mantener la irrigación miocárdica y han sido la base fisiológica para el desarrollo de pruebas de detección de isquemia como lo es el flujo de reserva fraccional, que hoy día hace parte de las recomendaciones de las guías.
Myocardial ischaemia as a whole is a series of physiological phenomena manifested by clinical conditions such as silent ischaemia, stable angina and acute coronary syndromes. Various blood flow regulation mechanisms, myocardial demand, adenosine release and endothelial function in the coronary arteries are vital for maintaining myocardial irrigation, and have been the physiological basis for tests like fractional flow reserve, developed to detect ischaemia, that today forms part of the guideline recommendations.
La carga global de enfermedades cardiovasculares es responsable de 17,3 millones de muertes por año, y se espera que aumente a 23,6 millones en 20301. Estas enfermedades cardiovasculares constituyen la principal causa de muerte y discapacidad en el mundo, con una carga económica de 47 trillones de dólares para los próximos 25 años. Aunque la incidencia mundial de hipertensión, tabaquismo e hipercolesterolemia ha disminuido, la obesidad, la diabetes y el envejecimiento han aumentado dramáticamente en el mundo, y con ello la posibilidad de padecer de alguna de estas enfermedades cardiovasculares2–8.
La aterotrombosis, la angina inestable, el infarto del miocardio y la muerte súbita cardiaca, también conocidos como síndromes coronarios agudos, son manifestaciones catastróficas de la isquemia miocárdica, en tanto que la isquemia silente, la angina estable y la cardiopatía isquémica son manifestaciones crónicas de esta condición, y todas son potencialmente reversibles. Sin embargo, el síndrome coronario agudo puede llevar a isquemia irreversible que genera daño miocárdico permanente. La razón por la que la oclusión coronaria puede desarrollar un síndrome coronario o un evento asintomático está relacionada con mecanismos de defensa múltiples y fascinantes, envueltos en la regulación del flujo sanguíneo coronario. La primera parte de este artículo estará dedicada a entender la isquemia miocárdica y el flujo sanguíneo coronario, mientras la segunda y tercera tratarán las manifestaciones clínicas de la isquemia miocárdica, controversias actuales y proyecciones futuras.
Isquemia miocárdicaEl corazón prácticamente no tiene reservas de oxígeno y depende casi por completo del metabolismo aeróbico para funcionar. La isquemia miocárdica se define como la falta de balance entre el aporte y la demanda de oxígeno, y esta puede ser variable, dinámica y reversible. La hipoxia, que es una disminución únicamente del aporte de oxígeno, puede desarrollarse por la isquemia, que a su vez también genera pérdida de la presión hidrostática, reducción de la entrega de los sustratos para la producción de energía y disminución en la eliminación de residuos producto de la lesión celular. Por lo tanto, la hipoxia y la isquemia están relacionadas pero no son exactamente la misma entidad.
La reducción súbita del flujo sanguíneo coronario o isquemia aguda, usualmente es secundaria a obstrucción epicárdica por aterotrombosis o espasmo coronario; esta isquemia también se conoce como de bajo flujo, bajo aporte o baja suplencia, y es responsable de los síndromes coronarios agudos y de la muerte súbita. No obstante, la isquemia miocárdica no debe definirse solamente como bajo flujo, ya que si la demanda de oxígeno también es baja, tanto la suplencia como la demanda podrían estar balanceadas9,10. Esto evidencia la limitación que existe en el cálculo de la isquemia miocárdica basado únicamente en los datos de las pruebas de perfusión miocárdica11.
Por su parte, la reducción crónica del flujo sanguíneo coronario se ve más a menudo en la enfermedad arterial coronaria estable, y es responsable de la cardiopatía isquémica y la angina. En estas condiciones el flujo sanguíneo coronario es relativamente fijo e insuficiente para incrementarse en casos de taquicardia, anemia y ejercicio, hecho que lleva a isquemia por aumento en la demanda12.
Cascada isquémicaEn los primeros segundos luego de una oclusión coronaria, la presión de oxígeno miocárdico cae rápidamente y ocurre disfunción ventricular; ya que la falta de oxígeno altera el metabolismo del calcio sarcomérico, cambiando la rigidez miocárdica y la relación de presión/volumen diastólica. La isquemia de suplencia se manifestará entonces como dolor torácico seguido por falla cardiaca diastólica y congestión pulmonar. Si esta no se corrige, una alteración sostenida en el metabolismo del calcio sarcomérico llevará a disfunción sistólica y asinergia regional que podrán inducir inestabilidad hemodinámica.
Luego de ocho segundos de reducción en el flujo sanguíneo coronario, el metabolismo de la energía miocárdica cambia inmediatamente de aeróbico o mitocondrial a glicólisis anaeróbica; este cambio en el metabolismo ocurre luego de que el tejido subperfundido consume las reservas de oxígeno almacenadas como oxihemoglobina y oximioglobina. Entonces la glicólisis anaeróbica tomará el mando y proporcionará un 80% de nuevos fosfatos de alta energía en la zona isquémica13. Sin embargo, la glicólisis anaerobia se torna luego insuficiente para cumplir con las demandas del miocito, lo cual lleva a disminución del ATP y acumulación del ADP. Esta depresión progresiva de energía conduce a falta de acoplamiento entre la excitación y contracción, y la asinergia del miocito. La fosfocreatina, que es la mayor reserva de fuente de energía, también disminuye rápidamente, agotándose en un 90% luego de 30 segundos de isquemia, generándose así acidosis tisular y salida de potasio del espacio extracelular, con edema intracelular ligero. Si el flujo no se restablece, los niveles de ATP caerán por debajo de lo que se requiere para mantener la función de la membrana, iniciándose así una cascada irreversible de muerte del miocito.
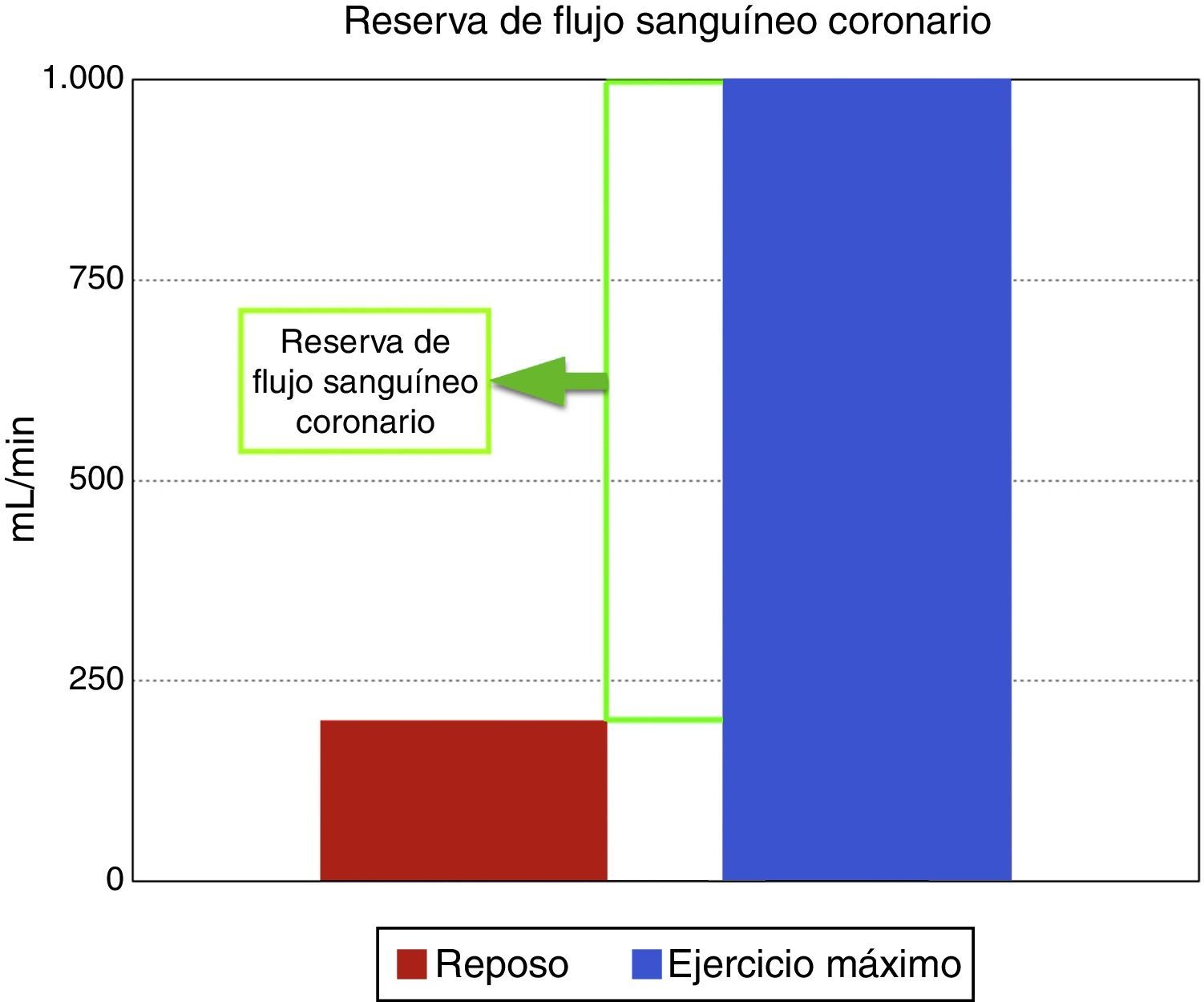
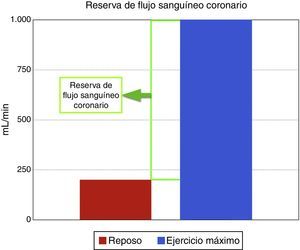
Regulación del flujo sanguíneo coronarioEl flujo coronario es una respuesta directa al consumo de oxígeno miocárdico, el cual en reposo es aproximadamente de 200ml/min y durante el ejercicio máximo puede incrementarse a 1.000ml/min, aumento conocido como la reserva de flujo sanguíneo coronario (fig. 1). El mecanismo por el cual los lechos coronarios adaptan el flujo sanguíneo a la carga de trabajo cardiaco se conoce como autorregulación coronaria, que es el incremento de la reserva de flujo sanguíneo coronario para igualar o responder a la demanda de oxígeno. Las arterias epicárdicas no crean una resistencia significativa al flujo sanguíneo, e incluso a altas tasas de flujo inducidas por el ejercicio o infusión de adenosina, solo existe una diferencia mínima entre la presión central de la aorta y la parte más distal de las arterias epicárdicas visibles mediante angiografía. Por tanto, las resistencias de flujo sanguíneo coronario son insignificantes en arterias grandes como las epicárdicas>400μm, también llamados vasos conductores, mientras que arterias por debajo de 400μm o vasos de resistencia, no están claramente delineados y aparecen como “blush” miocárdico; estos vasos se dilatan durante estímulos fisiológicos y farmacológicos e incluyen un compartimento proximal de vasos prearteriolares con un diámetro en rango de 100 a 400μm y compartimentos distales de arteriolas con diámetros menores de 100μm. Su tono es controlado por el flujo coronario que media la presión de distensión y el tono miogénico, y es modulado por el sistema nervioso autónomo y la función endotelial. Los lechos capilares distales consisten en una red de vasos interconectados de diámetro similar, de unos 5-10μm; y por último los miocitos se organizan dentro de la red de capilares y están interconectados por fibras de colágeno14.
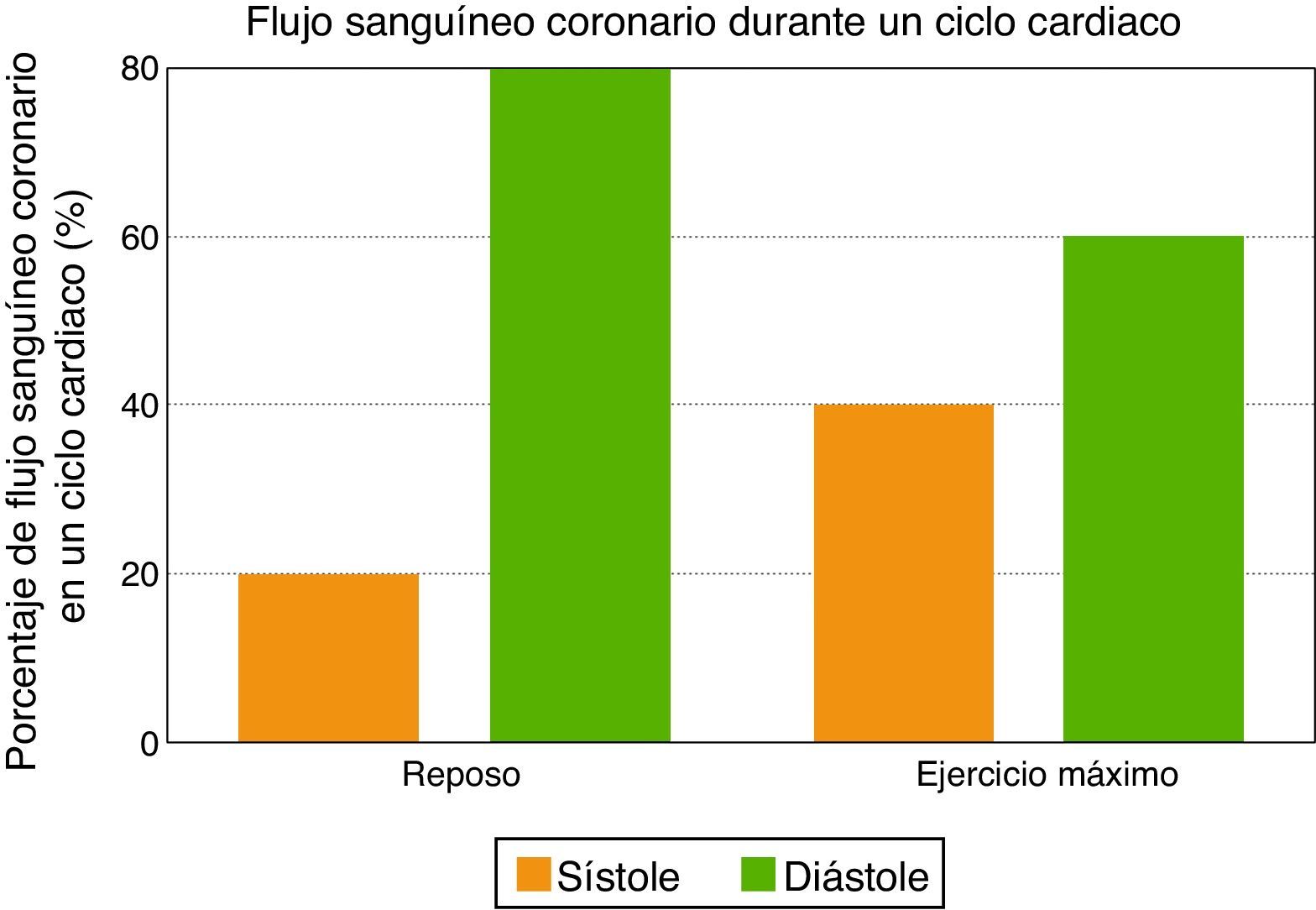
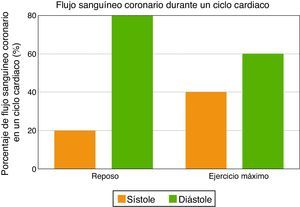
La primera característica del flujo sanguíneo coronario se relaciona con su naturaleza diastólica, ya que las fuerzas de compresión de la contracción miocárdica son opuestas al flujo sanguíneo coronario durante la sístole, mientras que la relajación ventricular permite una perfusión miocárdica óptima durante la diástole temprana. Como consecuencia, la sístole contribuye con menos del 20% del flujo sanguíneo coronario durante un ciclo cardiaco en reposo. Sin embargo, la contribución de la sístole no debe ser subestimada durante el ejercicio máximo, ya que al incrementarse la frecuencia cardiaca disminuye el tiempo diastólico, y entonces la sístole contribuye hasta con un 40% del flujo sanguíneo coronario (fig. 2).
Una segunda característica del flujo sanguíneo coronario es que se dirige desde el subendocardio al subepicardio. En un corazón normal, el flujo sanguíneo en el subendocardio es aproximadamente 125% del que está en el subepicardio; no obstante, esta relación disminuye dramáticamente en condiciones en las que la presión de perfusión se reduce o durante la oclusión coronaria epicárdica. Esta inversión de la relación de flujo endoepicárdica predomina, y se convierte en una característica de la isquemia miocárdica15. Los vasodilatadores son medicamentos que también pueden alterar esta relación de flujo sanguíneo coronario, ya que aumentan el flujo sanguíneo al subepicardio a expensas del subendocardio, condición conocida como robo coronario. Además, situaciones asociadas como la hipertrofia cardiaca que contribuyen al desplazamiento del flujo del endocardio al epicardio, hacen que el subendocardio sea más vulnerable a la isquemia miocárdica, y sea el primer segmento que sufre durante un evento coronario agudo16.
El rol de la demanda miocárdicaEl principal determinante del flujo sanguíneo coronario es el consumo de oxígeno miocárdico, que se calcula como el producto entre el flujo coronario y la diferencia arteriovenosa de oxígeno. Sin embargo, la extracción de oxígeno miocárdico de la arteria coronaria en reposo es en promedio del 75-80%, y puede incrementarse solo un poco más llegando hasta el 90% en situaciones de demanda máxima como ocurre en el ejercicio intenso, donde aumenta la frecuencia cardiaca, la contractilidad miocárdica y el estrés de la pared del ventrículo izquierdo. Como consecuencia, el principal mecanismo para entregar más oxígeno al miocardio en el momento que aumenta la demanda, es elevar el flujo sanguíneo coronario. Varios mecanismos actúan de manera simultánea y sinérgica sobre la demanda miocárdica para aumentar el flujo sanguíneo coronario, incluyendo la producción de adenosina, la autorregulación coronaria mediada por la presión y el metabolismo, y otros factores no metabólicos que regulan el flujo sanguíneo coronario como el endotelio y el sistema nervioso autónomo.
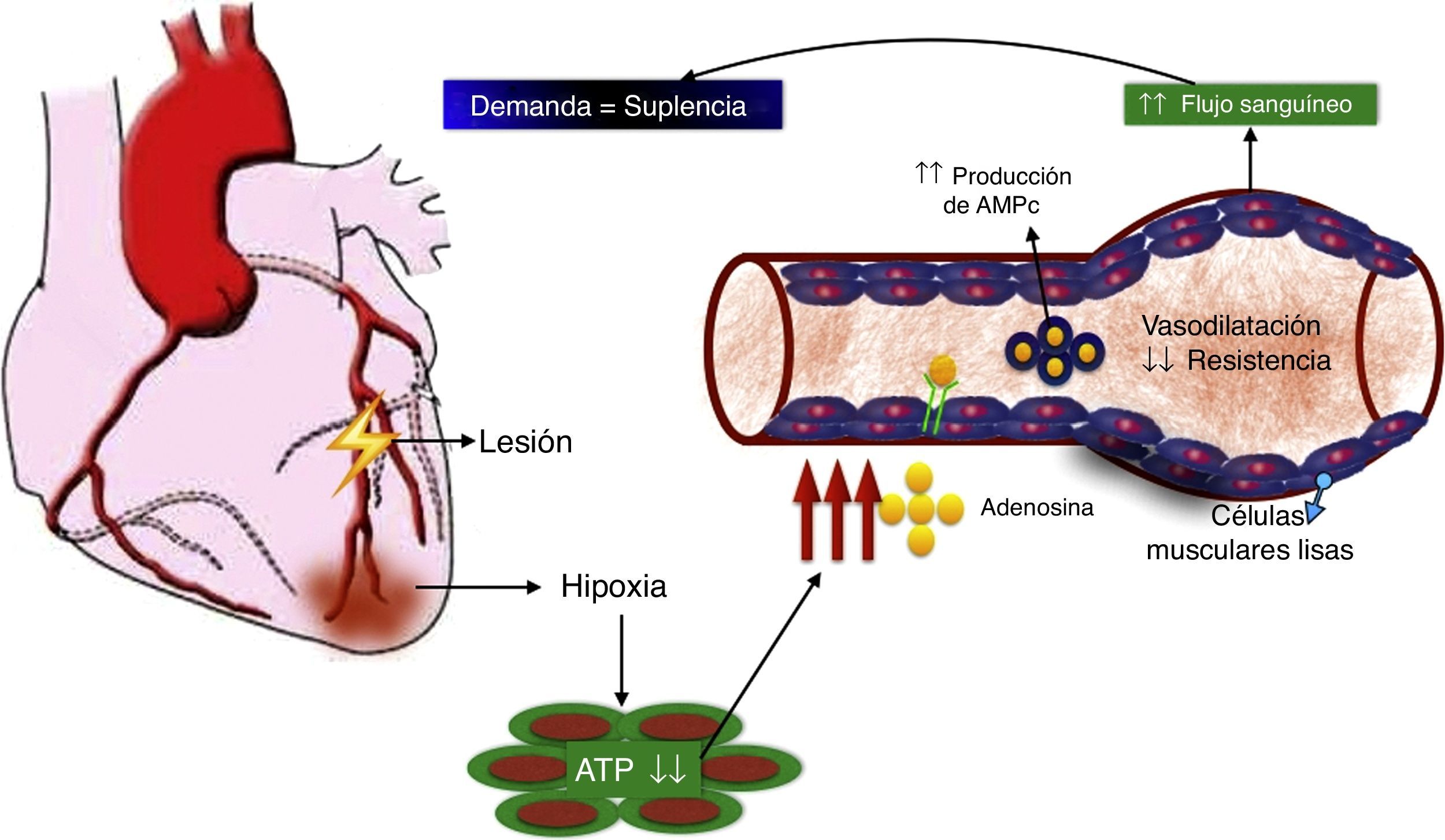
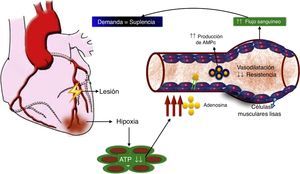
El rol de la adenosina en el flujo sanguíneo coronarioUno de los más potentes dilatadores de la circulación coronaria es la adenosina. La administración de adenosina por la arteria mamaria interna o intracoronaria genera un incremento inmediato en el flujo sanguíneo, medido por la señal Doppler intracoronaria. La relación entre el flujo sanguíneo coronario en reposo y después de la administración de adenosina representa la reserva del flujo coronario. En condiciones normales, esta relación está entre 4 y 5 para un rango de flujo entre 200ml/min en reposo hasta 1.000ml/min en el ejercicio máximo en atletas bien entrenados. En miocitos cardiacos in vivo, la adenosina se forma cuando la tasa de degradación de ATP (adenosín trifosfato) excede su tasa de regeneración. Considerando que la concentración de adenosina en el tejido cardiaco es aproximadamente 1.000 veces más baja que la concentración de ATP, y que la regeneración de este último resulta del incremento funcional de la adenosina, la hipoxia es el mayor desencadenante de la producción de adenosina, que se libera de los miocitos y se une a receptores de adenosina de las células musculares lisas vasculares, estimulando la vasodilatación a través de la producción de AMPc (adenosín monofosfato cíclico). El resultado de la disminución en la resistencia vascular es el aumento en el flujo sanguíneo coronario, que restablece el balance entre la demanda de oxígeno y la suplencia (fig. 3). Esta adenosina también se unirá a receptores de adenosina del miocito cardiaco para disminuir la inotropía y permitir un preacondicionamiento.
El rol del endotelio en el flujo sanguíneo coronarioVarias sustancias vasoactivas producidas por el endotelio incluidos el óxido nítrico, la prostaciclina, la endotelina y otros, desempeñan un rol muy importante en el flujo sanguíneo coronario. El vasodilatador más potente producido por el endotelio es el óxido nítrico, que se produce como un gas por la cascada colinérgica, el cual se difunde inmediatamente a las células musculares lisas adyacentes induciendo GMPc (guanosín monofosfato cíclico) dependiente de la relajación vascular. Además, el óxido nítrico también puede influir en la resistencia de los vasos coronarios manteniendo la perfusión miocárdica distal a la estenosis coronaria. La vasodilatación dependiente del óxido nítrico se ve entorpecida en pacientes con disfunción del endotelio, lo que hace que estos sean más vulnerables a la hipoperfusión distal en una estenosis epicárdica17.
Concepto de flujo miocárdico absolutoEn individuos con buen estado de salud el flujo sanguíneo miocárdico en reposo es alrededor de 1ml/g/min y se incrementa hasta 4ml/g/min durante la vasodilatación18. Estudios recientes muestran un aumento en el interés de cuantificar el flujo sanguíneo miocárdico absoluto de manera no invasiva, particularmente en vasodilatación completa de los lechos vasculares coronarios. Reducciones de este flujo no relacionadas con enfermedad arterial coronaria epicárdica se han convertido en una herramienta importante para identificar disfunción microvascular. Las nuevas terapias diseñadas para estimular la angiogénesis y la regeneración miocárdica pueden ejercer su efecto al mejorar este flujo microvascular.
Cuantificación de flujoLa cuantificación del flujo sanguíneo regional miocárdico es posible con el uso de PET/CT (tomografía por emisión de positrones/tomografía computarizada) y RMC (resonancia magnética cardiaca)19. Los trazadores comúnmente usados para medir el flujo sanguíneo miocárdico por PET son el agua marcada con oxígeno (H215O), el nitrógeno de amonio (13NH3), y el rubidio (82Rb; catión análogo del potasio). El 13NH3 y el 82Rb son administrados por vía intravenosa en bolo, mientras que el H215O se puede administrar en varios bolos, infusión lenta o por inhalación de dióxido de carbono marcado con oxígeno (C15O2), el cual luego se convierte en H215O por la anhidrasa carbónica de los pulmones. La tasa de captación del trazador dentro del miocardio provee un estimado del flujo sanguíneo miocárdico en ml/g/min, el cual puede ser calculado en condiciones basales y en el pico de la hiperemia. La reserva del flujo miocárdico está dada por la relación entre el flujo pico y el flujo basal. La extensión de su uso clínico es limitada por el número de cámaras de PET, materiales radioactivos de vida media corta, exposición a radiación ionizada y baja resolución espacial. La perfusión por RM puede cuantificar el flujo sanguíneo miocárdico absoluto en comparación con la PET, que solo da el flujo sanguíneo miocárdico relativo, en reposo y en el pico de hiperemia.
El flujo sanguíneo miocárdico y la relación entre la reserva de flujo sanguíneo miocárdico y la reserva de flujo coronario se calculan mediante PET o RM, las cuales ofrecen información respecto a la circulación epicárdica y microvascular. Por ejemplo, una reserva de flujo sanguíneo miocárdico de 2,04 medida por RM, tiene una sensibilidad mayor al 93% y una especificidad del 49% para predecir un flujo de reserva fraccional (FFR)<0,7520. Sin embargo, estas podrían ser áreas en la circulación miocárdica con un FFR normal y baja reserva de flujo coronario, lo que indica la presencia de disfunción microvascular. La disfunción microvascular involucra un compromiso estructural como se ve en la miocardiopatía hipertrófica, la estenosis aórtica severa o el infarto del miocardio, y podría ayudar a identificar nuevos objetivos terapéuticos. En pacientes sin enfermedad arterial coronaria, factores de riesgo como tabaquismo, diabetes mellitus, hiperlipidemia y obesidad pueden tener efectos en la reserva del flujo miocárdico, la cual podría medirse de manera no invasiva y dar información importante para modificar estilos de vida o terapia farmacológica.
El concepto del flujo de reservaHiperemia reactivaCuando la arteria es ocluida por más de unos segundos, el corazón es desprovisto de oxígeno y las células musculares lisas se relajan en las arterias coronarias pequeñas, una vez que pasa la oclusión el flujo sanguíneo se incrementa por encima de los valores normales (aproximadamente 3 a 5 veces el déficit de volumen que se presentó durante la oclusión temporal); este fenómeno se conoce como hiperemia posoclusiva o hiperemia reactiva. Durante el flujo con hiperemia, la diferencia arteriovenosa de oxígeno disminuye, lo cual indica que la extracción relativa de oxígeno es menor que en condiciones de flujo en reposo antes de la hiperemia. Inicialmente se pensó que la adenosina era el mediador principal del flujo sanguíneo con hiperemia; sin embargo, trabajos más recientes sugieren que luego de una pequeña restauración del flujo el estrés de alta tensión producido sobre la pared arterial estimula la liberación de óxido nítrico llevando a una vasodilatación prolongada. Independiente de este mecanismo multifactorial, el flujo de reserva coronario puede dividirse en flujo de reserva relativo y absoluto.
Flujo de reserva absolutoEl grado al que se puede incrementar el flujo coronario se conoce como flujo de reserva absoluto, definido como la relación del flujo hiperémico con el flujo en reposo, según la propuesta inicial de Gould21. Un incremento en el flujo cinco veces por encima del basal, identifica un flujo de reserva coronario normal. En presencia de estenosis, el flujo de reposo no cambia hasta que el estrechamiento sea del 80 al 85%; sin embargo, el flujo hiperémico coronario comienza a disminuir cuando el diámetro de la estenosis sea aproximadamente del 50%.
Flujo de reserva relativoEl flujo de reserva relativo se define como el flujo sanguíneo máximo en una arteria estenótica dividido por el flujo sanguíneo máximo en una arteria normal adyacente. Este concepto fue popular cuando se desarrolló la perfusión por gammagrafía; sin embargo, este requiere diferentes medidas en múltiples vasos, de modo que no puede ser aplicado en pacientes con enfermedad arterial coronaria de tres vasos, y actualmente tiene uso limitado o ningún valor clínico.
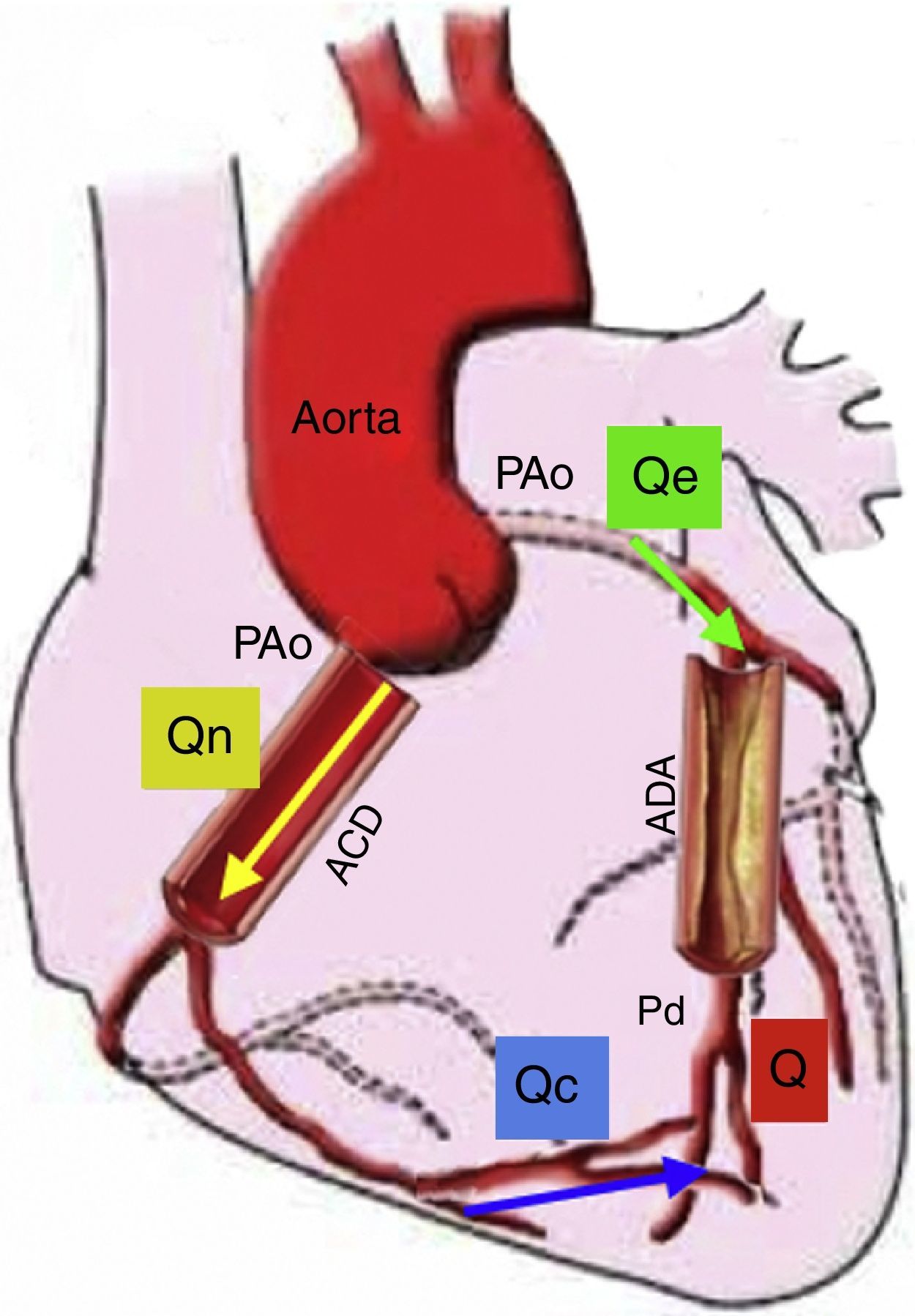
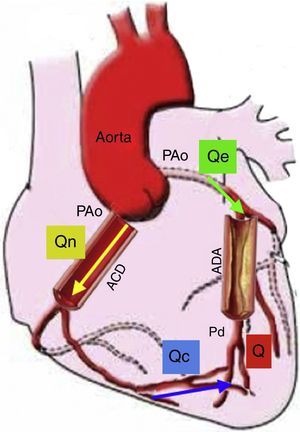
Flujo de reserva fraccionalLa reserva de flujo fraccional (FFR) puede ser calculada a partir de medidas de presión intracoronaria durante la hiperemia máxima. Se define como la relación entre la presión distal a la lesión y la presión aórtica, asumiendo que esta puede ser la presión proximal a la lesión en el pico máximo de hiperemia. La deducción de la ecuación del FFR ayuda a entender la fisiología, la presunción y las limitaciones de este cálculo22 (fig. 4). El cálculo del FFR es la relación de la presión distal a la lesión y la presión aórtica (Q/Qe=PDistal/PAo) y únicamente es verdadera si la resistencia vascular distal no está influenciada por la presión proximal o la estenosis, siendo despreciable la presión venosa. Sin embargo, estas presunciones no son del todo ciertas, ya que la resistencia microvascular distal podría incrementarse con la presencia de estenosis proximal23. Por lo tanto, la medida del FFR no es confiable en condiciones donde el sistema microvascular se ve afectado, como el síndrome coronario agudo o la hipertrofia del ventrículo izquierdo, en la cual la masa muscular hace que el sistema microvascular aumente de tamaño. A pesar de estas limitaciones, el FFR como índice específico del potencial isquémico de una lesión ha sido validado en numerosos trabajos clínicos24. La utilidad del FFR para guiar la intervención coronaria percutánea (ICP) comparada con la ICP guiada solo por angiografía, es apoyada por datos robustos de desenlaces clínicos. El FFR para guiar la ICP (FFR<0,8) en enfermedad arterial coronaria multivaso se asoció con menor número de eventos cardiovasculares mayores (13% ICP guiados por FFR vs. 18% ICP guiados por angiografía), menor número de implante de stents y menor cantidad de contraste. Medir de manera rutinaria el FFR en este estudio, redujo en un 30% todos los tipos de eventos adversos25,26.
Modelo de la circulación coronaria: donde Qe indica el flujo hiperémico con estenosis, Qn es el flujo hiperémico sin estenosis, y Qc es el flujo colateral. Q va a ser la suma del flujo anterógrado a través de la estenosis (Qe) y el flujo colateral (Qc). Entonces el FFR es igual a Q/Qn es decir Pd/PAo. En esta gráfica se representa el flujo sanguíneo colateral (Qc), el cual afecta el resultado del FFR; sin embargo, también podría medirse la suplencia colateral por FFR como ya se explicó en el texto. Si no existiera estenosis de la arteria descendente anterior (ADA), Q sería igual a 0, Qe sería igual a Qn, así como Pd sería igual a PAo. Presión aórtica (PAo), Presión distal (Pd), Arteria coronaria derecha (ACD) (Modificado de Circulation. 2006;113:446-455)22.
El FFR puede también estimar el flujo colateral distal a la oclusión con una relación entre la presión en cuña (medida después del pico de hiperemia ocluyendo con un balón a nivel proximal) y la presión proximal a una vasodilatación máxima. Un valor menor a 0,25 indica una circulación colateral inadecuada27. La limitación del FFR es que solo calcula el compromiso del vaso epicárdico y no toma en cuenta la resistencia microvascular. La medida también depende de la vasodilatación máxima en el vaso epicárdico, que se logra con nitroglicerina intracoronaria 200 mcg, y de la vasodilatación microvascular que se obtiene con papaverina intracoronaria y adenosina intravenosa 140 mcg/min, la cual ha sido usada en estudios aleatorizados controlados. Insertar la guía del FFR puede disminuir el área del vaso en un 10%, reducción que puede ser significativa en estenosis críticas.
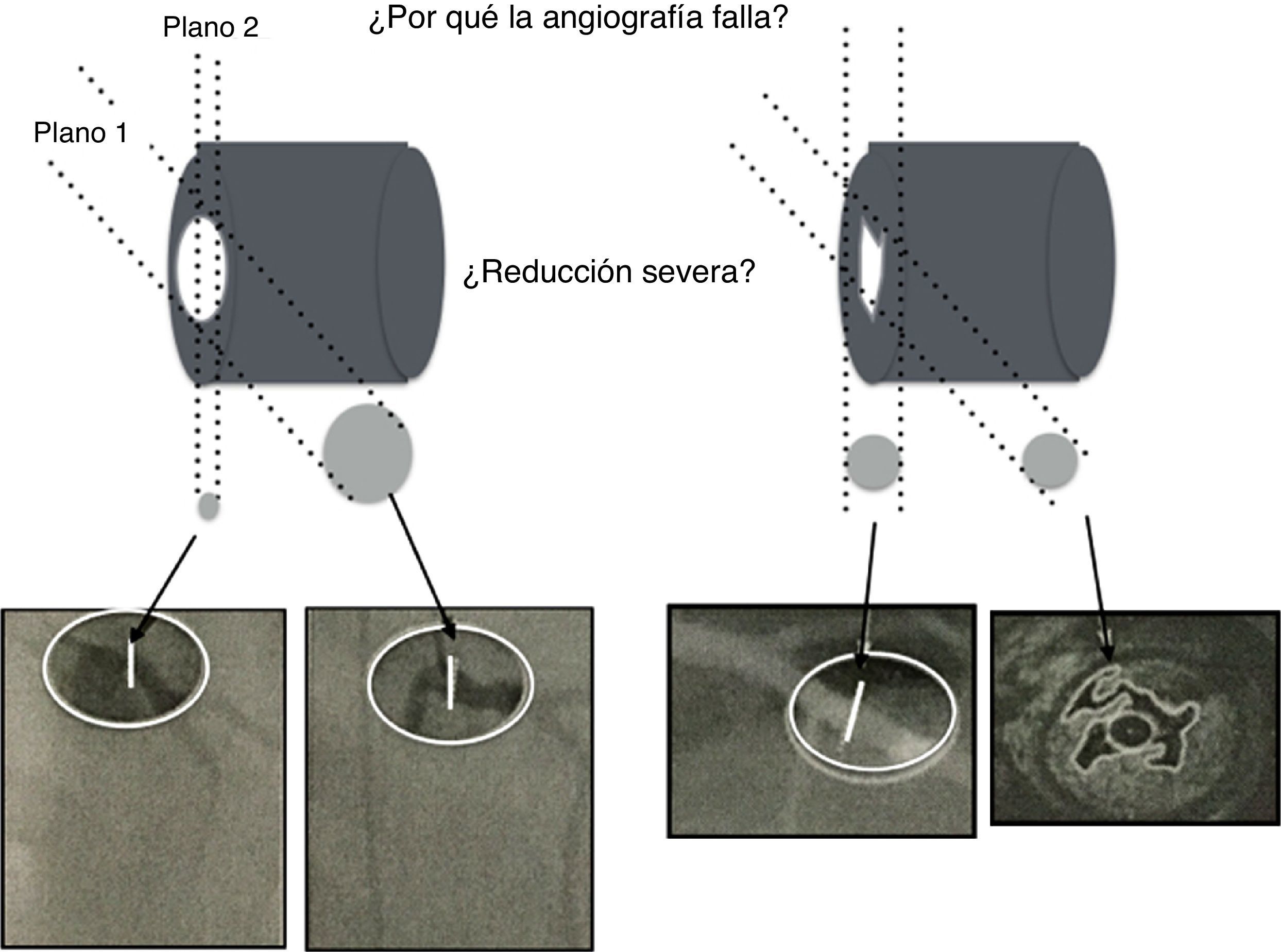
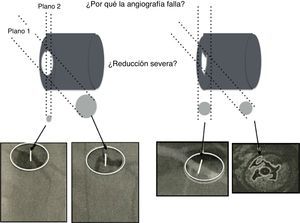
A pesar de las limitaciones inherentes, el FFR funciona como un revelador de isquemia y es el estándar para la valoración invasiva funcional de la enfermedad arterial coronaria. Este es más útil en lesiones coronarias ambiguas vistas por angiografía, en las cuales se observa una estructura de tres dimensiones en solo dos (fig. 5).
La ilustración muestra el uso regular de la intervención por angiografía rotacional y reconstrucción tridimensional, así como la complejidad anatómica del lumen ateroesclerótico que realmente no refleja el impacto fisiológico en la circulación. El angiograma es una imagen de dos dimensiones de una estructura tridimensional. La mayoría de lesiones intermedias son ovaladas con dos diámetros, uno estrecho y el otro amplio. La angiografía de lesiones excéntricas indica adecuadamente el flujo. Otras lesiones (abajo a la derecha) pueden ser confusas pero altamente permeables, siendo solo responsables de angina luego de la ruptura de una placa, como se identifica con el ultrasonido intravascular (abajo a la derecha en la esquina).
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existe ningún potencial conflicto de interés relacionado con el artículo.