Los inhibidores del cotransportador de sodio y glucosa tipo 2 (i-SGLT2) ejercen su efecto hipoglucemiante a través de la inhibición de la reabsorción de glucosa en el riñón. Sin embargo, los efectos cardiovasculares, renales y en falla cardiaca parecen ocurrir de manera independiente al efecto hipoglucemiante de estos fármacos. Los principales mecanismos de acción que explican sus beneficios cardiovasculares son el efecto hipotensor y la disminución en las presiones de llenado, efectos directos en el metabolismo de la célula miocárdica, reducción de la microalbuminuria, efectos metabólicos no glicémicos y disminución del tejido adiposo, aumento del hematocrito y uricosuria. En este artículo se describe cada uno de estos mecanismos novedosos.
Type 2 Sodium-Glucose Cotransporter (SGLT2) Inhibitors exercise their glucose-lowering effect through the inhibition of glucose reabsorption in the kidney. However, the cardiovascular and renal effects, as well as in those of cardiac failure, seem to occur independently from the glucose–lowering effects of these drugs. The principal mechanisms of action that explain their cardiovascular benefits are the hypotensive effect and the decrease in fill pressures, as well as direct effects on the metabolism of the myocardial cell. There is also a reduction in the urine albumin, as well as non-glycaemic effects, and a decrease in adipose tissue, with an increase in haematocrit and urine uric acid. Each one of these novel mechanisms is described in this article.
Los inhibidores del cotransportador de sodio y glucosa tipo 2 (i-SGLT2) ejercen su efecto hipoglicemiante a través de la inhibición de la reabsorción de glucosa en el riñón. Sin embargo, los efectos cardiovasculares, renales y en falla cardiaca parecen ocurrir de manera independiente al efecto hipoglicemiante de estos fármacos1. Por tanto, es fundamental entender y describir a profundidad los mecanismos fisiológicos involucrados en la protección cardiovascular.
Cada uno de los i-SGLT2 disponibles (empagliflozina, canagliflozina y dapagliflozina) han demostrado disminuir los eventos cardiovasculares, principalmente en pacientes con insuficiencia cardiaca, según múltiples estudios clínicos controlados, metaanálisis y estudios de vida real2–5. Estos beneficios cardiovasculares van más allá de su efecto hipoglicemiante y ocurren muy tempranamente para ser explicados por la pérdida de peso que producen (2 a 3kg). La rápida separación de las curvas del brazo activo versus placebo en los estudios clínicos, indica que los efectos beneficiosos están relacionados con la reducción de eventos asociados a insuficiencia cardiaca. En este capítulo se revisan los mecanismos de acción de los i-SGLT2, más allá de su efecto en la glucosa, que podrían explicar la disminución de los eventos cardiovasculares6.
El conjunto de efectos cardiovasculares no glicémicos de los i-SGLT2 se puede resumir de la siguiente manera:
- -
Efecto hipotensor
- -
Efectos miocárdicos
- -
Efectos renales hemodinámicos y reducción de la microalbuminuria
- -
Efectos renales no hemodinámicos: efectos antiinflamatorios
- -
Efectos metabólicos no glicémicos y disminución del tejido adiposo
- -
Disminución de la hipoxia renal
- -
Aumento del hematocrito
- -
Uricosuria
Uno de los principales mecanismos propuestos por los cuales los i-SGLT2 disminuyen los eventos cardiovasculares, es la disminución de la precarga del ventrículo izquierdo debido a su efecto diurético y natriurético. La inhibición del SGLT2 en el túbulo proximal causa natriuresis y glucosuria y la diuresis osmótica resultante tiene efectos favorables en la curva de Frank-Starling de un corazón diabético, además de pérdida de peso y disminución en las cifras de presión arterial (entre 3 y 5mm Hg de reducción de la presión arterial sistólica y 1 a 2mm Hg de la diastólica). Esta disminución de la presión arterial explica la reducción de la rigidez arterial y la mejoría de la función endotelial demostradas en algunos estudios clínicos7.
Efectos miocárdicosLas células miocárdicas son capaces de generar energía a partir de distintos sustratos, como glucosa, ácidos grasos libres y cuerpos cetónicos8. Los i-SGLT2 pueden aumentar la generación de ATP en el miocardio y optimizar el metabolismo celular a partir de una mayor utilización de cuerpos cetónicos por las células miocárdicas. En un estudio reciente se documentó que el uso de empagliflozina en ratones aumenta de manera significativa los niveles de cetonas, tanto en ayuno como postprandial, y que dicho aumento optimizaba la producción de ATP en el miocardio y se asociaba con una mejoría de la función ventricular9.
Otro mecanismo propuesto para la mejoría de la función ventricular y de los desenlaces favorables vistos en falla cardiaca, consiste en la disminución de la concentración intracelular de sodio y calcio (marcadores de disfunción ventricular y falla cardiaca). Baartscheer et al. demostraron que la exposición a empagliflozina inhibe el intercambiador de Na+/Ca++, en los cardiomiocitos, lo que se traduce en menor concentración de sodio intracelular, y en activación del intercambiador Na+/Ca++, con lo cual también hay reducción de los niveles de calcio en el interior de la célula cardiaca. Este conjunto de cambios en las concentraciones iónicas puede ejercer un rol protector sobre los cardiomiocitos10.
Efectos renales hemodinámicos y reducción de la microalbuminuriaLos i-SGLT2 son los únicos diuréticos conocidos que actúan en el túbulo proximal. Este efecto natriurético causa retroalimentación túbulo-glomerular al aumentar el envío de sodio a la mácula densa en el aparato yuxtaglomerular, lo cual conlleva vasoconstricción de la arteriola renal aferente y disminución de la presión intraglomerular con la consecuente reducción de la hiperfiltración glomerular, y explica, a largo plazo, su efecto renoprotector11,12.
Al compararlos con los diuréticos clásicos, como furosemida, los i-SGLT2 reducen selectivamente el volumen intersticial con mínima disminución del volumen intravascular, lo que secundariamente impediría la activación neurohumoral que ocurre cuando se depleta el volumen intravascular y que trae efectos deletéreos en la remodelación cardiaca de los pacientes con insuficiencia cardiaca13. Otra diferencia de los i-SGLT2 respecto a los diuréticos tradicionales es su efecto sobre los niveles de ácido úrico; mientras los i-SGLT2 son uricosúricos, los diuréticos de asa aumentan sus niveles plasmáticos, causando aumento de las especies reactivas de oxígeno, elevación de múltiples citoquinas y activación el sistema renina-angiotensina-aldosterona14,15.
Efectos renales no hemodinámicos: rol antiinflamatorioLa captación excesiva de glucosa en las células tubulares induce a un aumento en la expresión de sustancias inflamatorias potencialmente deletéreas para la célula. La inhibición del cotransportador SGLT2 bloquea la captación de glucosa por las células tubulares renales, lo que disminuye la expresión de mediadores inflamatorios. En un estudio realizado por Panchapakesan et al. con cultivos de células que tenían expresión aumentada de SGLT2 se documentó que agregar empagliflozina inhibía la expresión del TLR4 (toll like receptor), un receptor envuelto en la vía de señalización del NF-kB y la producción de IL-6. Esos efectos antiinflamatorios podrían ejercer un rol protector para las células renales16.
Un estudio publicado en el 2018, realizado en 33 pacientes diabéticos que recibían dapagliflozina por 6 semanas y luego de un período de lavado recibían placebo por otras 6 semanas, encontró que la administración de dapagliflozina se asociaba con menor excreción urinaria de marcadores inflamatorios, como la IL-6. Esta menor expresión de citoquinas a nivel renal se asoció con una reducción en la fracción excretada de IgG y de IgG4, que son marcadores de daño glomerular17.
Efectos metabólicos no glicémicosLa reducción de los niveles de glucosa con el uso de iSGLT2 activa diversos mecanismos de gluconeogénesis hepática, lo que lleva a movilización de reservas de glucógeno. Esto puede generar depleción de glucógeno hepático, que activa vías en las que se prioriza el uso de glucosa en órganos fundamentales como el cerebro. Todo lo anterior hace que los demás tejidos utilicen otras fuentes de energía18. De esta manera, hay mayor lipólisis y liberación de ácidos grasos no esterificados, que serán utilizados por el hígado para la formación de cetonas19.
Los pacientes que reciben i-SGLT2 periódicamente tienen pérdida de masa grasa, disminución de la grasa visceral y reducción de la esteatosis, efectos que son potencialmente beneficiosos para la salud cardiovascular20.
Disminución de la hipoxia renalAlgunos trabajos han demostrado que los pacientes diabéticos desarrollan hipoxia a nivel del parénquima renal. Este proceso es causado por un aumento en la demanda metabólica en las células renales como consecuencia de una absorción aumentada de glucosa en estados de hiperglicemia. La inhibición del cotransportador SGLT2 reduce el consumo de energía implicado en la reabsorción de glucosa y deja a la célula en un balance más favorable de oxígeno, manteniendo la integridad celular12.
Aumento del hematocritoLos pacientes diabéticos expuestos a terapia con inhibidores del cotransportador SGLT2 tienen aumento del hematocrito de entre 2 y 4%. Este efecto no ocurre en relación con el aumento de la diuresis, por lo que no puede ser explicado como consecuencia de una hemoconcentración. Después de iniciarse tratamiento con i-SGLT2 hay un aumento en los niveles de eritropoyetina, lo que aumenta el conteo de reticulocitos. Como se mencionó previamente, el tratamiento con i-SGLT2 reduce la hipoxia en las células del túbulo proximal. Este ambiente de menor estrés metabólico y mayor aporte de oxígeno permite que los fibroblastos se mantengan en condiciones apropiadas para la producción de eritropoyetina. Todo lo anterior se asocia con menor progresión de la enfermedad renal crónica lo que mejora el pronóstico de estos pacientes21. Adicionalmente, el aumento de la hemoglobina y del hematocrito optimiza el aporte de oxígeno a los tejidos, preserva la función cardiaca y optimiza el gasto cardiaco, lo que se traduce finalmente en mejor perfusión renal, que podría explicar parcialmente la disminución de los desenlaces cardiovasculares y de los efectos renoprotectores22.
UricosuriaLa inhibición del cotransportador SGLT2 en el túbulo proximal produce mayor concentración de glucosa en el filtrado glomerular en su paso a lo largo de la nefrona. Esta concentración elevada aumenta la actividad del transportador GLUT9, que se encarga de incrementar la absorción de glucosa intercambiándola por ácido úrico. De esta manera, los pacientes tratados con i-SGLT2 tienen una reducción del 10 al 15% en los niveles de ácido úrico plasmático23. La reducción en los niveles de ácido úrico se ha asociado con menor riesgo de enfermedades cardiacas y renales en pacientes diabéticos24.
En conclusión, son muchos mecanismos potenciales los que podrían explicar los beneficios encontrados en pacientes con falla cardiaca y de alto riesgo cardiovascular cuando se agrega i-SGLT2 al tratamiento. Con su uso clínico en los próximos años, seguramente se podrán entender con mayor precisión todos los mecanismos envueltos.
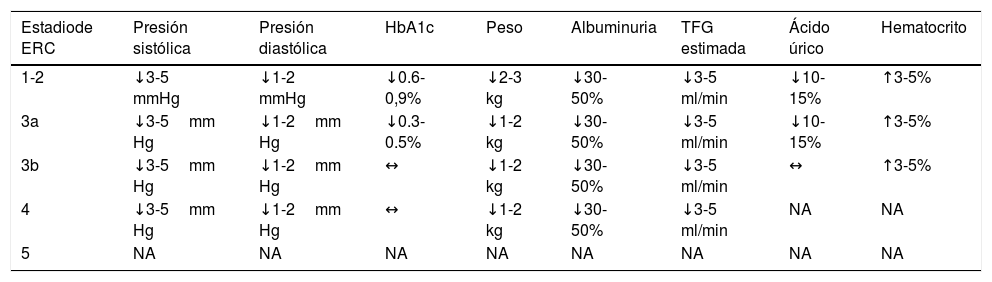
En la tabla se resumen algunos de los efectos que producen los i-SGLT2 en distintos parámetros clínicos que pueden resultar útiles para la reducción de eventos cardiovasculares y de desenlaces relevantes en falla cardiaca.
Efectos de los iSGLT2 en algunos parámetros clínicos en pacientes diabéticos
| Estadiode ERC | Presión sistólica | Presión diastólica | HbA1c | Peso | Albuminuria | TFG estimada | Ácido úrico | Hematocrito |
|---|---|---|---|---|---|---|---|---|
| 1-2 | ↓3-5 mmHg | ↓1-2 mmHg | ↓0.6-0,9% | ↓2-3 kg | ↓30-50% | ↓3-5 ml/min | ↓10-15% | ↑3-5% |
| 3a | ↓3-5mm Hg | ↓1-2mm Hg | ↓0.3-0.5% | ↓1-2 kg | ↓30-50% | ↓3-5 ml/min | ↓10-15% | ↑3-5% |
| 3b | ↓3-5mm Hg | ↓1-2mm Hg | ↔ | ↓1-2 kg | ↓30-50% | ↓3-5 ml/min | ↔ | ↑3-5% |
| 4 | ↓3-5mm Hg | ↓1-2mm Hg | ↔ | ↓1-2 kg | ↓30-50% | ↓3-5 ml/min | NA | NA |
| 5 | NA | NA | NA | NA | NA | NA | NA | NA |
Adaptada y modificada de Cherney D, et al. Sodium glucose cotransporter-2 inhibition and cardiorenal protection9.
Ninguno.