La miocarditis es una enfermedad inflamatoria del músculo cardiaco no asociada a anormalidades valvulares y en ausencia de enfermedad isquémica. Su prevalencia e incidencia se desconocen, ya que se presenta de manera subaguda o con síntomas iniciales inespecíficos. Su fisiopatología consta de tres fases: aguda (< 3 días–daño miocárdico mediado por acción directa del virus), subaguda (4-14 días–el daño miocárdico resulta de una disregulación de la respuesta autoinmune del huésped) y crónica (> 15 días–aclaramiento viral insuficiente y perpetuación del proceso inflamatorio, que conduce a remodelamiento cardiaco y falla cardiaca). Como agente etiológico más frecuente se describe el Parvovirus B19 y el herpes virus humano 6. Entre las manifestaciones clínicas: dolor torácico, arritmias, en lactantes (letargo, taquipnea, dificultad respiratoria leve, etc.), puede iniciar con pródromo viral, disfunción ventricular o muerte súbita. Tiene cuatro posibles presentaciones clínicas: asintomático, miocarditis aguda, fulminante o miocardiopatía crónica dilatada. El electrocardiograma detecta anormalidades entre el 93 al 100%; la resonancia magnética nuclear cardiovascular con gadolinio es de mayor uso, principalmente en la biopsia endomiocárdica. El tratamiento se basa en la monitorización hemodinámica del paciente, la evaluación de la necesidad de diuréticos, inhibidores de la enzima convertidora de angiotensina, betabloqueadores no selectivos, soporte inotrópico, antiarrítmicos o, en casos severos, el requerimiento de soporte mecánico cardiovascular. Se evalúa el uso de inmunoglobulina y, de manera controversial, el de inmunosupresor y antiviral. El pronóstico es variable y depende de factores inherentes al ambiente y al huésped. Se realizó una revisión actualizada de la literatura.
Myocarditis is an inflammatory disease of the heart muscle unrelated to valvular abnormalities and ischaemic disease. The prevalence and incidence are unknown since it is presented sub-acutely or with non-specific initial symptoms. Its pathophysiology consists of three phases: acute <3 days–myocardial damage mediated by direct action a virus), sub-acute (4-14 days–the myocardial damage is due to a dysregulation of an autoimmune host response), and chronic (>15 days - insufficient viral clearance and perpetuation of the inflammatory process, which leads to cardiac remodelling and heart failure). Parvovirus B19 and human herpesvirus 6 have been described as the most common aetiological agents. The clinical signs include, chest pain, arrhythmias, and in infants (lethargy, tachypnoea, mild shortness of breath, etc.) It can start with a viral prodrome, ventricular dysfunction, or sudden death. There are four possibilities of clinical presentation: asymptomatic, acute myocarditis, fulminant or dilated chronic cardiomyopathy. The electrocardiogram detects between 93%-100% of abnormalities. Cardiovascular nuclear magnetic resonance with gadolinium is the most used, mainly in endomyocardial biopsy. Treatment is based on the haemodynamic monitoring of the patient, the evaluation of the need for diuretics, angiotensin converting enzyme inhibitors, non-selective beta-blockers, inotropic support, anti-arrhythmic drugs or, in severe cases, and the need for mechanical cardiovascular support. The use of immunoglobulin has been evaluated, and there is controversy over the use of immunosuppressives and antivirals. The prognosis is variable and depends on factors inherent to the environment and the host. An updated review of the literature is presented.
El término miocarditis fue acuñado en el Siglo xix por el Dr. Jean-Nicolas Corvisart, para describir enfermedades del músculo cardiaco no asociadas a anormalidades valvulares1, y aunque fue olvidado temporalmente por el interés creciente hacia la enfermedad coronaria, a mediados del Siglo xx debido a hallazgos sugestivos de miocarditis en estudios postmortem y las técnicas de aislamiento viral, resurgió nuevamente el interés hacia este2.
DefiniciónLa miocarditis es la enfermedad inflamatoria del miocardio en ausencia de enfermedad isquémica3,4; sin embargo esta definición es más compleja debido a que debe ser establecida por criterios histológicos, inmunológicos e inmunohistoquímicos5,6. En 1995 la Organización Mundial de la Salud y la Sociedad Internacional y Federación de Cardiología, efectuaron varios cambios en la definición y clasificación de las enfermedades miocárdicas; las miocardiopatías son las enfermedades cardiacas que se asocian con disfunción cardiaca y la miocarditis es una miocardiopatía inflamatoria adquirida que a la vez pertenece a una subclase de la miocardiopatía dilatada7,8.
EpidemiologíaNo se conoce con exactitud la prevalencia e incidencia debido a que muchos casos se presentan de manera subaguda o los síntomas iniciales son inespecíficos. En general, es una enfermedad infrecuente en Pediatría, sin embargo, el diagnóstico equívoco tiene gran impacto dadas la morbimortalidad y las secuelas que genera. Estudios retrospectivos han calculado una prevalencia de 0,5 casos/10.000 consultas a urgencias y una incidencia entre 1 por 100.000/año3,8. La presencia de miocarditis en estudio de autopsias varía de 0,12% a 12%9; adicionalmente, alrededor del 16% al 20% de pacientes escolares y 17% de adolescentes y adultos jóvenes con síndrome de muerte súbita o sin causa explicada son secundarios a miocarditis, en tanto que el 27% de los casos de miocardiopatía dilatada son secundarios a miocarditis viral10 y el 9% de casos de miocardiopatía inexplicada obedecen a miocarditis11. En Colombia se desconoce la prevalencia exacta.
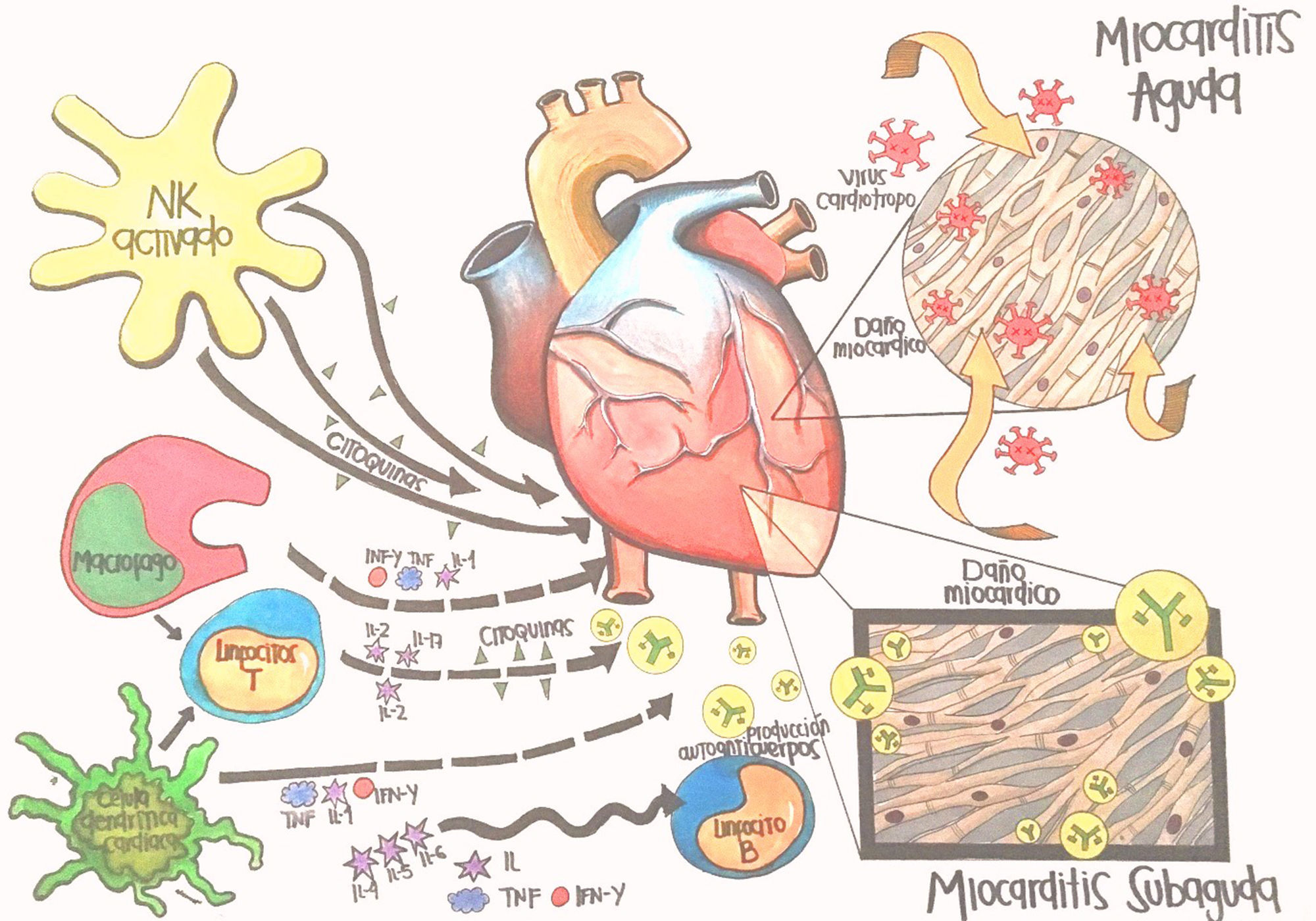
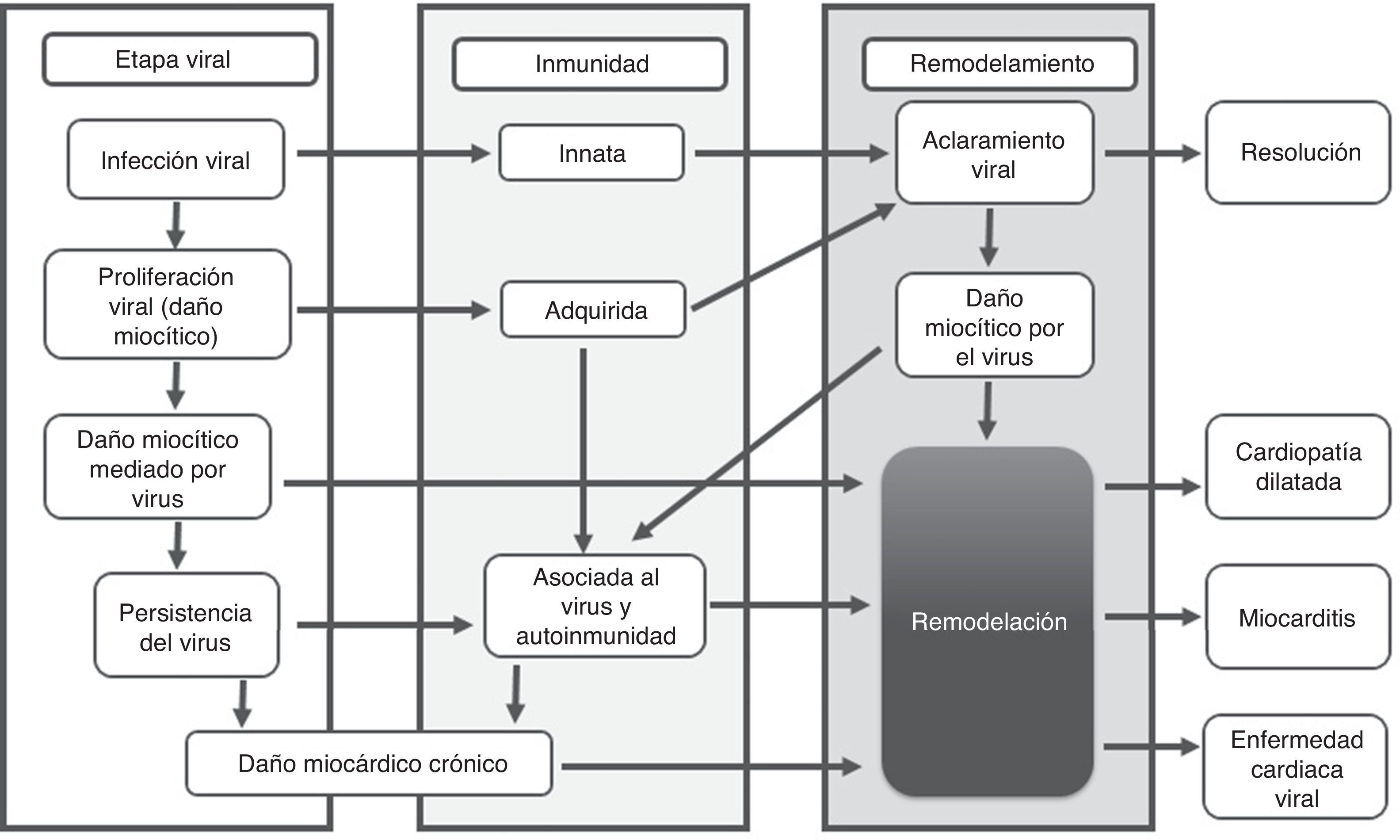
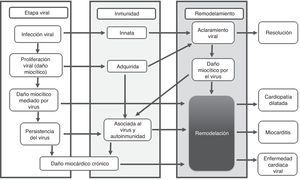
FisiopatologíaLa mayoría de estudios fisiopatológicos se llevan a cabo con virus en modelos murinos3,8; se proponen tres fases: aguda, subaguda y crónica. La primera sucede en los primeros tres días y representa el daño miocárdico mediado por acción directa del virus (fig. 1).
La entrada viral es regulada por receptores y correceptores específicos, entre ellos el coxsackievirus-adenovirus receptor (CAR), localizados en la región transmembrana que ayuda a la internalización del Coxsackie B, adenovirus 2 y 5. Los correceptores como el factor acelerador de la degradación (DAF) permiten la entrada de subtipos de coxsackievirus B1, B2 y B54,5,8,12. Otros correceptores son las integrinas (αvβ3 y αvβ5)6. La susceptibilidad genética desempeña un rol importante; se ha visto cierta predisposición para desarrollar miocarditis dependiendo del número de receptores expresados, así como también que en la ausencia de CAR en miocitos cardiacos, no hay infamación o infección viral6.
El daño citotóxico es mediado por la entrada y replicación del virus, generándose daño miocárdico con exposición de antígenos intracelulares, que activan la respuesta inmune innata, que se caracteriza por activación de células natural killers (NK) y macrófagos2,4,6,12.
La fase subaguda se desarrolla entre el día 4 al 148, incluso algunos autores plantean que puede extenderse hasta varios meses6; en esta fase la lesión miocárdica conlleva disregulación de la respuesta inmune, descrita como respuesta autoinmune del huésped (fig. 1). Inicialmente hay activación de células presentadoras de antígenos (CPA), liberación de citoquinas proinflamatorias, interleucina (IL)-1β, IL-2, IL-6, IL-12, IL-17, factor de necrosis tumoral α (TNF-α) e interferón γ3,4,6,9,12. Las células T activadas por las CPA se encargan de la inmunidad virus específica, dirigiendo un ataque al virus y a miocitos infectados, instaurando la fase más destructiva de la infección reflejada en compromiso de la contractilidad cardiaca3,6. Los anticuerpos producidos contra patógenos experimentan una reacción cruzada con los antígenos intracelulares expuestos por mimetismo entre epítopes; por ejemplo el Coxsackievirus B y la proteína M estreptocócica comparten determinantes antigénicos con la miosina cardiaca y otros antígenos intracelulares (laminina, receptor B1 del miocito)2,6,12. Generalmente, la mayoría de pacientes crean anticuerpos neutralizantes que limitan la replicación viral, se controla la respuesta inmune, aumentan los títulos de anticuerpos, se elimina el virus, se resuelve la inflamación y mejora la función ventricular con secuelas o recuperación completa1,2,6,8,9.
La fase crónica a partir del día 15, se caracteriza por aclaramiento viral inefectivo, persistencia de la respuesta autoinmune perpetuando el proceso inflamatorio que lleva a remodelamiento cardiaco, alteraciones de la contractilidad, fibrosis cardiaca, miocardiopatía dilatada y activación de los mecanismos compensatorios neurohormonales que se traducen en un cuadro de falla cardiaca crónica2,3,6,8(fig. 2).
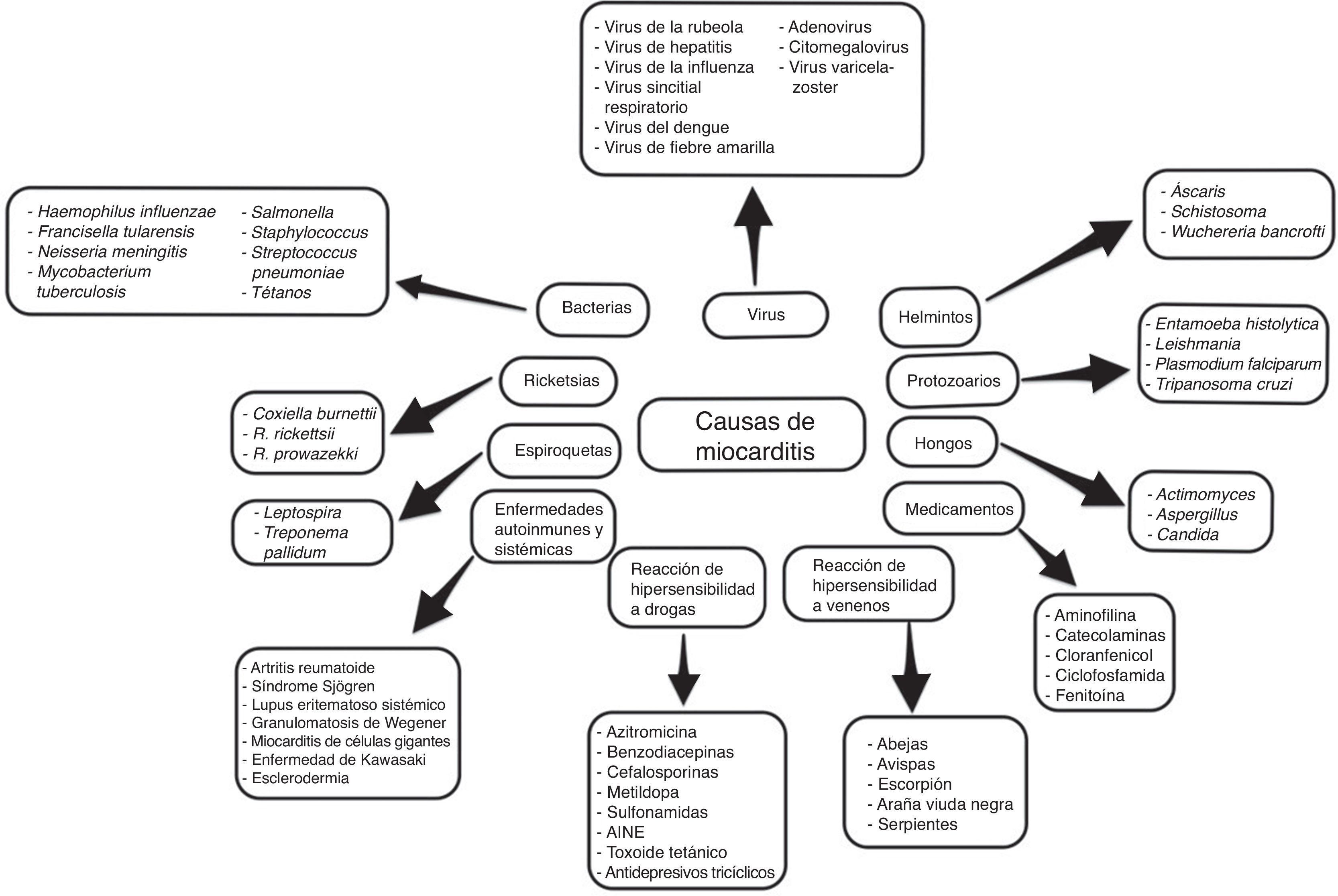
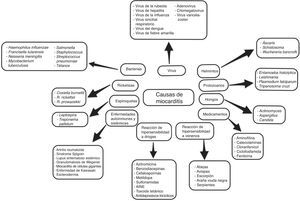
EtiologíaSe ha descrito una amplia variedad de causas, incluyendo numerosos agentes infecciosos, comúnmente virales, pero a menudo no se identifica la causa subyacente5–7.
Con frecuencia, es el resultado de infecciones virales comunes y respuestas inmunes postvirales. Tradicionalmente los enterovirus se han considerado el agente más común de miocarditis y miocardiopatía dilatada, pero en los últimos años se han identificado otros agentes con diversos grados de frecuencia, como el herpes virus humano 6 y tipo 2, adenovirus, virus de inmunodeficiencia humana (VIH), citomegalovirus (CMV), virus de la hepatitis C y otros.
Con el desarrollo de nuevas técnicas moleculares como la reacción en cadena de la polimerasa (PCR) y la hibridación in situ, el espectro de los virus más detectados en la biopsia endomiocárdica (BEM) pasó de enterovirus y adenovirus en los años 90 al parvovirus B19 y al herpes virus humano 6 en los últimos años (fig. 3).
Sin embargo, conviene tener en cuenta las diferencias geográficas sobre la distribución de diferentes especies de virus en la miocarditis, así como de otros agentes infecciosos no virales (fig. 3), y por otro lado, agentes bacterianos como difteria, meningococos, psitacosis, estreptococos, rickettsia (como el tifus, fiebre de las montañas rocosas), hongos (aspergilosis, candidiasis) y parásitos (helmintos), enfermedad de Chagas y toxoplasmosis6,10,13–15.
Los fármacos (clozapina, antibióticos-penicilina, ampicilina, sulfonamidas, tetraciclinas) pueden inducir inflamación miocárdica, ya sea por efecto tóxico directo sobre el tejido miocárdico o por reacción de hipersensibilidad, la cual a menudo se asocia con miocarditis eosinofílica6,10. Los procesos inflamatorios miocárdicos asociados a eosinófilos también se pueden observar en otras entidades como el síndrome de Churg-Strauss o enfermedad de Löeffler6.
La vacuna contra el meningococo C o la hepatitis B también ha sido asociada a miocarditis13,16. Otras causas de miocarditis pueden estar asociadas a algunas enfermedades sistémicas, a través de mecanismos autoinmunitarios13.
Manifestaciones clínicasEl espectro clínico de la miocarditis es inmensamente variable y dependerá de la edad del paciente, la etiología, las patologías de base y la gravedad de la afectación1,6,9. Clínicamente se puede observar desde un paciente asintomático, pródromos gripales como en los recién nacidos, lactantes o niños preescolares que llevan a un diagnóstico de gastroenteritis, neumonía, asma o bronquiolitis4,6,9,10, como se encontró en el estudio retrospectivo de Durani, donde el diagnóstico en la primera valoración médica comúnmente es más relacionado con infección respiratoria, pero además se enumeran signos y síntomas frecuentes9,17,18 (tabla 1). En una edad más avanzada, pueden referir dolor torácico, fatiga o imitar una angina típica, asociándose con cambios electrocardiográficos y en ocasiones con alteración de las enzimas cardiacas9,10,13,19.
Síntomas y signos de miocarditis perdiátrica más frecuentes. Adaptado de la serie de Durani17
| • Síntomas respiratorios altos • Síntomas gastrointestinales (Emesis o hiporexia) • Fiebre • Dolor torácico • Somnolencia • Intolerancia al ejercicio • Mialgias, artralgias • Fatiga • Palpitaciones | • Taquipnea • Hepatomegalia • Dificultad respiratoria • Anormalidades en la frecuencia cardiaca (normal, taquicardia o bradicardia) • Arritmias cardiacas • Edemas • Síncopes • Lipotimias |
Por tanto, el diagnóstico de la miocarditis basado en la presentación clínica es difícil y en algunos casos, por sí solo no suele ser posible2,4,10. Como se mencionó anteriormente, el espectro clínico de la miocarditis es altamente variable; sin embargo, puede haber cuatro formas de presentación clínica9,13,15:
- 1.
Miocarditis asintomática: pertenecen un alto porcentaje de pacientes con clínica asintomática o subclínica, la cual puede pasar inadvertida. El diagnóstico se realiza a partir de hallazgos electrocardiográficos como arritmias mortales, bloqueo aurículo-ventricular (BAV) completo o incluso muerte súbita9,12,13.
- 2.
Miocarditis aguda: en general es de inicio insidioso de días o semanas de evolución; se observan síntomas y signos de insuficiencia cardiaca, dilatación y disfunción ventricular. Los síntomas más comunes son disnea, dolor torácico, síncope y arritmias. En ocasiones existe historia de sintomatología gripal, sin fiebre.
- 3.
Miocarditis fulminante: se caracteriza por el desarrollo agudo (menor de 3 días) de signos y síntomas de insuficiencia cardiaca severa con necesidad de soporte inotrópico, arritmias refractarias, con síntomas previos de infección viral. La miocarditis fulminante es más frecuente en niños que en adultos8,20. Puede llevar a la muerte si no se instaura el tratamiento apropiado y de manera oportuna. Sin embargo, comparado con la miocarditis de presentación aguda no fulminante a largo plazo, la miocarditis fulminante es de mejor pronóstico (recuperación completa de la función ventricular), ya que raramente evoluciona a miocardiopatía dilatada y requerimiento de trasplante cardiaco, posiblemente por mejor aclaramiento viral y producción de citoquinas antivirales más efectivas1,6,11.
- 4.
Miocardiopatía crónica dilatada: el 30% de los pacientes evolucionan a una miocardiopatía dilatada con insuficiencia cardiaca crónica, la presentación clínica está directamente relacionada con el grado de afectación de la función ventricular1.
No obstante, como se mencionó, debido a las diferentes etiologías y otras de presentación menos frecuente, pueden aparecer con un curso clínico y pronóstico diferentes; es el caso de la miocarditis de células gigantes, la cual es una variedad rara y grave de miocarditis, en la que se evidencian células multinucleadas gigantes en la biopsia. Suele ocurrir en adultos jóvenes y es rara en niños. Se considera que su origen es autoinmune21 porque se asocia con otras enfermedades autoinmunes y reacciones de hipersensibilidad a fármacos. Desde un punto de vista clínico, se manifiesta como un cuadro de miocardiopatía dilatada con arritmias ventriculares o BAV completo que no mejora con tratamiento convencional con alto porcentaje de mortalidad o evolución a trasplante cardiaco22. La miocarditis eosinofílica se caracteriza por infiltrado inflamatorio de predominio eosinofílico y puede aparecer en el contexto de miocarditis por hipersensibilidad a fármacos. El cuadro clínico suele ir asociado a rash cutáneo, fiebre y eosinofilia periférica. Típicamente se presenta en pacientes previamente sanos y sin antecedente de infección6,10,16,22.
DiagnósticoEl diagnóstico es producto del empalme de la clínica y los paraclínicos; es importante tener alta sospecha clínica debido a que hasta el 84% de los pacientes deben consultar más de una vez, al menos 14 días previos al diagnóstico17. En la anamnesis se indaga por enfermedades recientes, infecciones respiratorias o gastrointestinales, fármacos, otro tipo de exposiciones y examen físico completo8,9. Entre los paraclínicos, el electrocardiograma es una prueba no invasiva, que puede llegar a detectar anormalidades entre el 93 al 100% según la serie estudiada. El hallazgo más frecuente es la taquicardia sinusal; otros hallazgos incluyen QRS de bajo voltaje, cambios del segmento ST, anormalidades de la onda T, crecimiento ventricular, arritmias (taquicardia supraventricular, taquicardia ventricular y extrasístoles), BAV y patrones de isquemia, aunque su sensibilidad puede oscilar entre 50% a 93%3,8–10,17.
En la radiografía de tórax puede evidenciarse cardiomegalia (uno de los hallazgos más frecuentes)17 por dilatación cardíaca o derrame pericárdico; sin embargo, anormalidades como derrame pericárdico o pleural, congestión venosa capilar y edema pulmonar10,17, se hallan entre el 69 al 90% de los pacientes3. El ecocardiograma es otro método no invasivo que aporta información valiosa hasta en el 98% de los casos; permite valorar función cardiaca, insuficiencias valvulares y alteraciones de la contractilidad en las paredes, crecimiento de cavidades y derrame pericárdico8,9, además de diferenciar si se trata de la forma aguda o la fulminante.
Con frecuencia, en la miocarditis fulminante el ventrículo izquierdo tiene dimensiones normales o levemente dilatadas y tabique interventricular engrosado, diferente a la miocarditis aguda en la cual existe marcada dilatación de cavidades y tabique de espesor normal23.
El hemograma, la proteína C reactiva y la velocidad de sedimentación globular muestran baja sensibilidad y especificidad. Freedman et al. encontraron en su serie que incluso la aspartato aminotransferasa (ASAT) puede estar elevada hasta en el 85% de casos18; la CPK total y la fracción MB detectan daño miocárdico aunque su utilidad es baja. La troponina I y T muestran mejor rendimiento que las pruebas mencionadas, de más utilidad cuando existe mayor sospecha clínica; la sensibilidad y especificidad dependen del punto de corte usado. La serología para virus y los cultivos periféricos virales tienen baja sensibilidad y especificidad; por su parte, los hemocultivos y los coprocultivos tienen baja utilidad. En la tabla 2 se resume su rendimiento. Recientemente está en estudio el uso de autoanticuerpos cardiacos para el diagnóstico de miocarditis2–4,9,10,16,18.
Utilidad de los paraclínicos en miocarditis2–4,9,10,16,18
| Marcador | Rendimiento | Sensibilidad | Especificidad |
|---|---|---|---|
| Hemograma | ↓↓ | ↓↓ | |
| VSG–proteína C reactiva | 27–56% | ||
| ASAT | 85% | ||
| CPK total | ↓ | ↓ | |
| Troponina T > 0,052ng/ml | 71% | 86% | |
| Troponina T > 0,1ng/ml | 53% | 94% | |
| Hemocultivos | ↓↓ | ↓↓ | |
| Coprocultivo | ↓ | ↓ | |
| PCR Virus por BEM | 25–68% |
La BEM del ventrículo derecho clásicamente ha sido el “estándar de oro” para el diagnóstico de miocarditis; tiene una sensibilidad del 3% al 63%. Para aumentar la sensibilidad al 80% se requieren entre 5 y 10 biopsias4,7 y debido al compromiso focal o en parches que exhiben los pacientes con miocarditis, es limitada y entró en desuso por ser una técnica invasiva, con riesgos graves inherentes al procedimiento quirúrgico4,22. Los criterios de Dallas aplicados a la BEM definen miocarditis así:
- •
Miocarditis activa: presencia de infiltrado inflamatorio con necrosis miocitaria.
- •
Miocarditis borderline: infiltrado inflamatorio con ausencia de necrosis
- •
Ausencia de miocarditis: carencia de infiltrado inflamatorio y de necrosis miocitaria24.
No obstante, esta clasificación ha sido cuestionada y ha perdido validez debido a la variabilidad de resultados de acuerdo con el observador y su pobre correlación histológica con la presencia de genoma viral (replicación viral en pacientes que no muestran cambios histológicos)22,24. Actualmente, para obtener mejores resultados de la prueba y aumentar la detección de partículas virales se utilizan criterios histológicos (microscopia de luz), inmunológicos, inmunohistoquímicos, PCR para detección de ADN viral en miocardio y técnicas de tinción con inmunoperoxidasas para antígenos de superficie tales como anti-CD3, anti-CD4, anti-CD20, anti-CD68 y antígeno leucocitario humano3,6,12,13. Las indicaciones actuales con buen nivel de evidencia y grado de recomendación para realizar la BEM son:
- 1)
Insuficiencia cardiaca de causa no clara con inicio menor de dos semanas, con ventrículo izquierdo normal o dilatado y compromiso hemodinámico.
- 2)
Insuficiencia cardiaca de dos semanas a tres meses de evolución, asociada a dilatación de ventrículo izquierdo y arritmias ventriculares de novo, BAV Mobitz II o completo que no responde al tratamiento usual en una a dos semanas.
- 3)
Insuficiencia cardiaca de causa no clara, asociada a miocardiopatía dilatada de cualquier duración relacionada con eosinofilia con sospecha de reacción alérgica.
- 4)
Miocardiopatía dilatada de causa no clara en niños22.
Recientemente, se ha dado mayor uso y se ha encontrado mejor utilidad a la resonancia magnética nuclear cardiovascular (RMNC)25,26 con secuencias T1, T2 y realce precoz y tardío con gadolinio. Tiene aplicaciones importantes como permitir visualizar anormalidades en el movimiento del miocardio, detectar el compromiso en parches, cuantificar y demarcar el área de inflamación e incluso ofrecer ayuda para guiar la BEM3,13,27. El gadolinio penetra el espacio intracelular a través de la membrana celular lesionada, de modo que realza las zonas inflamadas. En la etapa precoz de perfusión pueden omitirse algunas lesiones, pero en la etapa tardía (realce tardío) se identifican áreas de necrosis y fibrosis miocárdica, generalmente localizadas en la pared libre3,27. Algunos autores proponen los criterios de Lake Louise para el diagnóstico de miocarditis según los hallazgos de la resonancia con dos de tres criterios, los cuales tienen mayor validez en el contexto de un paciente con sospecha clínica de miocarditis:
- 1)
Hiperintensidad regional o global del miocardio en la secuencia T2.
- 2)
Incremento del radio en el realce precoz de la secuencia T1 con gadolinio entre el miocardio y el músculo esquelético.
- 3)
Mínimo una lesión focal de distribución en áreas no isquémicas en las secuencias de realce tardío con gadolinio.
El criterio 3 se asocia con lesión o cicatriz de los miocitos por inflamación miocárdica. En consecuencia, la RMNC se debe repetir entre 1 y 2 semanas después del primer estudio si no se cumple ningún criterio anterior si continua la sospecha de miocarditis, si el inicio de los síntomas es reciente o si sólo cumple un criterio; finalmente la presencia de disfunción ventricular o derrame pericárdico apoya la evidencia de miocarditis3,27.
TratamientoIdealmente se trataría el problema etiológico o se retiraría el evento desencadenante, que en muchos casos es difícil de establecer de manera oportuna. La finalidad es recuperar la función ventricular, prevenir la progresión del daño miocárdico y mejorar la sobrevida. Así, el manejo se agrupa en 5 puntos: 1) Medidas generales 2) Manejo de soporte 3) Inmunomodulador 4) Inmunosupresor y por último 5) Antiviral.
Medidas generalesCuando se sospecha miocarditis se hospitaliza al paciente para monitorización dado el riesgo de deterioro clínico, y/o se traslada a la unidad de cuidado intensivo según estabilidad hemodinámica. Se garantiza una oxigenación adecuada, ventilación, perfusión y homeostasis hidroelectrolítica; en modelos animales se ha encontrado que el reposo disminuye el consumo de oxígeno y disminuye la replicación viral2,4,6,12.
Los antiinflamatorios no esteroideos aumentan la mortalidad y por tanto no se recomiendan6.
Manejo de soporteSe basa en el tratamiento de la insuficiencia aguda de acuerdo con el perfil hemodinámico de cada paciente con el objetivo de mejorar la congestión, las presiones de llenado ventricular o ambas, garantizar el aporte, consumo de oxígeno equilibrado8, optimizar la precarga y la postcarga, la contractilidad y la frecuencia cardiaca; en caso de evolución a insuficiencia cardiaca crónica, se debe evitar la activación molecular y neurohormonal, además de no perpetuar el estímulo inflamatorio que llevará al remodelamiento cardiaco28,29. Incluye el uso de diuréticos para disminuir la congestión y la sobrecarga de volumen; se puede utilizar furosemida, hidroclorotiazida y espironolactona. El uso de inhibidores de la enzima convertidora de angiotensina (IECA) como enalapril o captopril, disminuye las resistencias vasculares sistémicas, evita el remodelamiento cardiaco e inhibe el eje neurohormonal4. Se han visto beneficios de uso de betabloqueadores no selectivos como el carvedilol que se administran en pacientes euvolémicos y estables3. La digoxina debe usarse con precaución ya que aumenta las citoquinas proinflamatorias y la mortalidad6,9. Debido a que la miocarditis se comporta como un choque de origen cardiogénico donde con frecuencia se requiere soporte inotrópico, entre ellos se describe el uso de milrinone, adrenalina, noradrenalina, dopamina y dobutamina8. Las arritmias cardiacas son comunes en el curso de la miocarditis y su manejo incluye el uso de amiodarona, si bien en casos severos es necesario el desfibrilador cardioversor implantable o por el contrario, en casos de BAV completo, los marcapasos temporales6,10,13. En casos severos, generalmente miocarditis fulminantes o disfunción ventricular severa y colapso cardiovascular, puede requerirse soporte mecánico cardiovascular, dispositivos de asistencia biventricular o izquierda, balón de contrapulsación intraaórtica u oxigenación por membrana extracorpórea (ECMO) -con lo cual se ha encontrado una tasa de supervivencia del 61%- o incluso uso de ECMO como puente previo a trasplante cardiaco30.
Manejo inmunomoduladorEl uso de inmunoglobulina intravenosa (IgIv) ha sido ampliamente estudiado; está dirigido a la inhibición de la respuesta inmune del huésped, a una dosis de 2g/kg en 24 horas3,4,6,8–10. En niños se debería recomendar su uso ya que la evidencia muestra beneficios. El estudio clásico de Drucker et al.31 demostró mejoría en la sobrevida al año y de la función ventricular. Igualmente, Haque et al.32 demostraron mayor sobrevida en 12 pacientes, pero sin diferencia en la recuperación de la función del ventrículo izquierdo.
Por el contrario, la revisión de Cochrane del año 2005 muestra que los estudios no avalan el uso de IgIv para el tratamiento de miocarditis viral en adultos33. Otras revisiones sistemáticas de la literatura han tratado de dilucidar esta controversia; por ejemplo Robinson et al. muestran que los datos son insuficientes para recomendar el uso rutinario de IgIv y sugieren realizar futuros estudios aleatorizados con base en la etiología de la miocarditis para determinar la eficacia de la IgIv34.
Manejo inmunosupresorPara el manejo inmunosupresor se ha utilizado ciclosporina, prednisona, azatioprina entre otros; su efectividad es controversial sobre todo por los sesgos que presentan los estudios al utilizar los criterios de Dallas para decidir el inicio de la terapia, de ahí que sea imprescindible descartar genoma viral con otras técnicas inmunohistoquímicas, moleculares o PCR para virus debido al riesgo de exacerbar la citotoxicidad mediada por virus en presencia de inmunosupresores en modelos animales con resultados contradictorios en otros estudios4,10. Algunos estudios han demostrado beneficio en ciertas patologías como en pacientes con miocardiopatía dilatada crónica inflamatoria (infiltrados linfocitarios en la biopsia) con genoma viral negativo; otras indicaciones incluyen miocarditis de células gigantes y miocarditis eosinofílica por hipersensibilidad2,3,6,13,21.
Terapia antiviralTiene evidencia limitada y controversial, además la viremia y la fase de replicación probablemente ya han sucedido al momento del diagnóstico. Se ha demostrado beneficio con interferón β, en pacientes con miocardiopatía dilatada con persistencia de genoma viral, con mejoría de la función ventricular2,5,13,35. Sin embargo, la mayoría de estudios muestran beneficios en cohortes de pacientes con diagnóstico etiológico específico por lo cual se da un tratamiento racional e individualizado a la condición clínica de cada paciente2.
PronósticoLa mayoría de niños con miocarditis tienen un pronóstico incierto ya que es impredecible que progrese a insuficiencia o miocardiopatía dilatada. Esto depende de factores inherentes al ambiente (respuesta al manejo), al huésped (susceptibilidad genética, expresión individual de receptores para virus ejemplo, expresión de CARs y capacidad de generar respuesta autoinmune) y al agente (virus cardiotrófico y factores de virulencia)6,10. En los casos de miocarditis aguda, un tercio de estos recuperará la función ventricular, un tercio evolucionará a miocardiopatía dilatada crónica y otro tercio requerirá trasplante cardiaco o fallecerá8. Por ejemplo, la serie de English35 mostró que de 41 pacientes con miocarditis aguda, 66% se recuperó completamente, 10% parcialmente y 24% falleció o fue sometido a trasplante. La miocarditis fulminante generalmente es de mejor pronóstico, excelente a largo plazo ya que hay mejor recuperación de la función ventricular y menores casos de necesidad de trasplante6,8,20.
Los pacientes con miocarditis de células gigantes tienen una mediana de supervivencia de seis meses; por su parte, el pronóstico de estos pacientes, depende probablemente del inicio precoz del tratamiento inmunosupresor o del trasplante cardiaco21.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna.
Conflictos de interésNinguno.