Los inhibidores de la calcineurina, la ciclosporina y el tacrolimus han jugado un papel preponderante en la prevención de los episodios de rechazo y de la enfermedad de injerto contra el huésped en pacientes tratados mediante el trasplante de órgano sólido y de la médula ósea. No obstante, el tacrolimus presenta efectos adversos relacionados con la neurotoxicidad, siendo el síndrome de encefalopatía posterior reversible la consecuencia más severa de dicha neurotoxicidad. El reporte de nuestro caso es de una mujer de 30 años de edad, con 2 días de evolución de cefalea intensa en la frente, náuseas, emesis, hiporexia y epigastralgia, afebril. Antecedente de un trasplante cardiaco 45 días antes, en tratamiento inmunosupresor con tacrolimus y micofenolato mofetilo. Se documentan niveles de tacrolimus adecuados (12,1ng/ml), los estudios imagenológicos normales y los resultados de laboratorio negativos para infección, lo que permite descartar las causas vasculares e infecciosas y la neurotoxicidad por el tacrolimus. Sin embargo, ante el desarrollo de alteraciones neuropsiquiátricas, y a pesar de niveles de tacrolimus<5,5ng/ml, se realiza nueva resonancia nuclear magnética cerebral con hallazgos que indican síndrome de leucoencefalopatía posterior reversible. Se suspende el tacrolimus y se inicia tratamiento con everolimus, lográndose remisión total. Este sería el primer caso reportado en el cual las alteraciones imagenológicas asociadas al síndrome de encefalopatía posterior reversible se desarrollaron en una paciente intervenida de trasplante cardiaco con niveles de tacrolimus<10ng/ml. El reporte de este caso permitirá a los grupos médicos tratantes considerar este diagnóstico a pesar de niveles de tacrolimus en rango terapéutico, de manera que se realice un reconocimiento y tratamiento oportuno, evitando así el desarrollo de complicaciones o secuelas neurológicas.
Calcineurin inhibitors, cyclosporine and tacrolimus, have played a major role in preventing graft rejection and graft-versus-host disease in patients undergoing bone marrow and solid organ transplantation. However, tacrolimus has adverse effects related with neurotoxicity, being the posterior reversible encephalopathy syndrome the most severe consequence of this neurotoxicity. We report the case of a 30 year-old woman with 2-day history of severe frontal headache, náusea, emesis, hiporexia and epigastric pain, without fever. History of heart transplant 45 days ago, immunosuppressive therapy with tacrolimus and mycophenolatemofetil. Appropriate levels of tacrolimus (12.1ng/ml), normal imaging and lab results were documented, excluding vascular and infectious causes as well as tacrolimus neurotoxicity. Nevertheless, due to the development of neuropsychiatric disorders and despite tacrolimus levels being <5.5ng/ml, a new brain MRI was performed showing a reversible posterior leukoencephalopathy syndrome. Tacrolimus was switched to everolimus achieving complete remission. This is the first reported case in which the imaging alterations associated with posterior reversible encephalopathy syndrome were developed in a patient undergoing heart transplantation with tacrolimus levels<10ng/ml. The report of this case will allow the treating physician groups to consider this diagnosis regardless oftacrolimus levels within therapeutic range, allowing therefore an early recognition and treatment, thus avoiding the development of complications and/or neurological sequels.
Los inhibidores de la calcineurina (IsC), la ciclosporina y el tacrolimus (antiguamente FK 506) revolucionaron la terapia inmunosupresora postrasplante desde su descubrimiento en la década de los 80. El tacrolimus, descubierto en el año 1984 a partir del Streptomyces tsukubaensis1, ha jugado un papel preponderante en la prevención de episodios de rechazo y de la enfermedad de injerto contra el huésped en pacientes tratados mediante trasplante de órgano sólido y de médula ósea1. A pesar de sus grandes beneficios, presenta inconvenientes relacionados principalmente con su estrecha ventana terapéutica y su amplio perfil de efectos adversos, incluyendo los diversos grados de la nefrotoxicidad y la neurotoxicidad1, siendo esta última menos frecuente con el uso de la ciclosporina2. El síndrome de encefalopatía posterior reversible (SEPR) es la consecuencia más severa y dramática de la neurotoxicidad ocasionada por IsC. Fue descrita inicialmente por Hinchey et al., en el año 19961, y sus manifestaciones incluyen la cefalea, las alteraciones del estado mental, las alteraciones visuales y las convulsiones. Si bien es una condición infrecuente, asociada en la mayoría de los casos a niveles sanguíneos elevados del tacrolimus, también ha sido descrita en pacientes con niveles considerados terapéuticos3.
El presente reporte busca concienciar a la comunidad médica sobre la posibilidad de desarrollo de encefalopatía con niveles terapéuticos de tacrolimus, ya que un reconocimiento y tratamiento oportuno puede evitar el desarrollo de complicaciones o secuelas neurológicas2.
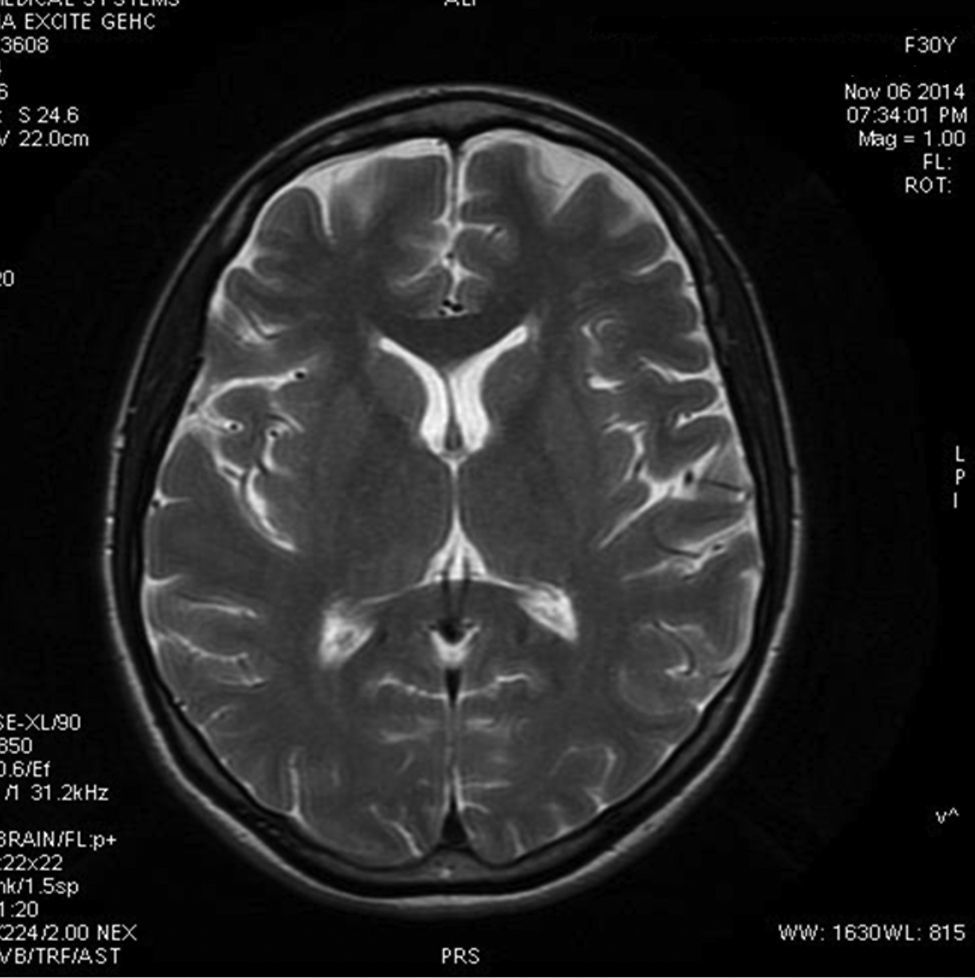
Caso clínicoMujer de 30 años de edad, con historia clínica de 2 días de evolución de cefalea severa con intensidad en la región frontal, asociada a náuseas, emesis, hiporexia y epigastralgia, sin fiebre, síntomas para los cuales se automedicó con metoclopramida. Dentro de sus antecedentes llama la atención: trasplante cardiaco: cardiopatía dilatada de etiología valvular; realizado 45 días antes. Al inicio de su sintomatología, estaba en tratamiento inmunosupresor con tacrolimus y micofenolato mofetilo. Al examen físico se presentaba afebril, taquicárdica, con dolor a la palpación en región frontal, con temblor en la voz y extremidades superiores, sin ninguna otra alteración. En la valoración por neurología, se documenta dolor ocular y alodinia en región frontal. Se considera pertinente descartar causas vasculares e infecciosas versus la neurotoxicidad por tacrolimus en el contexto de una paciente con consumo simultáneo de metoclopramida, por lo que se solicitan los laboratorios respectivos. Se documentan niveles de tacrolimus en 12,1ng/ml en rangos adecuados para el tiempo de trasplante cardiaco; sin embargo, al haber estado expuesta a la metoclopramida, se decidió modificar ligeramente la dosis a fin de que no se aumentaran los niveles de tracrolimus. La resonancia nuclear magnética cerebral simple y contrastada no presenta alteraciones (fig. 1), por lo que se considera poco probable la neurotoxicidad por tacrolimus, y la resonancia nuclear magnética de órbitas descarta afección ocular. La tomografía axial computarizada cerebral simple y contrastada con extensión a senos paranasales es normal, lo que descarta un compromiso vascular cerebral y un proceso infeccioso a nivel sinusal.
Se documenta carga viral para citomegalovirus negativa, leucopenia severa progresiva y reactantes de fase aguda en ascenso, por lo que se sospecha de neuroinfección. Se decide inicio empírico de antibioticoterapia. No obstante, los resultados de la punción lumbar descartan un proceso infeccioso, por lo que ante la mejoría clínica de la paciente y la evidencia de descenso en los reactantes de fase aguda se suspende la antibioticoterapia y se reinicia su esquema de inmunosupresión sin ningún cambio.
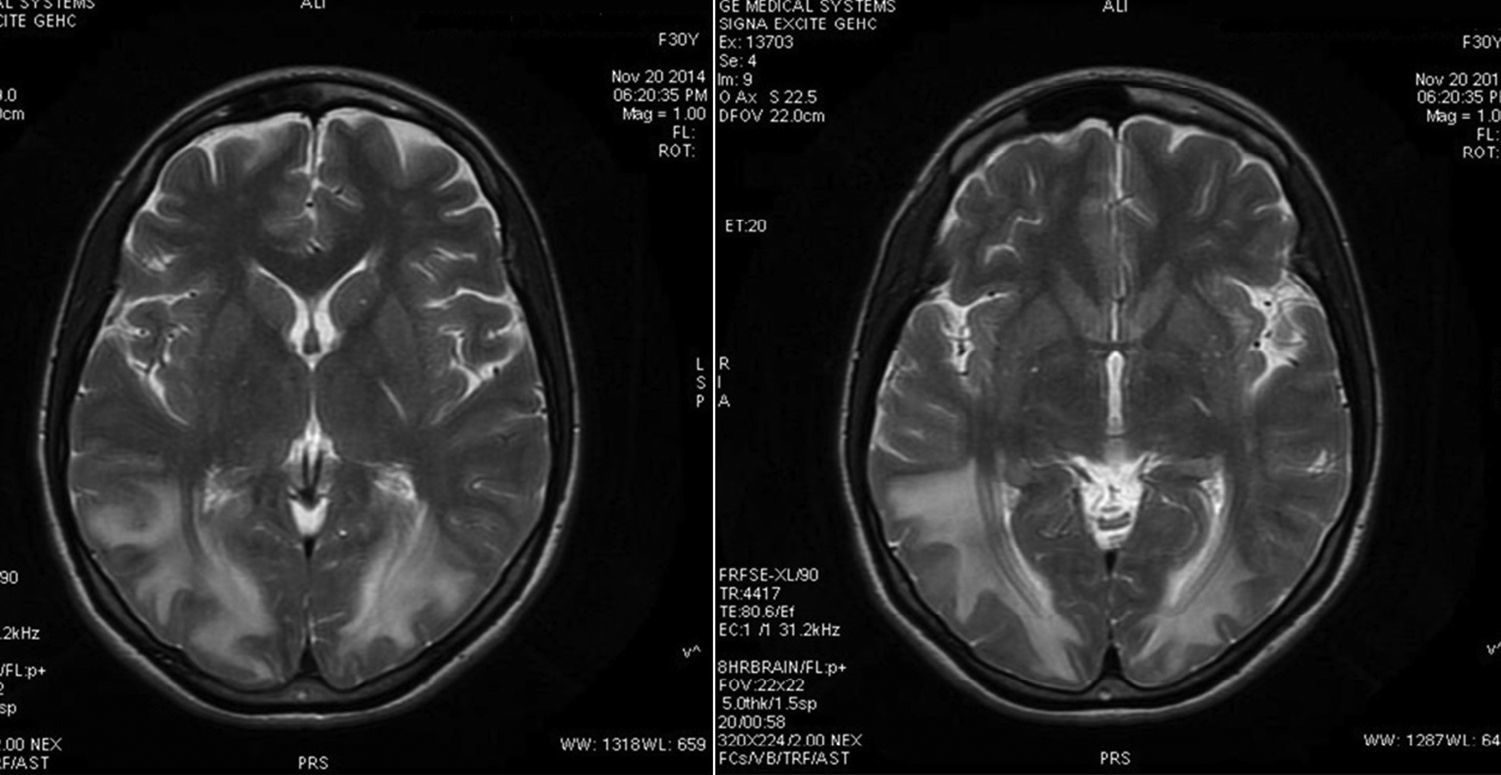
A los 7 días de su ingreso, la paciente presentaba epigastralgia intensa persistente, asociada a signos de irritación peritoneal, por lo que se la lleva a laparoscopia diagnóstica, la cual sale negativa. A pesar de esto, la paciente persiste con epigastralgia, asociada a disminución de la agudeza visual bilateral y síntomas psiquiátricos dados por ansiedad, irritabilidad y llanto fácil, lo que lleva a reconsiderar el diagnóstico de neurotoxicidad por tacrolimus como la causa de las diversas alteraciones neuropsiquiátricas presentadas. Ante la ausencia de otras posibles causas, a pesar de una resonancia nuclear magnética previa que sale negativa y con los niveles de tacrolimus en<5,5ng/ml, se realiza nueva resonancia nuclear magnética cerebral simple y contrastada, en las que se encuentra alteración en la intensidad de señal de la sustancia blanca de las regiones parietooccipitales predominantemente y, en menor grado, a nivel de las regiones frontales y la sustancia blanca profunda de los centros semiovales que indican síndrome de leucoencefalopatía posterior reversible (fig. 2). Se decide suspender el tacrolimus e iniciar esquema inmunosupresor con everolimus por riesgo de deterioro neurológico progresivo. La paciente evoluciona favorablemente, sin síntomas neurológicos, con mejoría de la agudeza visual. Al mes del egreso hospitalario se le realiza nueva resonancia nuclear magnética cerebral de control sin hallazgos de encefalopatía.
DiscusiónEl SEPR fue descrito inicialmente por Hinchey et al., en el año 1996, como una entidad cliniconeurorradiológica, caracterizada típicamente por déficits neurológicos, hallazgos característicos en la resonancia magnética y, usualmente, un curso benigno. Se han descrito como factores predisponentes para su desarrollo el uso de medicamentos inmunosupresores (la ciclosporina y el tacrolimus), las alteraciones metabólicas, la hipertensión, la eclampsia y la administración de la metilprednisolona3 entre otros. Sin embargo, este síndrome puede ser desencadenado por diversas causas2.
La frecuencia de la neurotoxicidad inducida por IsC se ha descrito entre un 7 y un 32%2. En cuanto al SEPR en pacientes con trasplante de órgano solido, Bartinsky et al. reportaron una incidencia del 0,49%, muy inferior a la reportada por otros autores en años anteriores4. Con relación al tacrolimus específicamente, hasta un 40-60% de los pacientes trasplantados inmunosuprimidos con dicho medicamento experimentan efectos neurotóxicos leves como cefalea, parestesias, temblores, alteraciones del sueño y disestesias5. Aproximadamente el 1,6%6 de estos pacientes puede desarrollar síntomas más severos que configuran un SEPR, también denominado leucoencefalopatía posterior reversible, cuyos 3 síntomas más comunes son las convulsiones, la cefalea y la alteración del estado mental3,7,8. También se han descrito otras manifestaciones clínicas como alteraciones visuales6 que abarcan desde la visión borrosa hasta la ceguera cortical7,8, anormalidades en la percepción como ilusiones y alucinaciones, y mutismo aquinético8.
Las convulsiones son típicamente generalizadas tónico-clónicas pero pueden ser focales o complejas parciales y se presentan de manera aislada hasta en un 30% de los pacientes1. La alteración del estado mental comprende desde la somnolencia leve o la confusión hasta el coma profundo7,8. La agitación es común y, aunque menos frecuente, los pacientes pueden desarrollar psicosis o manía1,8.
Generalmente este síndrome se presenta en los primeros 30 días, con una mediana de inicio a los 14 días1. No obstante, estudios recientes han demostrado diferencias estadísticamente significativas con relación al tiempo de presentación según el tipo de trasplante. Bartinsky et al. reportaron que, en pacientes con trasplante hepático, el SEPR se desarrolla en promedio en los primeros 45 días después del trasplante, mientras que en pacientes con trasplante renal este puede desarrollarse dentro de los 52 meses siguientes4. En pacientes con trasplante cardiaco, si bien no existieron diferencias significativas, en promedio el desarrollo de SEPR ocurrió a los 21 meses postrasplante4. En general, los síntomas son completamente reversibles y se resuelven tras la reducción o suspensión del tacrolimus, sin embargo, un reconocimiento tardío puede ocasionar un déficit neurológico permanente2.
La causa del SEPR inducido por IsC, específicamente por el tacrolimus, permanece controversial. No obstante, la hipertensión con falla en la autorregulación, el vasoespasmo y la hipoperfusión cerebral han sido propuestas como causa de desarrollo del edema vasogénico presente en esta condición.
La resonancia magnética es la herramienta imagenológica de elección para el estudio de pacientes con SEPR, encontrándose característicamente edema vasogénico en la sustancia blanca subcortical de regiones parietooccipitales bilaterales o unilaterales, que pueden extenderse a la corteza o hacia la sustancia blanca profunda5,6.
En un estudio realizado por Shimono et al., en el año 2003, se reportaron los hallazgos imagenológicos de 14 pacientes trasplantados que desarrollaron síntomas neurológicos asociados al uso del tacrolimus. Los estudios iniciales de resonancia magnética documentaron alteraciones en la sustancia blanca en 5 pacientes, hemorragia a nivel del putamen en un paciente y fueron normales en 8 pacientes. En los 5 pacientes con anormalidades en la sustancia blanca, todas las anormalidades se extendían a la corteza adyacente, 2 pacientes tenían además anormalidades talámicas y uno tenía además un hematoma subdural5.
En cuanto a los niveles del tacrolimus asociados al desarrollo de síntomas neurológicos, en general, se ha considerado que existe una relación dosis dependiente9. En el año 2007 Kaczmarek et al. reportaron la presencia de ataxia asociada a hallazgos de atrofia cerebelar en una paciente intervenida mediante trasplante cardiaco, con niveles del tacrolimus de 15ng/ml3. De forma similar, Kaleyias et al. reportaron la presencia de lesión cerebelar aislada asociada a niveles del tacrolimus de 35ng/ml en una paciente con trasplante renal3. Sin embargo, también se han reportado alteraciones neurológicas con niveles terapéuticos de tacrolimus. Labate et al. describieron el caso de una paciente que, tras un trasplante cardiaco, desarrolló polineuropatía sensorial y motora con niveles del tacrolimus de 9,6ng/ml10. De hecho, en el estudio de Shimono et al., mencionado previamente, 4 de los 8 pacientes con resonancias magnéticas normales tenían niveles del tacrolimus superiores a 15ng/ml y 3 de los 5 pacientes con anormalidades en la sustancia blanca no tenían niveles elevados del tacrolimus, por lo que existe pobre relación entre los niveles del tacrolimus, la ocurrencia y características de los síntomas neurológicos, y la presencia de alteraciones en las neuroimágenes. No obstante, es importante resaltar que el promedio de los niveles sanguíneos de tacrolimus encontrado en los pacientes que desarrollaron anormalidades imagenológicas fue de 16,2ng/ml. Ningún paciente desarrolló anormalidades imagenológicas con los niveles del tacrolimus inferiores a 10ng/ml y el mínimo valor del tacrolimus asociado al desarrollo de síntomas neurológicos en esta serie fue de 7,5ng/ml5.
En el presente reporte de caso, la paciente desarrolló un SEPR con síntomas dados por cefalea, alteraciones visuales, alteraciones psiquiátricas y neurológicas (alodinia), en el cual tras descartarse las causas infecciosas, las metabólicas y las vasculares, la neurotoxicidad por el tacrolimus se consideró como el diagnóstico más razonable3. Además, el hecho de que los síntomas neurológicos mejoraran después de cambiar a everolimus es evidencia adicional de la neurotoxicidad por tacrolimus.
Llama la atención que, en este caso, las alteraciones imagenológicas se desarrollaron con niveles de tacrolimus<10ng/ml, lo cual contrasta con lo reportado previamente en la literatura5. Además, dichas alteraciones se presentaron pasados 7 días de evolución, cuando lo usual es que estos hallazgos sean evidentes en el 88% de los casos al inicio de los síntomas y en el 94% de los pacientes en el día 2-4 de evolución7.
ConclusiónEn pacientes tratados mediante trasplante cardiaco los reportes de encefalopatía por IsC son escasos, sin embargo, en pacientes llevados a trasplante hepático y renal, el síndrome de leucoencefalopatía posterior reversible es una complicación asociada al tacrolimus1,3.
Según nuestra revisión de la literatura este sería el primer caso reportado en el cual las alteraciones imagenológicas asociadas al SEPR se desarrollaron en una paciente intervenida mediante trasplante cardiaco con los niveles del tacrolimus <10ng/ml. Por esta razón, el grupo médico tratante debe considerar este diagnóstico a pesar de los niveles del tacrolimus en rango terapéutico y una vez descartadas otras posibles causas, ya que un reconocimiento y tratamiento oportuno puede evitar el desarrollo de complicaciones o secuelas neurológicas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores manifiestan no tener ningún conflicto de intereses.