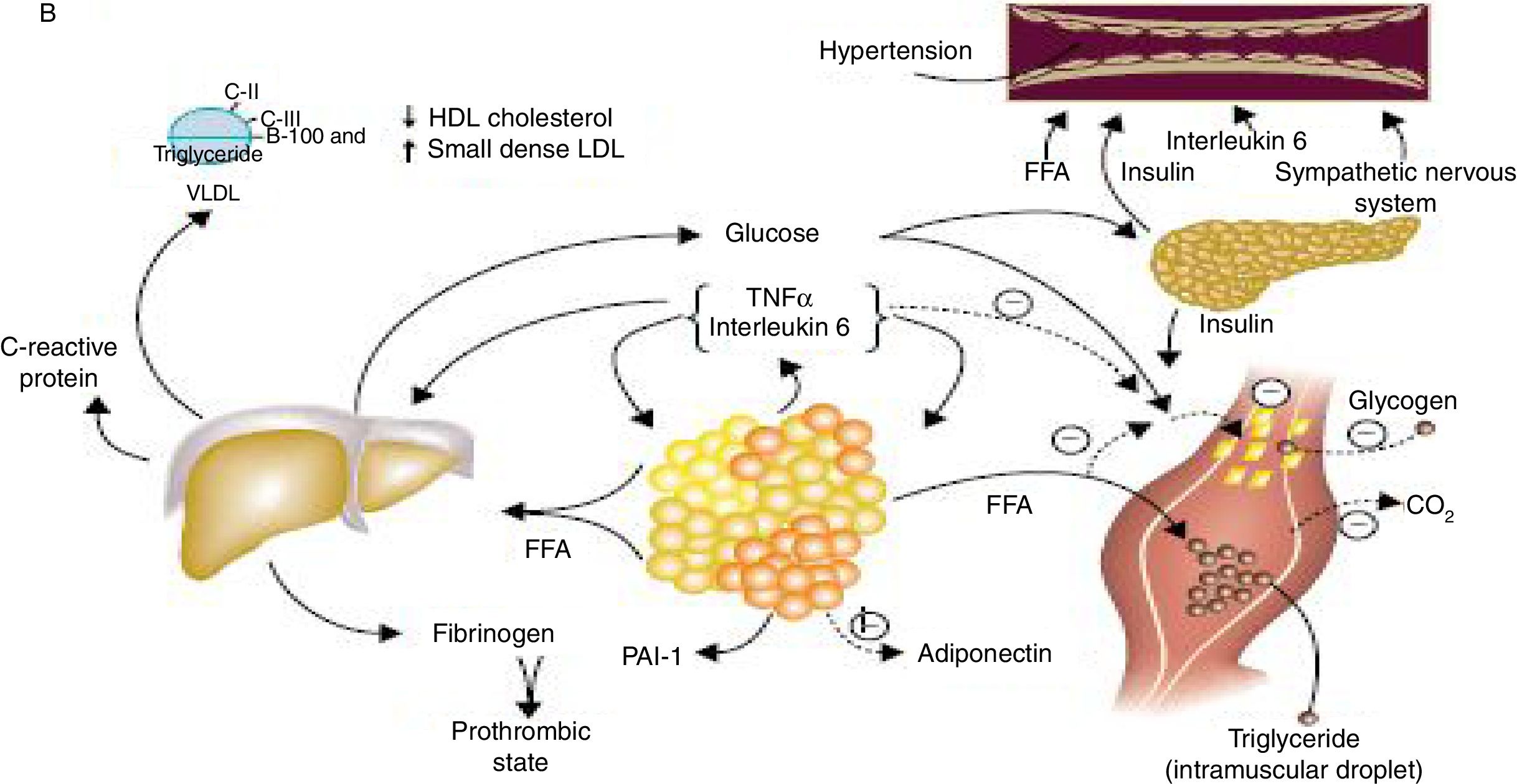
La obesidad, especialmente la abdominal, se asocia con la resistencia al efecto de la insulina sobre la glucosa periférica y la utilización de ácidos grasos, hecho que puede conducir al desarrollo de síndrome metabólico y a la diabetes mellitus tipo 2. La resistencia a la insulina, la hiperinsulinemia y la hiperglucemia asociada, y el aumento de adipoquinas también puede llevar a la disfunción endotelial vascular, perfil anormal de lípidos, hipertensión e inflamación vascular, todo lo cual promueve el desarrollo de enfermedad cardiovascular aterosclerótica; a esa asociación se le conoce como síndrome x, cuarteto de la muerte, síndrome de resistencia a la insulina.
En el estudio NHANES III, el síndrome metabólico estaba presente en el 5% de los pacientes de peso normal, 22% de los que tenían sobrepeso, y el 60% de aquellos que eran obesos. El aumento del peso corporal es un factor de riesgo importante para el síndrome metabólico, además de la edad y la raza, otros factores asociados con un mayor riesgo de síndrome metabólico, el consumo de bebidas endulzadas con azúcar y medicamentos antipsicóticos.
ObjetivoDeterminar cómo influye el síndrome metabólico en la mujer en el aumento de riesgo cardiovascular.
MétodoSe realizó una revisión sistemática de las investigaciones y de las revisiones de tema que se han realizado en últimos años sobre el síndrome metabólico en la mujer, a partir de los hallazgos arrojados de bases de datos científicas. Uptodate, PubMed y SciELO.
ConclusionesLa enfermedad cardiovascular es la principal causa de muerte en las mujeres y existen factores de riesgo específicos de la mujer para desarrollarla, entre los cuales están: edad temprana de menarquia, menopausia, síndrome premenstrual, síndrome de ovario poliquístico, uso de anticonceptivos orales, haber presentado trastorno hipertensivo del embarazo, parto pretérmino y otros factores de riesgo compartidos con los hombres, como edad, antecedentes familiares, hipertensión arterial, dislipidemias, diabetes mellitus, síndrome metabólico, enfermedad renal crónica, tabaquismo, dieta, consumo de alcohol, sedentarismo, obesidad, factores psicosociales, marcadores inflamatorios, proteína C reactiva, concentración elevada de fibrinógeno plasmático e hiperhomocisteinemia.
Obesity, especially abdominal obesity, is associated with resistance to the effect of insulin on peripheral glucose and the use of fatty acids. This can lead to the development of metabolic syndrome and type 2 diabetes mellitus, resistance to insulin, hyperinsulinemia and associated hyperglycemia, and adipokines. It can also lead to vascular endothelial dysfunction, an abnormal lipid profile, hypertension and vascular inflammation, all of which promote the development of atherosclerotic cardiovascular disease. This association is known as syndrome X, the quartet of death, or insulin resistance syndrome.
In the NHANES III study, metabolic syndrome was present in 5% of patients with normal weight, 22% of those who were overweight, and 60% of those who were obese. Increased body weight is a major risk factor for metabolic syndrome, in addition to age and race. Other factors associated with an increased risk of metabolic syndrome include the consumption of drinks sweetened with sugar and antipsychotic medications.
In this review, we will discuss how metabolic syndrome affects women in increasing cardiovascular risk.
MethodA systematic review of the research was carried out, with the subject reviews which have been carried out in recent years regarding metabolic syndrome in women, derived from scientific data bases. Uptodate, Pubmed and Scielo.
ConclusionsCardiovascular disease (CVD) is the main cause of death in women and there are risk factors which are specific to women, such as early onset of menarche, menopause, premenstrual syndrome, polycystic ovarian syndrome, the use of oral contraceptives, a history of pregnancy induced hypertension, and preterm delivery. Other risk factors are shared with men, such as age, family history, hypertension, dyslipidemias, diabetes mellitus, metabolic syndrome, chronic kidney disease, smoking, diet, consumption of alcohol, a sedentary lifestyle, obesity, psychosocial factors, C-reactive protein inflammatory markers, a high plasma fibrinogen level and hyperhomocysteinemia.
El síndrome metabólico se define por múltiples factores de riesgo de enfermedad cardiovascular, entre los que se incluye la obesidad abdominal, la dislipidemia aterogénica, la hipertensión y el aumento de la glucosa en ayunas. Este síndrome se considera como un importante problema de salud pública, ya que está asociado con un incremento de cinco veces en la prevalencia de diabetes tipo 2 y de dos a tres veces en la de enfermedad cardiovascular1.
Sus constituyentes clínicos: hipertensión arterial, intolerancia a los carbohidratos, perfil aterogénico y obesidad, tienen como sustrato común la resistencia a la insulina y son, a la vez, factores de riesgo para el desarrollo de enfermedad cardiovascular y diabetes. Se tienen informes de mayor prevalencia en mujeres mayores, en especial en afroamericanas, en relación con los hombres.
El riesgo de padecer síndrome metabólico incrementa en la etapa de transición de la menopausia, debido a un deterioro que guarda relación con la edad, los cambios metabólicos y hormonales, y el incremento en el depósito de tejido adiposo visceral.
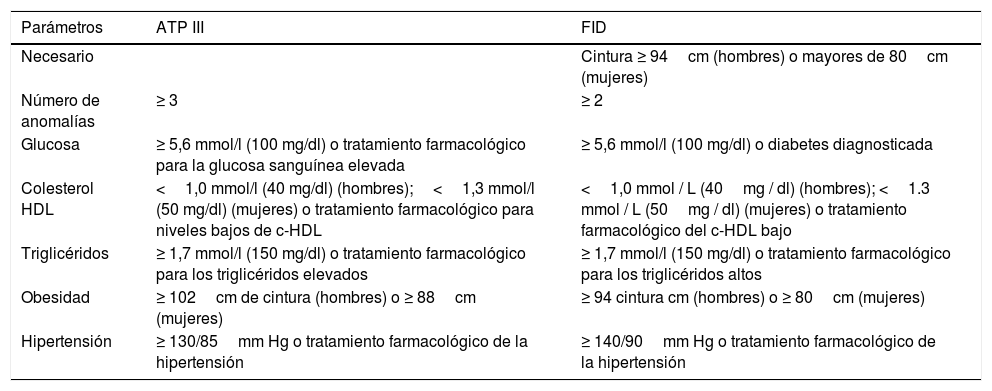
El síndrome metabólico fue descrito por primera vez por Reaven en 1988. Una década más tarde, el Adult Treatment Panel III del Programa Nacional de colesterol propuso la primera definición para adultos en 2001 y estableció sus criterios clínicos para definir el síndrome metabólico (tabla 1). El síndrome metabólico se ha reconocido como un estado proinflamatorio y protrombótico, asociado con niveles elevados de proteína C reactiva, interleucina 6 e inhibidor del activador del plasminógeno2.
Criterios más utilizados para definir síndrome metabólico
| Parámetros | ATP III | FID |
|---|---|---|
| Necesario | Cintura ≥ 94cm (hombres) o mayores de 80cm (mujeres) | |
| Número de anomalías | ≥ 3 | ≥ 2 |
| Glucosa | ≥ 5,6 mmol/l (100 mg/dl) o tratamiento farmacológico para la glucosa sanguínea elevada | ≥ 5,6 mmol/l (100 mg/dl) o diabetes diagnosticada |
| Colesterol HDL | <1,0 mmol/l (40 mg/dl) (hombres);<1,3 mmol/l (50 mg/dl) (mujeres) o tratamiento farmacológico para niveles bajos de c-HDL | <1,0 mmol / L (40mg / dl) (hombres); <1.3 mmol / L (50mg / dl) (mujeres) o tratamiento farmacológico del c-HDL bajo |
| Triglicéridos | ≥ 1,7 mmol/l (150 mg/dl) o tratamiento farmacológico para los triglicéridos elevados | ≥ 1,7 mmol/l (150 mg/dl) o tratamiento farmacológico para los triglicéridos altos |
| Obesidad | ≥ 102cm de cintura (hombres) o ≥ 88cm (mujeres) | ≥ 94 cintura cm (hombres) o ≥ 80cm (mujeres) |
| Hipertensión | ≥ 130/85mm Hg o tratamiento farmacológico de la hipertensión | ≥ 140/90mm Hg o tratamiento farmacológico de la hipertensión |
El síndrome metabólico es reconocido como una entidad patológica caracterizada por una serie de alteraciones metabólicas que en conjunto constituyen un factor de riesgo para desarrollar enfermedad cardiovascular y diabetes.
Bases genéticasEn la escasez de alimentos en la que vivía el hombre en épocas anteriores sumado al gasto energético que implicaba conseguir su comida se favoreció la aparición de un genotipo ahorrador caracterizado por la selección de determinados genes que aseguran una maquinaria enzimática capaz de generar gran ahorro energético mediante buena reserva de glucógeno muscular y abundante almacenamiento de grasa con el cúmulo de triglicéridos en el tejido adiposo. Ahora se vive en una época de abundantes alimentos y mínimo consumo de reservas, con un cambio en el estilo de vida caracterizado por disminución de la actividad física asociada al consumo de dieta alta en calorías y grasa.
Dicho consumo calórico aumentado asociado a la presencia de los genes ahorradores, permite explicar en parte el aumento de peso y la predisposición a la aparición de patologías como el síndrome metabólico y enfermedades crónicas no transmisibles.
Es indudable entonces que el peso corporal del adulto y en particular la masa de tejido adiposo es el resultado de la interacción entre los factores ambientales y genéticos. Dentro de estos factores genéticos se incluyen los siguientes grupos:
- 1.
Genes que codifican proteínas relacionadas con las vías de síntesis y degradación de triglicéridos: fosfoenol piruvato carboxicinasa, aP2, acil CoA sintetasa, proteína 1 transportadora de ácidos grasos, lipoproteín lipasa, receptores β2 y β3 adrenérgicos y lipasa sensible a hormona.
- 2.
Genes involucrados en la proliferación y diferenciación de adipocitos: factores de transcripción PPAR-γ- 1, C/EBP. Los PPAR son receptores de proliferación de peroxisomas activados, los cuales parecen regular el crecimiento, la maduración y la función del adipocito. Existen tres subtipos: α, β, γ. Los subtipos γ y α se expresan principalmente en el hígado y se encuentran involucrados en el control del metabolismo de las lipoproteínas, oxidación y utilización celular de ácidos grasos; además, participan en la respuesta inflamatoria. Algunos estudios sugieren que mutaciones en el gen que codifica el PPAR-γ producirían una pérdida de la función, siendo responsable en el desarrollo de la resistencia a la insulina, diabetes mellitus tipo 2 e hipertensión arterial3.
- 3.
Genes asociados con el síndrome metabólico: codifican para el sustrato del receptor de insulina (IRS)- 1, la glucógeno sintetasa y la proteína desacoplante UCP1, entre otros4.
Los PPAR comparten un alto grado de homología estructural con todos los miembros de la superfamilia, particularmente en el dominio de unión al ADN y el dominio de unión al ligando y al cofactor. Muchos roles celulares y sistémicos han sido atribuidos a estos receptores, llegando mucho más allá de la estimulación de la proliferación de peroxisomas en roedores, después de lo cual fueron nombrados inicialmente. Los PPAR presentan amplios patrones de expresión tisular específicos del isotipo. PPARalpha se expresa en niveles altos en órganos con catabolismo significativo de ácidos grasos. PPARbeta/delta tiene el patrón de expresión más amplio, y los niveles de expresión en ciertos tejidos dependen del grado de proliferación y diferenciación celular. PPARgamma se expresa como dos isoformas, de las cuales PPARgamma2 se encuentra a altos niveles en los tejidos adiposos, mientras que PPARgamma1 tiene un patrón de expresión más amplio. La regulación transcripcional por PPAR requiere heterodimerización con el receptor retinoide X (RXR). Cuando se activa por un ligando, el dímero modula la transcripción a través de la unión a un elemento de secuencia de ADN específico llamado elemento de respuesta del proliferador de peroxisoma (PPRE) en la región promotora de genes diana. Se identificó una amplia variedad de compuestos naturales o sintéticos como ligandos de PPAR. Entre los ligandos sintéticos, los fármacos hipolipemiantes, los fibratos y los sensibilizadores a la insulina, las tiazolidinedionas, son los agonistas PPARalfa y PPARgamma, respectivamente, lo que subraya el importante papel de los PPAR como dianas terapéuticas. El control de la transcripción por los heterodímeros de PPAR/RXR también requiere la interacción con complejos correguladores. Por tanto, la acción selectiva de PPARs in vivo resulta de la interacción en un punto de tiempo dado entre los niveles de expresión de cada uno de los tres isotipos PPAR y RXR, la afinidad por un promotor PPRE específico y las disponibilidades de ligando y cofactor5.
Bases fisiopatológicasEn la fisiopatología del síndrome metabólico están involucradas una serie de alteraciones en el metabolismo glucolipídico, asociado a un estado proinflamatorio y protrombótico. La resistencia a la insulina se ha considerado la base que relaciona estas alteraciones, la cual está favorecida por el aumento de ácidos grasos libres, secundaria a un mayor contenido de grasa corporal visceral, relacionada con sobrepeso u obesidad.
Por otro lado, la hipertensión se asocia con múltiples mecanismos de este síndrome como consecuencia de alteraciones en la vía de la insulina y regulación del sistema neurovegetativo, entre otros mecanismos2.
Resistencia a la insulinaEs un proceso fisiopatológico caracterizado por un defecto en la acción de la insulina que provoca un aumento de la insulina basal para mantener la glucemia en un rango normal. Está dada por una disminución de la sensibilidad tisular a su acción, lo cual provoca una respuesta compensadora que aumenta su producción a nivel pancreático.
El principal contribuyente a la resistencia a la insulina es el exceso de ácidos grasos libres circulantes, los cuales derivan de las reservas de triglicéridos del tejido adiposo sometidos a la lipasa dependiente de monofosfato de adenosina cíclico (AMPc) o bien de la lipólisis por parte de la lipoproteinlipasa de proteínas ricas en triglicéridos en los tejidos.
Por otra parte, esos ácidos grasos libres modifican la acción de proteincinasas en el músculo, y en el hígado provocan defectos en los receptores estimulados por insulina, aumentan la producción hepática de glucosa y disminuyen en los tejidos periféricos la inhibición de la producción de glucosa mediada por insulina.
Los defectos de la acción de la insulina generan incapacidad de la hormona para suprimir la producción de glucosa por el hígado y el riñón, además de alteraciones en el metabolismo de la glucosa en tejidos sensibles a la insulina. Este estado conlleva trastornos en la utilización de glucosa a nivel celular y desregulación en su producción hepática2 (tabla 2).
Anormalidades metabólicas y funcionales asociadas con insulinorresistencia e hiperinsulinemia
| Cierto grado de intolerancia a la glucosa/Metabolismo del ácido úrico anormal/Dislipidemia |
|---|
| -Glucemia alterada en ayunas - ↑ Concentración plasmática de ácido úrico - ↑Triglicéridos -Tolerancia a la glucosa alterada - ↓Aclaramiento renal de ácido úrico - ↓cHDL -↓Diámetro de las partículas LDL -↑Lipemia postprandial |
| Hemodinámicas/Hemostasia/Sistema reproductor |
|---|
| -↑Actividad del sistema nervioso simpático -↑Inhibidor del activador del plasminógeno 1 - Síndrome de ovario -↑Retención renal de sodio -↑Fibrinógeno poliquístico -↑Presión arterial (≈50% hipertensos son insulinorresistentes) |
| Disfunción endotelial |
|---|
| -↑Adhesión de monoclonales -↑Concentración plasmática de moléculas de adhesión celular -↑Concentración plasmática de dimetil-arginina asimétrica -↓Vasodilatación dependiente del endotelio |
c-HDL: colesterol unido a lipoproteína de alta densidad; LDL: lipoproteína de baja densidad.
Adaptada de: Laclaustra Gimeno et al.2.
Dada la estrecha correlación entre obesidad abdominal e insulinorresistencia, se considera la obesidad abdominal como uno de los componentes principales del síndrome y el factor de riesgo más importante que llevaría a desencadenar las demás anormalidades metabólicas.
La obesidad abdominal se caracteriza por un incremento del perímetro abdominal, lo cual representa una medida indirecta del aumento de grasa visceral. Esta distribución preferencial del tejido adiposo constituye un aspecto fundamental, ya que este tejido adiposo intraabdominal presenta actividad lipolítica elevada que aumenta el flujo de ácidos grasos libres en plasma, aumentado los sustratos para la síntesis hepática de lipoproteínas ricas en triglicéridos como las VLDL. Al mismo tiempo, no se inhibe efectivamente la síntesis hepática de glucosa y el músculo disminuye su captación, lo cual incrementa la glucemia y eleva la secreción de insulina.
Además, esta grasa visceral implica la producción en el tejido graso de sustancias químicas llamadas adipoquinas, las cuales favorecen estados proinflamatorios y protrombóticos, que a su vez contribuyen al desarrollo de insulinorresistencia, hiperinsulinemia, alteración en la fibrinólisis y disfunción endotelial. La adiponectina, a diferencia del resto, se encuentra disminuida, lo cual se asocia a un incremento de triglicéridos, disminución de HDL, elevación de apoliproteína B y presencia de partículas pequeñas y densas de LDL, contribuyendo al estado aterotrombótico que representa el perfil inflamatorio de la adiposidad visceral6.
Un aspecto importante es que el aumento del tejido adiposo visceral produce una elevación del flujo de ácidos grasos libres hacia la circulación esplácnica, mientras que los derivados del tejido subcutáneo evitan el paso hepático y de esta manera el aumento de la producción de glucosa, la síntesis de lípidos y la secreción de proteínas protrombóticas2.
Fenotipo lipoproteínico aterogénicoEn condiciones normales hay liberación de ácidos grasos libres desde los adipocitos hacia el hígado y el músculo. En el hígado una parte es oxidada y la mayoría reesterificada a triglicéridos, sin embargo, si este proceso se satura, la acumulación de triglicéridos puede conducir a hígado graso.
Además, en presencia de insulinorresistencia, el exceso de flujo de ácidos grasos libres al hígado, produce aumento de la síntesis de triglicéridos y colesterol VLDL rico en triglicéridos y apolipoproteína B. Por esto, la dislipidemia en este síndrome se caracteriza especialmente por elevación de triglicéridos y lipoproteínas de muy baja densidad (VLDL) y descenso de lipoproteínas de alta densidad (HDL), lo cual se denomina fenotipo lipoproteínico aterogénico2.
Relación con la aterosclerosisLa aterosclerosis es la consecuencia primaria del síndrome metabólico. Los cambios que se asocian con su aparición son: aumento de LDL pequeñas y densas, elevación de lipoproteína A, hipertrigliceridemia y disminución de HDL.
Por otro lado, la disminución del óxido nítrico, el incremento de sustancias proinflamatorias y el compromiso severo en el metabolismo de la glucosa tienen repercusiones importantes en cuanto al desarrollo de la aterosclerosis.
Relación con la hipertensiónVarios mecanismos podrían explicar el desarrollo de hipertensión a partir de la hiperinsulinemia; entre ellos están el incremento de la reabsorción de sodio en el túbulo contorneado proximal renal, el aumento de la activación del sistema nervioso simpático por hiperreactividad del eje hipotálamo hipofisario adrenal, las modificaciones del transporte iónico de membrana celular y la hiperplasia de las células de músculo liso de la pared vascular. Adicionalmente, se ha considerado que la insulina tiene un efecto directo sobre la resistencia vascular periférica aumentando la respuesta a la angiotensina II y a la noradrenalina.
Entre los mecanismos de transporte iónico a través de la membrana en los que se involucra la insulina se encuentran la estimulación de la bomba sodio potasio ATPasa, causante del mantenimiento del balance normal del potasio intracelular y extracelular y la regulación de la bomba calcio ATPasa, que mantiene el calcio intracelular. Si esta bomba es resistente a la acción de la insulina, aumenta el calcio intracelular desencadenando hiperreactividad vascular e hipertensión.
La insulina también parece causar vasodilatación mediante la estimulación de la producción endotelial de óxido nítrico, además existe una relación entre la resistencia a la insulina y las concentraciones plasmáticas de dimetil arginina asimétrica, que es un inhibidor endógeno de la óxido nítrico sintasa, por lo que cuando ocurre en las células endoteliales, la resistencia a la insulina puede contribuir a la disfunción endotelial.
Todo parece indicar que la resistencia a la insulina deteriora la función endotelial y que es esta alteración la que conduce a la hipertensión arterial, por desequilibrar la balanza hacia la vasoconstricción2 (fig. 1).
Fisiopatología del síndrome metabólico (resistencia a la insulina). Adaptada de Eckel et al.1.
El tejido adiposo secreta una serie de hormonas entre las que se encuentran la adiponectina y la resistina. La desregulación que implica la resistencia a la insulina, se caracteriza por disminución de la adiponectina y aumento de la resistina.
Por otro lado, los valores de leptina están elevados en este síndrome metabólico, lo que podría implicar un defecto de su actividad que altera el control de la saciedad en el diencéfalo y conduce a hiperfagia y sobrepeso u obesidad consecuentes.
Además, existen otros mediadores inflamatorios producidos por los adipocitos, como factor de necrosis tumoral alfa (NTF) e interleucina 6 (IL-6), que contribuyen a un ambiente inflamatorio crónico que propensa la disfunción endotelial.
La proteína C reactiva y la IL-6 se encuentran altas en pacientes con obesidad o diabetes mellitus tipo 2. La concentración de algunos de estos mediadores proinflamatorios se relaciona con la presencia de eventos cardiovasculares y además son reconocidos como índices de progresión de la aterosclerosis5.
Las especies reactivas de oxígeno (ROS) son derivadas del metabolismo del oxígeno altamente reactivo. Estas moléculas desempeñan papeles importantes en procesos fisiológicos normales tales como la expresión génica y la transducción de señales. En un estado saludable, las ROS se mantienen a un nivel óptimo debido a un equilibrio entre su producción y eliminación por antioxidantes enzimáticos (superóxidodismutasa, glutatión, catalasa, peroxidasa) y no enzimáticos (vitaminas C y E).
El aumento de los niveles de ROS durante el estrés oxidativo tiene efectos tóxicos sobre células y tejidos a través del incremento de la oxidación de carbohidratos, lípidos y proteínas. Se ha demostrado que desempeñan un papel importante en el desarrollo y progresión de la enfermedad cardiovascular; además han sido identificados como un importante mecanismo de complicaciones micro y macrovasculares en el síndrome metabólico.
Relación entre síndrome metabólico y menopausiaLas hormonas ejercen un rol importante en la vida de una mujer; hay tres etapas cuando el cuerpo de esta pasa por las principales transiciones hormonales: la pubertad, el embarazo y la menopausia. En estas fases de transición, las mujeres pueden verse expuestas a diferentes riesgos de enfermedades relacionadas con la obesidad y el síndrome metabólico. La pubertad es un período crítico del desarrollo caracterizado por cambios biológicos dinámicos. El aumento de la grasa corporal y la resistencia a la insulina durante la pubertad, pueden incrementar el riesgo de desarrollar síndrome metabólico.
La transición que experimenta la mujer durante la pre- y postmenopausia, se asocia con la presentación o el desarrollo de características propias del síndrome metabólico, entre las que se encuentran: aumento de la grasa central abdominal, alteración del perfil lipídico (elevación de lipoproteínas de baja densidad y triglicéridos, disminución de lipoproteínas de alta densidad y poca alteración de partículas de densidad intermedia, lo que lleva a mayor incidencia de aterogénesis), y resistencia a la insulina. Por esta razón, la prevalencia de síndrome metabólico se incrementa con la menopausia hasta en un 60%, al mezclarse variables como la edad, el índice de masa corporal y la inactividad física, entre otras. Este fenómeno puede explicar parcialmente el incremento en la incidencia de enfermedad cardiovascular observado después de la menopausia. Lo anterior se podría explicar como resultado directo de la falla ovárica o indirectamente por consecuencias metabólicas de la distribución central de la grasa asociada a la deficiencia estrogénica.
La resistencia a la insulina se asocia con hiperinsulinemia, la cual lleva a una supresión inadecuada de los ácidos grasos libres en los tejidos y altera la captación de la glucosa a nivel periférico. Diversos estudios han evidenciado que el estado postmenopáusico se asocia con elevación de los niveles de insulina y glucosa más que en el estado premenopáusico, lo que empeoraría aún más la resistencia a la insulina. Las adipocitoquinas circulantes, liberadas por los depósitos de grasa, están implicadas en los mecanismos generadores de la resistencia a la insulina y la enfermedad cardiovascular. En mujeres posmenopáusicas con síndrome metabólico se ha encontrado aumento de las leptinas, asociado a resistencia y reducción en las adiponectinas, las cuales tienen un efecto protector.
Por otro lado, la menopausia tiene efectos en los niveles de lípidos plasmáticos, evidenciándose un aumento significativo de las LDL, el colesterol total y los triglicéridos, asociados al descenso de las HDL. Se reportó que el incremento de la LDL fue menor en mujeres premenopáusicas que en postmenopáusicas, al igual que el aumento en los triglicéridos, la disminución del HDL y la obesidad central, siendo el HDL y los triglicéridos6.
Los mecanismos potencialmente protectores de los estrógenos serían múltiples: vasodilatación mediada por óxido nítrico, inhibición del vasoespasmo coronario, aumento del flujo y menor resistencia vascular, incremento del débito cardíaco, facilitación de la angiogénesis y efecto antiapoptótico en los cardiomiocitos. Otros mecanismos protectores corresponden a acciones antioxidantes y antiinflamatorias, cambios beneficiosos en el perfil lipídico, aumento de la sensibilidad a la insulina, atenuación del alza ponderal propia de la menopausia y menor adiposidad abdominal. Se cuentan entre los factores negativos de los estrógenos el aumento de triglicéridos, de la PCR y de factores de coagulación, exclusivos de la vía oral de administración de THM, y que se explica por el fenómeno “primera pasada hepática”. Sin embargo, la Women's Health Initiative (WHI) (alrededor de 27.000 mujeres de edad promedio de 63 años), desafió el concepto de cardioprotección de la terapia hormonal de la menopausia. Debe destacarse que el riesgo cardiovascular en el estudio WHI (enfermedad coronaria, ataque cerebrovascular y tromboembolia venosa) solo se incrementó en la rama combinada con estrógenos y progestinas orales; pero, a excepción del riesgo cerebrovascular, no se presentó en el grupo que utilizó estrógenos solos en mujeres histerectomizadas, lo que pone en evidencia el potencial efecto negativo de la progestina utilizada, la medroxiprogesterona7.
Síndrome metabólico en menopausia: implicaciones de la terapia hormonalLos estrógenos administrados por vía oral con o sin un progestágeno como terapia de reemplazo hormonal (TH), han demostrado reducción en la glucosa e insulina en ayunas y menor probabilidad de desarrollar diabetes hasta de un 35%. Aunque los datos han sido controvertidos y pueden ser diferentes según el tipo de pacientes tratadas, la dosis, el tipo y la vía de administración del estrógeno, se ha sugerido que mejora la sensibilidad a la insulina.
Análisis posteriores demostraron que el mayor riesgo de enfermedad coronaria puede disminuir en las mujeres más jóvenes y que las mujeres postmenopáusicas que reciben terapia hormonal no están en mayor riesgo de cardiopatía coronaria. Además, el análisis sugiere que las mujeres que iniciaron la terapia hormonal más cerca de la menopausia tienden a tener una reducción de enfermedad cardiovascular en comparación con aquellas que la inician en la postmenopausia.
Estudios realizados concluyeron que las pacientes con síndrome metabólico sin TH tienen mayor riesgo de desarrollar presión arterial diastólica>90mm Hg y tendencia a mantener rangos más elevados en el perfil de lípidos, lo que se traduce en elevación del riesgo de padecer enfermedad cardiovascular, la cual constituye la principal causa de muerte en los países desarrollados en este grupo de mujeres. La terapia hormonal se ha asociado principalmente con mejoría en parámetros como resistencia a la insulina y niveles de glucosa; su efecto sobre el riesgo cardiovascular aún es controvertido pese a los reportes actuales, en los que se asocia con un efecto benéfico en el grupo de pacientes en perimenopausia y menopausia temprana en comparación con los hallazgos descritos para mujeres en postmenopausia8,9.
Relación entre síndrome metabólico y síndrome de ovario poliquísticoEl síndrome de ovario poliquístico es una entidad que afecta entre el 5 y el 7% de las mujeres en edad reproductiva. El vínculo entre el síndrome metabólico y el síndrome de ovario poliquístico viene dado por cuanto alrededor del 60% de las mujeres portadoras, presentan insulinorresistencia con hiperinsulinismo compensatorio, lo cual constituye la base patogénica del síndrome metabólico, que entre sus componentes incluye la hiperestimulación ovárica.
Se conoce de manera independiente que la asociación entre síndrome metabólico y síndrome de ovario poliquístico predispone a alteraciones metabólicas con implicación cardiovascular y repercusiones significativas en la salud debido a que mujeres portadoras de síndrome de ovario poliquístico tienden a poseer mayor índice de masa corporal (IMC), circunferencia de cintura, presión arterial, glucemia en ayuno y concentración de insulina en comparación con aquellas que no lo presentan; por tanto, el síndrome de ovario poliquístico no sólo afecta la salud reproductiva, sino que plantea riesgos significativos potenciales a largo plazo, especialmente cardiovasculares.
Estudios reportan que las mujeres portadoras de síndrome de ovario poliquístico tienen riesgo mayor de producir síndrome metabólico, diabetes tipo 2, enfermedad vascular de gran vaso o afectación renal, síndrome de apnea obstructiva del sueño, alteración hepática y cáncer de endometrio8,10.
La metformina se ha utilizado para tratar muchas anomalías reproductivas y metabólicas con PCOS. Sin embargo, falta evidencia que respalde su amplio uso. Específicamente, las directrices avalan el uso de metformina para la intolerancia a la glucosa en PCOS, ya que puede prevenir el desarrollo de diabetes en mujeres con síndrome de ovario poliquístico. Por consiguiente, no se ha observado un beneficio claro para apoyar el uso de metforminas para las características reproductivas del síndrome de ovario poliquístico, como el tratamiento de las síntomas hiperandrógenos, la regulación de los ciclos menstruales o el tratamiento de la infertilidad y la optimización de las tasas de nacidos vivos11.
Evidencias de la acción de los factores de riesgo en la génesis de la enfermedad cardiovascular en las mujeresLos factores de riesgo cardiovascular señalados como significativos en las mujeres son: adicción al tabaco, hipertensión arterial (incluida la hipertensión sistólica aislada), dislipidemia, diabetes mellitus, obesidad, estilo de vida sedentario, edad mayor de 55 años y/o menopausia (especialmente la temprana o quirúrgica), historia familiar de enfermedad coronaria prematura en familiares de primer grado y alimentación inadecuada. El tabaquismo es una causal de enfermedad cardiovascular enteramente prevenible; más del 50% de los infartos entre las mujeres de mediana edad son atribuibles a esta adicción. El tabaco además de ser un factor de riesgo cardiovascular incrementa el riesgo de cáncer de pulmón, enfisema y otras enfermedades relacionadas tanto en hombres como en mujeres.
Las lipoproteínas de alta densidad (HDL) representan un espectro de partículas que varían en sus propiedades fisicoquímicas y funcionales. Se ha demostrado en muchos estudios poblacionales que la concentración de colesterol HDL (c-HDL) está inversamente relacionada con el riesgo de desarrollar un evento de enfermedad cardiovascular. En este paradigma, el c-HDL se ha considerado como un marcador de las funciones potencialmente cardioprotectoras del HDL. Sin embargo, estudios recientes sugieren que la concentración simple de c-HDL puede no reflejar siempre la función de HDL, con una evidencia creciente de que, en algunas circunstancias, la función de HDL puede verse comprometida a pesar de las altas concentraciones de c-HDL. La mejor conocida de las funciones potencialmente antiaterogénicas de las HDL es su capacidad para promover el flujo de salida de colesterol de las células, incluido el de los macrófagos en la pared arterial11.
El aumento del colesterol total (CT) y de las LDL también es un factor de riesgo importante en las mujeres. Los niveles bajos de HDL son predictores de enfermedad cardiovascular en la mujer y parecen ser un fuerte factor de riesgo para las mayores de 65 años de edad más que para los hombres de igual edad. Los triglicéridos elevados constituyen un factor de riesgo significativo en la mujer, especialmente cuando se asocia a HDL bajo.
La diabetes es un factor de riesgo importante en la mujer e incrementa el riesgo para enfermedad cardiovascular entre tres y siete veces, mientras que en los hombres lo eleva de dos a tres veces. Esta diferencia puede obedecer al particular efecto deletéreo que tiene la diabetes sobre los lípidos y la hipertensión arterial en el sexo femenino. Por ende, se aconseja medir la glucemia como parte del examen de rutina en las pacientes con factores de riesgo para diabetes como obesidad o historia familiar positiva. El peso ideal se deberá conseguir y mantener a través de la dieta (baja en grasas saturadas, alta en frutas, vegetales, granos y fibras con adecuado aporte de proteínas) y la práctica de actividad física.
El antecedente familiar de enfermedad cardiovascular (hombre consanguíneo menor de 55 años o mujer consanguínea menor de 65 años), demostró tener un alto grado de relación con otros factores de riesgo pero su valor absoluto como riesgo independiente permanece incierto12.
Riesgo cardiovascular en la mujerAnticonceptivos hormonalesLos anticonceptivos combinados están contraindicados en mujeres mayores de 35 años, fumadoras de más de 15 cigarrillos día. Los anticonceptivos que contienen estrógenos aumentan siete veces el riesgo trombótico, específicamente de IAM, en mujeres mayores de 35 años y fumadoras.
El uso de anticonceptivos combinados produciría un leve pero significativo aumento de la presión arterial. Los anticonceptivos orales de última generación combinan drospirenona, una progestina con efecto antimineralocorticoide y antiandrogénico, con etinilestradiol. Esta combinación disminuye la presión arterial 1-4mm Hg, de ahí que podrían usarse en mujeres hipertensas.
Así mismo, al no tener estrógenos, los dispositivos intrauterinos medicados con progesterona, el dispositivo subcutáneo de progesterona, los anticonceptivos y las inyecciones de progesterona, no aumentan la presión arterial y por ello pueden ser usados en mujeres hipertensas13.
Perimenopausia y riesgo cardiovascularSe sabe que las hormonas sexuales afectan al tono vascular; se han identificado receptores de estrógenos, progesterona y testosterona en las células vasculares. La estimulación inducida por las hormonas sexuales en los mecanismos de relajación vascular dependientes del endotelio y la inhibición de mecanismos de contracción del músculo liso vascular, pueden contribuir a producir diferencias entre los sexos en cuanto al tono vascular14.
Relación de obesidad y problemas de salud mentalLa obesidad se asocia con comorbilidades numerosas, que incluyen no sólo diabetes, enfermedades cardiovasculares, hipertensión arterial debilidad física, sino también problemas de salud mental (depresión, ansiedad y estrés). Se estima que los individuos obesos tienen aproximadamente 55% más probabilidades de desarrollar depresión y un 25% más probabilidades de sufrir de ansiedad, por consiguiente la obesidad es de muy difícil tratamiento y tiene alta tasa de recurrencia13.
Las causas que llevan al desarrollo de un trastorno alimentario son múltiples; entre ellas se destacan problemas emocionales, de personalidad, genéticos, familiares, sociales y socio-culturales.
Existen ciertos factores de origen psicológico que predisponen al desarrollo de un trastorno alimentario; en este sentido, los rasgos de personalidad son un factor que contribuye a generarlo, así como la autoestima baja y sentirse en indefensión o inconforme en relación con la apariencia.
Otro factor que acrecienta los niveles de riesgo es el genético. Es importante señalar que no sólo se hereda la predisposición a la adiposidad y la distribución de la grasa corporal; estudios de genética de la conducta indican que factores conductuales tales como la preferencia por las grasas, la elección del intervalo entre comidas, el grado de compensación calórica en respuesta a la restricción de alimentos y aun la inclinación por la actividad física, tienen componentes genéticos13.
TratamientoEl objetivo del tratamiento en cualquier enfermedad es disminuir la mortalidad y reducir las complicaciones de la misma, así como mejorar la calidad de vida. Primero se interviene el estilo de vida, con medidas no farmacológicas: la dieta y el ejercicio pueden ser suficientes para mantener un estado saludable en la población general, ya que ayudan a prevenir enfermedades cardiovasculares y diabetes.
La dieta debe ser abundante en fibra soluble a 20g/1.000 calorías y baja en grasas poliinsaturadas (20% del total de las calorías); así mismo, se limitará la ingestión de alimentos con alto índice glucémico. Está demostrado que la disminución de peso mejora la sensibilidad a la insulina, probablemente relacionado con la disminución de la grasa visceral: una reducción del 4% del índice de masa corporal mejora las cifras tensionales y la resistencia a la insulina. El ejercicio debe ser de tipo aeróbico de 30 a 45 minutos, 5 días a la semana, ya que reduce las resistencias vasculares periféricas, mejora la sensibilidad tisular a la insulina, disminuye los triglicéridos y baja el peso.
ConclusionesEl síndrome metabólico engloba distintas entidades que comparten como eje fisiopatológico la obesidad y la resistencia a la insulina. Se trata de un conjunto de anormalidades relacionadas, que en virtud de una combinación de factores genéticos y factores de riesgo relacionados con el estilo de vida, favorecen el desarrollo de una serie de alteraciones metabólicas que se asocian con un incremento importante en la morbilidad y mortalidad cardiovascular.
La principal estrategia para disminuir la prevalencia de este complejo síndrome se basa fundamentalmente en la reducción de peso y la realización cotidiana de actividad física, que unidas son las estrategias más útiles para disminuir la resistencia a la insulina.
El síndrome metabólico está convirtiéndose en un importante problema de salud pública en todo el mundo, ya que se considera como un elemento fundamental en la epidemia actual de diabetes y enfermedad cardiovascular, toda vez que está asociado a un incremento de cinco veces en la prevalencia de diabetes mellitus tipo 2 y de dos a tres veces en la de enfermedad cardiovascular.
La hipertensión arterial acelera el proceso de aterogénesis, al aumentar la formación de radicales libres. Estas sustancias reducen la producción de óxido nítrico por el endotelio, aumentan la adhesión de los leucocitos y elevan la resistencia periférica a la insulina. La hiperinsulinemia asociada al síndrome metabólico es capaz de elevar la presión arterial por vasoconstricción de las arteriolas e incremento de su permeabilidad; hipertrofia del músculo liso, alteración de bombas iónicas y activación del sistema nervioso simpático con aumento en la producción de catecolaminas, lo que facilita la reabsorción de sodio y agua e incrementa el volumen intravascular y la activación del sistema renina-angiotensina-aldosterona.
Las alteraciones en el metabolismo de los lípidos por deficiencia estrogénica son un componente del riesgo cardiovascular; sin embargo los efectos directos de los cambios hormonales sobre la distribución de la grasa corporal, la acción de la insulina, la pared arterial y la fibrinólisis pueden impactar la salud de las mujeres. Estos factores contribuyen a incrementar la prevalencia de síndrome metabólico en la postmenopausia, que, asociado al empeoramiento del perfil metabólico, puede favorecer el desarrollo de enfermedades cardiovasculares con mayor frecuencia y severidad.
Conflicto de interesesNinguno.