El tumor fantasma es una efusión interlobal pulmonar, interpretada como una manifestación radiológica poco común en personas con falla cardíaca descompensada; una vez se establece el tratamiento, estas lesiones que inicialmente se pueden confundir con infecciones o lesiones tumorales, desaparecen, por lo cual es fundamental realizar un diagnóstico adecuado que evite la práctica de estudios invasivos y no invasivos. Se expone el caso de un hombre con antecedente de falla cardíaca congestiva, quien ingresó al servicio de urgencias por exacerbación de síntomas respiratorios, edemas de miembros inferiores, disnea paroxística nocturna, ortopnea y signos clínicos de falla cardíaca. La radiografía de tórax mostró cardiomegalia, engrosamiento pleural derecho periférico y dos imágenes de tipo masa en tercios medio e inferior derechos y opacidad intersticial en bases. Se estableció manejo médico para falla cardíaca y se ordenó radiografía de tórax tres días después del tratamiento, luego de lo cual se observó desaparición de lesión intrapulmonar, confirmando diagnóstico de tumor fantasma.
The phantom (evanescent) tumour is an interlobar lung effusion, interpreted as a rare radiological sign in individuals with decompensated heart failure. Once the treatment is established, these lesions, which initially can be confused with infections or tumour lesions, disappear. This makes it essential to make an appropriate diagnosis that avoids carrying out invasive and non-invasive studies. The case is presented of a man with a history of congestive heart failure, who was admitted to the Emergency Department due to the exacerbation of respiratory symptoms, swelling in the legs, paroxysmal nocturnal dyspnoea, orthopnoea, and clinical signs of heart failure. The chest x-ray showed cardiomegaly, right pleural peripheral thickening, and two mass-type images in the right middle and lower thirds, as well as interstitial opacity in the bases. Medical management for heart failure was established, and a chest x-ray was requested three days after the treatment, in which it was observed that the intra-pulmonary lesion had disappeared, confirming the diagnosis of a phantom tumour.
Se denomina tumor fantasma al derrame pleural interlobar que aparece en los pacientes con falla cardíaca descompensada, y que simula una masa pulmonar que desaparece con tratamiento médico1. Su importancia radica en la necesidad de realizar un diagnóstico diferencial con masa o nódulos pulmonares de otra etiología. Esta entidad fue descrita en 1928 por Stewart, tras la realización de una autopsia para confirmar una sospecha clínica2. Se desconoce su frecuencia de aparición y hasta el momento sigue siendo una manifestación clínica poco común.
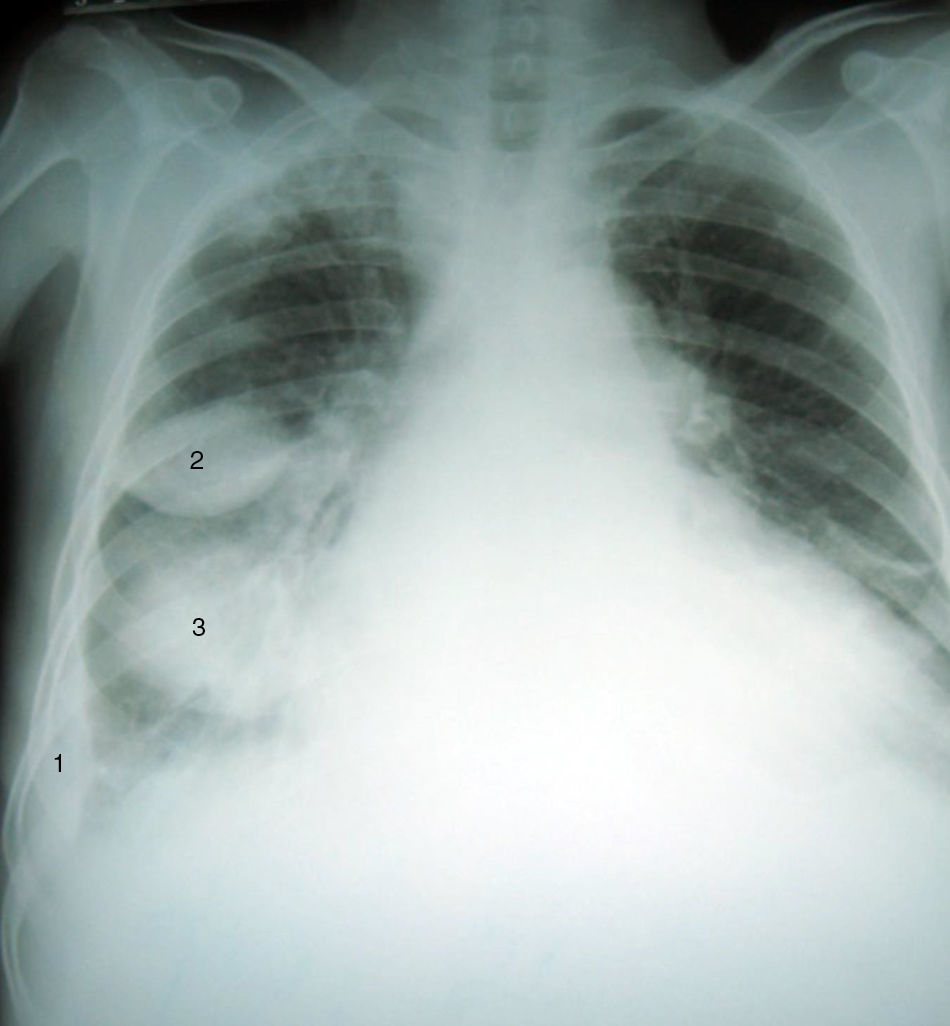
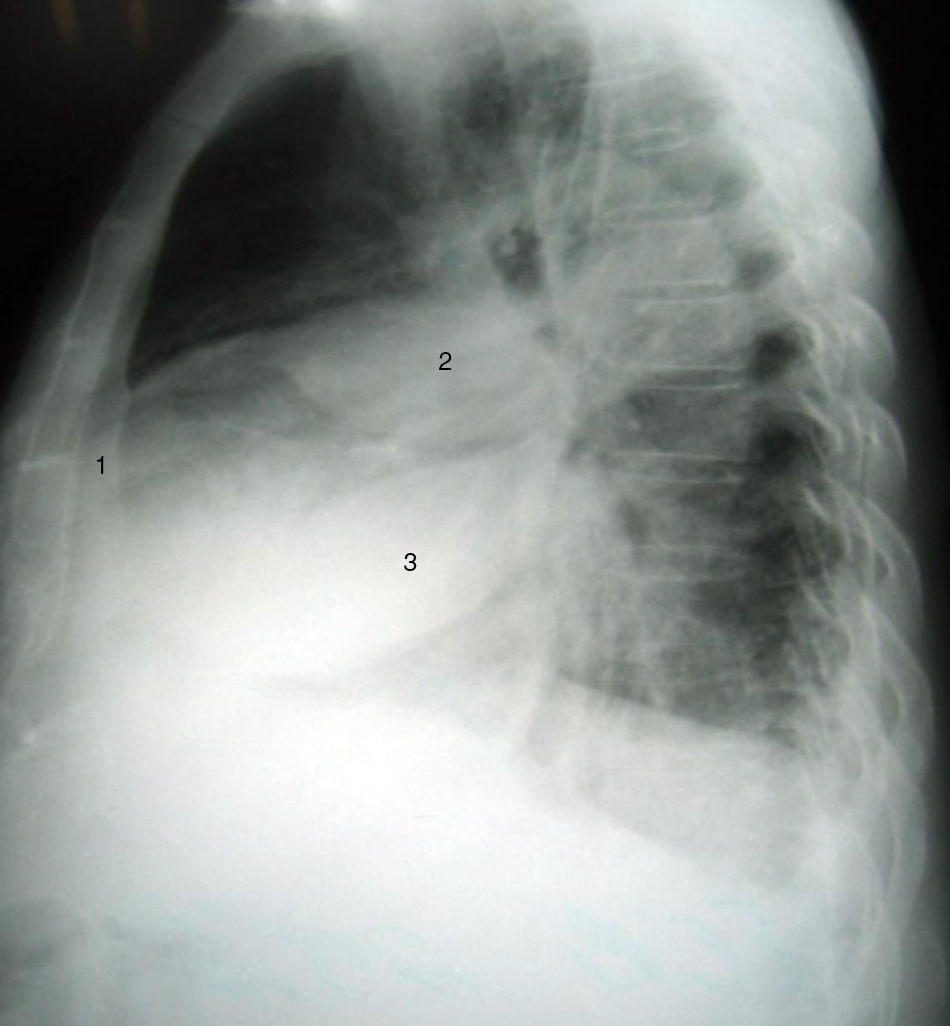
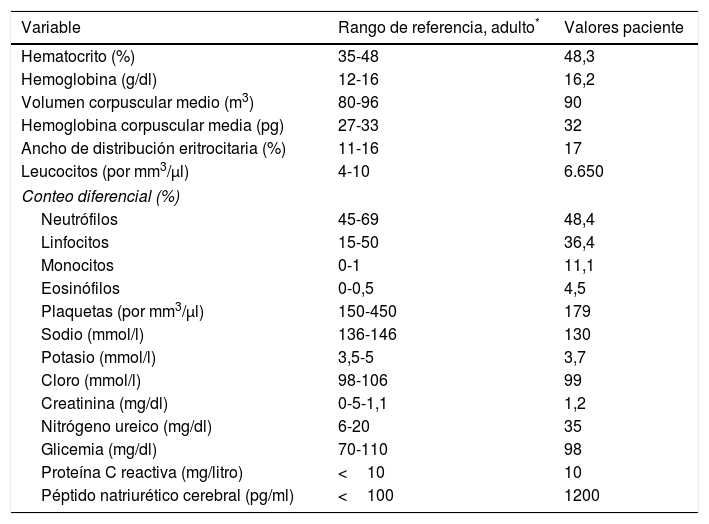
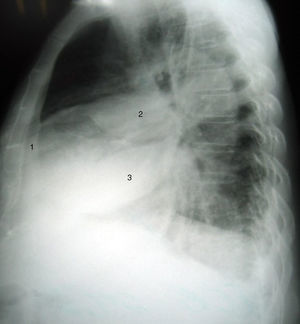
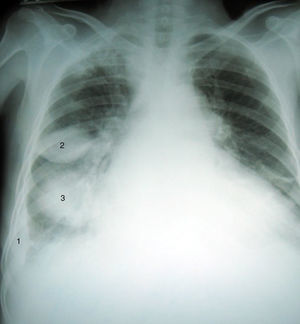
CasoHombre de 87 años que ingresó a urgencias por síntomas progresivos de veinte días de evolución, disnea de pequeños esfuerzos, ortopnea, disnea paroxística nocturna y retención hídrica (ascitis y edema de miembros inferiores), historia previa de falla cardíaca isquémica con fracción de eyección comprometida y tratamiento irregular no adherente con furosemida, enalapril y metoprolol. Al examen físico se destacaba la presencia de crépitos en bases. Los paraclínicos de ingreso descartaron evento coronario agudo mediante electrocardiograma sin cambios del ST y una placa de tórax mostró cardiomegalia, engrosamiento pleural derecho periférico y dos imágenes de tipo masa en tercios medio e inferior derechos, más opacidad intersticial en bases. En la vista lateral se observó que las masas correspondían a líquido en las cisuras menor y mayor derechas. Se ordenaron exámenes de laboratorio cuyos resultados se muestran en la tabla 1.
Resultados de laboratorio
| Variable | Rango de referencia, adulto* | Valores paciente |
|---|---|---|
| Hematocrito (%) | 35-48 | 48,3 |
| Hemoglobina (g/dl) | 12-16 | 16,2 |
| Volumen corpuscular medio (m3) | 80-96 | 90 |
| Hemoglobina corpuscular media (pg) | 27-33 | 32 |
| Ancho de distribución eritrocitaria (%) | 11-16 | 17 |
| Leucocitos (por mm3/μl) | 4-10 | 6.650 |
| Conteo diferencial (%) | ||
| Neutrófilos | 45-69 | 48,4 |
| Linfocitos | 15-50 | 36,4 |
| Monocitos | 0-1 | 11,1 |
| Eosinófilos | 0-0,5 | 4,5 |
| Plaquetas (por mm3/μl) | 150-450 | 179 |
| Sodio (mmol/l) | 136-146 | 130 |
| Potasio (mmol/l) | 3,5-5 | 3,7 |
| Cloro (mmol/l) | 98-106 | 99 |
| Creatinina (mg/dl) | 0-5-1,1 | 1,2 |
| Nitrógeno ureico (mg/dl) | 6-20 | 35 |
| Glicemia (mg/dl) | 70-110 | 98 |
| Proteína C reactiva (mg/litro) | <10 | 10 |
| Péptido natriurético cerebral (pg/ml) | <100 | 1200 |
Los valores de referencia pueden ser afectados por múltiples variables, incluidas la población de pacientes y los métodos de laboratorio empleados. Los rangos descritos son para personas adultas no embarazadas y sin condiciones médicas que afecten los resultados; por lo tanto, pueden ser inapropiados para todos los pacientes.
El ecocardiograma transtorácico mostró ventrículo izquierdo severamente dilatado, fracción de eyección del 20%, hipocinesia severa generalizada, disfunción diastólica con aumento de las presiones de llenado del ventrículo izquierdo con patrón restrictivo e insuficiencia tricúspide severa; presión sistólica de la arteria pulmonar de 60mm Hg, derrame pleural basal bilateral de predominio derecho y vena cava inferior ingurgitada.
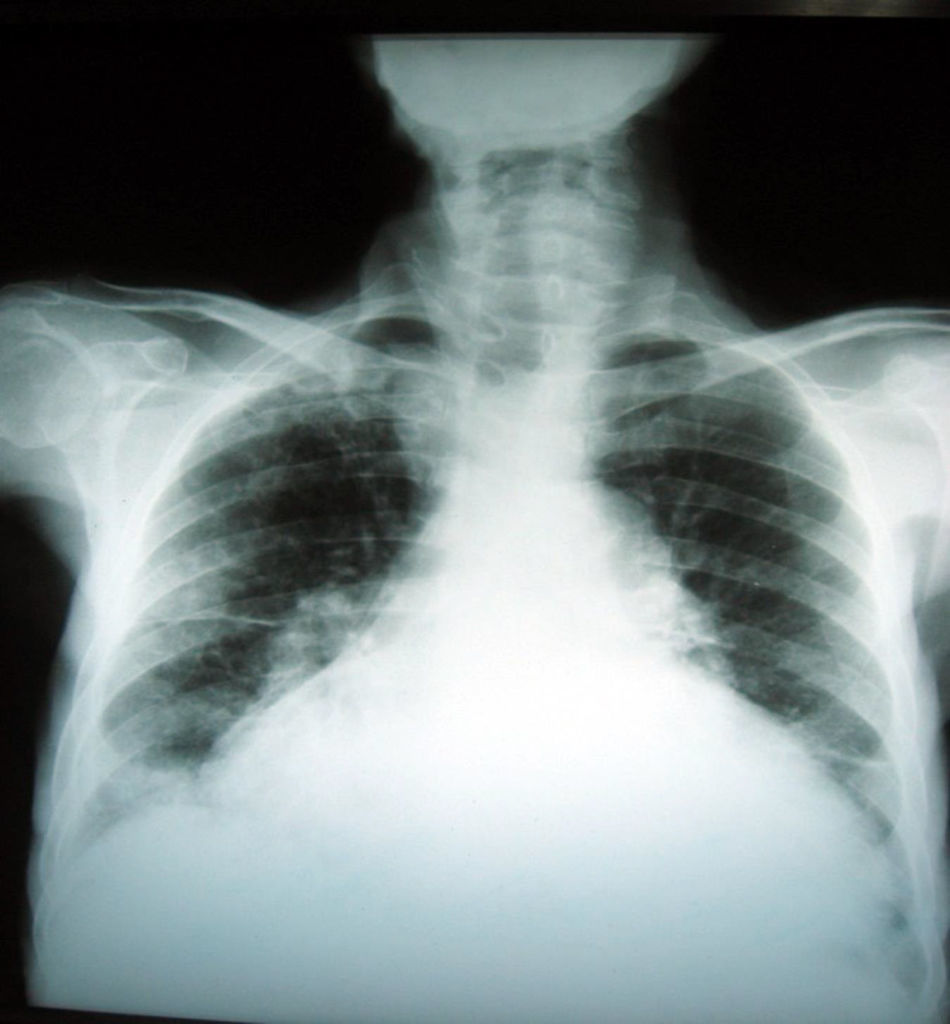
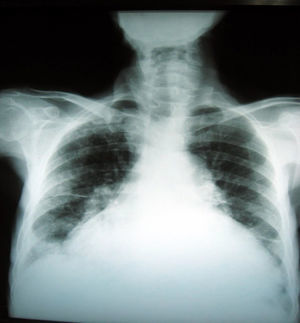
Se inició manejo farmacológico con diuréticos endovenosos, optimización de perfusión con soporte inodilatador, reanimación por metas y balance hídrico y de peso diario. Como se planteó la posibilidad de tumor o masa sin otros hallazgos, con la mejoría sintomática se ordenó nueva radiografía de tórax que mostró la resolución de las masas.
DiscusiónEl tumor fantasma o evanescente se caracteriza por derrame pleural interlobar localizado, que aparece en los pacientes con falla cardíaca, aunque se puede ver también en casos de insuficiencia renal e hipoalbuminemia, y simula una masa pulmonar que desaparece con tratamiento médico3.
Fue descrito por primera vez por Stewart en 1928, quien lo llamó “hidrotórax lobar”4.
Aunque no se conoce muy bien la causa de su aparición se asocia con defectos congénitos de la pleura o con la presencia de adherencias debidas a procesos pleurales antiguos. Ocurre predominantemente en los hombres en el hemitórax derecho, y se reportan tres cuartas partes de los casos dentro de la cisura transversal derecha, con menos frecuencia dentro de la cisura oblicua. El compromiso simultáneo de ambas cisuras se ha reportado hasta en un quinto de los casos, siendo esporádico el compromiso del hemitórax izquierdo.
Un papel clave en su patogénesis está relacionado con las adherencias y la obliteración del espacio pleural alrededor del borde de la cisura debido a la pleuritis. En tal configuración, los tumores fantasmas se dan cada vez que la trasudación desde el espacio vascular pulmonar excede la capacidad de resorción de los linfáticos pleurales. Sin embargo, esta distribución intercisural atípica de derrames pleurales también se puede explicar por aumento local del retroceso elástico de pulmón adyacente, parcialmente atelectásico, que produce un efecto de “ventosa” y favorece la acumulación de líquido, incluso en ausencia de adherencias pleurales. La predilección por el lado derecho se debe a que hay mayor presión hidrostática a diferencia del lado izquierdo, lo cual produce incremento del drenaje venoso y linfático que conduce a la acumulación de líquido.
En algunos casos la proyección lateral de la radiografía de tórax puede orientar el diagnóstico porque permite la localización de la lesión (fig. 2)5,6.
La historia clínica y los antecedentes epidemiológicos pueden servir de ayuda en el diagnóstico, al igual que puede ser útil la comparación con radiografías de tórax previas en las que no aparezca esta imagen, para descartar procesos tumorales.
Los síntomas y signos clínicos de insuficiencia cardíaca pueden constituir un elemento clínico orientador7. Sin embargo, se debe tener en cuenta que en los carcinomas pulmonares la disnea se describe en cerca del 60% de los pacientes, teniendo como característica el inicio progresivo, usualmente asociado con la diseminación intratorácica8. La aparición de otras imágenes radiológicas como cardiomegalia o líquido en los ángulos costofrénicos, son sugestivas del diagnóstico aunque también pueden cursar sin ellas.
La presencia de una masa en el parénquima pulmonar, obliga a realizar un diagnóstico diferencial entre neumonía y tumor9. Es importante interpretar correctamente los paraclínicos; se debe tener en cuenta la presencia de leucocitosis en el hemograma, lo que orientaría hacia un proceso infeccioso; sin embargo, recuérdese que dentro de los síndromes paraneoplásicos más frecuentes como en el cáncer de pulmón, también puede haber leucocitosis y reacción leucoeritroblástica10.
La neumonía redonda es otra enfermedad que se debe tener en cuenta en el diagnóstico diferencial de un tumor fantasma. Predomina en la infancia y es un proceso raro en adultos. Se localiza con mayor frecuencia en los lóbulos inferiores y una historia de fiebre y tos sugiere una causa infecciosa; sin embargo, estos síntomas pueden estar ausentes o no coincidir temporalmente con la imagen radiológica (fig. 1)11.
Aunque el cuadro clínico oriente hacia falla cardíaca por la clínica del paciente, se debe incluir el infarto pulmonar como diagnóstico diferencial, debido a que es una complicación que aparece entre el 10% al 15% de los casos de tromboembolia pulmonar y es secundario a la obstrucción de arterias segmentarias o subsegmentarias12. Con frecuencia se asocia a personas con enfermedad cardiovascular o neoplásica subyacente.
No obstante, el diagnóstico de un tumor fantasma se confirma mediante placas seriadas en las que se demuestra la resolución del derrame tras instaurar un tratamiento diurético, lo que hace que la correlación clínica de la falla cardíaca y sus estudios sea la clave para un diagnóstico precoz y un tratamiento adecuado, como se observó en este paciente (fig. 3).
La importancia de este caso radica en describir la dificultad del diagnóstico del tumor fantasma y la necesidad de un enfoque adecuado para abordar esta enfermedad con miras a optimizar el tiempo de intervenciones diagnósticas y terapéuticas. Así mismo, se resalta lo poco asiduidad de esta entidad y cómo su tratamiento está sujeto a estudios de bajo costo, que, siendo interpretados de manera apropiada, definirán el desenlace.
La complejidad en el diagnóstico de esta condición subyace en los pocos casos reportados, de ahí la importancia de tener conceptos claros para efectar un abordaje acertado.
ConclusionesEste caso ilustra síntomas de falla e imagen sugestiva de masa pulmonar, que se resolvió con la instauración del manejo médico, evitando estudios costosos o invasivos que aumentan su morbilidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna.
Conflicto de interesesNinguno.