Las enfermedades cardiovasculares son la principal causa de muerte en el mundo. Fármacos hipolipemiantes como las estatinas son la primera alternativa en la prevención primaria de eventos cardiovasculares, ictus cerebrales y procedimientos de revascularización. Estos fármacos son inhibidores de la enzima HMG-CoA reductasa, la cual regula la velocidad de la síntesis del colesterol y además aumenta la captación hepática del mismo por la vía del receptor de las LDL. El polipéptido transportador de aniones orgánicos 1B1 (OATP1B1) codificado por el gen SLCO1B1 es uno de los transportadores de captación y eflujo hepático de las estatinas. Por medio de estudios de asociación de genomas completos se han reportado diferentes SNPs dentro del gen SLCO1B1 con capacidad de reducir la captación de estatinas mediada por OATP1B1, por lo que las variaciones en la secuencia de este gen influyen en la farmacocinética y farmacodinámica de estos medicamentos, llegando a causar una condición conocida como miopatía inducida por estatinas. En la actualidad, genes que afectan las terapias cardiovasculares, así como los avances actuales en el campo de las pruebas diagnósticas basadas en la secuenciación de los mismos, ofrecen la posibilidad de revolucionar el diagnóstico y el tratamiento con el fin de validar el riesgo de predicción, pronóstico, prevención y manejo de pacientes con riesgo de enfermedades cardiovasculares, lo cual conducirá al desarrollo de nuevas formas de tratamientos médicos.
Cardiovascular diseases are the main cause of death in the world. Lipid-lowering drugs like statins are the first alternative in the primary prevention of cardiovascular events, strokes, and revascularisation procedures. These drugs are HMG-CoA reductase inhibitors, which regulate the rate of cholesterol synthesis, as well as increase its liver uptake via the LDL receptor pathway. The organic anion transporter polypeptide 1B1 (OATP1B1) coded by the solute carrier organic anion transporter 1B1 (SLCO1B1) gene is one of the hepatic influx and efflux transporters of statins. In genome-wide association studies (GWAS) different single nucleotide polymorphisms (SNPs) have been reported within the SLCO1B1 gene that are able to reduce the statin uptake mediated by OATP1B1. This suggests that the variations in the sequencing of this gene have an influence on the pharmacokinetics and pharmacodynamics of these drugs, leading to a condition known as statin-induced myopathy. Genes that affect cardiovascular treatments, as well as the current advances in diagnostic tests based on their sequencing, now offer the possibility of revolutionising their diagnosis and treatment. They could be used with the aim of validating risk prediction, prognosis, prevention, and management of patients with a risk of cardiovascular diseases, and will lead to the development of new forms of medical treatments.
Las enfermedades cardiovasculares son la principal causa de muerte alrededor del mundo. Cada año mueren más personas por enfermedades cardiovasculares que por cualquiera otra causa1,2. Se calcula que las enfermedades cardiovasculares le quitan la vida a 17,7 millones de personas cada año, lo cual representa el 31% de todas las muertes registradas en el mundo1.
De acuerdo con datos mundiales, en Colombia, el 28,7% de todas las defunciones se deben a las enfermedades cardiovasculares3. En hombres predomina la enfermedad coronaria y asociada a esta, la enfermedad cardíaca isquémica, mientras que en las mujeres sobresalen las enfermedades relacionadas con la hipertensión arterial, como la enfermedad cerebrovascular y la insuficiencia cardíaca, convirtiéndose en problemas importantes de salud pública en el país3. Se calcula que para 2030, cerca de 23,6 millones de personas en el mundo morirán por alguna enfermedad cardiovascular, principalmente por miocardiopatías y ataques cerebrovasculares; por ende se estima que estas enfermedades seguirán siendo la principal causa de muerte a nivel global3,4.
La mayoría de enfermedades cardiovasculares se pueden prevenir interviniendo factores de riesgo conductuales como el uso del tabaco, la dieta, la obesidad y la inactividad física. Las personas con este tipo de enfermedades o que tienen alto riesgo cardiovascular, debido a la presencia de uno o más factores de riesgo como hipertensión, diabetes y complejidad genómica, así como por la variedad de mecanismos de regulación celular y molecular requieren detección temprana y manejo apropiado de la enfermedad3,4.
La dieta, el ejercicio, el control de la presión arterial, la reducción del colesterol y la administración de fármacos han demostrado eficacia en la prevención primaria, la detección y el tratamiento de estas enfermedades4,5. Dentro de estos últimos, los fármacos hipolipemiantes como las estatinas, se prescriben ampliamente. Estas pueden inducir reducciones importantes en los niveles de colesterol plasmático y por ello se consideran como los medicamentos de elección para tratamientos de hipercolesterolemia, pues ayudan a la prevención de enfermedades cardiovasculares como infarto de miocardio e ictus tromboembólicos, al disminuir la morbilidad y la mortalidad cardiovascular, independientemente del sexo, la edad, la concentración basal de colesterol y la presencia de otros factores de riesgo asociados6–8.
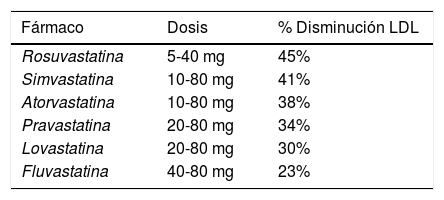
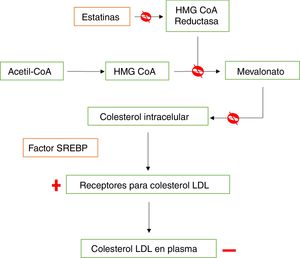
Las estatinas son inhibidoras de la 3-hidroxi-3-metilglutaril-coenzima A reductasa (HMG-CoA reductasa), la cual regula la velocidad de síntesis del colesterol, catalizando la conversión de acetil-CoA a HMG-CoA y posteriormente a mevalonato, metabolitos clave en la biosíntesis del colesterol en el hígado y otros tejidos9,10. Las estatinas funcionan como inhibidores competitivos, ya que se unen al sitio activo de la reductasa, con mayor afinidad que la HMG-CoA. Además, alteran la conformación de esta última y limitan su actividad funcional, lo que aumenta su eficacia y especificidad, facilitando la disminución en la síntesis y el contenido intracelular del colesterol10, lo que a su vez llevará a la activación del factor de proteína de unión a elementos de respuesta regulados por esteroles (SREBP, por sus siglas en inglés), que libera proteínas reguladoras que favorecen una mayor expresión del gen que codifica el receptor de lipoproteínas de baja densidad (LDL, por su sigla en inglés)11. El aumento en la cantidad de receptores funcionales en el hepatocito, aumenta la captura por endocitosis de colesterol LDL y otro tipo de lipoproteínas, principalmente en el hígado, la glándula suprarrenal y el tejido graso9,10, por lo que disminuyen el colesterol plasmático, no solamente al inhibir su síntesis, sino también al aumentar su captación hepática por la vía del receptor de LDL. Lo anterior conduce a un incremento en la concentración de colesterol de alta densidad (HDL, por su sigla en inglés) y disminuye la de triglicéridos (fig. 1)10,12.
Mecanismo de acción de las estatinas en la síntesis de colesterol. Las estatinas se unen de manera covalente al sitio activo de la HMG-CoA reductasa con mayor afinidad que la HMG-CoA, bloqueando (ᴓ) la formación de mevalonato, precursor de la síntesis de colesterol, ocasionando una disminución (-) en los niveles de colesterol intracelular mediante dos mecanismos: i) bloqueo de la síntesis del colesterol y ii) activación del factor SREBP, que activa el aumento (+) y expresión de los receptores de captación del colesterol LDL en el hígado, la glándula suprarrenal y el tejido graso.
Actualmente existen seis estatinas ampliamente comercializadas: lovastatina, pravastatina, simvastatina, fluvastatina, atorvastatina y rosuvastatina; las cuales difieren en su potencia hipocolesterolemiante y en sus características farmacocinéticas5,13.
La enzima CYP3A4 de la familia del citocromo P450 (CYP) está implicada en el metabolismo de estos fármacos. Las estatinas y sus productos son sustratos de la glicoproteína P y se eliminan por vía biliar luego del metabolismo hepático y extrahepático. Su vida media es de 14 horas, pero la inhibición de la actividad inhibitoria enzimática persiste de 20 a 30 horas7. Uno de los transportadores de captación y eflujo hepático es el polipéptido transportador de aniones orgánicos 1B1 (OATP1B1) codificado por el gen SLCO1B1. La importancia de este transportador radica en su capacidad de llevar de manera eficiente las estatinas al hígado, pues de lo contrario estas se acumulan en el cuerpo aumentando la exposición hepática a la estatina sistémica13. La terapia con estatinas reduce la incidencia de eventos cardiovasculares, ictus cerebrales y procedimientos de revascularización14. En ocasiones pueden causar una condición conocida como miopatía inducida por estatinas, que produce fatiga, sensibilidad, debilidad, calambres y dolor muscular, asociado a niveles de creatinina quinasa (miopatía), y eventualmente conducir a descomposición muscular y liberación de mioglobina (rabdomiólisis), con riesgo de insuficiencia renal y muerte13–16.
La mayoría de efectos adversos se ven potenciados por la presencia de SNPs (Single Nucleotide Polymorphisms, su sigla en inglés) o variaciones que aportan a la variabilidad genética de los individuos, las cuales son una fuente valiosa para el entendimiento de la fisiología de las enfermedades cardiovasculares, debido a que muchos de estos trastornos son altamente heredables, y el número de genes vinculados con estas patologías se halla en constante crecimiento17. Dichas variaciones son trascendentales en la identificación de personas en riesgo de desarrollar miocardiopatía e insuficiencia cardiaca, arritmias y enfermedades vasculares17. Además, dichas variaciones afectan la farmacocinética (absorción, distribución, metabolismo y excreción) de las estatinas, alterando la duración y la magnitud de la exposición al fármaco y por tanto, su eficacia y toxicidad13.
La información genética cumple un papel importante en la medicina personalizada; entiéndase esta como la capacidad de proporcionar el tratamiento adecuado a cada paciente, basados en su composición genética. Su papel más importante se encuentra, por ejemplo, dentro de la farmacogenética. En general, las variaciones en el DNA afectan la respuesta metabólica a los medicamentos, es decir, su farmacocinética, al igual que los efectos terapéuticos y adversos, es decir, su farmacodinámica (efectos biológicos del fármaco en el cuerpo). En la práctica clínica, un ensayo clínico farmacogenético deberá ser capaz de distinguir entre los pacientes que tienen más y aquellos que tienen menos probabilidades de responder de manera positiva a un fármaco, o por el contrario, aquellos que tienen más o menos riesgo de presentar efectos adversos a los mismos, teniendo en cuenta su composición genética18–21.
Farmacogenética del gen SLCO1B1 en la práctica clínicaLos agentes transportadores de solutos (SLC), son un conjunto de genes que codifican proteínas transportadoras de membrana, fundamentales para mantener las funciones vitales de las células. Estos intervienen en el transporte de gran cantidad de sustancias, incluyendo neurotransmisores y fármacos ampliamente utilizados, por lo que su función es clave en el tratamiento de muchas enfermedades. Existen más de 300 miembros que forman parte de 51 familias diferentes, algunos de ellos se expresan en diversas partes, mientras que otros están restringidos a órganos o tejidos específicos; entre estos se destacan los que se expresan en intestino, hígado, riñón y cerebro22.
Transportar una variedad de sustratos, hace que estas proteínas sean de vital importancia en las terapias contra el cáncer, las enfermedades autoinmunes, las enfermedades infecciosas, entre otras. Las fallas terapeúticas motivadas por variantes no funcionales del gen pueden afectar la respuesta de un organismo frente a un fármaco determinado, dando lugar a la falta de eficacia del mismo, causada por déficits en la absorción intestinal o por el contrario, produciendo toxicidad por la acumulación del fármaco al no eliminarse eficazmente a nivel renal22.
Genes como SLCO1B1, SLCO1B3, SLCO2B1, SLC1A2, y el polipéptido cotransportador de taurocolato sódico (NTCP), pueden influir en la absorción y distribución de las estatinas15. Mediante estudios de asociación de genoma completo (GWAS, su sigla en inglés), con una frecuencia de alelo mayor al 5%, se identificaron 190 SNPs, los cuales se extienden dentro de los 15 exones del gen SLCO1B1. Dentro de los SNPs más comunes que han demostrado reducir la captación de estatinas mediada por OATP1B1 están: *2, *3, *5, *6 y *9, denotados comúnmente con un asterisco (*) y un número según el orden en que hayan sido reportados (tabla 1)23.
Asociación genotipo-fenotipo para del genSLCO1B1, involucrado en el transporte hepático de las estatinas
| Fenotipo | Alelo | Genotipo | Código rs | |
|---|---|---|---|---|
| Función normal | Personas con este fenotipo no necesitan cambios en la dosis prescrita inicialmente. Los cambios en la dosis se ajustan a medida que avanza el tratamiento. | *1 | Normal | Normal |
| Función baja | Personas con este fenotipo necesitan empezar por dosis intermedias a altas del medicamento o incluso un medicamento diferente. Cerca de 1 de cada 20 personas presentan función baja del gen SLCO1B1, por lo que tienen un riesgo muy alto de padecer efectos secundarios. | *2 | T>C | rs56101265 |
| *3 | T>C | rs56061388 | ||
| *5 | T>C | rs4149056 | ||
| *6 | T>C | rs55901008 | ||
| *9 | G>C | rs59502379 | ||
El gen SLCO1B1, anteriormente conocido como transportador de aniones orgánico 2 (OATP2), OATPC, transportador específico del hígado 1 (LST1) y SLC21A6, se encuentra en el cromosoma 12 y codifica para una proteína llamada polipéptido de aniones orgánicos 1B1, u OATP1B124. Esta proteína se ubica en la membrana basolateral de los hepatocitos humanos, donde media la captación hepática de muchos compuestos xenobióticos, influyendo en su metabolismo, distribución y eliminación, en el que se incluyen fármacos de diferentes clases terapéuticas como las estatinas24–27.
No hay un conocimiento claro de cómo funcionan los transportadores SLC, sin embargo, los perfiles farmacocinéticos de estos varían basándose en su hidrofobicidad13. Los compuestos más hidrofílicos como la pravastatina, requieren de un transporte activo al hígado dependiente de SLCO1B1 y presentan una excreción renal activa más pronunciada, mientras que los compuestos menos hidrófilos son transportados por difusión pasiva y son mejores sustratos para los transportadores implicados en la excreción biliar13.
Las personas con los cambios mencionados en la tabla 1 se clasifican dentro del grupo “función baja” del transportador y poseen alto riesgo de padecer efectos secundarios, debido a la retención intracelular de la proteína y su expresión reducida en la superficie15,24,28. Pacientes con función baja del gen SLCO1B1 podrían necesitar dosis diferentes del medicamento o incluso otro tipo de medicamento con efectos iguales o similares, pero que no necesite ser transportado por la ruta del gen SLCO1B1. Aproximadamente 1 de cada 20 personas presentan función baja del gen29. Aunque existen otras variantes funcionalmente significativas en el gen SLCO1B1, se hallan ampliamente distribuidas y se producen a altas frecuencias dentro de las poblaciones y grupos étnicos en diferentes regiones del mundo (tabla 2)26,28.
SNPs asociado con el gen SLCO1B1 para las estatinas
| Fenotipo | Alelo | Genotipo | |
|---|---|---|---|
| Función alta | Al transportar rápidamente la estatina prescrita, el paciente tendrá una respuesta beneficiosa parcial y puede incluso no presentar ninguna respuesta al fármaco, ya que el mismo se puede acumular en sangre, llegando a causar efectos secundarios. Las personas en este grupo requieren seguimiento médico con dosis bajas y controladas del medicamento, teniendo en cuenta la vida media y el efecto o porcentaje inhibitorio del mismo. | *14 | C>A |
| Función media | Pacientes en este grupo, se sitúan entre el grupo de pacientes con función baja y alta del gen. Se requieren dosis más bajas del medicamento o ajustadas al porcentaje de descenso en los niveles de colesterol de las estatinas. | *1b,*15, *18 | A>G |
| *16 | T>C | ||
| *17 | G>A | ||
Dentro de estos SNPs reportados para este gen, dos de ellos, causantes de cambios no sinónimos, han sido ampliamente caracterizados. El primero es c.521T>C (rs4149056), cuyo cambio nucleotídico produce una sustitución del aminoácido valina en la posición 174 por el aminoácido alanina (p.V174A) y se encuentran dentro del haplotipo SLCO1B1*515,24,30. Esta variante ha sido asociada con concentraciones plasmáticas elevadas de estatinas, lo que significa acceso hepático reducido para su eliminación. Lo anterior puede causar mayor riesgo de miopatía inducida por estatinas. Por último, el SNP 388A>G (rs2306283), produce sustitución de asparagina en la posición 130 por ácido aspártico (p.N130D) y se encuentra dentro del haplotipo *1b. Es importante destacar que los SNPs c.521T>C y c.388A>G (*1b, p.N130D) (rs2306283) están en desequilibrio de ligamiento formando cuatro haplotipos funcionalmente distintos, *1A, *1B, *5 y *1515,24,27.
Las variantes mencionadas, parecen ser estatina-específicas, en cuyo caso la simvastatina, la atorvastatina y la lovastatina son las más afectadas por el transportador y su metabolismo15,25.
A la hora de seleccionar una estatina se debe considerar el nivel de colesterol-LDL basal del paciente y el valor de colesterol-LDL a alcanzar. Se plantea que el valor de LDL óptimo en personas con riesgo cardiovascular es <100mg/dl; subóptimo hasta 129mg/ml; alto bajo 160mg/ml; alto>160mg/ml; y muy alto>190mg/ml. La dosis más o menos equipotente de las estatinas necesarias para reducir el colesterol-LDL en un 25-45% del valor basal se encuentra consignada en la tabla 316,31. A partir de estos parámetros, se recomienda seleccionar el tipo de estatina y la dosis a emplear y de acuerdo con la ficha técnica comenzar con dosis bajas del fármaco y proceder a su titulación hasta alcanzar los objetivos terapéuticos5.
El tratamiento hipolipemiante con estatinas reduce el riesgo cardiovascular de un 25 a un 55%, con una relación costo-beneficio favorable. Un estudio realizado mediante metaanálisis muestra que el tratamiento de la dislipemia diabética con estatinas reduce la mortalidad vascular, los episodios coronarios y el ictus en un 13%, 22% y 21%, respectivamente32. Además, se evidenció que por cada 1 mmol (39mg/dl) de colesterol-LDL que disminuye, hay un descenso proporcional del 21% en la tasa de episodios cardiovasculares graves32. El beneficio de estos fármacos está en que reducen moderadamente la concentración de triglicéridos y elevan de forma discreta el colesterol-HDL. La reducción media de los triglicéridos varía entre un 10% y un 30%, mientras que el ascenso del colesterol-HDL se sitúa entre un 5% y 10%5. Las modificaciones de ambos parámetros se relacionan con los valores basales de triglicéridos; a mayor concentración, mayor su reducción y mayor el ascenso del colesterol-HDL. Lo anterior se ve influenciado por el tipo de estatina y la dosis formulada, por lo que la prescripción incorrecta que lleva a la exposición en plasma de altas dosis de las mismas puede ser un factor que contribuye significativamente al riesgo de toxicidad muscular5,16.
En el enfoque médico tradicional, todos los pacientes con una enfermedad determinada, por lo general reciben el mismo tratamiento basado en los resultados de estudios realizados en pacientes similares, y como es claro, la genética o la biología de los individuos no es la misma. Por tanto, diferentes tratamientos podrían ser necesarios para los pacientes18. Los avances actuales en el campo de las pruebas diagnósticas basadas en la secuenciación de genes ofrecen la posibilidad de revolucionar el diagnóstico y el tratamiento, prediciendo su respuesta o efectos adversos, con el fin de calcular la dosis apropiada de los fármacos, fundamentados esencialmente en la composición genética de cada paciente18.
Una prueba clínica con el fin de detectar variaciones genéticas, que permita predecir como responderá un paciente a un medicamento, deberá ser capaz de: i) medir de forma precisa el gen blanco de interés (validez analítica); ii) detectar o predecir el trastorno asociado, incluyendo sensibilidad y especificidad clínica (validez clínica); y iii) afectar las decisiones clínicas en torno a los resultados (utilidad clínica)18.
Las tecnologías de secuenciación de próxima generación (NGS, por su sigla en inglés), acompañadas por métodos como la PCR (polymerase chain reaction, por su sigla en inglés), debido a su extrema sensibilidad para amplificar y detectar mutaciones, SNPs y secuencias específicas, proporcionan una oportunidad para investigar aquellas variaciones genéticas en los seres humanos, su etiología en la salud y las enfermedades. NGS ofrece secuenciación de las regiones codificantes del genoma, denominado exoma, así como la secuenciación del genoma completo (whole genome sequencing-WGS, por su sigla en inglés), el cual incluye, las regiones codificantes (exones) y no codificantes (intrones)18,19,21. La identificación de las variaciones genéticas basadas en estas tecnologías, se puede utilizar para predecir el riesgo de enfermedad, con el potencial para detectar o disminuir la progresión de la misma. Es así como también tiene utilidad en la predicción de la respuesta o efectos adversos a los fármacos, o para calcular la dosificación apropiada de los mismos18. La determinación de la composición genética se convertirá en una parte integral y rutinaria de la evaluación médica, por lo que en un futuro cercano, los avances en las tecnologías moleculares proporcionarán una oportunidad para cambiar la práctica en el cuidado de la salud17.
En Colombia, el Ministerio de Salud y Protección Social emitió la resolución 5592 de 2015 donde se actualiza integralmente el Plan de Beneficios en Salud (anteriomente denominado POS o plan obligatorio de salud) con cargo a la unidad de Pago por Capitación del Sistema General de Seguridad Social en Salud. En los códigos 90.8.4.02 al 90.8.4.39 se menciona la cobertura del sistema para pruebas de tipo molecular/genéticas/genómicas21. Estos códigos indican que las pruebas farmacogenómicas están incluidas en el plan de beneficios, lo que supone una oportunidad para que la genómica clínica pueda ser implementada de manera rutinaria en la práctica clínica, abriendo una puerta no solo a la investigación farmacogenómica sino también a la medicina personalizada. De esta forma se podrán utilizar biomarcadores como el gen SLCO1B1, que ayudarán a validar el riesgo de predicción, pronóstico, diagnóstico, prevención y manejo de pacientes con riesgo de enfermedades cardiovasculares, lo cual conducirá al desarrollo de nuevas formas de tratamientos médicos18.
Entre tanto, es importante contemplar la identificación y el desarrollo de soluciones que busquen transformar el horizonte en la atención de la salud, por ejemplo, intervenciones dirigidas hacia procesos moleculares y celulares específicos que subyacen a la biología y a la patogenia de las enfermedades cardiovasculares3. Aplicar los conocimientos farmacogenéticos y las tecnologías existentes, permitirá no solo aumentar años de vida saludable, sino que reducirá la carga económica más allá del sector de la salud, ya que cada vez es mayor el número de personas y familias que se ven afectados. Sin una adecuada prevención y detección temprana, los costos de tratamientos, operaciones quirúrgicas y medicamentos aumentan.
FinanciaciónNinguna.
Conflicto de interesesNinguno.