El nervio ciático, rama terminal del plexo lumbosacro, emerge de la pelvis a través de la escotadura ciática mayor. Desde allí discurre por el espacio subglúteo, donde se requiere un libre movimiento (extrusión) cuando se efectúa flexoextensión de la cadera.
Existen patologías que comprimen o producen adherencias en el espacio subglúteo, con lo cual se limita el movimiento de las estructuras neurovasculares y la adecuada circulación por los vasa nervorum del nervio ciático, lo que constituye el síndrome de glúteo profundo. Entre sus causas se encuentran bandas fibrovasculares, alteraciones vasculares o traumatismo, pero no se ha reportado ningún caso de atrapamiento nervioso cuya etiología sea la aplicación de biopolímeros secundaria a un procedimiento estético.
Los biopolímeros son compuestos utilizados para aumentar el volumen de algunas zonas corporales, como glúteos y busto, pero pueden penetrar en el estroma y desencadenar una reacción fibrosa y reacción a cuerpo extraño con la formación de granulomas.
Presentamos el caso de una paciente con síndrome de glúteo profundo secundario a la aplicación de biopolímeros para aumento de volumen de glúteos a quien se le realizó una liberación endoscópica en el espacio subglúteo con resultados satisfactorios.
The sciatic nerve is branch terminal of the sacral plexus. Descends and leave the pelvis through the greater sciatic foramen, and from there pass to the subgluteal space, where it needs free range of motion (extrusion) in flexions or extension movements of the hip.
There are many pathologies that compress or produce adherences in the subgluteal space whereupon restrict the motion of the neurovascular structures and the appropriate circulation of vasa nervorum in the sciatic nerve, that we know as deep gluteal syndrome. Inside the etiologies we found fibrous bands containing blood vessels, vascular anomalies, and trauma; but it has not been described nervous entrapment for biopolymers application in a cosmetic procedure.
The biopolymers are compounds that has be using for increase the volume of some body parts as buttocks and breast, but they can penetrate in stroma and produce many scars with fibrosis and strange body reaction to bring of granuloma.
We present a case of a patient with deep gluteal syndrome secondary to biopolymers application for increase the buttocks volume; we do an endoscopic nerve entrapment release in the subgluteal space with satisfactory results.
El nervio ciático se origina de las raíces ventrales a la altura de la región lumbosacra desde L3 a S3, sale de la pelvis a la altura de la escotadura ciática mayor bajo el músculo piriforme en la mayoría de los casos1–2 y desciende cubierto por el glúteo mayor en la región posterior de la cadera. Continúa en el intervalo entre la tuberosidad isquiática y el trocánter mayor para descansar sobre los géminos superior e inferior, el obturador interno y el cuadrado femoral, e inerva parte de la musculatura biarticular de la región posterior del muslo y el complejo muscular de la pierna y el pie3–4.
Morfológicamente mide alrededor de 1,5cm de diámetro y finaliza en sus ramas terminales a la altura de la fosa poplítea, en su trayecto extrapélvico inicial, denominado espacio subglúteo. El nervio tiene una movilidad que oscila entre 1,8 y 2,3cm durante los movimientos de flexión y extensión de la cadera5,6.
En el trayecto extrapélvico que va desde la escotadura ciática hasta el músculo cuadrado femoral se han descrito atrapamientos (periféricos) por múltiples etiologías, como estructuras fibrovasculares, compresión por el músculo piramidal y/o pelvitrocantérico, y atrapamientos entre el isquion y el trocánter menor en la porción inferior del trayecto (canal isquiotrocantérico), entre otras7,8, que limitan la extrusión o libre movimiento del nervio y a su vez atrapan la irrigación de los vasa nervorum procedentes de la arteria glútea inferior. A este síndrome compresivo se lo denomina «síndrome de glúteo profundo»9–10.
Se han descrito pruebas clínicas para su diagnóstico, como el test de estiramiento del piriforme, signo de Pace, entre otras, con una sensibilidad y especificidad limitadas, lo cual lo configura como un diagnóstico de exclusión11,12.
Las causas de atrapamiento hasta ahora reportadas son adherencias por etiologías múltiples en un espacio anatómico susceptible, pero no se han descrito causas por tratamientos estéticos, como el uso de biopolímeros para el aumento de tamaño del glúteo13,14.
Los biopolímeros son compuestos derivados de hidrocarburos que cuentan con una matriz plástica similar a la silicona. Existen diversos usos, dentro de los cuales se encuentran procedimientos estéticos, que actúan como expansores. Se utilizan para aumento de volumen del glúteo y senos desde la década de los cincuenta del siglo pasado, pero estos se difunden de manera irregular dentro de los tejidos aplicados y desencadenan una cicatrización fibrosa o reacción inflamatoria por reacción a cuerpo extraño, además de pérdida de estroma y formación de granulomas15–16.
Para la liberación del nervio atrapado en el espacio subglúteo se presentan múltiples técnicas quirúrgicas, entre las cuales la liberación endoscópica presenta buenos resultados con rápida recuperación17. Desde el año 2003 se han realizado reportes de tenotomías de piramidal y liberación de nervio ciático18, y Martin et al. exponen una serie de casos con 47 pacientes con resultados satisfactorios medidos en escala de Harris19. Pérez Carro reporta excelente resultado en la serie de seis pacientes intervenidos de liberación endoscópica en síndrome de glúteo profundo con mejoría en la Escala Visual Analógica (EVA) y la funcionalidad20.
Presentamos un caso de atrapamiento del nervio ciático periférico debido a la aplicación de biopolímeros como procedimiento estético para aumento de volumen glúteo, con la formación de fibrosis en el espacio subglúteo que desarrolló un síndrome de glúteo profundo, por lo cual se realizó una liberación endoscópica del nervio ciático con adecuada evolución.
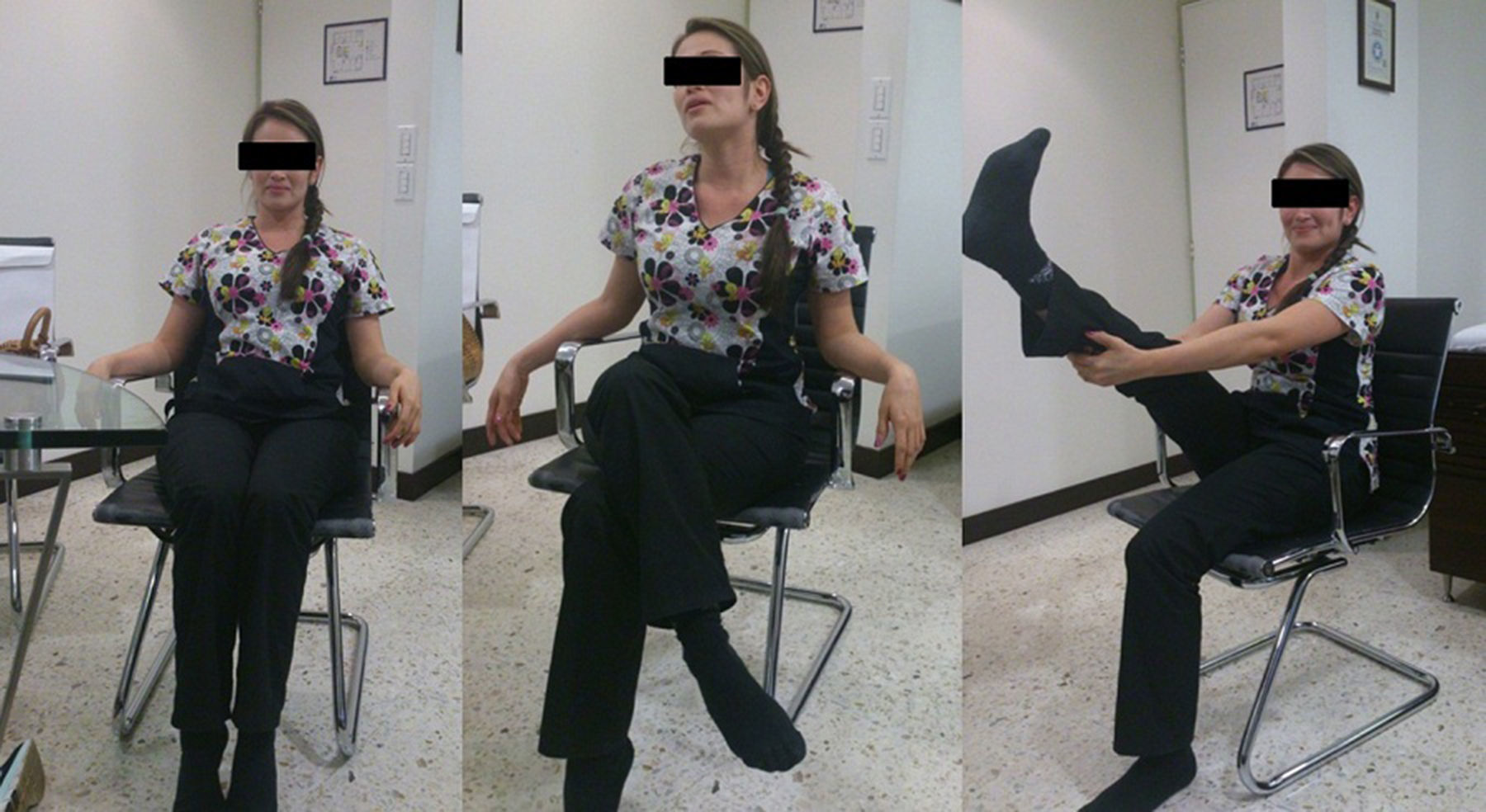
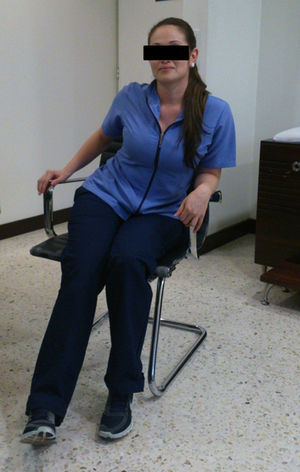
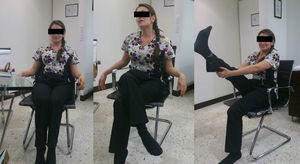
Caso clínicoPaciente femenina de 22 años con antecedente de tratamiento cosmético con aplicación de biopolímeros para aumento del volumen glúteo 3 años antes. Presenta cuadro clínico de 6 meses de dolor en región glútea derecha, irradiado por la región posterior del muslo a la pierna, con imposibilidad de permanecer sentada más de 30 minutos, lo que le hace modificar su postura (fig. 1), e imposibilidad de cruzar la pierna con ocasionales disestesias.
La paciente fue tratada con múltiples sesiones de fisioterapia con estiramiento de musculatura pelvitrocantérica y con antiinflamatorios no esteroideos (AINE) sin mejoría clínica.
En la exploración física presentó flexión de cadera de 90°, después de lo cual se tornó dolorosa; rotación interna de 30°; rotación externa de 70°; signo de Lasègue negativo y dolor marcado en el espacio subglúteo, con una prueba positiva del test de estiramiento del piriforme. Se descartó patología abdominal o lumbar mediante exploración física y estudios imagenológicos (resonancia magnética de columna lumbosacra).
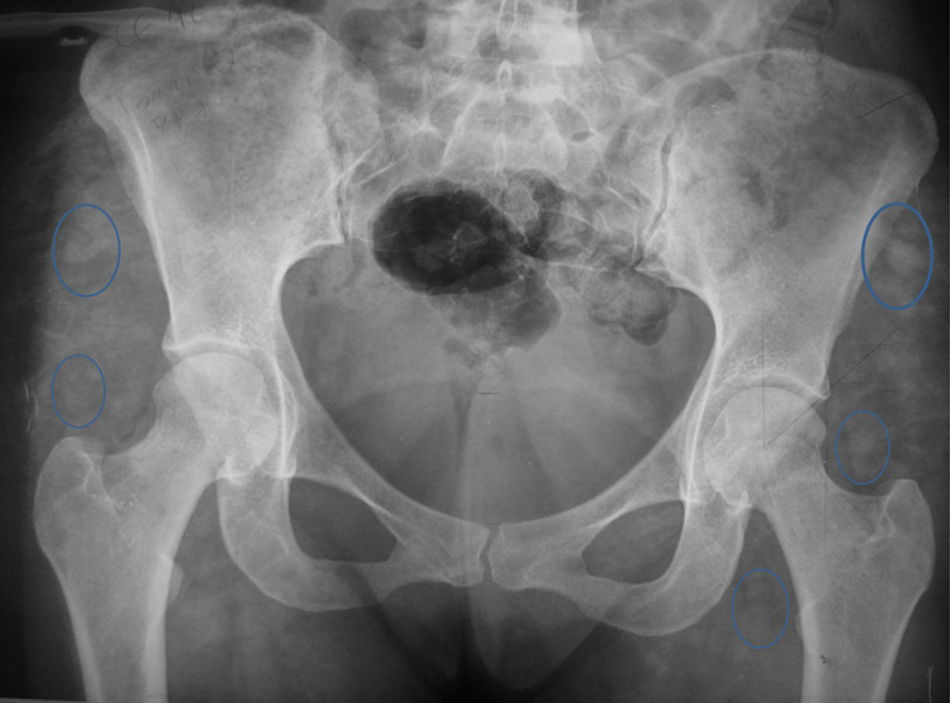
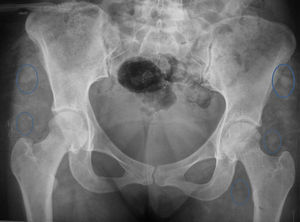
En la radiografía AP de pelvis encontramos CE de 42 y ángulo de Tonnis de 0 con signos de radioopacidades difusas múltiples en la región glútea compatibles con el antecedente de los biopolímeros (fig. 2).
Se estableció un diagnóstico de síndrome de glúteo profundo derecho: La funcionalidad prequirúrgica se valoró con escala WOMAC (74) y VAIL (25), y en escala BENSON (estado malo), por lo cual se planteó como manejo una liberación endoscópica del nervio ciático comprometido con neurólisis.
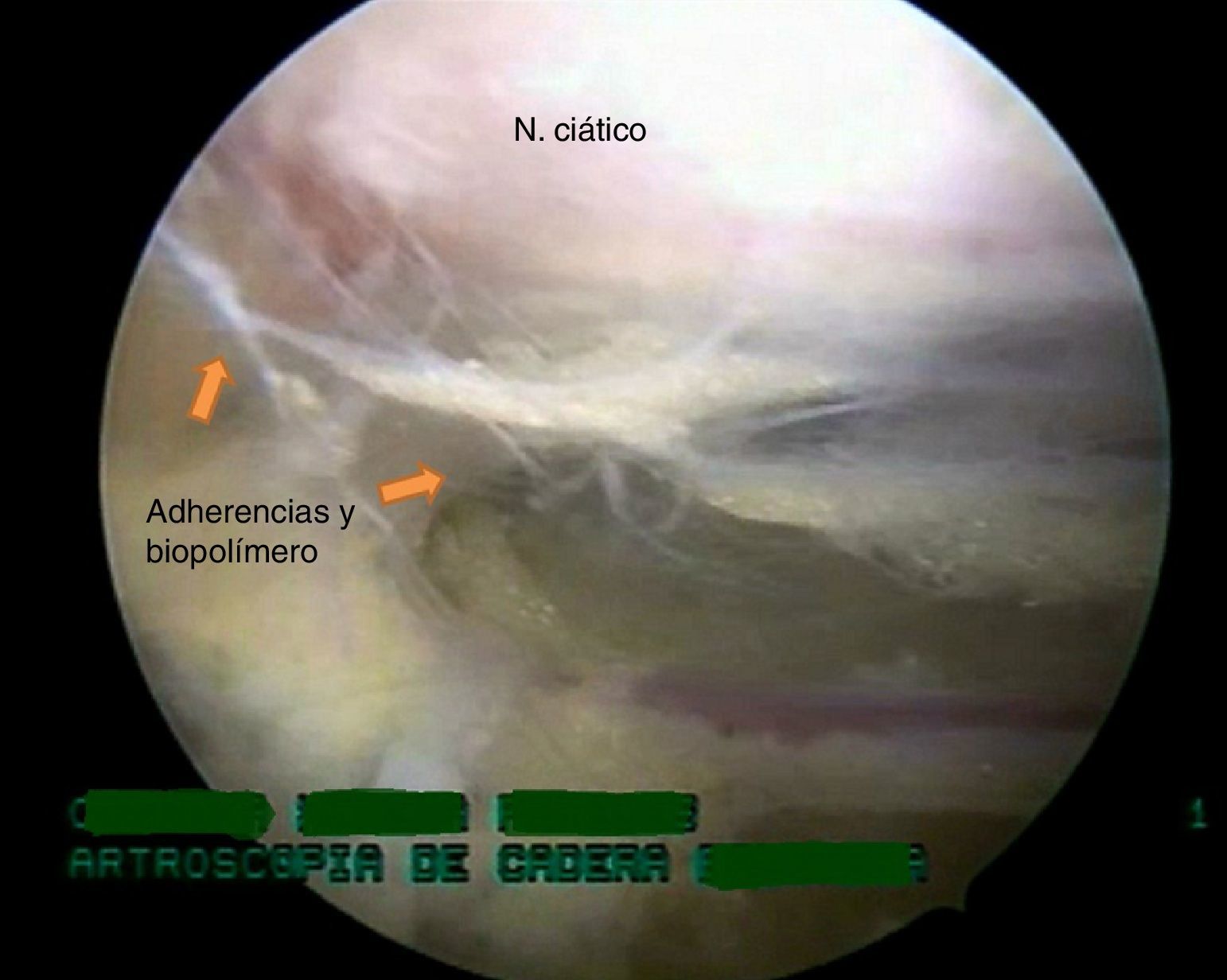
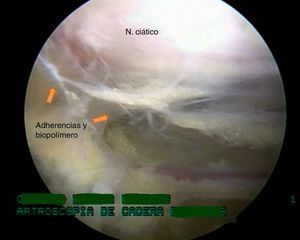
El procedimiento se llevó a cabo en decúbito supino y en mesa de tracción Maquet. Por medio de portales anterolateral, posterolateral y posterior superior accesorio se realizó visualización del espacio subglúteo y como hallazgos endoscópicos se encontraron adherencias fibrosas en la salida del nervio ciático a través de la escotadura ciática mayor que fijan el nervio al glúteo mayor y los rotadores externos, y limitan su movilidad y vascularización, con presencia de un compuesto blanquecino como punto central de las adherencias desde el piriforme hasta el cuadrado femoral (estos corresponden a biopolímeros; fig. 3).
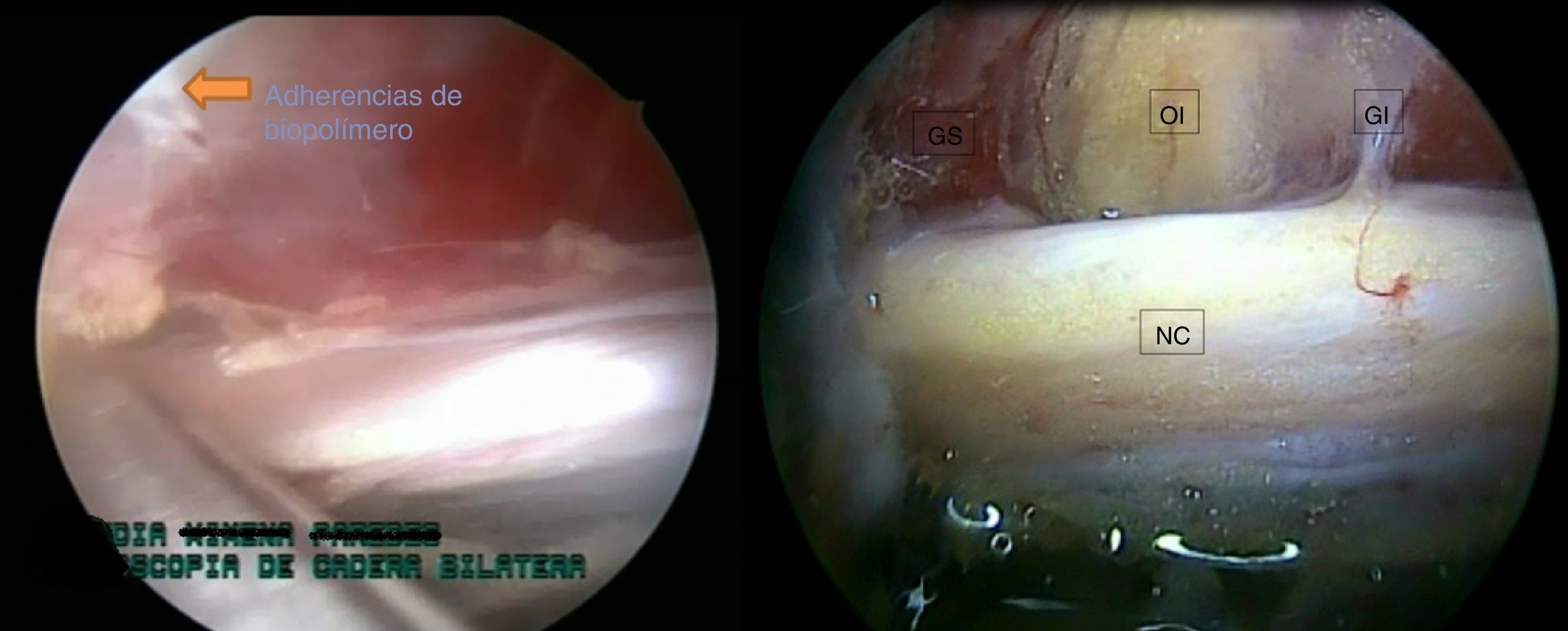
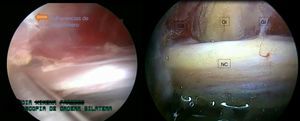
Se realizó liberación roma del nervio tras tomar como punto central el obturador interno. Hacia la región proximal se llegó hasta el tendón de piriforme, donde se efectuó tenotomía de este y hacia la región distal, se procedió a una liberación roma hasta el cuadrado femoral; Al terminar la liberación, se puso de manifiesto una mejoría de la circulación de la arteria satélite del nervio y los vasa nervorum, y mejoría de la movilidad del nervio intraoperatoria (fig. 4).
En el postoperatorio se somete a la paciente a régimen convencional de rehabilitación en cuatro fases con énfasis en ejercicios que mejoren la extrusión del nervio y estiramiento de musculatura pelvitrocantérica.
El seguimiento se realizó a los 6 meses. La paciente refirió completa mejoría de dolor con adecuada funcionalidad y retorno a la actividad laboral. En la exploración física presentaba una flexión de cadera de 130°, rotación interna de 25°, rotación externa de 60°, no se encontró dolor a la palpación del espacio subglúteo ni signos de radiculopatía, y tolera la posición sentada (fig. 5). La puntuación de la escala de seguimiento Benson específica de atrapamiento del nervio fue excelente.
DiscusiónEl atrapamiento de estructuras nerviosas en regiones anatómicas periféricas ya se ha descrito como en el caso del túnel carpiano, canal de Guyon y Froose en los miembros superiores y en el síndrome de túnel tarsiano en miembros inferiores y síndrome de glúteo profundo.
Con el mejor entendimiento de la anatomía se definió un síndrome de atrapamiento periférico de nervio ciático denominado «síndrome de glúteo profundo», en el cual ya están claras las manifestaciones clínicas y los síntomas, descritos por Martin et al. y las opciones de manejo quirúrgico cuando no responden a tratamiento conservador, incluyendo técnicas abiertas y endoscópicas.
El uso de biopolímeros en la cirugía estética es frecuente y se asocia con complicaciones de los tejidos blandos, con la formación de fibrosis y granulomas, como se ha descrito previamente por Coiffman y Munera, las cuales generalmente son manejadas con analgésicos y antiinflamatorios sin adecuados resultados, por lo cual es importante recalcar la búsqueda de los síntomas en estos pacientes, como se presentaron en nuestra paciente, y destacar que es el primer reporte de una complicación neurológica de este tipo.
Es necesario conocer los signos compatibles con atrapamiento de nervio ciático en pacientes con etiología no clara o clínica no específica alrededor de la cadera; más aun con antecedentes que predisponen al síndrome de glúteo profundo, como lo describen Kulcu, Nadero y Benson. Este es un diagnóstico de exclusión que requiere emplear a fondo la semiología.
De acuerdo con el tiempo y la gravedad del atrapamiento, se pueden encontrar resultados poco satisfactorios que deben entenderse en el momento de proponer el tratamiento al paciente candidato a cirugía ya que una alteración en la conducción nerviosa con un agente nocivo prolongado altera la conformación del nervio y no permite su adecuada reperfusión y movilización21.
Dentro de las opciones terapéuticas, la liberación por métodos abiertos presenta resultados variables con agentes nocivos para los tejidos blandos y una rehabilitación más prolongada. La cirugía endoscópica periarticular es nuestra opción de manejo en la paciente, con una adecuada técnica de exploración del espacio trocantérico y subglúteo, como la indicada por Voos, Rudzki y Shindle. Con la liberación roma se logró la excursión del nervio prevista en trabajos previos, como los de Coppieters et al. y Ridehalgh, y se obtuvo la mejoría clínica esperada.
Con una adecuada curva de aprendizaje, la liberación endoscópica del nervio permitirá obtener resultados satisfactorios; con la experiencia del grupo de preservación de cadera se han llegado a obtener resultados similares a los obtenidos por Martin y Pérez Carro20.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.