La patología del manguito de los rotadores es una de las causas más frecuentes de consulta de la población general. Aunque se cuenta con técnicas quirúrgicas más depuradas, el índice de rerroturas continúa siendo muy elevado.
En este artículo de revisión se evalúan la anatomía histológica del manguito de los rotadores, la fisiología de la cicatrización, el uso de las distintas ayudas biológicas disponibles para mejorar la calidad de la cicatrización y los distintos factores que la afectan directa o indirectamente.
Nivel de evidencia clínicaNivel IV.
The rotator cuff disease is one of the most frequent causes of consultation within the general population. Although it has more refined surgical techniques, the rate of re-ruptures continued to be very high.
This is a review of the histological rotator cuff anatomy and physiology of healing, using various biological aids currently available, their evaluation in order to improve the quality of healing and the various factors that directly or indirectly affect healing of the ruptures of rotator cuff.
Evidence levelIV.
La patología del manguito de los rotadores es una de las causas más frecuentes de consulta en ortopedia, pues ocupa el tercer lugar entre las consultas del sistema musculoesquelético. Se calcula que en Reino Unido aproximadamente el 1% de toda la población adulta consulta al ortopedista cada año por dolor en el hombro y que su patología es la responsable del 2,4% del total de todas las consultas generales realizadas al sistema1,2. Las estadísticas norteamericanas mencionan que se practican entre 75.0002 y 300.0003 reparaciones del manguito de los rotadores por año, lo que significa que esta patología es la responsable del gasto de unos 3 billones de dólares que se cargan al sistema anualmente4. A pesar de las mejoras en las técnicas de reparación mediante anclajes de diferentes composiciones que logran una mejor fijación al hueso, del uso de suturas de alta resistencia, que disminuyen la posibilidad de fracaso a ese nivel y de lograr mejores sistemas de fijación con técnicas de reparación que van desde la fila sencilla hasta la doble fila y últimamente el implemento de anclajes triplemente cargados, el índice de rerroturas continúa siendo muy alto, con porcentajes que oscilan entre el 11 y el 94%5,6. Así pues, las investigaciones se encaminan a mejorar los procesos de cicatrización ya que se conoce que después de la reparación, no se recrea la entesis originaria del manguito. La cicatriz que se forma es de tipo fibrovascular, con propiedades biomecánicas inferiores a las del tejido originario7. Se calcula que un tendón reparado alcanzará únicamente unos dos tercios de su resistencia originaria incluso años después de ocurrida la lesión8. Dado que los derivados plaquetarios tienen un alto contenido de factores de crecimiento, son económicos y fáciles de obtener, y que han sido utilizados en cirugía maxilofacial, odontología, dermatología, cirugía plástica y veterinaria con algún éxito9, su aplicación en cirugía del manguito de los rotadores es ahora motivo de investigación. Aparte de ello, se están investigando otras ayudas biológicas y de ingeniería genética con el mismo objetivo: mejorar los procesos de cicatrización y replicar la entesis original del manguito.
AnatomíaLa interfase hueso-tendón o entesis es la responsable de la transmisión de las cargas del tendón al hueso y está formada por 4 zonas con características histológicas diferentes. La zona I es la del tendón propiamente dicho y está formada por colágeno de tipo I y una matriz extracelular compuesta fundamentalmente por decorina. La célula predominante es el fibroblasto. La zona II o de fibrocartílago no mineralizado está compuesta por colágenos de tipos II y III, y pequeñas cantidades de colágenos de tipos I, IX y X. La matriz extracelular está compuesta por agrecanos y decorina, y la célula predominante es el fibrocondrocito. La zona III o de fibrocartílago mineralizado se encuentra compuesta por colágeno de tipo II y pequeñas cantidades de colágeno de tipo X; la matriz extracelular está compuesta por agrecanos y tejido mineral, y la célula predominante es el fibrocondrocito. Por último, la zona IV o zona ósea se encuentra compuesta por colágeno de tipo I, la matriz extracelular está compuesta mayormente por tejido mineral y el tejido celular, por osteocitos, osteoblastos y osteoclastos10.
Fisiología de la cicatrizaciónDe manera general, cuando un tendón se lesiona, se genera una compleja cascada de episodios que termina con la cicatrización del tendón y que ha sido dividida en 3 fases: una fase inicial, inflamatoria, que tiene una duración aproximada de 2 días; una segunda fase, proliferativa, que se extiende más o menos hasta el cuarto día, y una tercera fase de remodelación, que se extiende más o menos hasta el día 21 y más allá. Cada una de estas fases tiene unas características propias donde los factores de crecimiento tienen roles y propiedades específicas.
La primera fase –la inflamatoria– se inicia cuando el tendón se rompe y se produce una disrupción vascular que genera sangrado y la consiguiente migración de plaquetas al sitio de la lesión y la formación de coágulo. Las plaquetas, mediante la desgranulación de los gránulos α, inician la liberación de factores de crecimiento, particularmente PDGF (platelet-derived growth factor), TGF-β (transforming growth factor-β), IGF-I y II (insulin-like growth factor-I and -II), VEGF (vascular endothelial growth factor) y EGF (epidermal growth factor) entre otros. Las plaquetas igualmente almacenan y liberan difosfato de adenosina (ADP), trifosfato de adenosina (ATP) y hormonas, como serotonina, histamina, dopamina e iones de calcio, fundamentales también en la modulación de todos estos factores.
Concomitantemente, se produce la migración de células extrínsecas, en especial neutrófilos, que previenen la infección, y macrófagos, que eliminan los detritos celulares y liberan interleucinas. Estos, junto con células de tipo intrínseco (endotendón y epitenón), inician la liberación de una serie de citocinas que dan inicio a la segunda fase de cicatrización, esto es, la fase proliferativa. En ella se inicia la producción de colágeno, la formación de tejido de granulación, la neovascularización y la migración de fibroblastos extrínsecos e intrínsecos, que son los responsables de la formación de matriz extracelular compuesta fundamentalmente por colágeno y glucosaminoglucanos. Seguidamente se inicia la tercera y última fase, la de remodelación, que se caracteriza por una disminución del contenido celular y vascular, una disminución del contenido de colágeno de tipo III y un incremento en la producción de colágeno de tipo I11. Hay que tener en cuenta que, durante la fase embrionaria, la curación de las lesiones se produce mediante una regeneración completa del tejido y ello se encuentra determinado por la expresión de TGF-βIII que implica la ausencia de tejido cicatricial. En la vida posnatal, la curación de estas lesiones se produce mediante la producción de tejido de cicatrización mediada por el TGF-β1, que facilita la formación de tejido fibrovascular, el tejido predominante en las reparaciones (tabla 1)12.
Resumen de los factores de crecimiento y su participación en las distintas fases de la cicatrización
| Factor de crecimiento | Fase en que el factor de crecimiento es más activo | Funciones |
|---|---|---|
| IGF-1 | Inflamación, proliferación | Promueve la proliferación y migración de células, y estimula la formación de matriz |
| TGF-β | Inflamación | Regula la migración celular, la expresión de la proteinasa, las interacciones de fijación de la fibronectina, el cese de la proliferación celular y la estimulación de la producción de colágeno |
| VEGF | Proliferación, remodelación | Promueve la angiogénesis |
| PDGF | Proliferación, remodelación | Regula la síntesis de proteína y ADN en el sitio de la lesión y regula la expresión de otros factores de crecimiento |
| bFGF | Proliferación, remodelación | Promueve la migración celular y la angiogénesis |
bFGF: basic fibroblast growth factor; IGF-1: insulin-like growth factor-I; PDGF: platelet-derived growth factor; TGF-β: transforming growth factor; VEGF: vascular endothelial growth factor.
Tomada de Molloy11.
Los derivados plaquetarios o PRP son preparaciones que contienen una concentración plaquetaria de, por lo menos, un millón de plaquetas por microlitro y, por los menos, de 3 a 5 veces más de factores de crecimiento y citocinas que la sangre. También contienen factores bioactivos, como serotonina, dopamina, histamina, calcio y adenosina, que cumplen un papel importante en las tres fases de cicatrización y, además, moléculas de tipo adhesivo, como fibrina y otras13. Los PRP se obtienen después de centrifugar aproximadamente 10 ml de la sangre del paciente; de esta manera aparecen tres capas diferentes en color y contenido. La capa roja, la más densa, localizada en la parte mas baja del tubo de ensayo, está formada fundamentalmente por eritrocitos; la capa blanca o intermedia, por leucocitos y citocinas, y la capa más alta o capa amarilla contiene factores de crecimiento, plasma y plaquetas. Con frecuencia se utiliza esta última capa14. Existe mucha confusión en la bibliografía acerca del producto verdaderamente utilizado ya que la terminología cobija muchos preparados con el mismo nombre, lo que no es correcto. Se considera que un preparado que libere entre 503.000 y 1.729.000 plaquetas por microlitro tiene un efecto óptimo para la regeneración ósea.
Los derivados plaquetarios pueden dividirse en cuatro grandes categorías: los P-PRP (pure platelet-rich plasma) y L-PRP (leucocyte-platelet-rich plasma), que son suspensiones plaquetarias sin o con leucocitos, respectivamente, y los agregados plaquetarios, que proveen de una base semisólida y que se denominan P-PRF (leucocyte-poor o pure platelet-rich fibrin) y L-PRF (leucocyte platelet-rich fibrin). De igual manera, los primeros no poseen leucocitos y los últimos sí. A su vez, dichos preparados pueden ser subdivididos en función de si son activados ex vivo por trombina o calcio, o in vivo por la activación de colágeno endógeno15. En general, se ha establecido que las soluciones plaquetarias (P-PRP y L-PRP) se utilizan en el manejo conservador o de las tendinopatías del manguito, y que los agregados plaquetarios o de fibrina (P-PRF y L-PRF) son los compuestos utilizados en cirugía artroscópica o abierta16.
Además, pueden existir variaciones de dichos compuestos, por ejemplo, los P-RFM (platelet-rich fibrin matrix) utilizados en los trabajos de Rodeo17 utilizan una matriz de fibrina que se forma después de la adición de cloruro de calcio y una segunda fase se centrifugación. Con ello se persigue minimizar la activación plaquetaria, atrapar las plaquetas en la matriz de fibrina y, de esta manera, favorecer la liberación de citocinas en busca de un efecto específico. Toda esta variabilidad trata de lograr una expresión particular de las citocinas y, por tanto, efectos y resultados diversos. El término, pues, de PRP cobija un espectro amplio de preparaciones que debe tenerse en cuenta a la hora de evaluar la bibliografía. No existe un consenso acerca de cuál de los preparados puede ser el indicado en una situación particular y menos aún acerca de las dosis y la frecuencia con las cuales deben ser utilizados.
Citocinas o factores de crecimiento más comunesIGF-I (insulin growth factor)Tiene funciones durante el crecimiento corporal y en los procesos de cicatrización; estimula la migración y proliferación de fibroblastos al sitio de la lesión e incrementa la formación de colágeno y matriz extracelular. Está presente en las dos primeras fases de cicatrización, esto es, en la inflamatoria y la proliferativa. Aparentemente se encuentra contenido en depósitos inactivos mantenidos extracelularmente que son liberados rápidamente después de la lesión tisular18.
TGF-β (transforming growth factor β)Tiene un rol activo en las tres fases de la cicatrización y aumenta la producción de colágeno de los tipos I y III. Regula la migración celular al sitio de la lesión y la producción de proteinasas. Aunque está presente en las tres fases, su concentración es más alta en la primera fase de la cicatrización, o sea, la inflamatoria. Existen tres isoformas de este compuesto, la I, la II y la III, y es interesante tener en cuenta que, durante los procesos de cicatrización en adultos, existen concentraciones altas de TGF-βI, con formación abundante de tejido de cicatrización, mientras que durante el período embrionario existe una alta producción de las formas II y III. Ello se traduce en una baja producción de tejido cicatricial con la producción de un tejido mucho más parecido al tejido originario en un proceso que es conocido como scarless healing, donde desempeñan un papel activo en la modulación del tejido de cicatrización. La isoforma βIII no se encuentra presente en el microambiente de cicatrización del adulto, pero, si se suministra de forma exógena, puede mejorar el ambiente cicatricial de las reparaciones del manguito de los rotadores. Hoy día, los trabajos se encuentran más dirigidos a modular la expresión de estos factores y sus dosis para lograr un tejido cicatricial más parecido a la entesis originaria19. Los estudios de Kovasevich demuestran que el uso del TGF-βIII a través de una matriz osteoconductiva de fosfato de calcio produce una cicatrización del manguito de los rotadores menos fibrosa, mejor organización del colágeno, un aumento de la fuerza tensora a las 4 semanas del postoperatorio y una mejor relación entre colágeno I y colágeno III.
VGF (vascular endotelial growth factor)Es mucho más activo en las fases de proliferación y remodelación, lo que demuestra que es un poderoso estimulador de la angiogénesis. Sus niveles altos en el sitio de la lesión se correlacionan de manera apropiada con el tipo de crecimiento vascular que se inicia desde el epitenón hacia el interior de la cicatriz. Su concentración más elevada se alcanza hacia el día 7 y va disminuyendo de manera gradual hacia el día 21 cuando alcanza nuevamente sus niveles basales. Su existencia en la lesión depende tanto de factores biológicos como locales (hipoxia, existencia de interleucinas, interacción con otros factores de crecimiento, osteogénesis y distracción ósea)20.
PDGF (platelet derived growth factor)Se encuentra presente durante las dos últimas fases, la proliferativa y la de remodelación; regula la expresión de otros factores de crecimiento, la síntesis de proteínas y de ADN en el sitio de la lesión, y promueve la quimiotaxis, la proliferación de fibroblastos y la producción de matriz extracelular.
bFGF (basic fibroblast growth factor)Están formados por una familia de 23 polipéptidos caracterizados por su afinidad con los glucosaminoglucanos de las paredes celulares21. Los más frecuentes en el organismo son el FGF-1 (acid fibroblast growth factor) y el FGF-2 (basic fibroblast growth factor). Son potentes estimuladores de la angiogénesis, la migración y proliferación celular, y su producción depende tanto de los tenocitos como de los fibroblastos que migran desde el epitenón. Se sabe, por estudios in vitro, que favorecen la producción de colágeno en el manguito de los rotadores. Los estudios de Ide en ratas han demostrado que la aplicación de bFGF solo o en combinación con matriz dérmica acelular acelera la cicatrización inicial de la interfase hueso-tendón en las reparaciones del manguito de los rotadores con lesiones agudas reparadas.
Proteínas morfogenéticas (BMPS)Pertenecen a la familia de las TGF-β y son conocidas por su capacidad de estimular la producción ósea, la formación de fibrocartílago y tendón, y, por tanto, de modular de manera importante la cicatrización tendinosa. Se ha descrito que el uso de las proteínas morfogenéticas 12, 13 y 14 mejora la fuerza tensora y la estructura de los manguitos reparados en animales, lo que favorece una mejor organización celular. Los estudios de Rodeo han demostrado el restablecimiento del colágeno entre el hueso y el tejido fibrovascular de la cicatriz y un aumento del contenido de glucosaminoglucanos en especímenes tratados con proteína humana recombinante 12 (rhBMP12). Ello se ha traducido en un aumento de la fuerza tensora y de la falla a la carga de los tendones reparados de 2,7 veces comparados con los controles22.
Inhibidores de las metaloproteasas (MMP-TIMP)Las metaloproteasas (MMP) son enzimas (endopeptidasas) que requieren cinc para su correcto funcionamiento. Ese es el origen de su nombre. Su función es realizar la degradación de todos los componentes del tejido conectivo, modificar la estructura de la matriz extracelular y regular la respuesta inflamatoria a través de su acción sobre las citocinas23. Inicialmente se las describió como las responsables de la reabsorción de la cola del renacuajo, pero estudios ulteriores han demostrado que son sintetizadas por las células del tejido conectivo y que desempeñan un papel importante en la cicatrización de heridas. La familia de las metaloproteasas humanas está formada, por lo menos, por 18 compuestos relacionados estructuralmente que pueden dividirse en 5 subtipos: las colágenas, las gelatinasas, estromelisinas, las de tipo membrana y las aún no clasificadas.
Su existencia se ha vinculado con el crecimiento tumoral, la existencia de aneurismas vasculares, el desarrollo embrionario, la remodelación tisular, el desarrollo de artritis, osteoartritis y artritis reumatoide. Se piensa también que no solamente tienen efecto como enzimas degradantes, sino que poseen, además, un efecto antiinflamatorio. Sus características específicas se encuentran más allá del alcance de este artículo, pero pueden consultarse en Hidalgo24.
Estas enzimas poseen unos inhibidores naturales denominados TIMP (tissue inhibitors of metalloproteinase). El equilibrio entre ellas determina la composición de la matriz extracelular y la remodelación tendinosa y su desequilibrio, determina la disrupción de colágeno y predispone a la aparición de las tendinopatías y roturas tendinosas25,26. El uso de inhibidores de las metaloproteasas y su efecto en la cicatrización del manguito de los rotadores en animales ha sido bien documentado. La administración de α-macroglobulina colocada directamente en la impronta de ratas se ha asociado con la formación de fibrocartílago nuevo a las 2 semanas y un incremento en la organización del colágeno a las 4 semanas a la altura de la entesis en cicatrización. Otros inhibidores de las metaloproteasas, como la doxiciclina (un derivado de las tetraciclinas) a dosis bajas de 20 mg dos veces al día, ha demostrado ser de utilidad en las reparaciones del manguito de los rotadores y ha mejorado los parámetros biomecánicos e histológicos en la interfase hueso-tendón. Su uso, durante un tiempo limitado, puede ser de utilidad en el rescate de tejidos lesionados27–30. La inhibición de la MMP-13 con doxiciclina, después de la reparación del manguito de los rotadores en ratas, se ha asociado con una mejora sustancial de los parámetros histológicos y biomecánicos de la interfase hueso-tendón. Los inhibidores de las metaloproteasas también se han visto involucrados en la regulación de la angiogénesis y la proliferación celular.
BifosfonatosSon componentes que tienen una alta afinidad por la hidroxiapatita del hueso. Su mecanismo de acción está relacionado con la inhibición de la función del osteoclasto e interfieren en la reabsorción ósea e inhiben la producción de citocinas por parte de este. Su uso como inhibidores de las metaloproteasas es bien conocido, pero su utilidad en las reparaciones del manguito de los rotadores aún no se ha estudiado31.
Uso de los PRP en tendinopatías y roturas del manguito de los rotadoresEl término tendinopatía hace referencia a un proceso en el cual el tendón posee una capacidad funcional reducida, asociada con cambios histopatológicos que ponen de manifiesto una falla o, por lo menos, una deficiencia en los procesos de cicatrización. Existen factores de diversa índole: intrínsecos, como la edad del paciente, enfermedades genéticas o concomitantes, como la diabetes, la hipercolesterolemia o la gota; o extrínsecos, como el uso de quinolonas o corticoides, o mecánicos como el sobreuso, todos los cuales pueden conducir a una tendinopatía32. Al parecer, el factor subyacente es un déficit en los procesos de cicatrización del manguito.
En tejidos viejos, con poca capacidad de regeneración y de cicatrización, parece que los derivados plaquetarios tienen utilidad por la posibilidad potencial que tienen de mejorar la angiogénesis, la diferenciación celular, la replicación y la formación de matriz extracelular33. La bibliografía al respecto es controvertida; estudios como los de Kesikburun34, con niveles I de evidencia, sugieren que la aplicación de PRP en el espacio subacromial no surge ningún efecto en la calidad de vida, el dolor, la discapacidad y los rangos de movilidad después de 1 año de su aplicación, cuando se los compara con los placebos que se manejaron con fisioterapia. Sin embargo, una revisión sistemática de la bibliografía con un total de 886 pacientes mostró que a medio plazo el dolor mejoraba en aquellos pacientes con tendinopatías (no únicamente del manguito de los rotadores). Algo similar fue reportado por Wesner, quien concluye que la inyección intratendinosa del supraespinoso dirigida por ecografía puede conducir a mejorar el dolor, la función y la apariencia radiológica en la resonancia magnética (RM). Rha obtuvo resultados similares; encontró que aquellos pacientes que recibieron 2 dosis de PRP colocados intralesionalmente mediante ecografía, con intervalos de 1 mes entre la primera y la segunda aplicación, mejoraron sus escalas funcionales y de dolor35.
En lo referente a la reparación del manguito, el grupo de Hak en Canadá realizó un estudio utilizando PRP para evaluar su eficacia en el manejo del dolor. Los pacientes recibieron el producto en el intraoperatorio y 4 semanas después. Realizaron un análisis a las 6 semanas del postoperatorio de la escala análoga del dolor y aplicaron las escalas funcionales de DASH y WORK. Los resultados no mostraron ninguna diferencia estadísticamente significativa entre el grupo placebo y el grupo manejado con PRP36.
Un metaanálisis realizado en China por Cai, con nivel I de evidencia, demostró que no existía diferencia en cuanto a los resultados funcionales, pero que la falla de la cicatrización fue considerablemente menor en aquellos tratados con PRP cuando se manejaron roturas de pequeñas a moderadas37. Vavken confirmó igualmente que los PRP pueden promover la cicatrización en roturas pequeñas o moderadas, pero que su uso no es rentable38. El grupo de Chicago encontró los mismos hallazgos; no se encontraron mejorías en los seguimientos clínicos ni en la tasa de rerroturas. Sin embargo, cuando se consideraba específicamente el uso de PRP administrados sobre una matriz sólida, cuando se colocaban en la interfase hueso-tendón, cuando se asociaban con una reparación en doble fila o cuando se usaban en roturas de pequeñas a medianas, la tasa de rerrotura tendía a ser menor39.
Castricini y Barber, utilizando el mismo compuesto, encontraron resultados contradictorios. El primero de ellos concluyó que el uso de P-RFM no mejoró la cicatrización de las lesiones pequeñas o medianas reparadas mediante técnica de doble fila, mientras que Barber concluyó que la tasa de rerroturas era menor cuando se utilizaba dicho compuesto y se realizaba una reparación de fila sencilla40,41.
Jo en Corea, sobre un total de 74 pacientes tratados con reparación artroscópica del manguito de los rotadores, que presentaban roturas de medianas a grandes, no encontró que las lesiones cicatrizaran más rápidamente, pero puso de manifiesto una mejoría en la calidad de la reparación, lo que quedó claro por una menor tasa de rerrotura y un incremento en la CSA (cross sectional area) del supraespinoso42. Estudios muy recientes tampoco apoyan el uso de PRP como ventajosos en cirugía del manguito de los rotadores43–46; únicamente Zhang reporta una tasa de cicatrización mayor en pacientes con reparación artroscópica mediante técnica de doble fila y colocación de PRP47. Otro estudio publicado en 2016 concluye que el uso de derivados plaquetarios no produce beneficios sobre los resultados clínicos de manera general, pero la tasa de rerroturas es menor en los pacientes con roturas pequeñas o medianas. Zumstein, también este año, concluye que el uso de L-PRF como técnica de aumento biológico en las reparaciones de doble fila no están indicados, pues no se encontraron mejorías en los resultados clínicos y estructurales en aquellos pacientes así tratados48. Finalmente, Andia, en su artículo, concluye que todavía no se puede decidir, si el uso de los PRP en la patología del sistema musculoesquelético es de utilidad o no. hace hincapié en la necesidad de optimizar los protocolos de manejo en las distintas patologías por la diversidad de preparados y dosis utilizadas. Sin embargo, al parecer queda claro que minimizar el contenido de leucocitos y eritrocitos es más importante que aumentar el número de plaquetas porque disminuyen los procesos inflamatorios y aumentan los procesos anabólicos del tejido en reparación49. En resumen, la revisión de los artículos de manera general no apoya el uso de PRP como técnica única de aumento biológico.
Otros factores biológicos que pueden mejorar la cicatrización del manguito de los rotadoresCélulas mesenquimales (MSCs)La International Society for Cellular Therapy (ISCT) estableció los criterios para definir qué son las células mesenquimales y son: las células deben demostrar una adherencia de tipo plástico, expresar ciertos antígenos de superficie (CD105, CD73 y CD90), pero no otros (CD45, CD34, CD14, CD11b, CD79α, CD19, antígenos leucocitarios humanos o antígenos D relacionados), y tener la capacidad de diferenciarse en osteoblastos, condroblastos y adipocitos in vitro50.
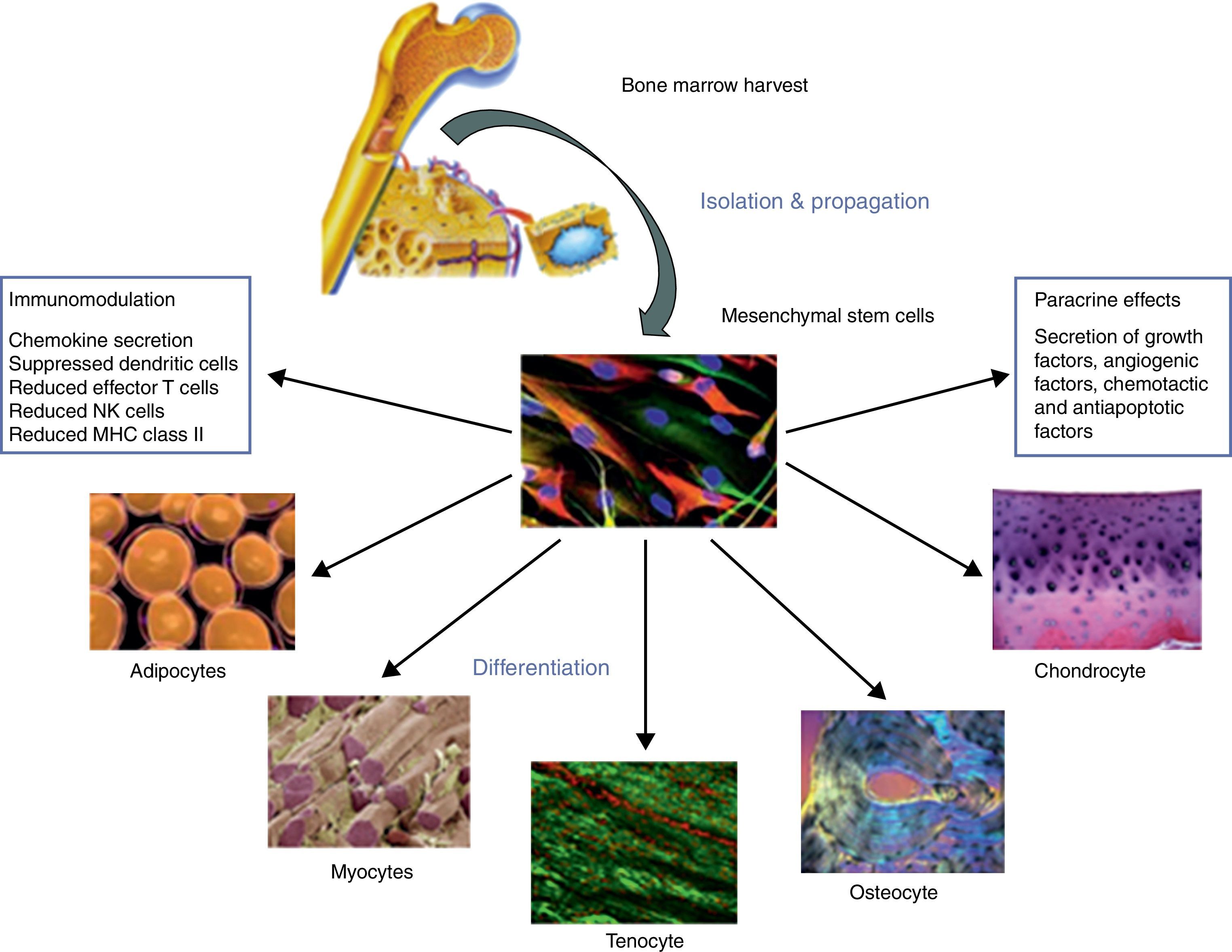
Las células mesenquimales pueden obtenerse de distintas fuentes y por distintos medios; la médula ósea es la más comúnmente utilizada, pero pueden obtenerse de tejido adiposo (ADSCs, adipose-mesenchymal stem cells), de los pericitos y células adventicias de las paredes vasculares, de tejido muscular (M-MSCs, muscle mesenchymal stem cells), de tejido tendinoso (TDSCs, tenocyte-derived stem cells), de la bolsa subacromial e, incluso, del manguito de los rotadores (fig. 1)51,52.
Se conoce que, aunque todas las células mesenquimales poseen características biológicas similares, sus propiedades químicas son ligeramente distintas y se encuentran influidas tanto por el tejido de origen como por las características del genoma del donante y, por tanto, su uso tiende a ser específico dependiendo del tejido tratado.
El uso de BMC (bone marrow concentrate) en tendinopatía del manguito de los rotadores ha mostrado resultados alentadores al demostrarse una mejoría en las escalas de dolor y en las escalas funcionales (DASH)53. En lo referente a reparaciones, una revisión realizada por Isaac demuestra que, con el uso de células madre «se pone de manifiesto una mejoría modesta tanto en la estructura como en la biomecánica de las reparaciones del manguito de los rotadores manejadas con células madre o con factores de crecimiento». El uso de células mesenquimales en el manejo de la patología del manguito de los rotadores se remonta al año 2009. Desde entonces se ha estado estudiando su utilidad en modelos animales. Ese año, Gulotta demostró que la colocación de células mesenquimales en el sitio de la reparación no modificaba la estructura, la composición ni la fuerza tensora en las ratas manejadas de esta manera aunque se documentó un incremento de estas células en el sitio de la reparación54. El mismo autor, en estudios subsiguientes, utilizando modificaciones de las células madre mediante ingeniería genética, con objeto de lograr expresiones diferentes de factores de crecimiento, encontró resultados contradictorios; por ejemplo, tras modificarlas para lograr mayor expresión de inhibidores de las metaloproteasas, consiguió una mejora en la producción de fibrocartílago, con un incremento en las propiedades mecánicas de la reparación55; de igual manera, cuando realizó la modificación con scleraxis (factor de transcripción relacionado con la formación de tendón durante la embriogénesis) logró un incremento en la producción de fibrocartílago, con una mejoría de las fuerzas mecánicas de la reparación56. Sin embargo, cuando las utilizó para lograr un incremento en la producción de proteína morfogenética 13 (BMP 13) no logró ningún incremento en la cicatrización del manguito recién reparado57. Los trabajos de Kida en ratas demostraron un incremento de células madre cuando se realizaba la perforación de la tuberosidad mayor. De esta manera se logró un incremento de las propiedades mecánicas del tendón reparado a la cuarta y a la octava semana de la cirugía58. Tornero, utilizando modelos animales, demostró que el uso de MSC, en conjunto con un andamiaje de colágeno de tipo I, mejoró la fuerza tensora del tendón reparado, después de 3 meses de su realización59. Manipulaciones realizadas en células madre para lograr una disminución en la producción del TGIF-1 mostraron que su uso mejoró la fuerza tensora y la falla a la carga de las reparaciones en ratas a las 4 semanas60.
En otro estudio practicado en ratas, Oh demostró que el uso de células mesenquimales de origen adiposo (ADSCs) tiene la posibilidad de mejorar la calidad muscular, disminuir la infiltración grasa y mejorar la calidad de la cicatrización tendinosa en las reparaciones del manguito de los rotadores61. Sin embargo, estudios más recientes, practicados también en ratas, no pudieron demostrar lo mismo62,63, por lo que su uso aún es discutible.
En ese mismo sentido Jo describió que, cuando se realizan perforaciones a la altura de la tuberosidad mayor para reclutar células mesenquimales autólogas, la tasa de rerroturas era considerablemente menor (el 22,2% frente al 45,2% del grupo control) en cirugías practicadas en seres humanos64. Milano, en un estudio de nivel I de evidencia realizado sobre un total de 80 pacientes, no encontró cambios significativos en la resonancia entre los pacientes tratados con perforaciones y aquellos que no lo fueron. Sin embargo, apareció una tasa de cicatrización mucho mayor en aquellos a quienes se trató con microfracturas65. Taniguchi66, sobre un total de 111 pacientes, encontró que las microfracturas de la tuberosidad mayor mejoraron la integridad de las reparaciones cuando se juzgaron de acuerdo con la clasificación de Sugaya67, en especial cuando se trataba de roturas masivas.
Gomes demostró, en 14 pacientes con reparación con técnica de mini-open, que no se presentaron rerroturas a 1 año de seguimiento en aquellos pacientes que fueron tratados con células mesenquimales obtenidas de cresta ilíaca e inyectadas en los bordes del reparo. El aumento en la intensidad de señal en la secuencia T2, en la zona crítica del tendón, sugiere la formación de tejido neorregenerado. Desafortunadamente, el número de pacientes fue muy pequeño y no se tomaron muestras histológicas del tejido que confirmaran los hallazgos de la resonancia68.
Más recientemente, Yoon demostró que el uso de células mesenquimales obtenidas mediante perforación de la impronta y el aumento con parches redujo significativamente el índice de rerroturas en aquellos pacientes con roturas masivas del manguito. Sin embargo, el estudio no pudo concluir si ello se debía al uso del parche únicamente, al uso de las células mesenquimales únicamente o al uso combinado de las dos técnicas69.
Los estudios de Mazzocca demostraron que las células mesenquimales obtenidas de médula ósea, estimuladas con una sola dosis fisiológica de insulina, pueden producir células con las características propias del tendón. Ello constituiría una ayuda biológica importante en las reparaciones del manguito de los rotadores70.
Otros factores que afectan a la cicatrización del manguito de los rotadoresLa diabetes71, la nicotina72, el uso de antiinflamatorios no esteroideos, como la indometacina y el celecoxib73, afectan de manera clara a los procesos de cicatrización del manguito, pues los retrasan. Factores externos, como el uso de ultrasonido pulsátil74–76, tienen efectos benéficos en la cicatrización de la interfase hueso-tendón. Otros factores que afectan a la cicatrización del tendón son la edad del paciente, el tamaño de la rotura, el tabaquismo, el grado de atrofia muscular, la calidad del tendón y el protocolo de rehabilitación. Además de ello, la competencia del cirujano, el tipo de creación y las mejoras del hardware influyen en el tipo de cicatrización y los resultados finales77–79.
Recientemente se han vinculado los niveles bajos de vitamina D con la degeneración grasa del manguito de los rotadores. Sin embargo, los estudios de Ryu demostraron que no existe relación con el tamaño de la lesión, el grado de retracción o el grado de infiltración grasa y que tampoco afectan a la cicatrización de la reparación80.
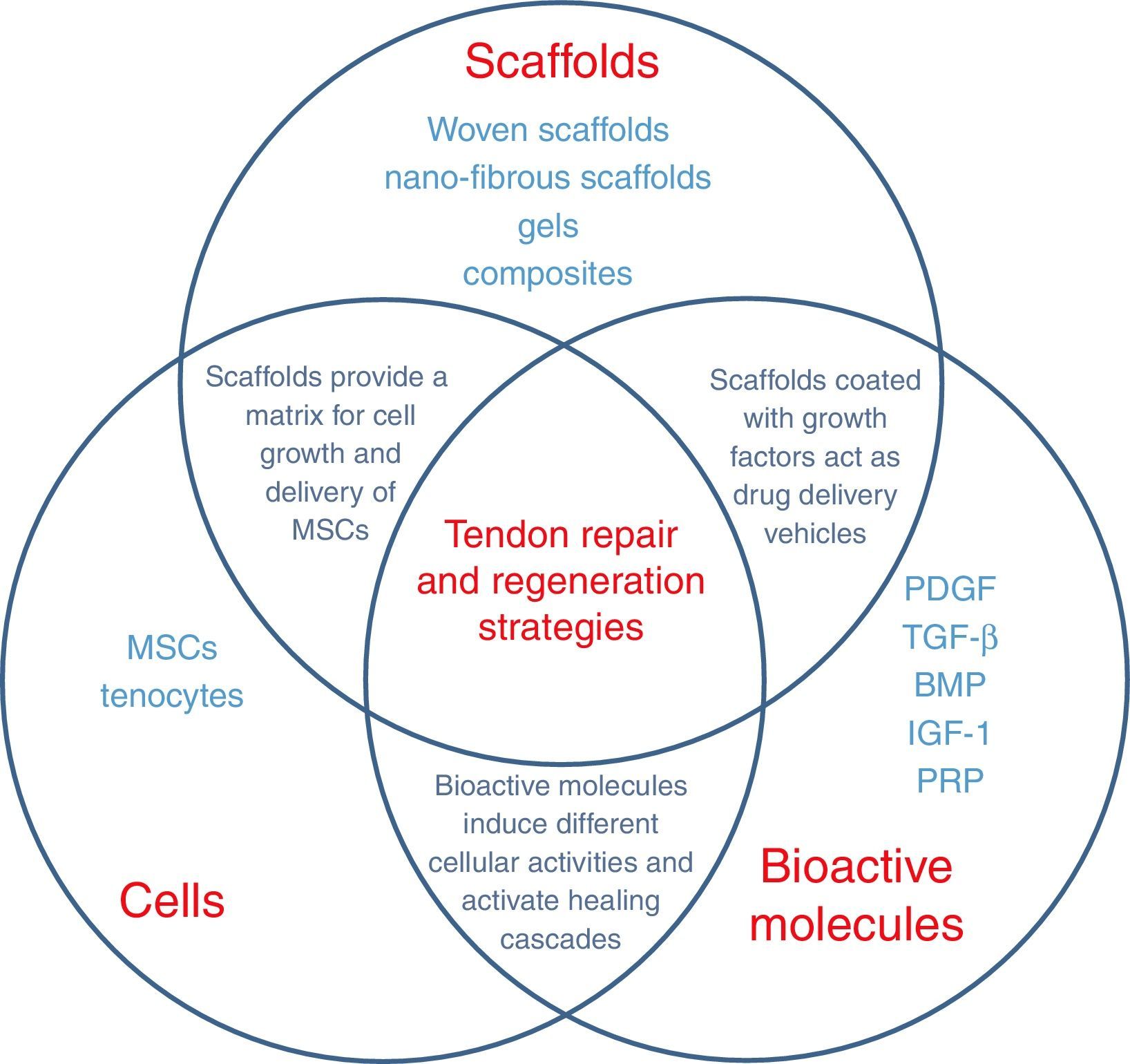
ConclusiónCada una de las terapias analizadas tiene sus propias ventajas, pero hoy día parece que los tratamientos que combinan las células madre con los factores de crecimiento y los andamiajes de origen biológico o sintético ofrecen la mejor opción de manejo. El uso aislado de cada una de esas terapias, aunque ha sido alentador en animales, no ha podido ser reproducido en seres humanos y todavía no se encuentra apoyado como terapia habitual en las reparaciones del manguito de los rotadores (fig. 2).
BMP: bone morphogenetic proteins; IGF-1: insulin-like growth factor-I; MSC: mesenchymal stem cells; PDGF: platelet-derived growth factor; PRP:; TGF-β: transforming growth factor. Tomada de Lorbach O, Baums MH, Kostuj T, Pauly S, Scheibel M, Carr A, et al. Advances in biology and mechanics of rotator cuff repair. Knee Surg Sports Traumatol Arthrosc. 2015;23:530-41.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.