La cirugía asistida por computador tiene más de dos décadas. Desde sus inicios en neurocirugía se ha utilizado para realizar procedimientos que requieren precisión como la como la resección de tumores intracraneales y la toma de biopsias cerebrales. En ortopedia, una extensa bibliografía muestra su utilidad en cirugía de columna para la colocación de tornillos transpediculares, posicionamiento de prótesis en reemplazos articulares, reconstrucción del ligamento cruzado y en cirugía traumatológica. Esta tecnología ha presentado grandes avances, lo cual ha permitido incorporarla en la ortopedia oncológica para la resección de tumores óseos con resultados prometedores.
Computer assisted surgery has more than two decades. From the beginning in neurosurgery, navigation was used for biopsies and intracranial tumor resections. In orthopedic surgery, a wide literature demonstrated the use of computer assisted surgery in different procedures included positioning of pedicular screws in spine surgery, join prosthesis alignment, anterior cruciate ligament reconstruction and trauma surgery. This technology has progressed, and more recently it was incorporated in orthopedic oncology for bone tumor resections showing promising results.
El uso del navegador como herramienta en cirugía tiene mas de dos décadas. Desde sus inicios en neurocirugía se ha utilizado para realizar procedimientos que requieren precisión, como la resección de tumores intracraneales y la toma de biopsias cerebrales. En ortopedia, una extensa bibliografía muestra su utilidad en cirugía de columna para la colocación de tornillos transpediculares1, posicionamiento de prótesis en reemplazos articulares2–4, reconstrucción del ligamento cruzado anterior5,6 y en cirugía traumatológica7,8.
Los cirujanos utilizan cada vez abordajes menos invasivos guiados por imágenes como el fluoroscopio. Sin embargo, estas técnicas aumentan la exposición al paciente y al equipó quirúrgico a radiaciones ionizantes que pueden ser deletéreas a largo plazo. Los equipos de navegación disminuyen de manera importante el uso del fluoroscopio9. Esta tecnología ha presentado grandes avances, lo cual ha permitido incorporarla en la ortopedia oncológica para la resección de tumores óseos con resultados prometedores.
DefiniciónEl planeamiento preoperatorio utiliza imágenes radiográficas convencionales, como la tomografía computarizada (TC) o la resonancia magnética (RM)10. Con el advenimiento de procedimientos más complejos que exigen mayor precisión, se requiere una mejor visualización y manipulación de la anatomía de manera interactiva. Al igual que el sistema de navegación GPS de un auto, el conductor recibe una instrucción visual sobre un mapa que lo orienta en un camino desconocido; el módulo de cirugía asistida por computador en ortopedia (CAOS, según sus siglas en inglés) le da información al cirujano en tiempo real acerca de sus acciones en una escena virtual del sitio anatómico11–15.
HistoriaLa primera resección asistida por computador está descrita por Krettek et al. y Hufner et al. en el año 2004. Utilizan la navegación basada en la TC para la resección de tumores de pelvis y sacro. Concluyen que es un método que mejora la precisión de la resección16,17.
La TC y la RM se complementan en el planeamiento de la resección y reconstrucción de tumores musculoesqueléticos. Wong et al. describen la fusión de imágenes en la cirugía de navegación. Esta fusión permite delinear mejor los márgenes del tumor con una definición precisa del plano de resección18.
Cartiaux et al. describen en un estudio experimental en 2008 que en condiciones ideales de trabajo, con una completa visualización y acceso a las superficies óseas, se solicitó a 4 cirujanos experimentados operar sobre modelos de pelvis en plástico. La probabilidad de un cirujano experimentado de obtener un margen de 10mm con una tolerancia de 5mm era solo del 52% y el grado de contacto del aloinjerto en la reconstrucción no fue satisfactorio. En los cortes realizados asistidos con el navegador mejoró la precisión significativamente, el error de una sierra navegada fue de solo 2,8mm y en la no navegada de 5,2mm19.
Otros centros reportan aplicaciones clínicas del navegador en ortopedia oncológica. Cho et al. demostraron una mejoría en el contacto del aloinjerto con menor riesgo de falta de unión20.
Li et al. y Aponte-Tinao describen sus resultados con osteotomías multiplanares usando el navegador. Se espera una mejor función posterior a la reconstrucción si se conservan hueso y tejidos blandos no afectados21,22.
En la actualidad se publican series con más casos y mayores seguimientos, Gerber et al. muestran la experiencia de 130 casos en un solo centro. Concluye que la navegación es una técnica segura para las resecciones tumorales y puede obtener mejores resultados funcionales y oncológicos23.
Jeys et al. confirman estos hallazgos en una serie de 31 pacientes de resecciones de tumores malignos en pelvis o sacro asistidas por computador, lo cual redujo las resecciones intralesionales del 29 al 8,7%24,25.
Navegación intraoperatoriaCAOS ha crecido como un área independiente, en la cual sistemas computarizados de rastreo o dispositivos robóticos permiten mejorar la visibilidad del campo quirúrgico e incrementan la precisión en diferentes procedimientos26.
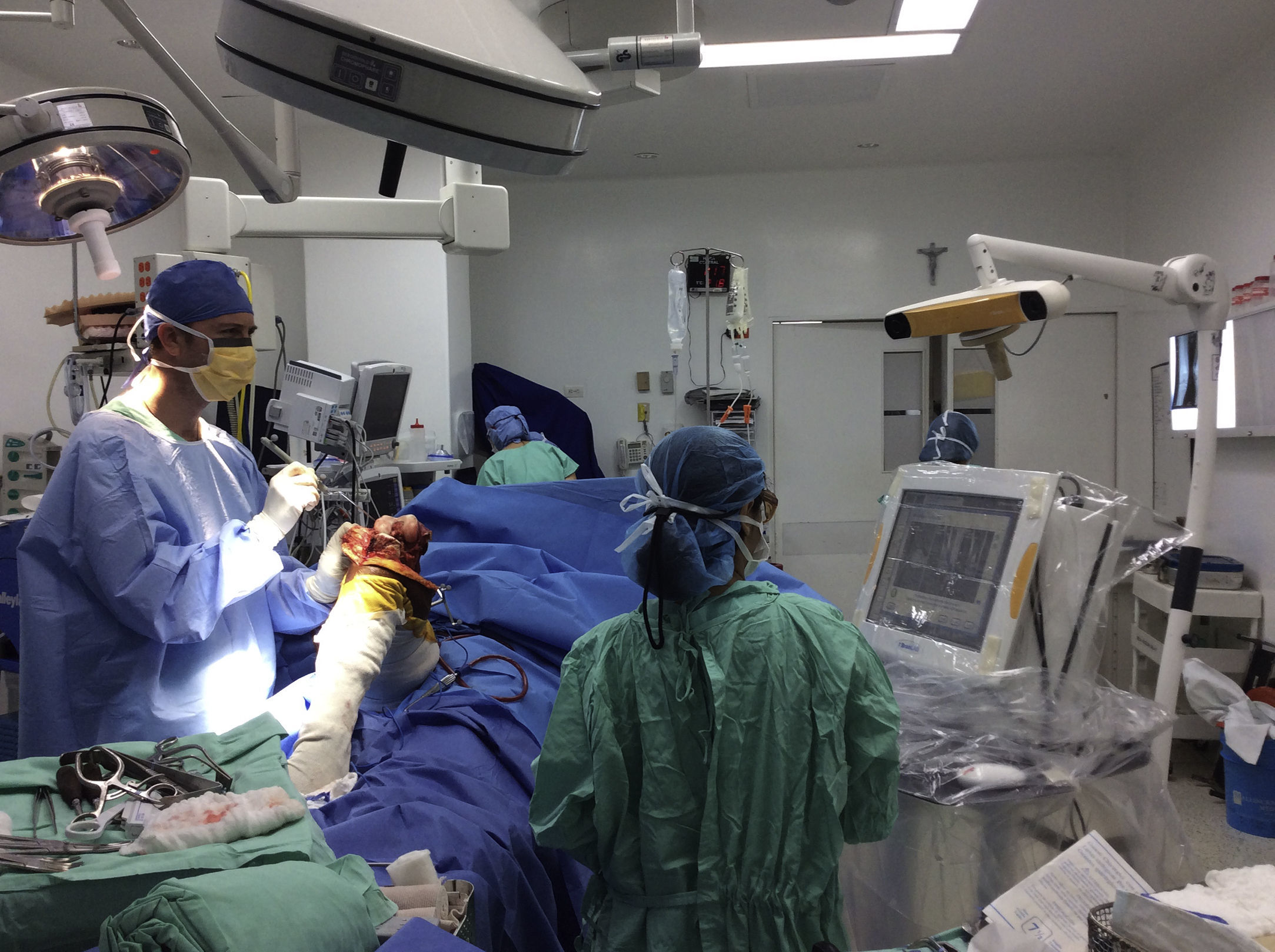
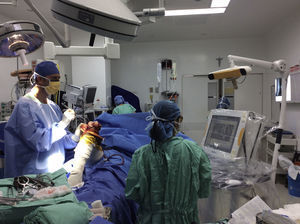
El sistema está integrado por: una cámara de infrarrojos, un monitor de visualización, una computadora que contiene el software de planeamiento 3D, donde se carga el planeamiento y las interfaces (rastreador y puntero de orientación; fig. 1).
Los dispositivos de navegación utilizan una cámara como sensor óptico para obtener información sobre la posición. A los instrumentos quirúrgicos y al hueso se les coloca una marca con diodos que emiten luz infrarroja (rastreadores o trackers) para ser reconocidos por la cámara y medir su posición en el sitio operatorio mientras contemplan los ejes X-Y-Z. El software de la computadora integra la información enviada por el registrador y el puntero con las imágenes del planeamiento preoperatorio. Este rastreo óptico es tan preciso que puede tener un error de posición inferior a 0,1mm. La posición y orientación de un puntero o de un instrumento es visible en tiempo real sobre las imágenes médicas adquiridas.
La navegación involucra tres pasos esenciales: adquisición de datos, registro y rastreo27–29.
Adquisición de datosSe adquieren las imágenes médicas (TC y RM) en formato DICOM (Digital Imaging and Communications in Medicine). Se transfieren estas imágenes al sistema de navegación donde se analizan y se puede elaborar un plan preoperatorio.
El cirujano define unos puntos de referencia en el hueso que corresponden usualmente a prominencias óseas, con un mínimo de 3 puntos visibles, tanto en el esquema en 3D como en el hueso expuesto del paciente.
RegistroEl registro de «imagen al paciente» es el proceso que le permite al cirujano ubicar la computadora espacialmente en el área quirúrgica, identificar los puntos de referencia anatómicos para el sistema y permitir enlazar las imágenes médicas con la anatomía del paciente en el sitio operatorio.
El registro manual (punto por punto) es el más utilizado, en el cual se escogen al menos de 4 a 5 puntos predefinidos en las imágenes y la anatomía del paciente, teniendo en cuenta que, cuantos más puntos se elijan, mayor precisión se obtendrá.
Otros métodos incluyen el registro semiautomático (con un fluoro-TC) o con marcas fiduciarias (sobre la piel o el hueso) para enlazar las imágenes preoperatorias y el registro automático que utiliza imágenes 3D intraquirúrgicas (TC o RM).
El error de registro es variable con los diferentes sistemas de navegación. El sistema informa que una correspondencia es aceptable cuando se encuentra entre 1 y 3mm.
RastreoEs la colocación de diodos infrarrojos sobre el hueso para referenciar su posición y compensar el movimiento durante el procedimiento quirúrgico. Tanto el puntero de orientación como el rastreador que se encuentra firme en el paciente (rastreador de referencia dinámico DBR) tienen marcadores ópticos que son reconocidos por la cámara infrarroja. La calibración del objeto efector hace referencia a la descripción de la geometría y forma de un instrumento en el sistema de coordenadas del navegador.
Planeamiento virtual preoperatorioRitacco et al. recomiendan que, para realizar un planeamiento virtual preoperatorio (PVP), es necesario recrear las estructuras anatómicas en una escala en 3D. Esta reconstrucción se realiza en 3 fases con un software específico30:
- 1.
Fase de adquisición. Se capturan las imágenes tomográficas o de la RM digitalizadas en un archivo DICOM.
- 2.
Fase de segmentación. Una vez que se han obtenido las imágenes, el objetivo es eliminar elementos que no sean útiles o puedan confundirse (p. ej., tejidos que no corresponden al hueso). En el caso de que sea necesario reconstruir el tumor, se realiza este procedimiento marcando píxel a píxel lo que el operador considere que sea tumor. Esta operación requiere ser supervisada.
- 3.
Fase de reconstrucción tridimensional. Es posterior a la segmentación de las imágenes bidimensionales. Con un algoritmo de interpolación se transforman los volúmenes bidimensionales en una estructura ósea tridimensional dentro de un escenario virtual y así se cuenta con los ejes X-Y-Z.
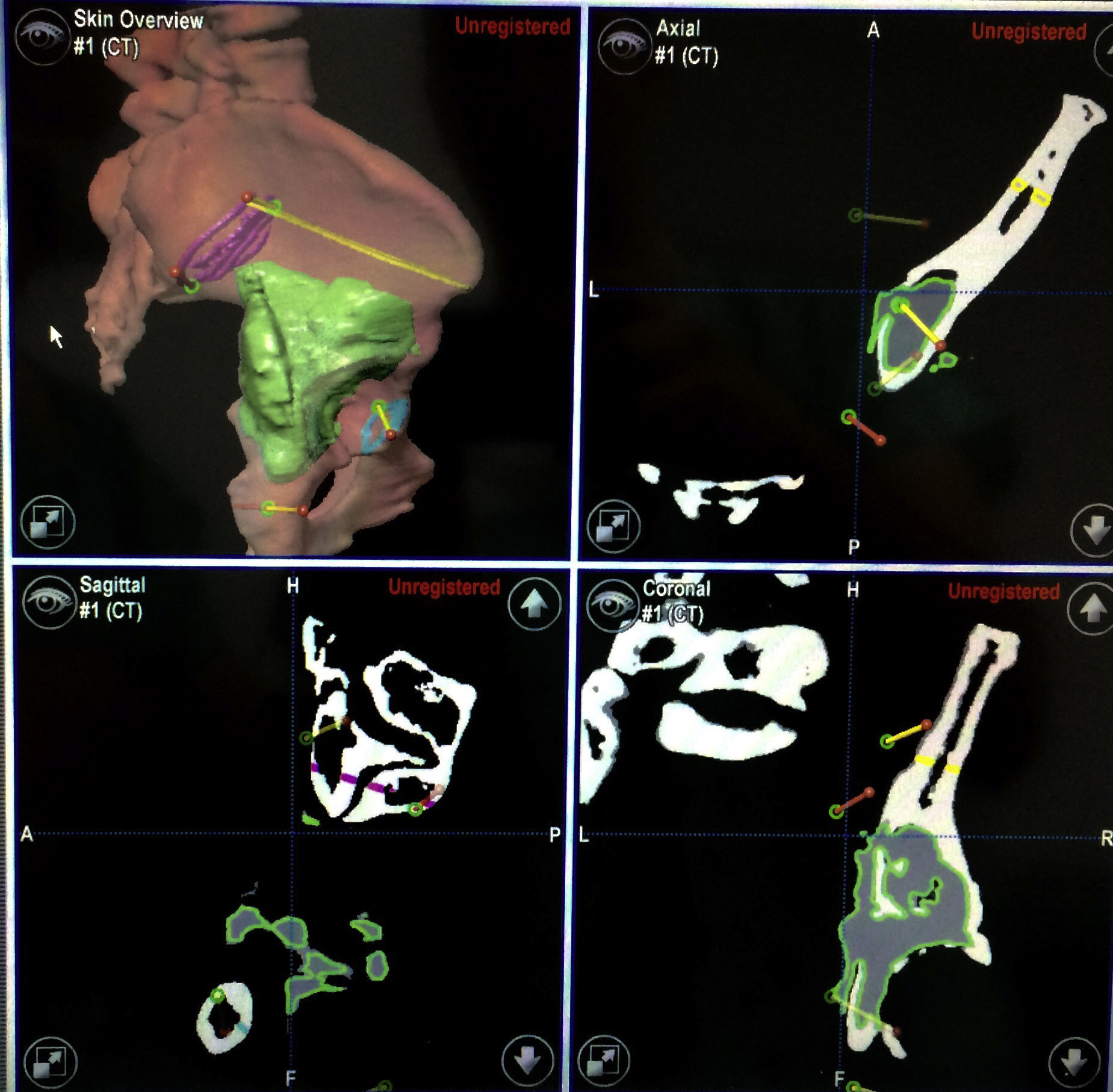
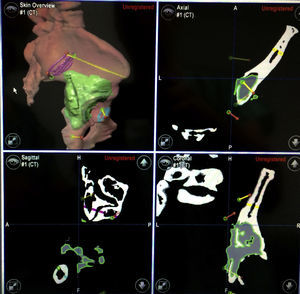
Una vez que se ha reconstruido el área anatómica de interés, se procede a realizar el PVP, se planean trayectorias, se calculan los márgenes oncológicos y planos de corte o simplemente se localiza alguna estructura de interés en una simulación virtual (fig. 2).
En las resecciones tumorales, el PVP es tan importante como la navegación intraquirúrgica. Cuanto mejor se encuentre detallado este planeamiento, mayor posibilidad de alcanzar los objetivos quirúrgicos existirá. La fusión de imágenes permite la creación de una imagen híbrida, en la cual se resaltan las mejores características de cada estudio. La extensión del tumor se puede apreciar mejor con la RM, mientras que la TC permite la visualización detallada de la anatomía ósea y la creación de un modelo en 3D.
Los sistemas de navegación también pueden fusionar imágenes funcionales (tomografía por emisión de positrones o TEP), que podrían distinguir entre tumor y tejido cicatricial en casos de recidivas tumorales o si el paciente ha recibido radioterapia.
El planeamiento también puede incluir la reconstrucción. Los ingenieros de implantes pueden utilizar la información de los planos de resección para elaborar una prótesis que reconstruya el defecto con exactitud31,32.
Aponte-Tinao et al. muestran que, a efectos de reconstrucción, al realizar una TC del aloinjerto, los planos de resección tumoral pueden ser incorporados en el PVP33. Los cortes del aloinjerto pueden ser guiados con el navegador y obtener la misma resección que en el tumor y un contacto preciso del aloinjerto con el hueso del paciente34. Otros estudios han demostrado gran utilidad del PVP para la selección y manipulación de aloinjertos35–37.
Navegación en tumores óseosIndicaciones clínicasEn general, se considera que la navegación ofrece beneficios si se quiere:
- 1.
Anticiparse a las dificultades de obtener una adecuada resección tumoral.
- 2.
Obtener un plano adecuado para acomodar una prótesis a medida.
- 3.
Dar forma a un aloinjerto que reconstruya un defecto óseo.
Las indicaciones se han ampliado (tabla 1) y en la actualidad hay trabajos que muestran su utilidad en la resección de tumores benignos con procedimientos más precisos y menos invasivos.
Indicaciones para resección de tumores óseos
| Medición de márgenes oncológicos en 3D | Orientación integrada de TC y RM que marca los márgenes de forma tridimensional |
| Localización de tumores pequeños | Evita resecar hueso sano o invadir superficies articulares |
| Control de resección tumoral que respeta estructuras nobles | Cortes sin lesionar el cartílago de crecimiento o alejarse de estructuras neurovasculares |
| Selección y preparación del aloinjerto | Realizar cortes sobre el aloinjerto con navegador |
| Orientación de implantes a medida o endoprótesis | Conservar longitud y rotaciones |
Se pueden citar las siguientes:
- 1.
El registro de imágenes está basado completamente en la anatomía ósea. Cuando se realiza una incisión y una manipulación quirúrgica, los tejidos blandos se deforman y su localización real cambia.
- 2.
Pueden ocurrir errores en el planeamiento preoperatorio y en la ejecución intraoperatoria. Cualquier mala interpretación de los datos puede provocar una resección inadecuada y afectar los resultados clínicos de forma adversa.
- 3.
Las imágenes deben ser recientes para que no exista mayor discrepancia entre el planeamiento y una progresión tumoral.
- 4.
Requiere un entrenamiento del cirujano y el equipo quirúrgico.
- 5.
No existe un método claro para evaluar la precisión de la cirugía asistida por computador.
- 6.
Exige un tiempo de preparación adicional en cirugía que varía de 24 a 28 minutos, aunque se sugiere que, al definir el plano de resección, es posible reducir el tiempo quirúrgico.
- 7.
Requiere un costo adicional, aunque se requieren estudios que investiguen la rentabilidad.
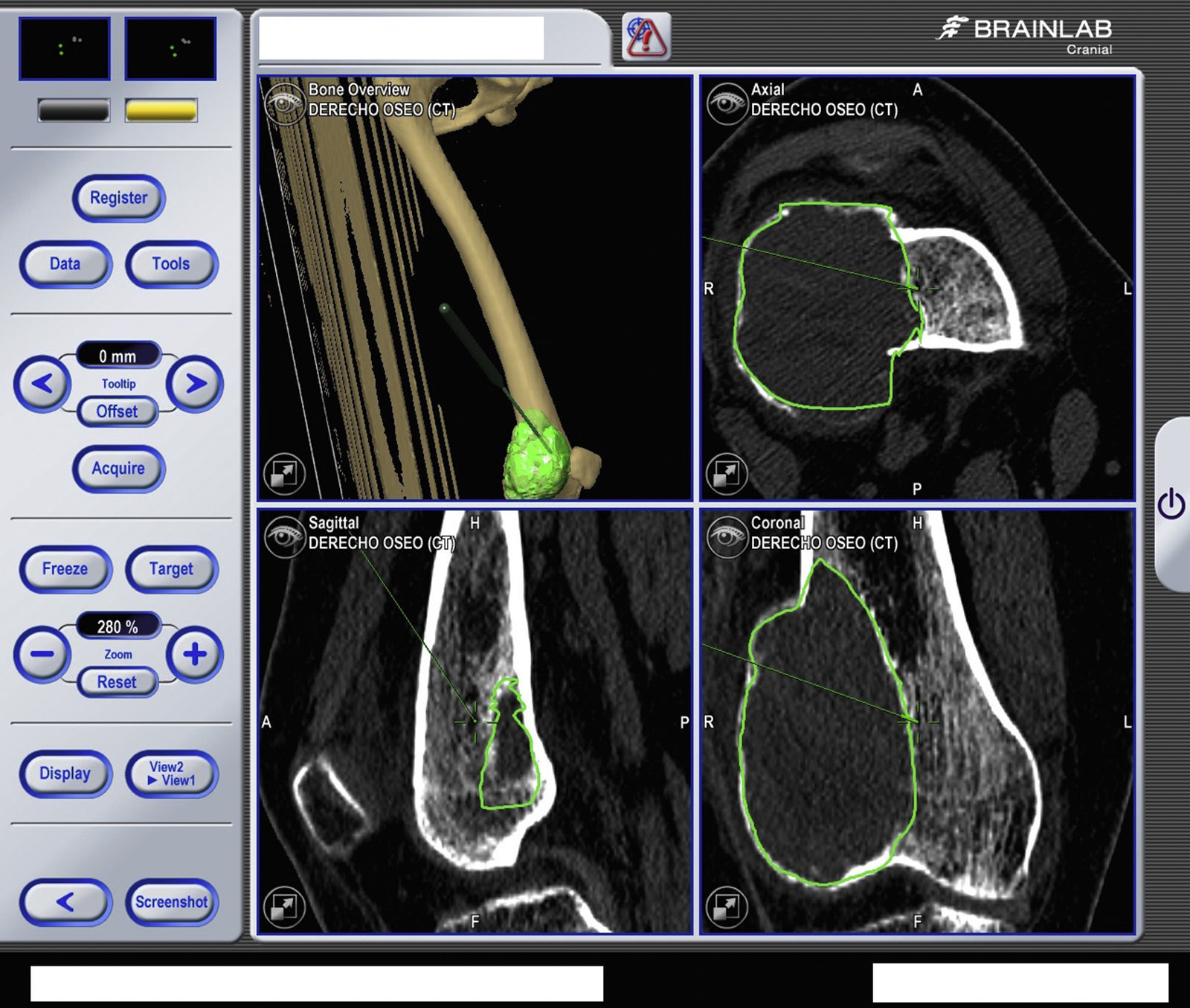
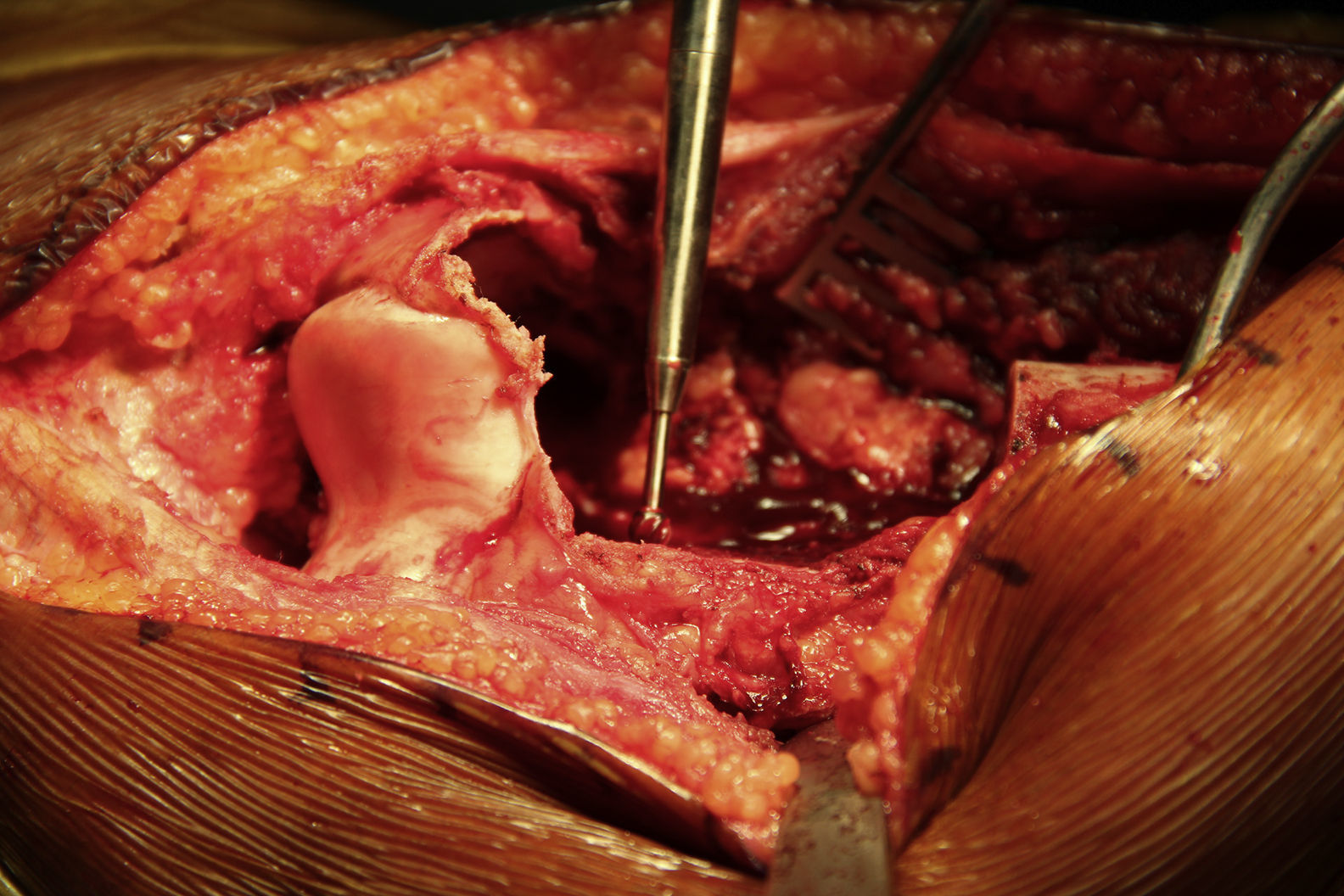
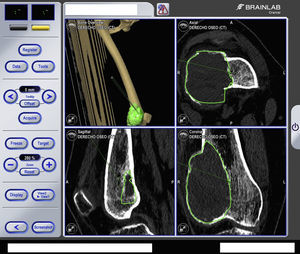
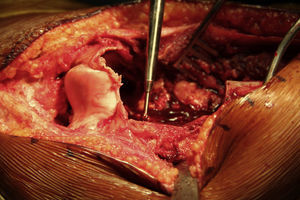
Cualquier instrumento que conste de un eje lineal y finalice en punta puede ser calibrado y rastreado en un sistema de navegación (fresa de hueso, broca u osteótomo) mientras se observa su localización y dirección en tiempo real sobre la anatomía virtual (figs. 3 y 4).
Para realizar una osteotomía, se puede marcar con el electrobisturí o con una broca sobre la superficie del hueso y posteriormente realizar el corte con el osteótomo siguiendo la orientación guiada con el navegador.
También se puede utilizar una sierra. Sin embargo, la hoja de corte puede doblarse y la vibración que produce puede hacer el corte impreciso.
En algunos casos, un instrumento útil es un osteótomo de corte ultrasónico (BoneScalpel [Misonix Inc., Farmingdale, NY, USA]), utilizado inicialmente para craneotomías y cirugía maxilofacial38,39, es un dispositivo diseñado para corte específico de hueso sin afectar a los tejidos blandos adyacentes. Está compuesto por una hoja ultrasónica que oscila a más de 22.500 ciclos/s. Los impactos pulverizan las estructuras cristalinas y permiten un corte preciso. Los tejidos blandos presentan mayor tolerancia, por lo cual no se ven afectados por la oscilación. Este instrumento es particularmente útil en resecciones en las cuales se requiera proteger estructuras nobles, como la columna, o si existe cercanía a raíces nerviosas o un paquete vascular, como en resecciones de pelvis y sacro40.
Tumores de pelvis y sacroLos tumores malignos de pelvis y sacro son un reto en ortopedia oncológica. La presentación usual con tumores de gran tamaño, la compleja anatomía del anillo pélvico y su cercanía a estructuras nobles dificultan la resección con márgenes libres, lo cual afecta el pronóstico41. La navegación en tumores de pelvis ofrece múltiples beneficios. En algunos casos puede evitarse la necesidad de amputar, la resección tiene un monitoreo intraoperatorio y su precisión en los cortes permite salvar raíces nerviosas43.
En el estudio realizado por Cho et al. y en el de Wong y Kumta se resecaron tumores en pelvis en 10 y 12 casos, respectivamente, utilizando el navegador. En todos los casos se pudieron obtener márgenes libres. Con un mínimo de 3 años de seguimiento, la tasa de recidiva local fue del 20% (2 de 10) y del 25% (3 de 12), respectivamente, lo cual mejoró si se compara con el 70% (47 de 67) de un estudio de osteosarcomas operados con la técnica tradicional44. Aunque parece que la recidiva es imposible de erradicar aun con márgenes libres, los tumores de alto grado y con márgenes cercanos en los tejidos blandos presentan peor pronóstico42,43,45.
Jeys et al. recientemente reportan la serie más grande de tumores en pelvis y sacro operados con navegación. Las resecciones intralesionales se redujeron del 29 al 8,7% en esta institución con una tasa de recidiva del 13% con un seguimiento a 13,1 meses.
Estas tres series sugieren que CATS puede ayudar a preservar las raíces nerviosas en tumores de sacro. La técnica parece segura, sin complicaciones específicas. Mejora el planeamiento quirúrgico para obtener márgenes libres sobre una anatomía compleja.
Jeys et al. describen la técnica utilizando la fusión de imágenes entre TC de alta resolución y una RM. Estudios como el TEP o la angio-TC pueden adicionarse en el planeamiento preoperatorio si son de utilidad. Las secuencias STIR de la RM fueron utilizadas, aunque el edema peritumoral puede interpretarse erróneamente y provocar más resección de lo necesario. Se cruzan con secuencias T1 para un planeamiento más preciso. Es preferible la segmentación del tumor de forma manual.
Los planos de resección pueden utilizarse para que los ingenieros diseñen un implante a medida.
Tumores de extremidadesLas indicaciones de CAOS inicialmente se enfocaron hacia los tumores de pelvis. Sin embargo, con los avances en el planeamiento y su ejecución intraquirúrgica sus indicaciones se han extendido a tumores en las extremidades. La adquisición de imágenes es similar a lo descrito previamente. Farfalli et al. recomiendan la realización del registro en forma de punto por punto sobre la superficie ósea expuesta y un afinamiento de la superficie46.
La navegación de un tumor en extremidad permite mejorar las resecciones biplanares (intercalares o transepifisarias), realizar osteotomías multiplanares con reconstrucciones con aloinjertos cortados con igual morfología que la pieza resecada, resecciones articulares que requieran reconstrucción con aloinjerto osteocondral, asistencia para colocación de endoprótesis y asistencia para realizar biopsias o raspados intralesionales en localizaciones difíciles.
Resecciones intralesionalesLas resecciones intralesionales o raspados navegados se utilizan para tumores benignos o para algunos casos de tumores malignos de bajo grado47,48. Permite a los cirujanos ganar confianza en casos que no requieran resecciones en bloque, pero además es útil para realizar abordajes menos invasivos o para localizar lesiones pequeñas49.
El tratamiento de lesiones localmente agresivas requiere un equilibrio entre el control ideal del tumor y una tasa de recidiva satisfactoria, con una morbilidad aceptable y función duradera. Los raspados intralesionales con adyuvancia o sin ella implican una mayor tasa de recidiva. La resección amplia de una lesión tiene la menor tasa de recurrencia. Sin embargo, la morbilidad del procedimiento, dado la naturaleza benigna, no lo justifica. Se espera que la cirugía asistida por computador minimice la resección innecesaria de hueso, preserve la mejor función y permita buenos resultados oncológicos y funcionales.
ConclusionesEl planeamiento virtual es una herramienta revolucionaria. Médicos e ingenieros pueden trabajar juntos para acceder a una visión más extensa de la anatomía compleja, fusionar imágenes, definir planos de corte en 3D, desarrollar instrumentos específicos del paciente y reconstruir defectos óseos con soluciones individuales.
El uso intraoperatorio del navegador basado en imágenes, como la RM o la TC, permite realizar procedimientos más avanzados, disminuir la exposición a radiaciones ionizantes del fluoroscopio en momentos necesarios como confirmar la localización de una estructura en particular, determinar la orientación y alineación, y además guiar la colocación de un implante. Los cirujanos deben reconocer la magnitud de los daños a largo plazo de la radiación con el fin de limitar su exposición50,51.
Otra de las ventajas consiste en el hecho de que su uso puede ser compartido con otras especialidades, como neurocirugía o cirugía maxilofacial, lo cual disminuye costos y aumenta la exposición del personal quirúrgico para su entrenamiento.
En el momento no existen herramientas en cirugía que permitan validar los márgenes quirúrgicos diferentes a la descripción del anatomopatólogo, la cual solo es posible obtener después de la intervención. La toma de muestras de congelación puede definir la presencia de tumor en un sitio en particular. Sin embargo, es difícil saber su localización respecto a las imágenes preoperatorias. Con el navegador es posible marcar un punto exacto en un escenario tridimensional, lo cual permitiría ajustar la resección en caso necesario. Esto definitivamente puede redefinir algunos conceptos en márgenes quirúrgicos.
Aún existen limitaciones. Los equipos se encuentran en muy pocos centros, su costo es elevado y el software para ortopedia oncológica está disponible en una sola compañía. Requiere una curva de aprendizaje y no se dispone de centros para su capacitación. Existen errores propios del sistema, el registro y la validación de datos.
El cirujano y personal presente en el quirófano debe reconocer todo el método y protocolizar un chequeo de los posibles errores para obtener un resultado óptimo.
La resección de tumores malignos en pelvis continúa siendo la mejor indicación debido a la dificultad de obtener márgenes negativos que afectan a los resultados oncológicos. Un planeamiento preoperatorio minucioso y la cirugía guiada con el navegador facilitan la resección tumoral sin alterar significativamente los tiempos quirúrgicos. Además, provee de información útil durante la resección y la reconstrucción para realizar así procedimientos más seguros y precisos.
La cirugía asistida por computador en tumores óseos está madurando con buenos resultados; hoy día logra ser uno de los puntos de mayor interés en la ortopedia oncológica y a largo plazo demostrará su verdadera utilidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo existen fuentes de financiación ni conflicto de intereses.
Desearía agradecer a Diana Rodríguez (instrumentadora quirúrgica) y a Mauricio Zuluaga y Federico Pérsico (ortopedistas), del Centro Médico Imbanaco, Cali, Colombia, su colaboración en la revisión y edición.