Determinar las frecuencias alélicas y genotípicas del gen de la apolipoproteína E (APOE) en adultos de Medellín durante el año 2010.
MétodosSe tomó una muestra representativa de la población adulta de Medellín, mediante un muestreo polietápico estratificado por conglomerados. Se realizó genotipificación para APOE a cada uno de los sujetos participantes. En el análisis de frecuencias y asociación, se tuvo en cuenta el diseño muestral.
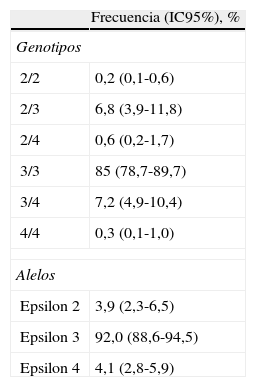
ResultadosLas frecuencias de los alelos E2, E3 y E4 de APOE fueron del 3,9, el 92,0 y el 4,1% respectivamente. Las frecuencias genotípicas fueron: 2/2, el 0,2%; 2/3, el 6,8%; 2/4, el 0,6%; 3/3, el 85,0%; 3/4, el 7,2%, y 4/4, el 0,3%.
ConclusionesLas frecuencias alélicas y genotípicas de APOE en adultos de Medellín tienen una distribución similar a las reportadas en poblaciones suramericanas, y son datos que tienen valor para conocer el impacto poblacional de estas variantes genéticas en distintos trastornos psiquiátricos.
To determine the allelic and genotype frequencies of apolipoproteine E (APOE) gene in a representative sample of the adult population of Medellin in 2010.
MethodsA representative sample of the adult population of Medellin, was obtained by means of a multi-stage, stratified, conglomerate based sampling method. APOE genotyping was carried out on each of the participants. The sampling design was taken into consideration for the frequencies and association analysis.
ResultsThe frequencies of the APOE alleles E2, E3 and E4 were 3.9, 92.0 and 4.1%, respectively. The frequencies of the different APOE genotypes were as follows: 2/2, 0.2%; 2/3, 6.8%; 2/4, 0.6%; 3/3, 85.0%; 3/4, 7.2%, and 4/4, 0.3%.
ConclusionsThe allelic and genotype frequencies of APOE in an adult population of Medellin did not differ substantially from other series reported in South America. These data are important to determine the real impact of APOE on the population risk of several psychiatric diseases.
La apolipoproteína E (ApoE) es una proteína de 299 aminoácidos, codificada por un gen en el cromosoma 19 (q13.2-q13.3)1. El gen APOE es polimórfico, con tres alelos conocidos como E2, E3 y E4 que se heredan de manera codominante. Cada uno de los padres aporta un alelo, lo cual da como resultado tres genotipos homocigóticos denominados: E2/2, E3/3, E4/4 y tres heterocigotos: E3/2, E4/2 y E4/32. El alelo E3 es el más frecuente y E2 y E4 se consideran variantes que se diferencian entre sí por una sustitución de aminoácidos de los codones 112 y 1582,3. Cada alelo codifica una proteína conocida como E2, E3 y E4. Cada isoforma se diferencia funcionalmente por su afinidad por el receptor de lipoproteínas de baja densidad (LDLR) y por las partículas lipoproteicas4. La ApoE se sintetiza principalmente en el hígado y el cerebro, su velocidad de síntesis es inversa a la absorción3 y participa en el transporte de lípidos desde el hígado a las células periféricas y en el transporte inverso desde las células a la circulación. Además, tiene un papel crucial en enriquecer de colesterol la lipoproteína de alta densidad (HDL)3.
La ApoE es la principal apolipoproteína encontrada en el sistema nervioso central (SNC) y se la ha relacionado con varias enfermedades neuropsiquiátricas. El alelo E4 es uno de los factores genéticos más firmemente asociados con el riesgo de enfermedad de Alzheimer esporádica y de progresión a esta desde un deterioro cognitivo leve5–8; por otro lado, el alelo E2 está considerado factor protector contra esa misma enfermedad9. También se ha encontrado asociación del alelo E4 con otras demencias como la frontotemporal10,11.
El gen APOE ha sido estudiado en otros trastornos mentales diferentes de las demencias, como la depresión de aparición tardía, que es 4,7 veces más frecuente en portadores del alelo E412,13, y en pacientes con trastorno bipolar se ha observado que este alelo se asocia con peor desempeño cognitivo, aparición temprana y síntomas psicóticos14,15. Además, se ha encontrado asociación entre el alelo E4 y el riesgo y la presentación clínica de esquizofrenia, particularmente una menor edad de inicio, pero los resultados han sido contradictorios16–19.
Con respecto a trastornos no psiquiátricos, los portadores de un alelo E4 tienen una respuesta peor al tratamiento después de traumatismo craneoencefálico y mayor depósito cerebral de betaamiloide20,21. Más aún, se ha reportado que los portadores del alelo E2 tienen mayor riesgo de expansión del hematoma cuando hay hemorragia intracerebral22. Además, el polimorfismo en APOE puede ser la causa de entre el 2 y el 11% de la variación total del colesterol en sangre23. El efecto de este gen en el colesterol no se ha visto que cambie significativamente entre diferentes poblaciones24 y se considera que está involucrado en el desarrollo de la enfermedad cardiovascular mediante mecanismos relacionados con la agregación plaquetaria y el transporte inverso de colesterol25,26. La asociación entre APOE y aumento del riesgo de enfermedad cardiovascular puede deberse a causación inversa; es decir, que la enfermedad en sí produzca cambios en las lipoproteínas o que la ApoE tenga otras funciones diferentes del transporte de lipoproteínas27. No obstante, la distribución geográfica de los alelos para la ApoE puede ser un predictor estadísticamente significativo de la variación en el promedio de las concentraciones de colesterol y la tasa de mortalidad cardiovascular28,29.
Ya que el alelo E4 del gen APOE es un factor de riesgo de diversos trastornos claramentemente demostrado, es importante saber qué impacto tiene en la incidencia poblacional de estos. Para ello es necesario conocer las prevalencias de los alelos y genotipos de APOE en población general. Se han realizado estudios en diversos lugares del mundo que han mostrado que las frecuencias de alelos y diferentes genotipos varían mucho entre poblaciones. Por ejemplo, en Líbano la frecuencia del genotipo E3/3 de APOE fue del 68,7%, con frecuencias alélicas de E3 del 84%, de E2 del 7,2% y de E4 del 8,8%30. El E2 se reportó ausente en una población de 165 sujetos de Arabia Saudí, que son semejantes a los libaneses en sus ancestros31. Resultados concordantes en cuanto a la ausencia del E2 se han publicado para tribus indígenas americanas como los Bari y Yucpa en Venezuela y Mazateca en México32,33. En otras poblaciones suramericanas, como la brasileña, se han reportado frecuencias alélicas de APOE semejantes a las de población caucásica de países occidentales. Por ejemplo, el alelo E3 se encontró con una frecuencia de 80%; el E2, del 6,5%, y el E4, del 13,5%34. En Colombia, ya se han realizado varios estudios sobre el tema. Uno en sujetos amerindios y afrocolombianos, que incluyó aproximadamente a 30 individuos de 17 poblaciones para un total de 532. Se observó que en todas las poblaciones el alelo más común era el E3; en las comunidades negras de Cauca y Quibdó, el alelo E2 tenía una prevalencia inusualmente alta (20%), pero en los indígenas estaba ausente (excepto los Tule); además el alelo E4 se presentaba en el 37% de los Nukak y el 41,1% de los Coreguaje35. Hay otros dos estudios, realizados en niños: uno con 691 escolares de la región centro-oriental (Cundinamarca, Boyacá, Meta, Santander y Norte de Santander), que mostró prevalencias de E3 del 86%, de E2 del 4% y de E4 del 8%, y otro con 500 niños del Quindío, que obtuvo frecuencias de los alelos E3, E2 y E4 del 91,6, el 5,3 y el 3,1% respectivamente36,37. Forero et al38 reportaron en adultos bogotanos de 18–65 años frecuencias de E3, E2 y E4 del 85,6, el 5,5 y el 8,9%, y en adultos mayores de 65 años, cifras similares: el 86,8, el 3,9 y el 9,3%. Sin embargo, en este estudio las muestras se tomaron por conveniencia de estudiantes universitarios y sujetos no dementes que participaron en estudios de deterioro cognitivo y alta longevidad, por lo que podrían no ser representativos de la población de Bogotá. No tenemos conocimiento de un estudio realizado en una muestra representativa de población adulta en Colombia que permita una estimación no sesgada de la prevalencia de las variantes genéticas de APOE. Además, dadas las variaciones que se han visto en subpoblaciones colombianas, sería útil tener datos de frecuencias alélicas y genotípicas en población antioqueña, la cual tiene grado de homogeneidad debido a un efecto fundador y aislamiento geográfico durante la mayor parte de su expansión39. Por consiguiente, se realizó la presente investigación, que tuvo como objetivo establecer la prevalencia de los diferentes genotipos y alelos del gen APOE en la población general adulta del área urbana de Medellín, Antioquia, Colombia.
Materiales y métodosEste es un estudio de corte transversal realizado en población general adulta de Medellín. Antes de cualquier procedimiento, el protocolo de investigación y el consentimiento informado fueron aprobados por los Comités de Ética e Investigaciones de la Facultad de Medicina de la Universidad de Antioquia y el Hospital Universitario San Vicente Fundación.
ParticipantesSe tomó como población de referencia para el estudio a todas las personas mayores de 18 años que vivían en la zona urbana de la ciudad de Medellín, exceptuando los corregimientos, en 2010.
Se calculó un tamaño de muestra para el estudio de la proporción de genotipos en la población empleando una proporción del 50% para garantizar un máximo tamaño de muestra, una confianza en la estimación del 95%, un error máximo permisible del 3% y un efecto de diseño del 1,5 (razón entre el error estándar del diseño empleado y el obtenido tratando la muestra como simple aleatoria). El tamaño de muestra calculado fue 1.267 sujetos y se adicionó un 10% por posibles pérdidas, lo que hizo un total de 1.393.
Se hizo un muestreo polietápico estratificado por conglomerados. Se estratificó por nivel socioeconómico y los conglomerados fueron las comunas, manzanas y casas. Finalmente, se escogió aleatoriamente a personas adultas que fueron la unidad de análisis final.
Para seleccionar las manzanas de donde se escogieron las viviendas y en estas las personas mayores de 18 años, se estableció un cociente entre el número de viviendas en cada estrato socioeconómico y el gran total, y cada uno de estos porcentajes se multiplicó por el número total de adultos mayores de 18 años que se requería seleccionar. Así se obtuvo el número de personas a las que se encuestaría en cada estrato. Se tomó como criterio estadístico a 5 personas de cada manzana, bajo la presunción de distribución similar de los adultos mayores de 18 en cada una. De esta forma, se estableció una estimación del total de manzanas que era necesario elegir en general y en cada estrato. Dado que se seleccionaron las manzanas de acuerdo con su volumen en cada estrato socioeconómico, se tomó la información que da cuenta de dichos volúmenes del Departamento Administrativo de Planeación Municipal y Secretaría de hacienda Municipal del año 2002, porque no se logró obtener información más reciente. Asimismo se utilizó el listado de manzanas de la Oficina de Catastro Municipal como marco de muestreo. Una vez hecha la distribución aleatoria del número de manzanas a elegir en cada comuna por estrato socioeconómico, se procedió a su selección aleatoria; para ello se utilizó un muestreo sistemático, ordenando las manzanas por la comuna a la cual están asignadas y luego utilizando un salto de muestreo (cociente del número de manzanas existentes y número de manzanas a seleccionar en el estrato socioeconómico específico). Las manzanas seleccionadas se ubicaron en un mapa que las georreferenciaba en la ciudad de Medellín. Para la selección de las viviendas, se fue a cada una de las manzanas escogidas previamente y allí se hizo, de nuevo, un muestreo sistemático de modo que la primera vivienda fuera seleccionada; luego se calculó el salto de muestreo (cociente entre el número de viviendas en la manzana y 5), y se procedió a escoger la vivienda. Se excluyeron de la muestra de viviendas los edificios correspondientes a instituciones tales como cuarteles, colegios o similares, por sus características especiales que los apartan de la definición de vivienda familiar. En cada vivienda se hizo un listado de los que allí residían y tuvieran más de 18 años, y se escogió de forma aleatoria simple a la persona a la que se invitaría a participar en el estudio.
ProcedimientosUna vez identificada la vivienda, en la víspera de la visita se dejaban bajo las puertas volantes en los cuales se les informaba acerca del estudio. Al día siguiente se hacía una visita en la cual se seleccionaba a la persona que iba a ser invitada a participar en el estudio y se hacía el procedimiento de lectura y firma del consentimiento informado. Si la persona seleccionada de la lista de residentes en la vivienda no se encontraba allí, se acordaba con ellos una nueva visita.
Después de leer y firmar el consentimiento informado, a todos los participantes se les hizo un breve cuestionario sobre información sociodemográfica y de antecedentes médicos y se tomo una muestra de 10 ml de sangre.
Procedimientos de laboratorioExtracción de ADN: se tomaron medidas de cuidado biológico para la manipulación de las muestras, que consisten de 10 ml de sangre periférica en tubos con EDTA. Estas se almacenaron a 4°C. La extracción de ADN se hizo utilizando protocolos estándar de fenol-cloroformo. El ADN extraído se resuspendió en buffer Tris EDTA, se prepararon alícuotas de trabajo y se almacenaron a –20°C.
Genotipificación de polimorfismos en APOE: el gen APOE se tipificó usando PCR como describieron Hixson et al40. Un fragmento del exón 4 del gen APOE se amplificó utilizando los cebadores con las siguientes secuencias: 5’- ACAGAATTCGCCCCGGCCTGGTA-3’ y 5’- TCCAAGGAGCTGCAGGCGGCGC-3’. La PCR se llevó a cabo en un volumen total de 25 μl y se utilizaron 0,5 U de Taq polimerasa, un buffer para PCR sin magnesio que contenía 200 mM de tris-HCl, pH 8,4 y 500 mM de KCl, 1 mM de MgCl2, un 10% de dimetilsulfóxido y una mezcla de nucleótidos que contuvieran 0,2 mM de cada uno dNTPs pH 7, 0,5 mM de cada primer y 100 ng de ADN y se ajustó al volumen de 25 μl de agua doblemente destilada. Se realizaron 40 ciclos de amplificación a 94 1 min, 64°C 1 min y 72°C 1 min; finalmente, un paso adicional de elongación de los productos de amplificación a 72°C 10 min. El producto de amplificación se digirió mediante 0,33 U/μl de la endonucleasa de restricción HhaI (Fermentas), que reconoce la secuencia GCGC. El ADN amplificado se cortó en todos los sitios que contuvieran esta secuencia. El número de fragmentos cortados permitió la genotipificación del APOE. Por ejemplo, dos fragmentos invariables de 16 y 18 pb son comunes para todas las isoformas. El alelo 3 tiene otras tres secuencias GCGC que se digieren y producen fragmentos de 33, 48 y 91 pb. El alelo 2 fue cortado en cuatro sitios y se produjeron fragmentos de 91, 81, 18 y 16 pb. El alelo 4 contiene seis secuencias GCGC. Los fragmentos que se produjeron fueron de 16, 18, 19, 34, 48 y 42 pb. La resolución de los genotipos se realizó mediante una electroforesis en gel de poliacrilamida al 18% teñido con bromuro de etidio.
Control de calidad de la genotipificación: en cada gel se incluyó a los individuos con genotipos conocidos para descartar digestiones parciales. Se tomó registro fotográfico de cada gel para realizar una segunda lectura independiente. En caso de discrepancia entre lecturas, el genotipo se repitió desde la amplificación hasta que hubiera consenso. Se repitió el 5% de los genotipos al azar para evaluar la concordancia entre experimentos. Tal procedimiento se repitió hasta obtener una reproducibilidad al menos del 95%.
Procesamiento de los datos y análisis estadísticoSe evaluó el equilibrio de Hardy-Weinberg para APOE utilizando el programa ARLEQUIN versión 3.01.
Para la generación de estimaciones no sesgadas de las prevalencias, se analizaron los datos con el módulo para muestras complejas del programa estadístico SPSS versión 18,0, teniendo en cuenta el factor básico de expansión que es el recíproco de la probabilidad final de selección de las personas, la cual es el producto de las probabilidades de selección de cada etapa del muestreo. Las ponderaciones se multiplicaron entre sí, y el factor resultante se normalizó en función del tamaño de la muestra obtenida, lo que dio lugar a la ponderación final. Se calcularon promedios con sus respectivos intervalos de confianza del 95% (IC95%) para la variable edad y frecuencia y porcentajes para las variables sexo, alelos y genotipos de APOE.
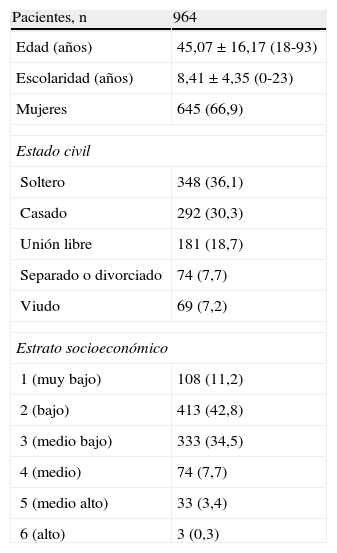
ResultadosLas frecuencias genotípicas de APOE estuvieron en equilibrio de Hardy-Weinberg (p>0,05). De los 1.393 sujetos invitados a participar en el estudio, únicamente aceptaron 964 (69,20%), y hubo una alta frecuencia de rechazo en los estratos socioeconómicos 4 (medio), 5 (medio-alto) y 6 (alto). Las características sociodemográficas de los sujetos se pueden ver en la tabla 1. La muestra estuvo constituida en un 66,9% por mujeres, lo cual es diferente de los reportes de los censos de la ciudad. Debido al sesgo que esto pudiera generar, se hizo corrección por sexo para el análisis teniendo en cuenta las distribuciones reportadas por el DANE del último censo.
Características demográficas y antecedentes clínicos de los adultos de población general de estratos bajos y medios-bajos de la ciudad de Medellín, 2010
| Pacientes, n | 964 |
| Edad (años) | 45,07 ± 16,17 (18-93) |
| Escolaridad (años) | 8,41 ± 4,35 (0-23) |
| Mujeres | 645 (66,9) |
| Estado civil | |
| Soltero | 348 (36,1) |
| Casado | 292 (30,3) |
| Unión libre | 181 (18,7) |
| Separado o divorciado | 74 (7,7) |
| Viudo | 69 (7,2) |
| Estrato socioeconómico | |
| 1 (muy bajo) | 108 (11,2) |
| 2 (bajo) | 413 (42,8) |
| 3 (medio bajo) | 333 (34,5) |
| 4 (medio) | 74 (7,7) |
| 5 (medio alto) | 33 (3,4) |
| 6 (alto) | 3 (0,3) |
Los valores expresan n (%) o media ± desviación estándar (intervalo).
El alelo E3 fue el encontrado con mayor frecuencia en la población (92%; IC95%, 88,6%-94,5%), y los alelos E2 y E4 tuvieron una prevalencia similar entre sí. Los genotipos más frecuentes fueron E3/3, 3/4 y 2/3 (tabla 2).
Frecuencias de los genotipos y alelos del gen APOE en los adultos de población general de Medellín, 2010
| Frecuencia (IC95%), % | |
| Genotipos | |
| 2/2 | 0,2 (0,1-0,6) |
| 2/3 | 6,8 (3,9-11,8) |
| 2/4 | 0,6 (0,2-1,7) |
| 3/3 | 85 (78,7-89,7) |
| 3/4 | 7,2 (4,9-10,4) |
| 4/4 | 0,3 (0,1-1,0) |
| Alelos | |
| Epsilon 2 | 3,9 (2,3-6,5) |
| Epsilon 3 | 92,0 (88,6-94,5) |
| Epsilon 4 | 4,1 (2,8-5,9) |
En el presente estudio se describe la prevalencia de alelos y genotipos de APOE en población general adulta de Medellín. Como en muchas de las poblaciones del mundo, el genotipo E3/3 fue el más prevalente, seguido por el E3/4. La prevalencia del alelo E2 fue del 3,9%, muy semejante a la del E4 y ligeramente más baja que la encontrada en 500 niños de la región central del país (5,3%)24. La frecuencia del E2 reportada en el estudio que incluyó a niños de la región centro-oriental (4%) y el de adultos de la región nororiental de Colombia no difieren de la reportada en este estudio36,38. No obstante, la frecuencia de este alelo es inferior a la reportada en poblaciones europeas (hasta el 10% de los controles sanos)41.
Se ha mostrado que la frecuencia del alelo E2 es muy baja o ausente en la población mestiza centroamericana y suramericana de ascendencia Maya y Mazateca, al igual que en algunas tribus indígenas como los Bari y los Yucpa en Venezuela19,42. En Perú, la frecuencia del alelo E2 en voluntarios aparentemente sanos fue del 1,1%43. En Colombia, dada la mezcla racial, la frecuencia de este alelo ocupa un lugar intermedio entre las poblaciones aborígenes de Centroamérica y Suramérica y la población caucásica europea.
Callas et al encontraron frecuencias alélicas muy semejantes a las presentadas en este estudio; en 691 niños de la región nororiental del país, el alelo E3 se presentó con una frecuencia del 86% y los alelos E4 y E2 se presentaron con frecuencias del 8 y el 4% respectivamente36. Forero et al38, en su estudio de adultos de Bogotá, reportaron frecuencias semejantes para E3, pero para el alelo E4 la frecuencia fue del 8,9%, más del doble de la encontrada en el presente estudio. Esta menor frecuencia para el alelo E4 puede ser el reflejo de la diferencia en la composición ancestral de la población de Medellín en comparación con la de Cundinamarca, Boyacá, Santanderes y Meta, donde la proporción de mezcla amerindia es más prevalente que en Antioquia39.
Estudios en comunidades amerindias colombianas han mostrado una frecuencia elevada del alelo E4 (18,1%) de APOE35. De manera similar, frecuencias altas de E4 se han reportado en Brasil, México y Venezuela y se ha postulado que este alelo es más frecuente en personas con más melanina en la piel34,44–46.
En Papúa-Nueva Guinea y ciertas tribus africanas, el E4 es más frecuente incluso que el E346. En Europa, se han reportado frecuencias diferenciales para E4 entre el sur y el norte. En el sur de Europa la frecuencia de este alelo alcanza el 15%, y en el norte puede ser tan alta como el 50%46. Una explicación para este fenómeno es la migración hacia Europa de tribus agricultoras provenientes del Oriente medio46. Otra posible explicación para la frecuencia diferencial de los alelos de APOE en Europa es que los poseedores de un E4 son más resistentes a la deficiencia de vitamina D, y la mayor frecuencia de este alelo podría entenderse como una ventaja evolutiva entre los habitantes del norte de Europa, que son países con menos horas de sol al año46. Las frecuencias alélicas para APOE varían entre diferentes grupos poblacionales, y se ha mostrado que la latitud donde está situado el país tiene más influencia en estas diferencias42.
La principal fortaleza de este estudio es que se basó en una muestra representativa de la población adulta de Medellín y que en sus resultados se tuvo en cuenta el diseño muestral, lo que podría dar una estimación más válida de la prevalencia de los alelos y genotipos. Al tener estos datos, podría calcularse el porcentaje de riesgo atribuible poblacional (PRAP) para trastornos en los que se ha demostrado que el gen APOE tiene un papel en la susceptibilidad. Por ejemplo, si en estudios con población colombiana se ha observado que los portadores del alelo E4 tienen 5,1 veces el riesgo de enfermedad de Alzheimer47, el PRAP sería de 14,4%, calculado con la fórmula PRAP = b (odds ratio [OR] – 1)/[b (OR – 1) + 1], donde b es la frecuencia de la exposición en la población, que corresponde a la prevalencia del alelo E4. El PRAP se interpretaría así: el alelo E4 explica el 14,4% del riesgo de enfermedad de Alzheimer en adultos de Medellín.
Una limitación de este estudio es la baja tasa de respuesta, especialmente en estratos socioeconómicos altos, lo que podría sesgar los resultados. Por esta razón, estas estimaciones podrían ser más generalizables a los adultos de niveles socioeconómicos bajos y medio-bajos. Es posible que las diferencias en prevalencias sean de muy pequeña magnitud entre distintos estratos, pero también se ha reportado que entre estos hay variaciones en el origen étnico amerindio, lo cual podría tener alguna influencia en las frecuencias alélicas y genotípicas de APOE48.
ConclusionesLas frecuencias alélicas y genotípicas de APOE en adultos de Medellín tienen una distribución similar a otras reportadas en Suramérica. Los datos sobre estas frecuencias son valiosos para establecer el impacto en población general de las variantes genéticas de APOE sobre enfermedad de Alzheimer y otros trastornos en los que aún se está estudiando su papel etiológico y las manifestaciones clínicas, tales como los depresivos en ancianos, esquizofrenia y trastorno bipolar.
FinanciaciónEste artículo fue financiado por la Facultad de Medicina de la Universidad de Antioquia (código: 2476) y parcialmente por la Estrategia de Sostenibilidad 2013-2014 de la Universidad de Antioquia dada al Grupo Académico en Epidemiología Clínica (GRAEPIC).
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés.
Agradecemos al Prof. Hugo Grisales, de la Facultad de Salud Pública, por el diseño muestral de la presente investigación, a Manuel José Castilla por su contribución a la genotipificación, a Lisandra Arango García por su labor de recolección de información y toma de muestras y a Dayana Naranjo por la elaboración de la base de datos y el trabajo de laboratorio.