Describimos el caso de un paciente masculino de 41 años que cursa con cuadro clínico de dolor torácico, astenia y adinamia, con estudios imagenológicos que evidencian masa en mediastino anterior que corresponde a timoma, de acuerdo con el reporte de patología. Además cursa con anemia hemolítica e hipotiroidismo autoinmune, sin miastenia gravis asociada.
The case is presented of a 41 year-old male patient with chest pain, asthenia and adynamia. The imaging studies showed a mass in the anterior mediastinum, which according to the pathology report, was a thymoma. Also, the patient also had haemolytic anaemia and autoimmune hypothyroidism, and with no associated myasthenia gravis.
El timoma es una neoplasia poco frecuente con una incidencia de 1 a 5 casos por cada millón de personas/año, se presenta en todas las edades, con un pico de incidencia entre los 55 y 65 años1.
La aproximación diagnóstica inicial de timoma se realiza por medio de tomografía axial contrastada de tórax, sin embargo, la resección quirúrgica y el estudio patológico es la herramienta diagnóstica más importante y adicionalmente es el tratamiento de elección, sobre todo en los estadios III y IV. En el caso de tumor irresecable se puede emplear quimioterapia coadyuvante con ciclofosfamida, doxorrubicina y cisplatino1.
Asociadas al cuadro neoplásico pueden coexistir otras entidades patológicas, las cuales se denominan síndrome paratímico, tales como miastenia gravis, aplasia medular, hipogammaglobulinemia, entre otras2.
Como se evidencia en los reportes de caso y en los artículos de revisión de la literatura, la asociación entre el timoma, anemia hemolítica, hipotiroidismo autoinmune y lupus like es bastante infrecuente como síndrome paratímico, a diferencia de la asociación entre timoma y miastenia gravis que es la asociación entre este tumor y enfermedad autoinmune más común y mejor estudiada3–9.
La anemia hemolítica autoinmune se define como la destrucción de eritrocitos secundaria a la presencia de anticuerpos dirigidos contra antígenos de membrana eritrocitaria. Tiene una incidencia de 0,61 a 1,3 por cada 100.000 habitantes por año. La primera aproximación diagnóstica se realiza con hemograma con evidencia de descenso en las cifras de hemoglobina y hematocrito, que generalmente se caracteriza por ser una anemia de volúmenes corpusculares normales, elevación de deshidrogenasa láctica (asociada a mayor severidad de la hemólisis), descenso de haptoglobina, conteo de reticulocitos elevados, presencia test de Coombs directo positivo (que indica etiología autoinmune de la anemia), presencia de anticuerpos calientes o fríos (inmumoglobulina G e inmunoglobulina M, respectivamente). Finalmente, el estudio se basa en la búsqueda de la etiología, causa primaria (idiopática) o secundaria (neoplasias, enfermedades del colágeno o farmacológicas)10,11.
El hipotiroidismo autoinmune o tiroiditis de Hashimoto es una inflamación crónica de la glándula tiroides asociada a un componente autoinmune, siendo la enfermedad autoinmune más frecuente. Los anticuerpos antiperoxidasa son el mejor marcador serológico para el diagnóstico, encontrándose positivo en el 95% de los pacientes, mientras que los anticuerpos antitiroglobulina presentan menor sensibilidad (60-80%) y especificidad que los mencionados anteriormente12.
El lupus like o imitadores del lupus se refieren a un grupo de entidades con características clínicas y paraclínicas, incluyendo el perfil de autoanticuerpos, semejantes a los descritos en los pacientes con lupus eritematoso sistémico (LES)13.
A continuación se presenta el reporte de caso de un paciente con timoma, anemia hemolítica, hipotiroidismo autoinmune y lupus like como síndrome paratímico, con resolución de la anemia hemolítica y negatividad de anticuerpos antinucleares (ANA) posterior a la resección quirúrgica de la neoplasia a nivel mediastinal.
Presentación de casoPaciente masculino de 41 años, quien consultó por cuadro clínico de 8 días de evolución consistente en dolor epigástrico tipo picada, asociado a astenia y adinamia, sin fiebre, ni otra sintomatología. Tiene antecedente de hipotiroidismo de difícil manejo en suplencia hormonal y antecedente familiar de LES y artritis reumatoide. Al examen físico el paciente se encontraba taquicárdico, con palidez mucocutánea. El resto del examen físico no presentó hallazgos relevantes.
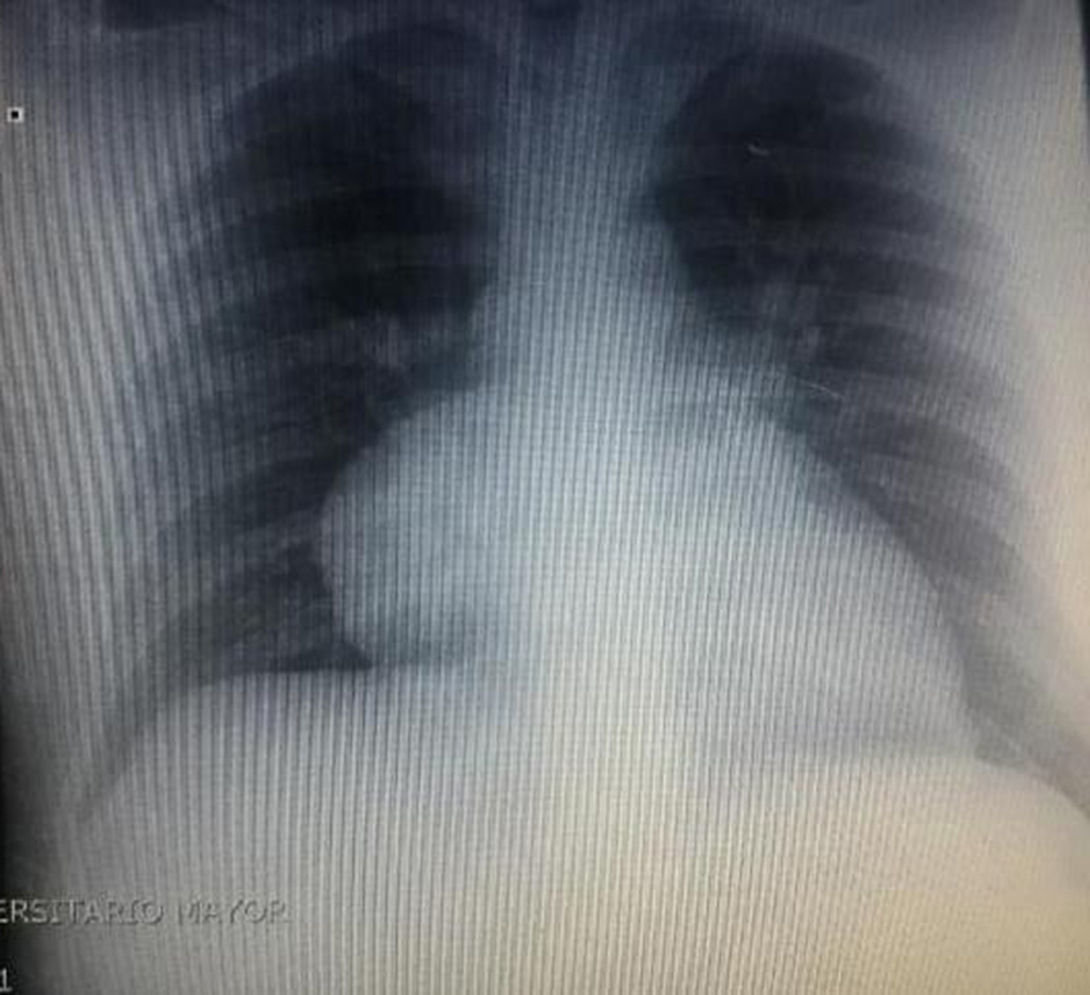
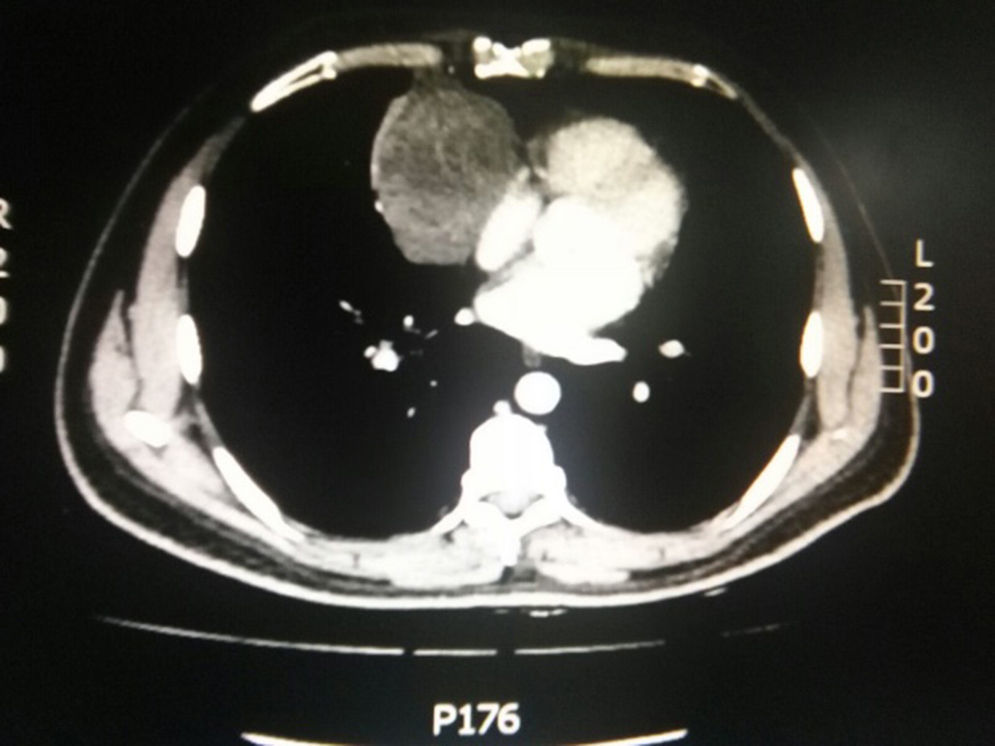
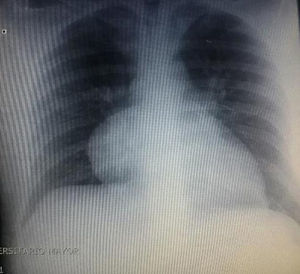
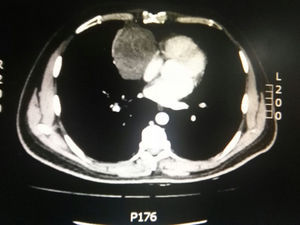
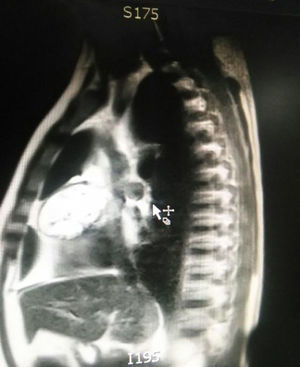
Durante la hospitalización el hemograma inicial muestra bicitopenia (leucocitos 2.660 cel/mm3, hemoglobina 7,1g/dl, VCM 97,7 fL), perfil hepático con hiperbilirrubinemia a expensas de la indirecta (bilirrubina total: 2,5mg/dl, bilirrubina indirecta 1,54mg/dl), test de Coombs positivo, con conteo corregido de reticulocitos elevado (19,43%) y lactato deshidrogenasa elevada 352 UI/l; por lo que se considera cuadro de anemia hemolítica autoinmune, requiriendo dosis de esteroide sistémico. Adicionalmente, la radiografía de tórax (fig. 1) evidencia ensanchamiento mediastinal, por lo cual se solicita TAC de tórax (fig. 2) con hallazgo de masa en el ángulo cardiofrénico derecho, sólida, de contornos lisos que sugiere infiltración de pericardio y diámetros mayores de 70 x 65 x 64mm, compatible con timoma, sin poder descartar linfoma. Dado el hallazgo de bicitopenia y masa que podrían corresponder a linfoma, se realiza aspirado de médula ósea que es informado como hipercelularidad con hematopoyesis de las tres líneas, hiperplasia eritroide con cambio megaloblástico y estudio negativo para infiltración neoplásica.
Se decide, posteriormente, realizar biopsia trucut de la masa mediastinal que documenta células ovoides entremezcladas con linfocitos pequeños, con estudios de inmunohistoquímica positivas para CKAE1AE3, con población linfoide de fenotipo T inmunorreactiva para CD5, sin inmunorreactividad para CD20, con ki67 que muestra proliferación celular en la población linfoide, cuyos hallazgos corresponden a una lesión con componente epitelial y linfoide T, que dada la localización es compatible con timoma.
Adicionalmente, dado que el paciente presenta hipotiroidismo de difícil manejo, con TSH elevada (16,6 mUI/l) y antecedentes familiares de enfermedades autoinmunes, se consideró que podrían también estar presentes este tipo de patologías. Se solicitan ANA, los cuales son positivos en 1/360 diluciones con patrón homogéneo, anticuerpos antitiroideos mayores a 400 UI/ml (positivos) y anticuerpos microsomales tiroideos mayores a 600 UI/ml (positivos) que permiten realizar el diagnóstico de hipotiroidismo de etiología autoinmune y lupus like.
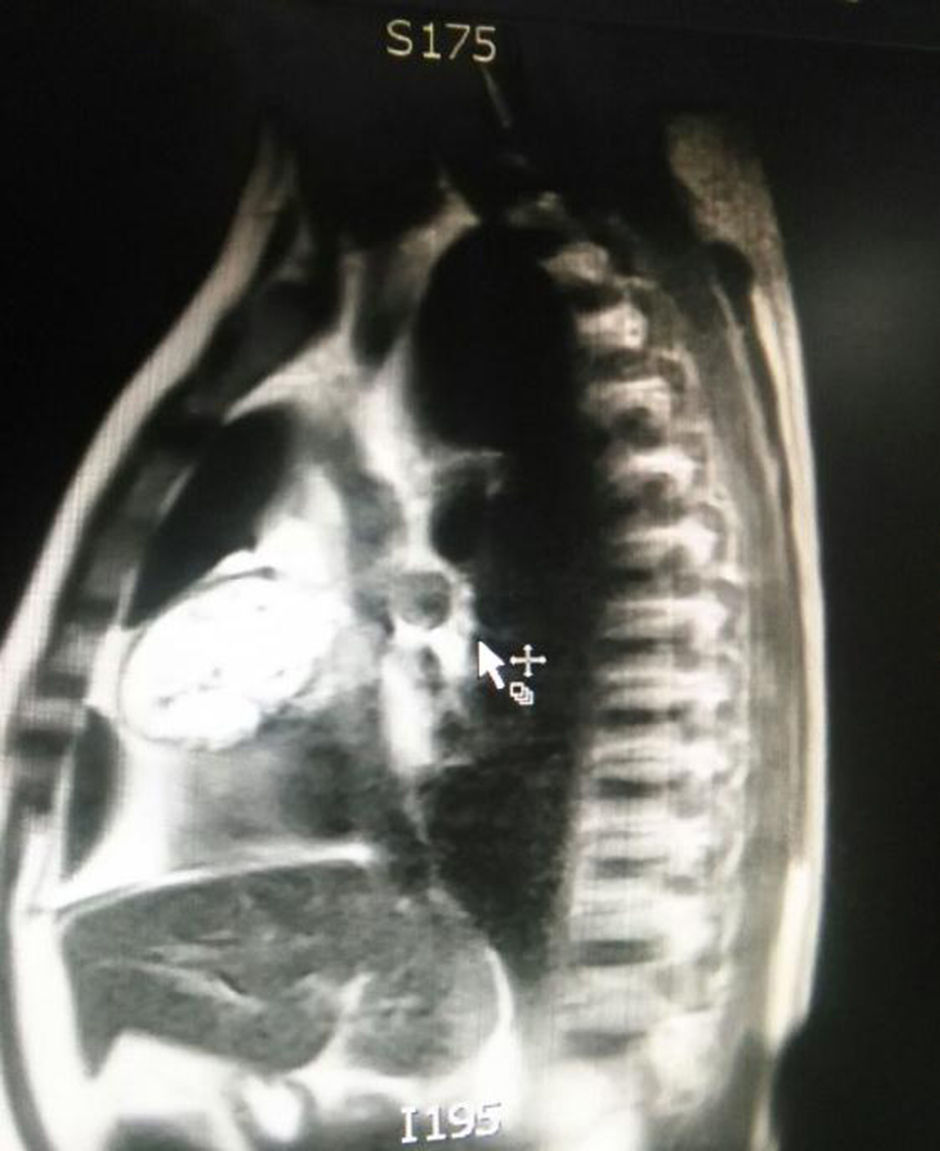
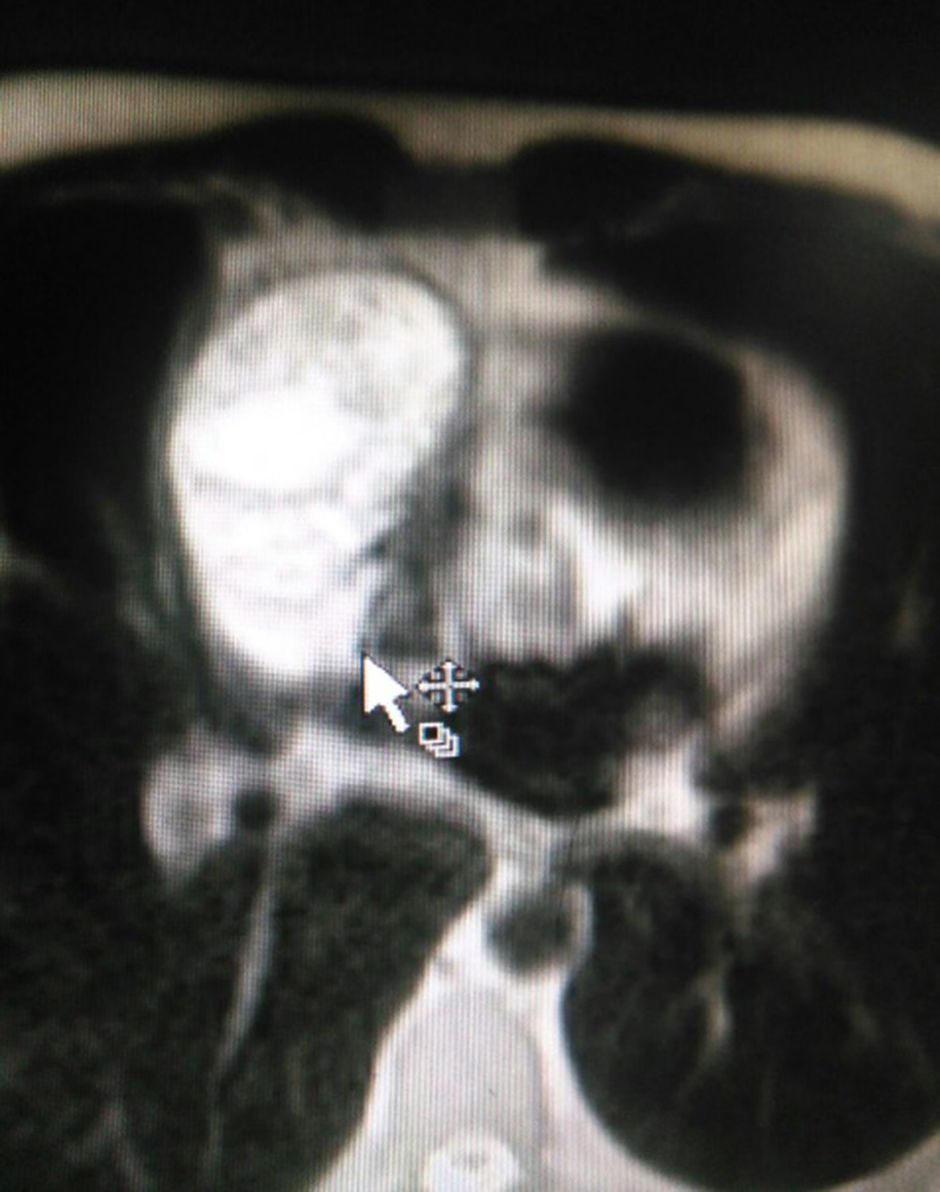
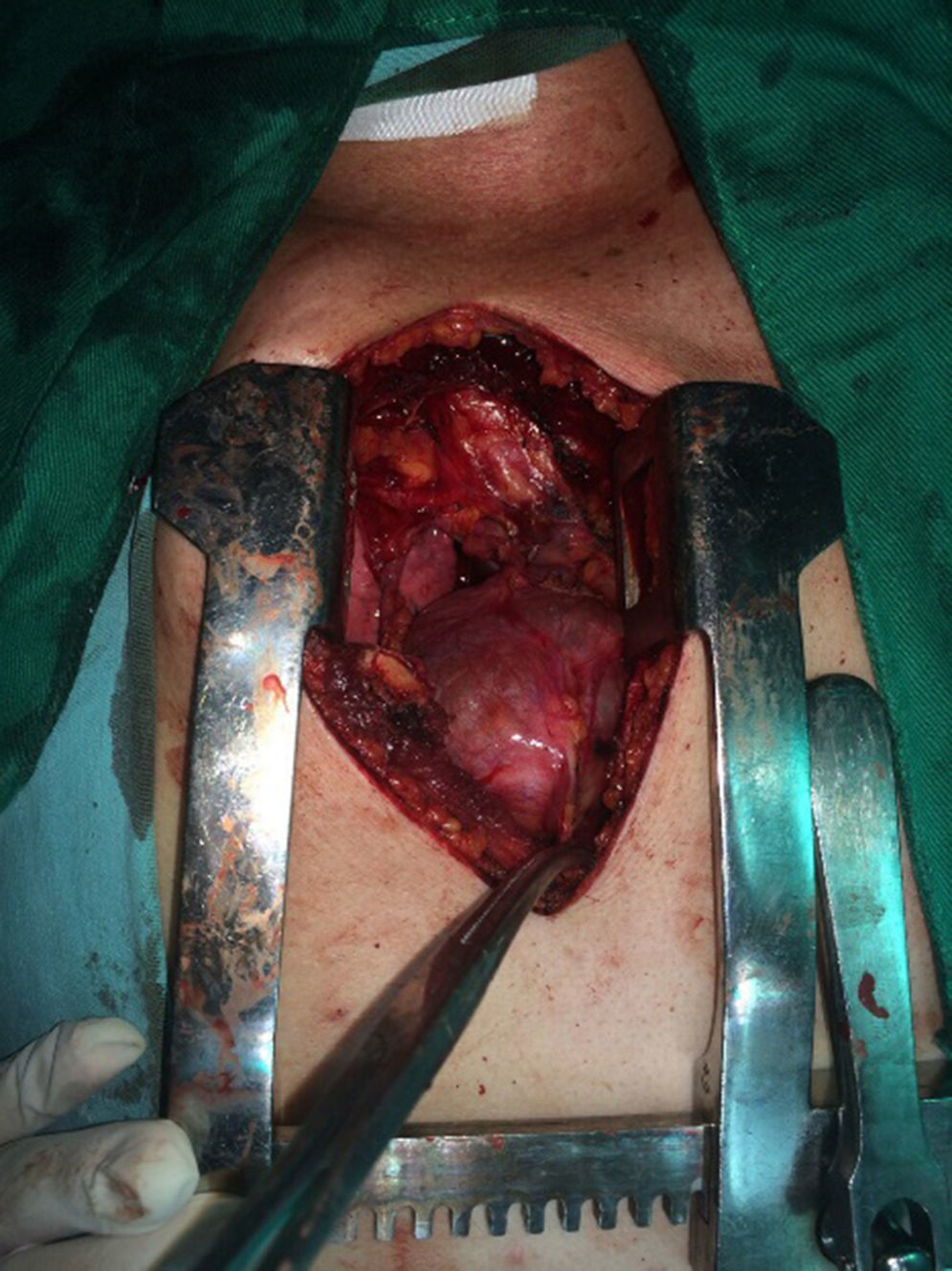
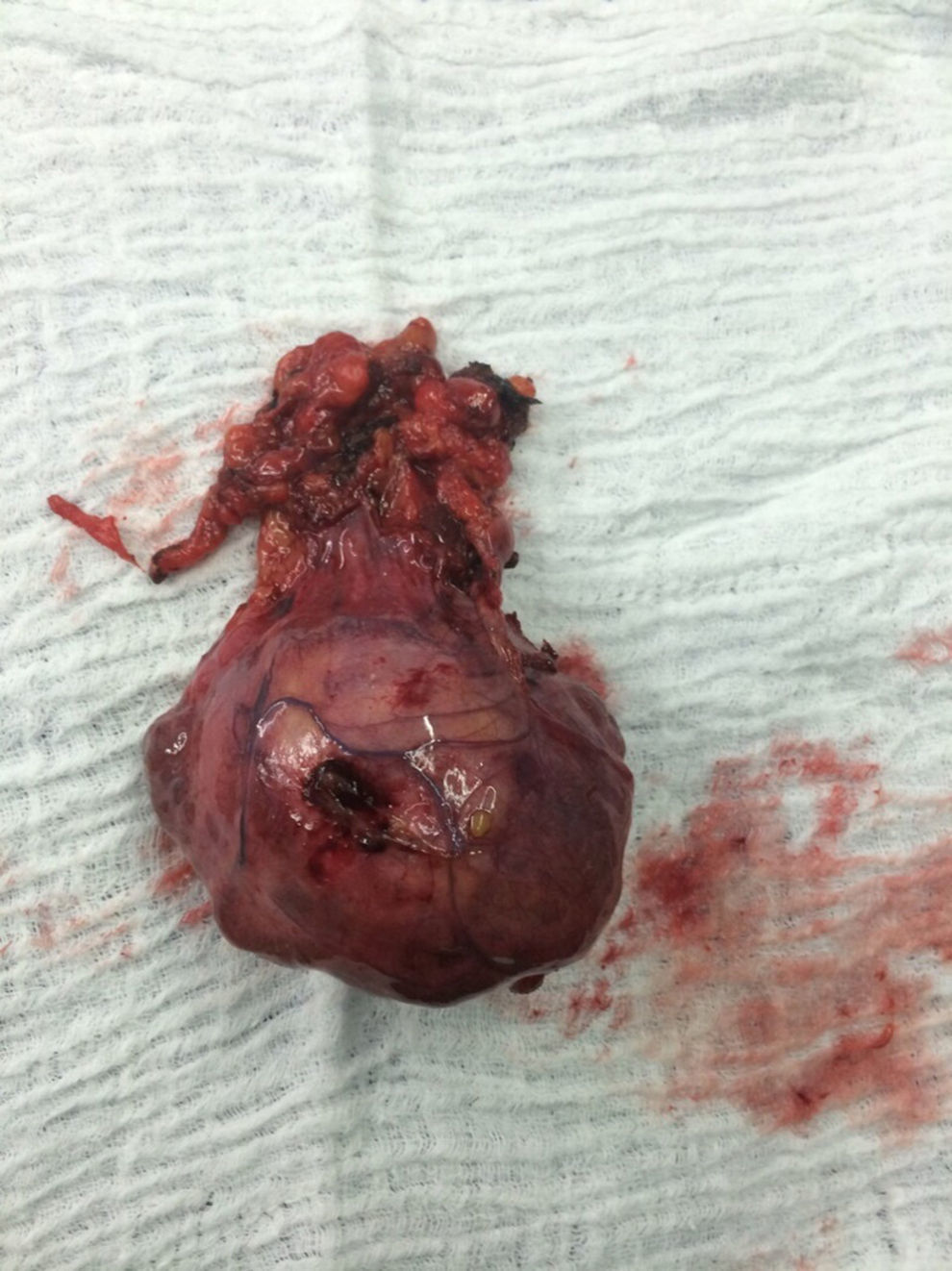
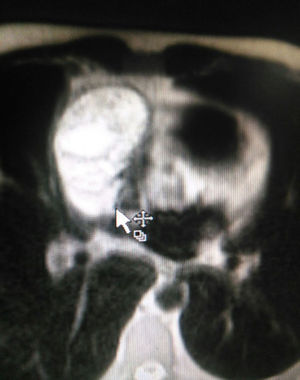
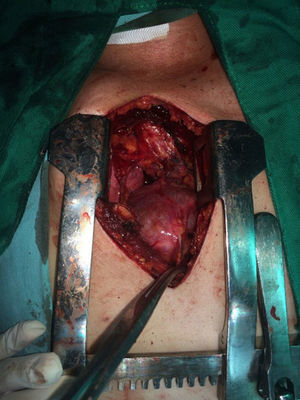
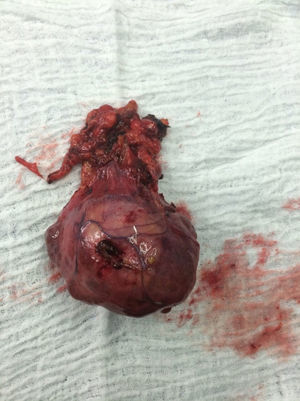
El paciente es valorado por cirugía de tórax quienes solicitan marcadores tumorales (antígeno carcinoembrionario, alfa fetoproteína, subunidad beta de gonadotropina coriónica humana, los cuales estaban dentro de rangos normales) y estudios imagenológicos de ecografía testicular con reporte normal y resonancia magnética de tórax con contraste, con el fin de descartar compromiso pericárdico (figs. 3 y 4), la cual documenta masa mediastinal anterior en contacto con aurícula derecha y la vena cava superior, que dada la localización de la lesión y el engrosamiento y derrame pericárdico, sugiere invasión del saco pericárdico. Con el reporte de estudio imagenológico, cirugía de tórax considera resección de masa mediastinal por esternotomía (figs. 5 y 6), evidenciando masa en mediastino anterior de 12cm x 8cm en íntimo contacto con el pericardio. Esta pieza se envía a patología que documenta timoma tipo A con compromiso capsular, sin evidencia de compromiso de los tejidos adyacentes o componente ganglionar, con inmunohistoquímica para componente epitelial CKAE1AE3 positivo y para componente linfoide CD3, CD5 y CD99 positivo.
El paciente evoluciona de forma satisfactoria en el postoperatorio, se reestablecieron las líneas hematológicas posterior a la resección tímica, por lo cual se da egreso para control ambulatorio. Se solicitaron nuevos ANA, los cuales fueron negativos.
DiscusiónLos timomas son neoplasias poco frecuentes, representando menos del 1% de todos los tipos de cáncer del adulto y un 15% de las masas mediastinales9, no presenta predilección por sexo, siendo la razón entre hombres y mujeres de 1:12,14. Del total de los casos, el 44% manifiesta malignidad y el 56% es benigno2. En el 40% de los casos de timoma se ha descrito la presencia de síndrome paratímico, que hace referencia a entidades que acompañan al cuadro tumoral2.
Las enfermedades autoinmunes relacionadas con timoma se han asociado a una alteración en la inmunidad adaptativa, dado la afectación del timo como órgano fundamental en la maduración de las células T, con producción de clones de células T autorreactivas responsables de las manifestaciones autoinmunes en estos pacientes3.
Se han propuesto múltiples teorías respecto a la fisiopatología del timoma y su asociación con la autoinmunidad, tales como la teoría de las células T inmaduras, que hace referencia a la carencia de autotolerancia por parte de los timocitos del timoma, reaccionando por tanto contra epítopes propios; la teoría genética, en la cual las células del timoma tienen alteraciones genéticas en la expresión del antígeno mayor de histocompatibilidad, lo que se asociaría a alteraciones en el reconocimiento de antígenos; la teoría combinada celular y humoral, que hace referencia en primera instancia a una alteración en los linfocitos T CD4 del timoma, conllevando a la activación de las células B con la posterior producción de anticuerpos autorreactivos15 y, finalmente, la teoría que sugiere que la necrosis de las células neoplásicas puede resultar en inflamación y liberación de antígenos propios, que pueden ser reconocidos por el propio sistema inmune generando así respuestas nocivas16.
Se ha descrito que el timoma se presenta en el 15% de los pacientes con miastenia gravis, siendo la patología más estudiada junto con este cuadro tumoral4–9. Además de este cuadro neurológico, también se ha reportado la aparición de timoma en 10-15% de los pacientes con aplasia medular y 10% de los pacientes con hipogammaglobulinemia5,15,17, y de manera inversa, cuando el timoma es la enfermedad primaria, se asocia a miastenia gravis en el 35% de los casos, a aplasia medular en el 50% y a hipogammaglobulinemia en el 10%2.
Otras entidades asociadas a timoma mucho menos frecuentes son LES, sarcoidosis, esclerodermia, artritris reumatoide, síndrome de Sjögren15, dermatopolimiositis, pénfigo vulgar18, candidiasis crónicas19, colitis ulcerativa, esclerosis múltiple9, hemoglobinuria paroxística nocturna20 e hiperparatiroidismo21.
Con respecto al compromiso hematológico asociado a timoma, la aplasia medular y la anemia hemolítica son las entidades más frecuentes5. El primer caso de anemia hemolítica como primera manifestación de timoma maligno fue descrito en 1985, cuyo paciente cursó con características clínicas y paraclínicas similares al caso descrito en este reporte, dado por síntomas sugestivos de anemia asociado a hallazgo incidental de timoma en radiografía de tórax y perfil de hemólisis por test de Coombs positivo, LDH elevada e hiperbilirrubinemia a expensas de la indirecta con resolución total del cuadro anémico con ciclo de corticoides y la resección quirúrgica de la masa mediastinal22.
La literatura aporta alrededor de 19 casos de timoma asociado a anemia hemolítica, siendo más frecuente la asociación con timoma tipo C y en segundo lugar con timoma tipo A2,3,5,22, de igual manera se ha documentado que el orden de aparición de ambas entidades difieren. En el 16% de los casos cursa inicialmente con la manifestación de hemólisis y posteriormente con presencia de masa tímica22. En el 44,5%, el timoma precede a la anemia hemolítica y en el 39% de los casos se diagnostica la anemia hemolítica y el timoma de manera simultánea2, como en el caso reportado en este artículo.
El tratamiento de la anemia hemolítica asociada a timoma se basa en el uso de corticoides con dosis convencionales de 1 a 1,5 miligramo/kilogramo (mg/kg) durante 3 semanas, con mejoría clínica en el 70 a 90% de los pacientes, en cuyo caso se recomienda la disminución gradual de la dosis de corticoide si hay evidencia de mejoría clínica sostenida2. Los pacientes con refractariedad al uso de corticoides pueden beneficiarse de otras alternativas farmacológicas como azatioprina, ciclosporina, ciclofosfamida, micofenolato mofetil y terapia biológica con rituximab y alemtuzumab y esplenectomía10,11.
En más del 50% de los casos revisados (10 casos)2,5,22 se documentó la remisión de la anemia hemolítica mediante la resección quirúrgica del timoma asociado a una terapia previa de corticoides3, como ocurrió en el desenlace del paciente reportado en este artículo.
Dentro de los estudios de extensión de nuestro paciente, a diferencia de la mayoría de los casos reportados en la literatura, se evidenció positividad de anticuerpos antitiroideos, anticuerpos microsomales tiroideos y ANA sugestivos de hipotiroidismo de etiología autoinmune y lupus like, respectivamente.
En la literatura se evidencia asociación entre timoma y enfermedad tiroidea5,15, en donde se ha encontrado, principalmente, la coexistencia de miastenia gravis en 5 a 11,9%, y la presencia de hipotiroidismo con tiroiditis de Hashimoto, como en el caso de nuestro paciente, representa menos de la mitad de los casos que los reportados con enfermedad de Graves, (2-4 versus 5-8%). En estos casos se ha observado que la timectomía no tiene ningún efecto en la recuperación de la función tiroidea5.
Con respecto al LES y timoma, se ha descrito la aparición simultánea de estas dos patologías5,9,15,23,24 entre 1,5 a 2% de los casos, mientras que el desarrollo de LES en pacientes con timoma tiene una ocurrencia de 2-10%.
Nuestro paciente no cumplía los criterios clasificatorios de LES, sin embargo, por reporte de ANA positivos y anemia hemolítica autoinmune, se asocia a una entidad conocida en la terminología médica como lupus like o imitadores del lupus, caracterizado por presentar 2 o 3 criterios de esta patología, sin cumplir a cabalidad el cuadro clínico característico13. Dicha entidad puede estar asociada a lo aberrante del sistema inmune tras la afección de la inmunidad adquirida en la alteración tímica. En cuanto al efecto de la timectomía en la actividad lúpica, se ha reportado en la literatura, que posterior al procedimiento quirúrgico 5 pacientes no presentaron ningún efecto, 6 pacientes aumentaron la actividad lúpica y 7 pacientes demostraron mejoría clínica y paraclínica del cuadro lúpico5.
En conclusión, el timoma aunque es una patología poco frecuente puede asociarse a diversas entidades, generalmente de índole autoinmune. Teniendo en cuenta la revisión de la literatura, presentamos el caso clínico de un paciente con timoma y anemia hemolítica asociados a otras manifestaciones autoinmunes como hipotiroidismo y lupus like, lo cual es muy poco frecuente como síndrome paratímico en pacientes con timoma. En la actualidad, la recomendación inicial respecto al tratamiento de estas entidades es iniciar ciclos cortos de corticoides asociados a la resección quirúrgica de la masa mediastinal, obteniendo en la gran mayoría resultados satisfactorios, como en el caso del paciente reportado en este artículo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.