El objetivo de este estudio fue establecer recomendaciones para la disminución y descontinuación de la terapia biológica con el fin de que se convierta en un documento guía para los profesionales de la salud involucrados en el manejo de pacientes con artritis reumatoide, espondilitis anquilosante y artritis psoriásica.
Materiales y métodosLas recomendaciones fueron establecidas mediante consenso desarrollado a través de un panel de expertos en reumatología, basado en el análisis de la evidencia científica disponible obtenida de revisiones sistemáticas y sobre la experiencia clínica de los panelistas.
ResultadosSe incluyeron 33 estudios relacionados con artritis reumatoide, 6 de artritis psoriásica y 9 de espondilitis anquilosante. Las recomendaciones para la disminución de las terapias biológicas se realizaron estableciendo un plan para determinar cuándo y cómo reducir los fármacos biológicos modificadores de enfermedades reumáticas en pacientes con estas 3 enfermedades y en algunos casos conducir a la descontinuación de estos tratamientos.
ConclusiónLas recomendaciones establecidas en este documento servirán de guía para mejorar la eficiencia de la terapia biológica en estas enfermedades, reducir la variabilidad en la práctica clínica y establecer de manera adecuada una relación riesgo/beneficio.
The objective of this study was to establish recommendations for the reduction and discontinuation of biological disease-modifying antirheumatic drugs, with the aim of becoming a guide document for health professionals involved in the management of patients with rheumatoid arthritis, ankylosing spondylitis, and psoriatic arthritis.
Materials and methodsThe recommendations were established through consensus by a panel of experts in rheumatology, and based on the analysis of available scientific evidence obtained from systematic reviews and the clinical experience of the panellists.
ResultsA total of 33 rheumatoid arthritis related studies were included, with 6 psoriatic arthritis related, and 9 ankylosing Spondylitis related. The recommendations for the reduction of biological therapies were made by establishing a plan to determine when and how to reduce the biological disease-modifying antirheumatic drugs in patients with these 3 diseases, and in some cases lead to the discontinuation of these treatments.
ConclusionThe recommendations established in this document will serve as a guide to improve the efficiency of biological therapy in these diseases, reduce the variability in clinical practice, and establish an adequate risk / benefit ratio.
La artritis reumatoide (AR), la espondilitis anquilosante (EA) y la artritis psoriásica (APs) son enfermedades inflamatorias crónicas, las cuales tienen un espectro clínico heterogéneo y afectan principalmente las articulaciones. Estas enfermedades generan un alto impacto social y sanitario debido al efecto sobre la calidad de vida y su asociación con el incremento en morbimortalidad. Se acepta que a escala mundial entre el 1 y 3% de la población puede presentar alguna de estas enfermedades, y a pesar de la existencia de algunas aproximaciones1–5, las cifras para Colombia aún no son tan claras6.
Desde hace aproximadamente 2 décadas, la terapia biológica (TB) es considerada una terapia sucesiva al tratamiento con medicamentos convencionales modificadores de enfermedades reumáticas, debido a que ha demostrado ser efectiva en el control de los síntomas, el enlentecimiento de la progresión radiológica de la enfermedad, al compararse con tratamientos estándares como el metotrexato (MTX) u otros medicamentos modificadores de la enfermedad7,8.
Sin embargo, la gran variabilidad en la respuesta clínica de un individuo a otro, con los medicamentos biológicos, se debe a: la heterogeneidad en las características clínicas de la presentación de cada una de estas enfermedades, la gran variabilidad genotípica y fenotípica de los individuos que las padecen, y las diferencias en el comportamiento de las concentraciones séricas que pueden tener estos medicamentos en diferentes poblaciones y con diferentes dosis. Por lo anterior, en la práctica clínica, los especialistas dirigen el tratamiento de acuerdo con las diferentes características clínicas de la enfermedad, el tipo de paciente y su experiencia durante la práctica8–11.
Una vez iniciada la TB, se establecen metas terapéuticas. Estas son medidas con diferentes herramientas que evalúan la actividad, dolor, funcionalidad y calidad de vida del paciente. Con el uso de los medicamentos biológicos, se ha propuesto la posibilidad de disminuir la dosis o suspender la terapia una vez se logre la remisión o baja actividad de la enfermedad, que según algunas publicaciones puede reducir el riesgo relacionado con la exposición a los medicamentos y disminuir costos para los sistemas de salud7,12,13.
El proceso de reducción de dosis de la TB es una cuestión de equilibrio entre seguridad y eficacia. Cuando la eficacia se ha conseguido, reducir la dosis tiene los beneficios de disminuir el riesgo de infecciones graves, como se ha establecido en recientes publicaciones14,15, además de conseguir un ahorro económico que puede redundar en que se beneficien otros pacientes del uso de la TB.
En los últimos años, las enfermedades reumatológicas han tomado relevancia en el país, debido al incremento paulatino en su diagnóstico y a la disponibilidad de medicamentos biológicos como parte del tratamiento; los cuales han cambiado la historia de la práctica de la medicina y han mejorado la calidad de vida de los pacientes.
El uso de medicamentos biológicos alcanza el 15,5% en los pacientes con estas enfermedades; la Cuenta de Alto Costo en Colombia reporta que se genera un aumento en los costos al sistema de salud que hace que se creen barreras de acceso para el tratamiento16.
Por lo anterior, el uso racional y la definición de estrategias de ahorro, al lograr las metas terapéuticas, en el tratamiento de las diferentes enfermedades, motiva la construcción de un documento de consenso.
Este documento está basado en la evidencia de la literatura científica, que permite realizar una aproximación acerca de cómo lograr la reducción de la dosis y la descontinuación de la TB, en los casos donde el clínico considere pertinente y oportuno, con el objetivo de optimizar el uso de los recursos en salud.
El objetivo de este documento es generar las recomendaciones avaladas por la Asociación Colombiana de Reumatología (ASOREUMA), para llevar a cabo la disminución o descontinuación de la TB, basadas en la evidencia científica disponible. Esto con el ánimo de que sea de referencia para reumatólogos y demás profesionales de la salud que estén implicados en el tratamiento de pacientes con enfermedades inflamatorias o autoinmunes.
Materiales y métodosLa iniciativa de construir un documento de consenso basado en la evidencia para este tema surgió a raíz de una conferencia durante el XVI Congreso Colombiano de Reumatología, a partir de la cual se generó una propuesta que fue presentada a ASOREUMA.
Esta propuesta fue revisada por el comité de educación y aprobada para su ejecución. Posteriormente, la Junta Directiva realizó una convocatoria, vía correo electrónico, a todos los miembros de la Asociación para la participación de manera libre en la realización del documento de consenso; bajo la tutoría de un coordinador del proyecto, 8 reumatólogos más (grupo nominal), participaron en una primera reunión donde se presentó la propuesta.
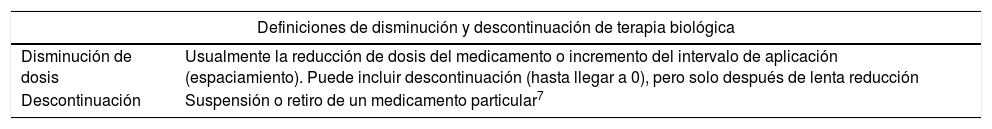
Durante la primera reunión se establecieron las enfermedades y medicamentos biológicos a tener en cuenta para llevar a cabo la estrategia de búsqueda, además, por consenso, se determinaron las definiciones operacionales de disminución de dosis, descontinuación, remisión, baja actividad de la enfermedad y recaída (tabla 1). Además de establecer las preguntas de investigación bajo la estructura PICO (Población, Intervención, Comparador y Desenlace), las cuales fueron usadas para conducir la revisión sistemática.
Definiciones meta terapéutica, recaída leve y recaída severa para enfermedades reumáticas, y disminución dosis y descontinuación terapia biológica
| Definiciones de disminución y descontinuación de terapia biológica | |
|---|---|
| Disminución de dosis | Usualmente la reducción de dosis del medicamento o incremento del intervalo de aplicación (espaciamiento). Puede incluir descontinuación (hasta llegar a 0), pero solo después de lenta reducción |
| Descontinuación | Suspensión o retiro de un medicamento particular7 |
| Definiciones por enfermedad de meta terapéutica y recaída | |||
|---|---|---|---|
| Enfermedad | Meta terapéutica | Recaída leve | Recaída severa |
| Artritis reumatoide y artritis psoriásica poliarticular | DAS28 (VSG) ≤3,2 | Incremento DAS28≥0,6+DAS28 final≥3,2 | Incremento DAS28≥1,2 |
| Espondilitis axial y artritis psoriásica axial | BASDAI≤4 ASDAS≤2,1 | Incremento BASDAI≥1 (Incremento ASDAS≥1,1)+2≤BASDAI final≤4 (ASDAS final≤2,1) | Incremento BASDAI≥2 Incremento ASDAS≥ 2 o BASDAI≥4 (ASDAS final≥2,1) o Leve recaída+PCR≥LNS |
| Artritis psoriásica o entesis oligoarticular | AI y AD≤1 Dolor por EVA≤1,5 Paciente EGE≤2 Entesis dolorosas≤1 | AI≥3 o entesis dolorosas≥3+PCR≥LNS | |
AD: articulaciones dolorosas; AI: articulaciones inflamadas; ASDAS: escala de actividad de la enfermedad de EA; BASDAI: índice de actividad de la enfermedad Bath de EA; DAS: escala de actividad de la enfermedad; EA: espondilitis anquilosante; EGE: evaluación global de la enfermedad; EVA: escala visual análoga; LNS: límite normal superior; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Tomada de González-Álvaro et al.12.
Para desarrollar la búsqueda, se estableció una pregunta de investigación para cada enfermedad, con el fin de identificar la evidencia específica para cada caso, que muestre los efectos que resultan con la descontinuación de los tratamientos biológicos.
Dentro de los límites de la búsqueda, se tuvieron en cuenta estudios publicados en los últimos 20 años, escritos en inglés, portugués o español. En cuanto al tipo de estudio y a la calidad metodológica se incluyó la evidencia de metaanálisis o revisiones sistemáticas. En caso de que no se encontrara este tipo de evidencia se incluyeron estudios clínicos, estudios de cohorte o estudios observacionales.
Se desarrolló una tamización de la información por título y resumen, eliminándose todos aquellos estudios que no contemplaran la información relacionada con las diferentes preguntas de investigación, aquellas publicaciones que fueran solo resúmenes de investigaciones o memorias de congresos, que no reportaran la totalidad de los resultados de las investigaciones. Posteriormente, la búsqueda y los resultados fueron socializados con un experto temático para la validación de estos17.
De acuerdo con el tipo de estudio identificado, la evidencia fue calificada en términos de calidad metodológica con herramientas como AMSTAR, declaración PRISMA, ISPOR, riesgo de sesgos de la colaboración Cochrane, la escala JADAD y la declaración de la iniciativa Strengthening the Reporting of Observational studies in Epidemiology (STROBE); partiendo de la calidad metodológica se aplicó la herramienta de clasificación del Grading of Recommendations Assessment, Development and Evaluation (GRADE) (tabla 2)18–20.
Sistema GRADE, niveles de evidencia
| Niveles de calidad | Calificación | Definición |
|---|---|---|
| Alta | A | Alta confianza en la coincidencia entre el efecto real y el estimado. Un metaanálisis, revisión sistemática de alta calidad o estudio clínico con bajo riesgo de sesgos |
| Media | B | Moderada confianza en la estimación del efecto. Hay posibilidad de que el efecto real esté alejado del efecto estimado. La evidencia incluye una revisión sistemática de casos y controles o de estudios de cohorte; o estudios de casos y controles o de cohortes, con bajo riesgo de sesgos, con una probabilidad alta de relación causal |
| Baja | C | Confianza limitada en la estimación del efecto. El efecto real puede estar lejos del estimado. La evidencia incluye estudios de casos y controles o estudios de cohorte con bajo riesgo de sesgos y una probabilidad media de relación causal |
| Muy baja | D | Poca confianza en el efecto estimado. El efecto verdadero muy probablemente sea diferente del estimado. Estudios de casos y controles o de cohorte con alto riesgo de sesgo; estudios de reportes de caso, series de caso u opinión de expertos |
Tomada de Aguayo-Albasini et al.20.
Establecido el nivel de evidencia, se procedió a determinar el grado de recomendación de acuerdo a GRADE (tabla 3) para cada pregunta. Posteriormente el coordinador del proyecto envió un primer borrador de los niveles de evidencia y los grados de recomendación a los 8 reumatólogos participantes, quienes, junto con el coordinador, establecieron los niveles de acuerdo para cada recomendación, las cuales se realizaron de manera individual, anónima e independiente, estableciendo así el nivel de acuerdo entre los 9 participantes.
Grados de recomendación, sistema GRADE
| Grado | Definición |
|---|---|
| Fuerte a favor | Las consecuencias deseables claramente sobrepasan las consecuencias indeseables |
| Débil a favor | Las consecuencias deseables probablemente sobrepasan las consecuencias indeseables |
| Débil en contra | Las consecuencias indeseables probablemente sobrepasan las consecuencias deseables |
| Fuerte en contra | Las consecuencias indeseables claramente sobrepasan las consecuencias deseables |
| Opinión de expertos | Basados en la experiencia de la práctica clínica de los desarrolladores |
El nivel de acuerdo de las recomendaciones se determinó puntuando cada elemento en una escala de 1 a 10 (1=total desacuerdo y 10=totalmente de acuerdo) y se estimó el promedio de los valores dados por los especialistas; el porcentaje de reumatólogos que calificó cada recomendación fue mayor a 80%. El nivel de acuerdo se consideró alto si las recomendaciones alcanzaban una calificación en promedio mayor a 8 puntos y que el porcentaje de los reumatólogos que otorgaran una calificación a cada recomendación mayor a 8 puntos superara el 80%.
Cinco reumatólogos, miembros de ASOREUMA, que no hacían parte de los participantes del desarrollo del documento de consenso, lo revisaron, como parte de una revisoría interna, y enviaron comentarios que se tuvieron en cuenta al momento de la redacción de este documento.
Finalmente, el documento terminado fue enviado a un revisor externo extranjero, quien cuenta con gran experiencia en el tema, adicionalmente tiene reconocimiento científico y académico a escala internacional (Dr. Isidoro González-Álvaro).
Esta investigación siguió los principios éticos para realizar investigación en Colombia de acuerdo con la resolución 8430 de 1993. El documento se construyó declarando los conflictos de intereses, teniendo en cuenta que hay una empresa patrocinadora que no tuvo injerencia sobre el contenido del documento y respetando los derechos de autor para ASOREUMA. Cabe aclarar que ni la empresa de investigación que apoyó el desarrollo del documento, ni la compañía farmacéutica que patrocinó la realización del documento final, tienen derechos sobre el mismo. Cada uno de los autores realizó una declaración de conflicto de interés.
ResultadosLa búsqueda de la literatura arrojó 11.819 artículos relacionados con AR, 4.616 artículos de APs, 3.055 artículos de EA y espondiloartritis. De estos, respectivamente, los estudios evaluados en texto completo fueron 70, 12 y 18 y los incluidos finalmente fueron 33, 6 y 9 (anexo diagramas de flujo 1, 2 y 3).
La primera recomendación se realizó para cada una de las enfermedades de interés y se discriminó entre disminución de la TB y descontinuación de la misma.
Se realizó la recomendación acerca de cómo manejar la recaída durante la disminución de la TB. Asimismo, describimos lo correspondiente a la disminución de dosis del rituximab (RTX) de manera independiente, debido a la diferencia que tiene frente a los demás medicamentos biológicos.
1. ¿Cuánto tiempo después de alcanzar la meta terapéutica debe considerarse la disminución de la dosis de la TB en pacientes con AR?
Recomendación: El proceso de disminución de TB en AR temprana o en AR establecida puede iniciarse en pacientes quienes han mantenido su meta terapéutica durante mínimo 12 meses.
En los estudios identificados para dar esta recomendación no se comparan los beneficios de la disminución de la dosis de la TB, entre tener un periodo de remisión o actividad baja de la enfermedad de 6 meses frente a 12 meses; los estudios en general realizan la disminución de la TB una vez el paciente ha alcanzado la remisión o la baja actividad de la enfermedad de acuerdo con el DAS28, VSG o PCR9,21–31.
Sin embargo, para tomar esta decisión el comienzo de la disminución de la dosis de la TB debe evaluarse de manera individual con cada paciente, teniendo en cuenta que la literatura informa que los pacientes con una historia prolongada de la enfermedad mayor a 10 años y mayor actividad de la enfermedad dada por el DAS28 previo al inicio del tratamiento se asocia con mayor recaída12,23,24. Otro aspecto que se recomienda, para considerar la disminución de la dosis de TB en AR establecida, es realizarla en aquellos pacientes que permanecen en remisión a pesar de reducir la dosis de esteroides al mínimo necesario.
2. ¿Cuánto tiempo después de alcanzar la meta terapéutica debe considerarse la descontinuación de la dosis de la TB en pacientes con AR?
Recomendaciones:
a) El proceso de descontinuación de TB en AR temprana puede iniciarse en pacientes que han mantenido su meta terapéutica durante mínimo 12 meses.
Al igual que en los estudios donde se evalúa la disminución de la dosis de la TB para pacientes con AR, los estudios que evalúan la descontinuación de la TB tampoco comparan el beneficio de esperar 6 o 12 meses para iniciar dicha estrategia. La mayoría de los estudios inician la descontinuación en AR temprana, 6 a 12 meses después de lograr la meta terapéutica, ya sea remisión, ya sea baja actividad de la enfermedad24,32–36.
En términos del desenlace de cambios radiológicos, en la revisión de Galvao et al.24 el mantener la TB con adalimumab o etanercept tiene un menor riesgo de progresión radiológica comparada con la descontinuación de esta (NNT=12, IC 95%: 7-56)24.
En el estudio de Smolen et al.33, la progresión radiográfica fue evaluada con la escala modificada de Sharp, que se vio ligeramente deteriorada en los pacientes en los cuales se suspendió el tratamiento con adalimumab; sin embargo, el 81% de los pacientes sometidos a descontinuación de la TB no presentaron deterioro radiológico a la semana 78 de seguimiento.
El estudio clínico PRIZE, publicado por Emery et al.31, muestra cómo con la descontinuación del tratamiento de etanercept más MTX, en pacientes con AR temprana, no hubo cambios significativos en la progresión radiológica, evaluada con la puntuación total de Sharp modificada por Genant, con un promedio de 7,9±12,7 de daño articular en las radiografías31.
b) El proceso de descontinuación de TB en AR establecida NO se recomienda por el riesgo de progresión radiológica y mayor riesgo de recaída posterior a la suspensión del medicamento22,27,30,37–40.
La revisión sistemática de Galvao et al.24 es la única que reporta factores relacionados con mayor riesgo de recaída tras la descontinuación de la TB. Esta publicación incluye estudios desarrollados en pacientes con AR de inicio temprano y establecida, en los cuales tener un valor de DAS28 elevado al momento de iniciar el tratamiento (HR de 1,39; IC 95%: 1,21-1,60) y más de 10 años con AR (HR de 1,29; IC 95%: 1,03-1,61) generan un mayor riesgo de recaída24.
La revisión sistemática de Van Herwaarden et al.29 estimó que la progresión radiográfica en los pacientes con descontinuación de la TB con adalimumab generaba un aumento en los cambios radiológicos, basado en la escala modificada de Sharp, a las 52 semanas de seguimiento, con una diferencia de medias de 0,66 (IC 95%: 0,63-0,69).
En la revisión sistemática de Kuijper et al.41, aunque no especifican la escala de medición para la progresión radiológica, la descontinuación del uso de etanercept frente al tratamiento continuo en pacientes con AR, fue mayor en los pacientes que suspendieron el tratamiento comparado con los que tuvieron solo una disminución de la dosis (0,60 unidades/año frente a −0,06 unidades/año, respectivamente, p=0,026); dentro de la revisión no identificaron estudios de tocilizumab en los que reportaran la progresión radiológica41.
En el estudio STRASS, publicado por Fautrel et al.22, al igual que en el estudio de Brocq et al.39, evaluaron la progresión radiológica con la escala modificada de Sharp y reportan que no hubo cambios significativos en los pacientes en los que se les disminuyó la frecuencia de la dosis de etanercept o adalimumab.
3. ¿Cuánto tiempo después de alcanzar la meta terapéutica debe considerarse la disminución de la dosis de la TB en pacientes con APs?
Recomendación:
El proceso de disminución de TB en pacientes con APs puede iniciarse en pacientes que han mantenido su meta terapéutica durante mínimo 12 meses.
En los pacientes con APs, las herramientas usadas para establecer la baja actividad de la enfermedad o la remisión fueron el PASI42,43, los criterios de mínima actividad de la enfermedad propuestos por Coates et al.44 o combinaciones de herramientas como en el estudio de Chimenti et al.45, en el que se usó el DAS28-PCR, ausencia de edema y rigidez articular, rigidez articular matinal<15min, ausencia de dactilitis, entesitis o compromiso extraarticular, PASI<75%, escala análoga visual de fatiga y escala análoga visual de dolor<10.
El estudio observacional de Piaserico et al.42 es el único que reporta factores relacionados con un mayor riesgo de recaída tras la disminución de la TB. Los factores que aumentan el riesgo de recaída fueron: el uso de etanercept (HR 3,6 [IC 95%: 1,4−9,9], p=0,01); duración de la enfermedad de más de 20 años (HR 2,8 [IC 95%: 1,2−6,6], p=0,019); PASI>15 antes de iniciar los anti-factor de necrosis tumoral (TNF) (HR 2,9 [IC 95%: 1,2-7,2], p=0,018).
En pacientes con APs la evidencia es limitada, en términos de disminución de la dosis. Solo se dispone del estudio de Cantini et al.43, el cual reporta que el 88,6% (47 de 53) de los pacientes con APs en remisión, en los que se lleva a cabo la disminución de la dosis de adalimumab, se mantuvieron en remisión.
Es importante mencionar que no se encontraron estudios que evalúen las consecuencias respecto a cambios radiológicos posteriores a la disminución de la dosis de TB en pacientes con APs.
4. ¿Cuánto tiempo después de alcanzar la meta terapéutica debe considerarse la descontinuación de la dosis de la TB en pacientes con APs?
Recomendación:
La descontinuación de TB en pacientes con APs NO se recomienda en pacientes que han mantenido su meta terapéutica.
En el estudio de factibilidad desarrollado por Moverley et al.46 evaluaban la posibilidad de descontinuar el tratamiento con etanercept, adalimumab, infliximab o golimumab en pacientes con APs que tuvieran enfermedad estable por 6 meses. Durante este estudio se observó que la tasa de recaída fue del 54,6% (IC 95%: 23,4-83,3%), la cual se presentó 8 semanas después de haber iniciado la suspensión de infliximab, etanercept, golimumab o adalimumab, razón por la cual interrumpieron el estudio clínico.
Por otro lado, el estudio observacional de Chimenti et al.45 evalúo la descontinuación de etanercept en pacientes con APs, comparando aquellos que habían recibido tratamiento por más de 72 semanas frente a aquellos que lo habían recibido durante menos de dicho periodo. Encontraron que no hay una diferencia estadísticamente significativa en la duración de la remisión tras la suspensión del tratamiento, el cual fue de 18,1 semanas (rango: 46-12) en los que recibieron menos de 72 semanas de tratamiento comparado con 18,7 semanas (rango: 52-11) en los tratados por más de 72 semanas con etanercept.
5. ¿Cuánto tiempo después de alcanzar la meta terapéutica debe considerarse la disminución de la dosis de la TB en pacientes con EA?
Recomendación:El proceso de disminución de TB en pacientes con EA puede iniciarse en pacientes que han mantenido su meta terapéutica durante mínimo 12 meses.
Para evaluar la baja actividad de la enfermedad o remisión, los estudios desarrollados en pacientes con EA reportan el uso de las herramientas BASDAI47–50, remisión parcial por ASAS51,52 o una combinación de escalas que incluía BASDAI y no compromiso articular periférico (artritis o entesitis).
En la literatura encontrada para pacientes con EA, se evidencia que algunos estudios inician el proceso de disminución de la dosis de la TB en pacientes que han permanecido con la dosis estándar del biológico hasta por 2 años. Sin embargo, el panel considera que puede iniciarse la disminución de dosis de TB posterior a 12 meses de haber logrado la meta terapéutica de manera continua.
En pacientes con espondiloartritis, el estudio clínico de Cantini et al.47, reporta que el 86,3% (19 de 22) tratados semanalmente con etanercept y 90,4% (19 de 21) tratados con aumento del intervalo de administración, a semana de por medio, permanecieron en remisión, mostrando que no hay una diferencia estadísticamente significativa entre los dos grupos.
Por otro lado, en el estudio observacional de Plasencia et al.50, en pacientes con espondiloartritis, la recaída se dio en el 30% (22/74) de los pacientes que disminuyeron el tratamiento con etanercept, adalimumab o infliximab, y en el 19% (8/43) de los pacientes que tuvieron tratamiento estándar.
El estudio observacional de Almirall et al.51, muestra cómo, en pacientes con espondiloartritis, a medida que pasa el tiempo, aumenta la proporción de pacientes que recaen a un BASDAI≥4, cuando se disminuye la dosis del tratamiento biológico con etanercept, infliximab o adalimumab, pasando del 4,8% en los primeros 3 meses, al 16,7% a los 6 meses y al 23,8% a los 12 meses de haber iniciado la disminución de la dosis.
En pacientes con EA, el estudio de Závada et al.53, en el que se compara el tratamiento a dosis estándar frente a dosis disminuida con anti-TNF, no se encontraron diferencias estadísticamente significativas. El BASDAI cambió anualmente en 0,47 (IC 95%: 0,18-0,76) en los pacientes con tratamiento estándar y en 0,36 (IC 95%: 0,01-0,71) en pacientes en los que se disminuyó el tratamiento con una diferencia de medias de −0,12 (IC 95%: −0,57-0,34; p=0,615) y en el HAQ un cambio de 0,07 (IC 95%: 0,00-0,14) con el tratamiento estándar y de 0,08 (IC 95%: −0,01-0,17) con el tratamiento disminuido y una diferencia de medias de 0,00 (IC 95%: −0,11-0,12); p=0,942.
Es importante mencionar que no se encontraron estudios que evalúen las consecuencias respecto a cambios radiológicos posteriores a la disminución de la dosis de TB en pacientes con EA.
6. ¿Cuánto tiempo después de alcanzar la meta terapéutica debe considerarse la descontinuación de la dosis de la TB en pacientes con EA?
Recomendación: No se recomienda la descontinuación de la TB en pacientes con EA, debido a que la evidencia ha demostrado que al realizarlo se observa un incremento paulatino de actividad de la enfermedad49,52,54–56.
El estudio de Sieper et al.52 estimó, para pacientes con espondiloartritis axial, en los que se suspende la dosis de infliximab, un tiempo promedio hasta la recaída de 23 semanas (IC 95%: 14,43-25,14) en el grupo con naproxeno y de 12,6 semanas (IC 95%: 10,71-no estimado) en el grupo sin tratamiento. La media de duración de la remisión parcial fue de 23 semanas (IC 95%: 14,43-25,14) en los pacientes en que se suspendió infliximab y continuaron con naproxeno, y de 12,6 semanas en los que se suspendió todo tratamiento. Los resultados de ASDAS, BASDAI, BASMI y BASFI aumentaron paulatinamente en los 2 periodos de evaluación (semana 28 y semana 52), encontrando una diferencia de medias en el grupo de naproxeno de 0,6±0,71; 0,6±1,06; 0,3±0,47; 0,5±0,79, respectivamente en cada escala; y en el grupo sin tratamiento la diferencia de medias fue de 0,6±0,63; 1,1±1,37; 0,3±0,63; 0,9±1,41, respectivamente para cada escala.
La tasa de recurrencia en pacientes con espondiloartritis en los que suspende el tratamiento biológico reportada en el estudio de Deng et al.49 fue del 60% (18 de 33 pacientes) en los que se les continuó tratamiento con talidomida, del 84,8% (28 de 33 pacientes) en los que se continuó el tratamiento con sulfazalasina y del 89,2% (33 de 37 pacientes) en los que se continuó tratamiento con un antiinflamatorio no esteroideo (AINE).
7. ¿Cuál es el esquema de disminución de dosis de TB que debemos seguir cuando se decide esta conducta?
Recomendación: Al momento de decidir realizar la disminución de la dosis de la TB, la dosis indicada y aprobada para el inicio de estos medicamentos, en estas enfermedades, puede ser reducida en un 25% de la dosis inicial, ya sea disminuyendo la dosis por aplicación o incrementando el intervalo entre su administración.
Cada estudio y en cada una de las enfermedades se propone un esquema de disminución del tratamiento biológico, pero el estudio Cárdenas et al.30 propone 2 esquemas de disminución de dosis, para 7 medicamentos, en pacientes con AR, en los que no se identificaron diferencias estadísticamente significativas en términos de efectividad en mantener la remisión de la enfermedad (tabla 4).
Esquemas de disminución de dosis de medicamentos biológicos
| Medicamento | Dosis estándar | Esquema 1 | Esquema 2 |
|---|---|---|---|
| Infliximab | 3mg/kg iv cada 8 semanas | 3mg/kg cada 9 semanas | 3mg/kg cada 10 semanas |
| Etanercept | 50mg sc cada 7 días | 50mg cada 10 días | 50mg cada 14 días |
| Adalimumab | 40mg sc cada 2 semanas | 40mg cada 3 semanas | 40mg cada 4 semanas |
| Golimumab | 50mg sc mensuales | 50mg cada 5 semanas | 50mg cada 6 semanas |
| Tocilizumab | 8mg/kg iv cada 4 semanas o 162mg sc cada 7 días | 4mg/kg cada 5 semanas o 162mg sc cada 10 días | 4mg/kg cada 6 semanas o 162mg sc cada 14 días |
| Abatacept | Dosis según peso (500mg, 750mg, 1g) iv cada 4 semanas o 125mg sc cada 7 días | Dosis según peso (500mg, 750mg, 1g) cada 5 semanas o 125mg sc cada 10 días | Dosis según peso (500mg, 750mg, 1g) cada 6 semanas o 125mg sc cada 14 días |
| Certolizumab pegol | 200mg sc cada 2 semanas o 400mg sc cada 4 semanas | 200mg cada 3 semanas o 400mg cada 5 semanas | 200mg cada 4 semanas o 400mg cada 6 semanas |
iv: intravenoso; sc: subcutáneo.
Tomada y modificada de Cárdenas et al.30.
Es importante mencionar que para el caso de los medicamentos administrados por vía intravenosa la reducción puede ocurrir, tanto disminuyendo los miligramos por kg de peso en cada infusión o incrementando el intervalo entre las aplicaciones. La selección de cualquiera de las alternativas será de acuerdo con lo que defina el reumatólogo junto con el paciente.
Esta disminución de dosis debe realizarse de acuerdo con las características clínicas de cada individuo como: baja actividad vs. remisión, tiempo de evolución de la enfermedad, presencia de factores de mal pronóstico establecidos para cada enfermedad y características particulares de cada paciente.
8. ¿Cómo realizar el seguimiento una vez se inicia la disminución de la dosis de TB?
Recomendación: Desde el momento en que se inicia la disminución de la dosis de TB se recomienda realizar el primer control a los 2 meses durante los primeros 6 meses y si el paciente permanece en la meta terapéutica establecida desde el inicio, las visitas posteriores pueden realizarse de acuerdo con las recomendaciones de la estrategia T2T.
Hay diferentes estudios tanto en AR, como en APs y EA donde se establece el tiempo promedio a la recaída posterior a la disminución o descontinuación de la TB, los cuales tienen rangos diferentes en meses y no superan los periodos entre visitas a los recomendados por nosotros21,24,29,31,42,43,45,46,49,50. Es importante establecer que cuando el reumatólogo tome la decisión de realizar esta, se debe garantizar el acceso a las consultas de control por parte de los pacientes.
9. ¿Qué debemos realizar si ocurre una recaída durante el proceso de disminución de dosis o descontinuación de la TB?
Recomendaciones:
a) Para el caso de pacientes con AR que sufren una recaída en el proceso de disminución de dosis, esta debe ser reajustada con el objetivo de conseguir nuevamente la meta terapéutica; para definir si se prescribe la dosis estándar aprobada para el medicamento o se retorna a la dosis usada previamente a la recaída, se requiere evaluar cada caso en particular determinando la severidad y la causa de la recaída. En caso de recaída leve se recomienda retornar a la dosis previa a la recaída y si esta es severa debemos retornar a la dosis estándar inicial21,24,29,31.
b) Para el caso de los pacientes con APs, ya sea poliarticular o una APs con compromiso axial, que sufren una recaída en el proceso de disminución de dosis, recomendamos retornar a la dosis estándar aprobada del medicamento para lograr la meta terapéutica nuevamente42,43,45,46.
c) En cuanto a los pacientes con EA que sufren una recaída leve en el proceso de disminución de dosis, se recomienda utilizar AINE a dosis plena por mínimo 4 semanas y de acuerdo con una nueva evaluación definir si se requiere o no retornar a la dosis previa a la recaída o retornar a la dosis estándar aprobada para cada medicamento en caso de no alcanzar la meta terapéutica. Si se trata de una recaída severa debemos prescribir nuevamente la dosis estándar inicial aprobada para el medicamento49–51.
En cualquiera de estos casos, se requiere evaluar cada caso en particular, determinando gravedad y causa de la recaída, y puede requerirse la ayuda de paraclínicos como los reactantes de fase aguda y, en algunos casos, imágenes para establecer actividad de manera más objetiva.
10. ¿Puede realizarse la disminución de dosis de RTX en pacientes con AR?
Recomendación: La evidencia aún es escasa para realizar una precisa recomendación acerca de un esquema de disminución de dosis en pacientes con AR que reciben RTX; sin embargo, por algunos estudios que se describen en este documento, se puede sugerir que una vez el paciente ha logrado la meta terapéutica se puede disminuir la dosis a la mitad y evaluar. En caso de recaída retornar a la dosis estándar aprobada.
No se dispone de estudios en los que se haya descontinuado o disminuido la dosis de la terapia con RTX tras haber alcanzado la remisión o baja actividad de la enfermedad. Los estudios de RTX disponibles evalúan diferentes esquemas de tratamiento en pacientes con la enfermedad establecida. No se pueden hacer recomendaciones relacionadas al momento de inicio, indicar un esquema o establecer la eficacia y seguridad de llevar a cabo una disminución o descontinuación del tratamiento en pacientes que se encuentren en remisión o baja actividad de la enfermedad, por falta de evidencia.
Por otro lado, el estudio de Mariette et al.57 evalúa el retratamiento de pacientes con AR en 2 grupos, uno recibía RTX 1.000mg, en una sola dosis, y el otro recibía RTX 1.000mg, en 2 dosis (día 1 y día 15). Todos los pacientes recibieron metilprednisolona 100mg 30min antes de cada infusión y tras cada infusión continuaron tratamiento con MTX57.
El estudio incluyó a 143 pacientes con AR que fueron aleatorizados, 70 pacientes en el grupo de dosis única de RTX y 73 en el grupo de 2 dosis de RTX. Se evaluaron los desenlaces de DAS28-PCR y efectos adversos57.
Los resultados del DAS28-PCR a la semana 24 fueron de 4,2±1,2 en todos los pacientes evaluados, la diferencia de medias ajustada entre los grupos aleatorizados fue de 51,4 (IC 95%: 131,2-234)57.
En términos de seguridad, reportan un total de 1.058 eventos adversos en 204 pacientes, sin diferencias estadísticamente significativas entre el grupo que fue retratado con RTX de una dosis y el grupo con RTX de 2 dosis. La tasa de infecciones fue respectivamente del 70 y 59%, estimándose una incidencia de infecciones serias del 12 y 3%57, respectivamente.
El estudio MIRROR58 evaluó la eficacia y seguridad de 3 regímenes de dosificación y repetición del tratamiento con RTX más MTX en pacientes con AR activa. Los pacientes con AR activa, a pesar de MTX estable (10-25mg/semana), fueron asignados aleatoriamente a uno de los 3 regímenes de tratamiento que comprendían 2 cursos de RTX con 24 semanas de diferencia: 2×500mg y 2×500mg; 2×500 y 2×1.000mg (aumento de la dosis); y 2×1.000 y 2×1.000mg. El desenlace primario fue la proporción de pacientes que alcanzaron ACR20 en la semana 48. Los esquemas de RTX 2×500mg y 2×1.000mg no pudieron ser claramente diferenciados, aunque los resultados indican ser mejores en el grupo de RTX 2×1.000mg. Retratamiento a la semana 24 resultó en una supresión sostenida de la actividad de la enfermedad hasta la semana 48.
Por último, el estudio de Henry et al.15, el cual tiene un buen tamaño de muestra y seguimiento durante 5 años, demuestra que el uso de dosis reducidas de RTX, para retratamiento en pacientes con AR no altera el mantenimiento del tratamiento a lo largo del tiempo y se asoció con una tasa significativamente menor de infecciones graves. La dosis reducida de RTX permite una reducción del 40% en comparación con la estrategia de dosis estándar y del 65% comparado con un retratamiento de dosis completa cada 6 meses.
DiscusiónEn este consenso realizamos 13 recomendaciones basadas en la evidencia que describen el procedimiento para disminuir la dosis de la TB en pacientes con AR, APs y EA. La evidencia recolectada y evaluada muestra que en los pacientes con AR temprana existe mayor evidencia relacionada con la descontinuación, mientras que en AR establecida, aunque la evidencia favorece tanto la disminución como la descontinuación de la TB, nuestra recomendación es que se puede descontinuar la TB en pacientes con AR temprana y en caso de presentarse una recaída debemos reiniciar el tratamiento biológico de acuerdo con lo descrito en la recomendación21,27,30–32,34. Para el caso de los pacientes con AR establecida no recomendamos la descontinuación de la TB por el riesgo de progresión radiológica y mayor riesgo de recaída posterior a la suspensión del medicamento22,27,30,37,38,39,40.
Los estudios desarrollados en pacientes con APs y EA en quienes se disminuye o descontinúa la TB son de menor calidad, comparados con los disponibles en pacientes con AR.
En APs la evidencia indica que se puede disminuir la dosis del tratamiento biológico, mientras que la evidencia para descontinuación es contradictoria, pues hay un estudio inconcluso debido a las tasas elevadas de recaída que obligaron al cese de la estrategia de descontinuación46; en otra publicación logran descontinuar la TB, pero los pacientes tienen recaída al poco tiempo45.
Dentro de la búsqueda se tuvo en cuenta la diferencia en los efectos que puede haber en los pacientes con AR tratados con RTX, pero los estudios clínicos desarrollados con el medicamento no evalúan los efectos de la descontinuación a largo plazo57; por lo cual no es posible establecer recomendaciones, basadas en la evidencia científica, que permitan saber en qué momento se debe suspender la administración del medicamento o qué esperar una vez se suspende; sin embargo, publicaciones recientes soportan la reducción de la dosis de RTX en pacientes con AR, manteniendo la eficacia y disminuyendo la proporción de infecciones serias con dicha estrategia15.
Adicionalmente, se tuvo en cuenta la espondiloartritis no radiográfica, incluyéndose el término dentro de la búsqueda, sin lograr identificar estudios que fueran desarrollados en población con dicha característica y en donde se evaluaran los efectos relacionados con la disminución o suspensión del tratamiento biológico.
El nivel de acuerdo que se estableció a priori para realizar cualquier recomendación categorizado como alto nivel en este consenso fue 8 o más, y eso se logró en 9 de las 13 recomendaciones.
Una de ellas en las que no se logró acuerdo fue en la que se habla acerca de la NO descontinuación de la TB en pacientes con AR establecida. Algunos de los participantes, a pesar de los argumentos que se describen en el texto de arriba, indican que algunos pacientes con importante daño estructural, a quienes se les inició la TB y se logra la meta terapéutica, se les puede suspender la TB si se continúan los DMARD convencionales y se observan de manera estricta.
Lo mismo sucedió con la recomendación de NO descontinuar la TB en pacientes con APs posterior al logro de la meta terapéutica. Los participantes del consenso arguyen que la evidencia hasta el momento no es suficiente para definir conclusivamente esta recomendación.
Otra de las recomendaciones en las que no se logró el nivel de acuerdo, fue para el caso en el cual se sugiere el uso de AINE por 4 semanas para pacientes con EA que presenten una recaída leve. Los participantes plantean que si el paciente se encuentra en TB es porque previamente no respondió al uso de los AINE y, por tanto, se debería retornar a la dosis de TB estándar aprobada para esta indicación.
Por último, no se presentó acuerdo en lo que respecta a la disminución de dosis de RTX en pacientes con AR, debido a la escasa evidencia para realizar esta recomendación con desenlaces duros como progresión radiológica.
Se requieren parámetros confiables, que en la práctica clínica ayuden a predecir qué pacientes pueden mantener un control adecuado de la enfermedad después de disminuir la dosis de la TB.
Sin embargo, hasta el momento, ni los niveles de medicamentos inhibidores del TNF (TNFi) en suero, ni los niveles de anticuerpos antimedicamento han podido predecir la reducción exitosa de la dosis o la interrupción de etanercept, infliximab o adalimumab en pacientes con AR que permanecieron con enfermedad estable en baja actividad; al parecer únicamente los niveles elevados de adalimumab podrían ser predictores; por tanto, no se recomienda utilizar solamente estas pruebas para realizar este ajuste de dosis59.
Otro estudio confirma lo anterior ya que tampoco se encontraron predictores que de manera confiable garantizaran la disminución o descontinuación exitosa de la TB en pacientes con AR; sin embargo, se han detectado algunos factores que podrían ser predictores, como: tener altos niveles de medicamento, menor puntuación de erosión de Sharp/van der Heijde y una menor duración de los síntomas al inicio de la TB59.
En los últimos años, una serie de estudios muestran que la inflamación de las articulaciones detectada por ultrasonido, y hallazgos como sinovitis determinado con doppler y, en menor medida, la hipertrofia sinovial por medio de la escala de grises, son mejores predictores de recaída que las medidas clínicas una vez la TB se disminuya o se suspenda60–62. Sin embargo, el valor agregado del ultrasonido al examen clínico aún necesita mayor evidencia63. Faltan datos de predicción de la resonancia magnética nuclear después de realizar la disminución o retiro de la TB, sin embargo; la sinovitis detectada por resonancia magnética nuclear y el edema de la médula ósea han demostrado predecir progresión radiográfica en pacientes con AR64,65. La resonancia magnética nuclear proporciona una herramienta confiable y receptiva para estudios multicéntricos (con lectura central).
En general, en los pacientes con AR temprana o en aquellos con una remisión clínica más profunda o por un largo término, es menos probable que se presente una recaída de la enfermedad después de que se disminuye la TB pero se necesitan más estudios para confirmar estos resultados7.
Por lo tanto, preguntas sin respuesta relacionadas con la disminución de dosis de la TB incluyen: qué paciente o características de la enfermedad son predictivos de riesgo de recaída y si estas características podrían ser utilizadas para diseñar un algoritmo para la selección de pacientes. Además, no se conoce bien qué régimen de dosis de TNFi después de una recaída, al haber disminuido la dosis, proporciona el mismo control de la enfermedad66,67. Aunque el reinicio de la terapia con TNFi ha tenido éxito para recuperar el control de la enfermedad en la mayoría de los pacientes (hasta el 100% de los pacientes, en algunos estudios)27,61,66, no todos los estudios han mostrado resultados tan benéficos y el número de pacientes generalmente fue bajo (recuperación de la remisión en solo el 57% de los pacientes)68.
Estudios como el The imPact of Residual inflammation detected via imaging techniques, Drug levels and patient characteristics on the outcome of dose taperIng of adalimumab in Clinical remission rheumatoid arThritis (RA) study (PREDICTRA)69 y algunos con similar diseño probablemente nos ayudarán a responder algunos de tantos interrogantes, que aún con la literatura disponible no podemos contestar, y que aún nos planteamos en la práctica clínica al momento de realizar la disminución y la descontinuación de la TB en los pacientes con estas 3 enfermedades.
FinanciaciónAsociación Colombiana de Reumatología.
Conflicto de interesesTodos los autores realizamos la declaración de conflicto de intereses por escrito y ninguno presenta conflicto relacionado con la realización de este documento.
Miembros ASOREUMA que participaron como revisores internos: doctores Juan Manuel Bello, Luis Cajas, Aura Domínguez, Adriana Rojas y Carlos Jaime Velásquez.
Revisor externo: doctor Isidoro González-Álvaro. Servicio de Reumatología, Instituto de Investigación Sanitaria La Princesa, Hospital Universitario de La Princesa, Madrid-España.