Determinar si la seropositividad en pacientes con artritis reumatoide tratados con adalimumab (ADL), se asocia a la presencia de anticuerpos anti-adalimumab (anti-ADL).
Materiales y métodosEs un estudio observacional descriptivo que incluyó pacientes con diagnóstico de artritis reumatoide según criterios ACR 1987, que estaban en tratamiento con ADL como primer biológico, por al menos 6 meses. Todos los pacientes se evaluaron para factor reumatoide, anticuerpos anticitrulina, velocidad de sedimentación globular, proteína C reactiva, índices clinimétricos y nivel de anticuerpos anti-ADL.
ResultadosSe evaluaron 80 pacientes con edad promedio de 56 años, el 86% fueron mujeres, la duración promedio de la enfermedad fue de 15 años y el tiempo de exposición a ADL de 52 meses (valor mediano). La seropositividad para factor reumatoide tendió a ser mayor en los pacientes que desarrollaron anticuerpos anti-ADL en comparación con los que no (90,5% vs. 66,1%). La magnitud de la asociación entre factor reumatoide y la presencia de anticuerpos anti-ADL tendió a ser fuerte y estadísticamente significativa (OR=4,87; IC 95%: 1,03-23,03). Los análisis ajustados de regresión multivariable mostraron una asociación fuerte (OR=9,77; IC 95%: 1,74-54,79) entre la seropositividad y la presencia de anticuerpos anti-ADL, que dado el bajo número de pacientes carece de precisión (IC 95% muy amplios).
ConclusionesLos pacientes seropositivos tienden a presentar más anticuerpos anti-ADL; sin embargo, se requiere tener un mayor tamaño muestral para obtener la precisión necesaria y tener mayor certeza en estos hallazgos.
To determine whether seropositivity in rheumatoid arthritis patients treated with adalimumab (ADL) is associated with the presence of anti-adalimumab (anti-ADL) antibodies.
Materials and methodsA descriptive observational study that included patients diagnosed with rheumatoid arthritis according to ACR 1987 criteria, and who were on treatment with ADL as the first biological, for at least six months. All patients were evaluated for rheumatoid factor, anti-citrulline antibodies, erythrocyte sedimentation rate, C-reactive protein, clinimetric indices, and level of anti-ADL antibodies.
ResultsA total of 80 patients with a mean age of 56 years were evaluated, of whom 86% were women. The mean duration of the disease was 15 years, and the ADL exposure time was 52 months (median value). The seropositivity for rheumatoid factor tended to be higher in patients who developed anti-ADL antibodies compared to those who did not (90.5% vs. 66.1%). The magnitude of the association between rheumatoid factor and the presence of anti-ADL antibodies was shown to be strong and statistically significant (OR=4.87, 95% CI; 1.03-23.03). Adjusted multivariate regression analyses showed a strong association (OR=9.77, 95% CI; 1.74-54.79) between seropositivity and the presence of anti-ADL antibodies, which, given the low number of patients, lacks precision (95% CI very wide).
ConclusionsSeropositive patients tend to have more anti-ADL antibodies. However, a larger sample size is required to obtain the necessary precision and greater certainty in these findings.
La artritis reumatoide (AR) es una enfermedad sistémica, crónica y autoinmune de etiología desconocida. Una citoquina claramente identificada responsable del daño y de la destrucción articular es el factor de necrosis tumoral alfa (TNF-α)1–4. Actualmente disponemos de 5 agentes anti-TNF-α (etanercept, infliximab, adalimumab [ADL], certolizumab y golimumab)3,5. El uso de agentes anti-TNF-α ha beneficiado a muchos pacientes con AR, sin embargo algunos pacientes no responden5,6. El mecanismo exacto de la inadecuada respuesta a anti-TNF-α no ha sido completamente explorado y cualquier biológico independiente de su origen: humano, quimérico o humanizado puede causar una respuesta inmune generadora de anticuerpos contra él mismo6,7. La formación de anticuerpos anti-medicamento puede ser una de las causas de pérdida de respuesta, desarrollo de reacciones adversas y su severidad5,8–10. La prevalencia de anticuerpos anti-medicamento varía considerablemente en los estudios de anti-TNFα, observación que puede ser explicada por diferencias en los grupos de pacientes, uso de inmunosupresores concomitantes, momento de toma de la muestra, tiempo de exposición al medicamento y la técnica utilizada para hacer la medición5,7,8,11. Los datos de inmunogenicidad a ADL sugieren que los anticuerpos anti-ADL se desarrollan después de al menos 6 meses de exposición, están asociados a niveles subterapéuticos del medicamento y a la pérdida de la respuesta clínica. Bartels et al., en 2011, y Balsa en 2018, reportan que su prevalencia varía entre el 20% y 25% de los pacientes11–13.
La definición de seropositividad en AR según los criterios del American College of Rheumatology de 1987 (ACR 1987) está dada por la presencia del factor reumatoide (FR)14, mientras que por los criterios (ACR/EULAR 2010) está basada en la presencia de FR o anticuerpos anticitrulina (ACCP)15. Ser seropositivo se asocia a enfermedad articular más agresiva, manifestaciones extraarticulares y mayor mortalidad16,17.
La influencia de la seropositividad en la respuesta a los anti-TNF-α es incierta; sin embargo, datos del Registro británico sugieren que la presencia de FR o ACCP está asociada a leve reducción en DAS28 a los 6 meses de tratamiento, de igual forma datos del Registro italiano sugieren que la presencia de FR está asociada a menor posibilidad de lograr la remisión de la enfermedad3.
Aproximadamente el 70% de los pacientes con AR son seropositivos10. Actualmente existe evidencia que sugiere que la AR seropositiva es genética y patogénicamente diferente a la seronegativa, y por ello se han estudiado numerosos genes que podrían reducir la mala clasificación. Los diferentes loci encontrados pueden dividir la enfermedad en 4 grupos: loci que son a menudo encontrados en los pacientes seropositivos, loci frecuentemente encontrados en los seronegativos, loci frecuentemente encontrados en ambos grupos y loci vistos como específicos de enfermedad18. A pesar de que fenotípicamente parecen ser la misma entidad, el ser seropositivo sugiere una enfermedad más agresiva y se asocia a la presencia de autoanticuerpos, lo cual indicaría que los linfocitos B están produciendo anticuerpos por alteración en su regulación. La exposición a proteínas terapéuticas (ADL), podría ser un estímulo adicional, en algunos pacientes, al sistema inmune para producir anticuerpos contra el medicamento (anticuerpos anti-ADL) ante linfocitos B no regulados y comprometer de esta manera la eficacia. El principal objetivo del estudio fue evaluar si ser seropositivo en AR es un factor asociado a la presencia de anticuerpos anti-ADL en pacientes que reciben ADL como primer biológico, hallazgo que no ha sido descrito en publicaciones previas.
Materiales y métodosSe incluyeron pacientes con diagnóstico de AR según los criterios ACR 1987; debido a que se quería conocer el seroestado antes del inicio de ADL, y dado que hay pacientes con AR establecida en quienes no es factible obtener el dato de ACCP previo al inicio de ADL, mayores de 18 años que estaban en tratamiento con ADL como primer biológico por al menos 6 meses y acudían a Riesgo de Fractura, CAYRE® IPS y aceptaron participar. La recolección de muestras se inició el 16 de marzo del año 2015 y la última muestra se tomó el 20 de enero de 2017. Los criterios de exclusión fueron: uso previo de otro biológico (otro anti-TNF-α, abatacept, tocilizumab, rituximab) o tener otra enfermedad reumática autoinmune asociada (dato tomado de los antecedentes de la historia clínica).
La evaluación clínica fue programada para el día de la aplicación del medicamento antes de su administración (valle), y a los pacientes que dieron su consentimiento para participar en el estudio se les diligenció un formulario que detallaba las características demográficas y clínicas y se les calcularon los índices clinimétricos. En los casos en que fue posible tener acceso a la historia clínica completa del paciente se extrajo el dato de FR y de ACCP previo al inicio de ADL si estaba disponible. Posterior a la valoración médica se tomó una muestra de sangre venosa (15cc), que se dividió en 2 tubos: uno de ellos fue procesado inmediatamente para determinar velocidad de sedimentación globular (VSG), proteína C reactiva (PCR), FR y ACCP y el otro tubo, una vez centrifugado a 3.500g por 10minutos, se almacenó a –20°C para realizar la determinación de anticuerpos anti-ADL. Los anticuerpos anti-ADL fueron detectados por ELISA (inmunoanálisis) y fueron reportados en unidades de absorbancia por mililitro (UA/ml). Se definió positivo si el valor fue>10UA/ml, según lo especificado en el kit (Promonitor®. Ref. 5090130000).
Análisis estadísticoInicialmente se realizó un análisis descriptivo de las variables demográficas y clínicas, para lo cual se utilizaron medidas de tendencia central que incluyeron: promedio, mediana, porcentaje y medidas de dispersión como: desviación estándar y rango intercuartílico (RIC). Para evaluar las diferencias entre los grupos en las variables continuas se utilizó «t» de Student y el test de Mann-Whitney, y para evaluar las diferencias en las proporciones se usó Chi cuadrado y el test de Fisher para los casos en los que la frecuencia esperada era<5 en más del 20% de las celdas.
Se determinó la seropositividad (FR) en los participantes siguiendo los criterios de ACR 1987. Se estimó la magnitud de la asociación entre FR y anticuerpos anti-ADL mediante el cálculo del riesgo relativo indirecto, conocido como odds ratio (OR) crudo. Para determinar la influencia de otras variables en la dirección y magnitud de la asociación se realizaron análisis bivariados. A partir de estos análisis se identificaron las variables que mostraron estar relacionadas con la presencia de anticuerpos anti-ADL, y se incluyeron en el modelo multivariado. Para evaluar la asociación del FR y los anticuerpos anti-ADL, controlando por variables intervinientes, se construyó un modelo multivariado de regresión logística. Este análisis permitió evaluar la presencia de interacciones y de confusión con las variables de control. Para la elección del mejor modelo se utilizó la técnica backward. Finalmente se realizó un diagnóstico del modelo, utilizando criterios de información como el Akaike Information Criterion y el Bayesian Information Criterion.
El estudio se ajustó a las normas nacionales e internacionales de investigación en seres humanos, conforme con los principios establecidos en la Declaración de Helsinki y en la Resolución 8430 de 4 de octubre de 1993; correspondió a un estudio con riesgo mínimo. La investigación se desarrolló de acuerdo con el protocolo y con las normas de buena práctica clínica (Resolución 2378 de 27 de junio de 2008). Con el fin de garantizar la seguridad e integridad de los participantes el estudio fue sometido al Comité de Ética de la Institución Riesgo de Fractura, CAYRE® IPS para su evaluación y aprobación, y esta se obtuvo previo al inicio del mismo.
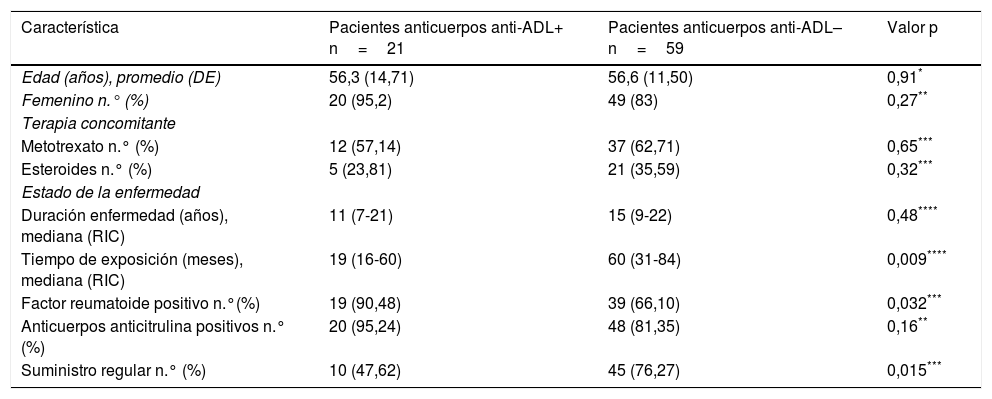
ResultadosSe incluyeron 80 pacientes, de los cuales 21 fueron positivos para anticuerpos anti-ADL (26,25%) y 59 fueron negativos (73,75%). Las características de cada grupo se muestran en la tabla 1.
Características demográficas y clínicas de los pacientes
| Característica | Pacientes anticuerpos anti-ADL+ n=21 | Pacientes anticuerpos anti-ADL– n=59 | Valor p |
|---|---|---|---|
| Edad (años), promedio (DE) | 56,3 (14,71) | 56,6 (11,50) | 0,91* |
| Femenino n.° (%) | 20 (95,2) | 49 (83) | 0,27** |
| Terapia concomitante | |||
| Metotrexato n.° (%) | 12 (57,14) | 37 (62,71) | 0,65*** |
| Esteroides n.° (%) | 5 (23,81) | 21 (35,59) | 0,32*** |
| Estado de la enfermedad | |||
| Duración enfermedad (años), mediana (RIC) | 11 (7-21) | 15 (9-22) | 0,48**** |
| Tiempo de exposición (meses), mediana (RIC) | 19 (16-60) | 60 (31-84) | 0,009**** |
| Factor reumatoide positivo n.°(%) | 19 (90,48) | 39 (66,10) | 0,032*** |
| Anticuerpos anticitrulina positivos n.° (%) | 20 (95,24) | 48 (81,35) | 0,16** |
| Suministro regular n.° (%) | 10 (47,62) | 45 (76,27) | 0,015*** |
DE: desviación estándar; RIC: rango intercuartílico.
El uso concomitante de medicamentos inmunosupresores como metotrexato fue menor en el grupo con anticuerpos anti-ADL+ (57,1% vs. 62,7%) que en el grupo con anticuerpos anti-ADL–, diferencia que no fue estadísticamente significativa (p=0,65). El consumo de esteroides fue mayor en el grupo con anticuerpos anti-ADL– (35,6% vs. 23,8%) que en el grupo con anticuerpos anti-ADL+, diferencia que no fue significativa (p=0,32).
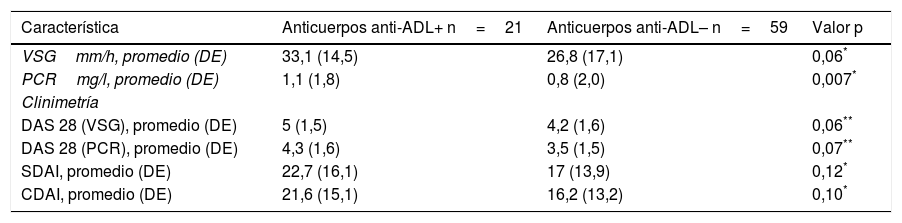
Los índices compuestos de actividad de la enfermedad (DAS 28 VSG, DAS 28 PCR, SDAI y CDAI) y los reactantes de fase aguda (VSG y PCR) tendieron a ser mayores en el grupo con anticuerpos anti-ADL+, y solo se logró demostrar diferencia estadísticamente significativa en el valor de PCR (p=0,007), y se muestran en la tabla 2.
Reactantes de fase aguda e índices de actividad de la enfermedad
| Característica | Anticuerpos anti-ADL+ n=21 | Anticuerpos anti-ADL– n=59 | Valor p |
|---|---|---|---|
| VSGmm/h, promedio (DE) | 33,1 (14,5) | 26,8 (17,1) | 0,06* |
| PCRmg/l, promedio (DE) | 1,1 (1,8) | 0,8 (2,0) | 0,007* |
| Clinimetría | |||
| DAS 28 (VSG), promedio (DE) | 5 (1,5) | 4,2 (1,6) | 0,06** |
| DAS 28 (PCR), promedio (DE) | 4,3 (1,6) | 3,5 (1,5) | 0,07** |
| SDAI, promedio (DE) | 22,7 (16,1) | 17 (13,9) | 0,12* |
| CDAI, promedio (DE) | 21,6 (15,1) | 16,2 (13,2) | 0,10* |
CDAI: índice clínico de actividad de la enfermedad; DAS 28: puntaje de actividad de la enfermedad; DE: desviación estándar; PCR: proteína C reactiva; SDAI: Índice de actividad de enfermedad simplificado; VSG: velocidad de sedimentación globular.
Cincuenta y ocho pacientes (72,5%) fueron seropositivos para FR y para ACCP (doble positivos), mientras que 10 pacientes (12,5%) fueron seropositivos solo para ACCP y 12 pacientes fueron negativos en las 2 pruebas (15% doble negativos). De los 58 pacientes doble positivos 19 presentaron anticuerpos anti-ADL (32,7%), y de los 12 pacientes doble negativos uno presentó anticuerpos anti-ADL (8,3%). De los que eran solo positivos para ACCP uno de ellos presentó anticuerpos anti-ADL (10%).
El promedio de dosis suspendidas de ADL en los que no tuvieron suministro regular del tratamiento fue de 7 dosis (3 meses y medio) durante el último año, sin encontrar diferencias en el número de dosis según el grupo; pero sí hubo diferencia estadísticamente significativa con respecto a la presencia de anticuerpos anti-ADL, siendo el suministro regular en el 47% de los pacientes con anticuerpos anti-ADL+, y en el 76% de los que fueron anticuerpos anti-ADL– (p=0,015).
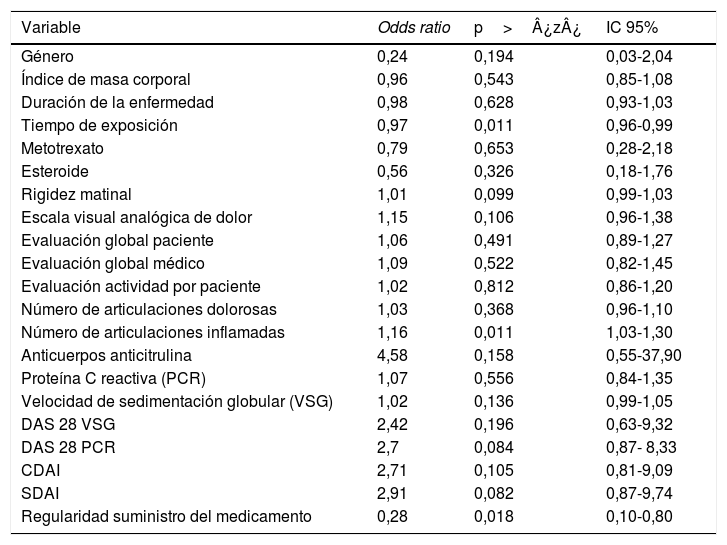
Para para evaluar la magnitud de la asociación entre FR y anticuerpos anti-ADL se calculó la OR crudo y su intervalo de confianza (IC) del 95%, como se aprecia en la tabla 3.
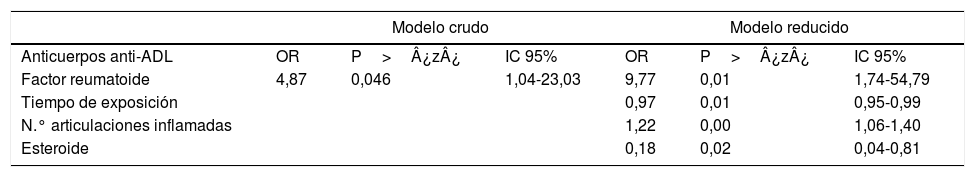
Al evaluar si la asociación de FR y anticuerpos anti-ADL está influenciada por otras variables, se realizó un análisis bivariado, encontrando variables relevantes que se tuvieron en cuenta para la construcción del modelo multivariado (tabla 4). Finalmente, se construyó un modelo de regresión logística que permitiera evaluar la asociación entre FR y la presencia de anticuerpos anti-ADL; se diseñó un modelo al que se le denominó «completo», en el cual se incluyeron las variables consideradas relevantes. Este modelo se evaluó para la presencia de interacciones (tiempo de exposición, MTX y esteroides) a través de la prueba lrtest, que resultó ser no significativa para ninguna de las interacciones (lrtest=0,1895), por tanto, estas interacciones fueron excluidas del modelo. Posteriormente, se evaluó para confusión y se decidió mantener en el modelo las variables: tiempo de exposición, número de articulaciones inflamadas y consumo de esteroides, por ser las que más influyeron en el cambio del OR. Finalmente, se seleccionó el modelo que mejor ajustaba los datos al que se le denominó «modelo reducido», sobre el cual se realizó un diagnóstico calculando los criterios de información (Akaike Information Criterion y Bayesian Information Criterion) (tabla 5).
Análisis bivariado entre la presencia de anticuerpos anti-ADL y otras variables
| Variable | Odds ratio | p>¿z¿ | IC 95% |
|---|---|---|---|
| Género | 0,24 | 0,194 | 0,03-2,04 |
| Índice de masa corporal | 0,96 | 0,543 | 0,85-1,08 |
| Duración de la enfermedad | 0,98 | 0,628 | 0,93-1,03 |
| Tiempo de exposición | 0,97 | 0,011 | 0,96-0,99 |
| Metotrexato | 0,79 | 0,653 | 0,28-2,18 |
| Esteroide | 0,56 | 0,326 | 0,18-1,76 |
| Rigidez matinal | 1,01 | 0,099 | 0,99-1,03 |
| Escala visual analógica de dolor | 1,15 | 0,106 | 0,96-1,38 |
| Evaluación global paciente | 1,06 | 0,491 | 0,89-1,27 |
| Evaluación global médico | 1,09 | 0,522 | 0,82-1,45 |
| Evaluación actividad por paciente | 1,02 | 0,812 | 0,86-1,20 |
| Número de articulaciones dolorosas | 1,03 | 0,368 | 0,96-1,10 |
| Número de articulaciones inflamadas | 1,16 | 0,011 | 1,03-1,30 |
| Anticuerpos anticitrulina | 4,58 | 0,158 | 0,55-37,90 |
| Proteína C reactiva (PCR) | 1,07 | 0,556 | 0,84-1,35 |
| Velocidad de sedimentación globular (VSG) | 1,02 | 0,136 | 0,99-1,05 |
| DAS 28 VSG | 2,42 | 0,196 | 0,63-9,32 |
| DAS 28 PCR | 2,7 | 0,084 | 0,87- 8,33 |
| CDAI | 2,71 | 0,105 | 0,81-9,09 |
| SDAI | 2,91 | 0,082 | 0,87-9,74 |
| Regularidad suministro del medicamento | 0,28 | 0,018 | 0,10-0,80 |
CDAI: índice clínico de actividad de la enfermedad; SDAI: Índice de actividad de enfermedad simplificado.
Modelos de regresión logística crudo y reducido para definir asociación entre seropositividad por FR y anticuerpos anti-ADL
| Modelo crudo | Modelo reducido | |||||
|---|---|---|---|---|---|---|
| Anticuerpos anti-ADL | OR | P>¿z¿ | IC 95% | OR | P>¿z¿ | IC 95% |
| Factor reumatoide | 4,87 | 0,046 | 1,04-23,03 | 9,77 | 0,01 | 1,74-54,79 |
| Tiempo de exposición | 0,97 | 0,01 | 0,95-0,99 | |||
| N.° articulaciones inflamadas | 1,22 | 0,00 | 1,06-1,40 | |||
| Esteroide | 0,18 | 0,02 | 0,04-0,81 | |||
| LR Chi cuadrado | 5,34 | 27,05 |
| Prob>Chi cuadrado | 0,0209 | 0,0000 |
| Log likelihood | –43,384 | –32,5294 |
| McFaddeńs R2 | 0,058 | 0,2936 |
| Count R2 | 0,738 | 0,800 |
| AIC | 90,7689 | 75,0588 |
| BIC | 95,5329 | 86,969 |
En 66 pacientes se obtuvo el dato del seroestado (FR) antes del inicio de ADL y en 14 de ellos (21,2%) era negativo, mientras que en 52 pacientes (78,8%) era positivo. Este dato en comparación con la determinación de FR el día de la visita permitió demostrar que 9 pacientes se mantuvieron negativos para FR (persistente negativo), mientras que 44 pacientes de los seropositivos se mantuvieron positivos (persistente positivo) y 13 pacientes habían cambiado su seroestado: 8 pacientes inicialmente positivos para FR se habían vuelto seronegativos (FR–) y 5 pacientes que eran inicialmente negativos para FR se habían vuelto seropositivos (FR+).
Entre los persistentemente negativos 2 pacientes (22%) desarrollaron anticuerpos anti-ADL+, entre los persistentemente positivos 13 pacientes (29,5%) desarrollaron anticuerpos anti-ADL+, y en 2 pacientes de los que cambiaron su seroestado se encontraron anticuerpos anti-ADL+ (15,3%) solo en el grupo que se seropositivizó.
DiscusiónEste es el primer estudio que evalúa si ser seropositivo en AR por criterios ACR 1987 (presencia de FR+) es un factor asociado al desarrollo de anticuerpos anti-ADL en pacientes que reciben ADL como primer biológico. A pesar de ser un análisis sobre 80 pacientes, aporta información importante que permite un mayor acercamiento al conocimiento de la inmunogenicidad a productos biológicos, específicamente a ADL en los pacientes de nuestro país.
Keiserman et al. resumieron la evidencia de los ensayos clínicos aleatorios que estudiaron los inhibidores de factor de necrosis tumoral en la incidencia de anticuerpos antimedicamento, su relación con los niveles séricos del medicamento y la respuesta clínica en pacientes con AR. Un estudio a largo plazo que incluyó 148 pacientes que estuvieron expuestos a ADL por 156 semanas encontró positividad para anticuerpos anti-ADL en el 28% de los pacientes. Estudios adicionales que incluyeron 1.559 pacientes, con exposición a ADL entre 12 y 56 semanas, reportaron anticuerpos anti-ADL+, en un rango entre 1% y 87% de los pacientes16,19. Los datos encontrados en este estudio evidenciaron anticuerpos anti-ADL+ en 21 pacientes (26,25%); lo cual es consistente con lo reportado.
La proporción de pacientes seropositivos por FR (90,5%), como por ACCP (95,2%), tendió a ser mayor en los pacientes con anticuerpos anti-ADL positivos vs. los negativos (66,1% vs. 81,3%) respectivamente; diferencia que fue estadísticamente significativa para FR (p=0,032).
El uso concomitante de inmunosupresores (MTX), fue menor en el grupo con anticuerpos anti-ADL+, por lo que este estudio añade evidencia a que la coadministración de inmunosupresores puede asociarse a reducción en la formación de anticuerpos anti-ADL4,20.
Los reactantes de fase aguda y los índices clinimétricos tendieron a estar más elevados en los pacientes con anticuerpos anti-ADL+, y esta tendencia es similar a la reportada por Bartels et al. en 2007, en 2009 y en 201111,20,21.
Un aspecto interesante fue el hallazgo de que el tiempo de exposición a ADL en los pacientes que presentaron anticuerpos anti-ADL+ fue menor que en los pacientes con anticuerpos anti-ADL-–(mediana 19 vs. 60 meses) respectivamente (p=0,009). Lo anterior es acorde con lo reportado en la literatura por Bartels et al., quienes describieron que la positividad de anticuerpos anti-ADL es mayor en las primeras 84 semanas de tratamiento (21 meses), tendiendo a aplanarse la curva de presentación luego de este tiempo11. Para nuestro estudio es importante resaltar que el criterio de inclusión fue que llevaran al menos 6 meses de tratamiento con ADL, que es el mínimo tiempo de exposición para presentar anticuerpos anti-ADL, lo cual disminuye el sesgo de seleccionar la población con menos probabilidades de tener anticuerpos anti-ADL.
Existe evidencia que demuestra que el suministro regular del medicamento induce un estado de tolerancia inmunológica, mientras que el uso irregular genera activación persistente del sistema inmunológico cada vez que se expone de nuevo al medicamento, lo cual favorece la formación de anticuerpos anti-ADL22,23. Esto es consistente con lo encontrado en nuestro estudio, pues hubo regularidad en el suministro del medicamento en el 47% de los pacientes que fueron anticuerpos anti-ADL+, vs. el 76% en los que fueron anticuerpos anti-ADL–, diferencia que fue estadísticamente significativa (p=0,015).
Es de resaltar que los pacientes que fueron doble positivos (FR+ y ACCP+) presentaron mayor proporción de anticuerpos anti-ADL+ (32,7%) que los que fueron doble negativos (FR– y ACCP–), quienes los presentaron en el 8,33%, lo cual muestra la tendencia de presentar anticuerpos anti-ADL+ en pacientes seropositivos, hallazgo consistente en los diferentes análisis realizados.
Debido al fenómeno de interferencia que puede presentarse por la presencia de ADL en el suero, la muestra de sangre para hacer la cuantificación de anticuerpos anti-ADL fue tomada el día de la aplicación del medicamento, y antes de su administración en todos los pacientes, por lo que se considera que las condiciones para realizar las determinaciones de anticuerpos anti-ADL fueron óptimas; sin embargo, existe una limitación y es que al ser ELISA la técnica utilizada para la determinación únicamente estamos detectando los anticuerpos anti-ADL libres y no los unidos a ADL (complejos inmunes), por lo que la presencia real de anticuerpos anti-ADL puede estar subvalorada con estos resultados8,24.
Una de las limitantes de este estudio fue la necesidad de obtener datos de registros históricos, lo cual nos introdujo sesgos en la información para los análisis y limitó el impacto de los resultados.
A pesar de que los valores encontrados sugieren una fuerte asociación entre la seropositividad en AR y la presencia de anticuerpos anti-ADL, estos resultados deben ser interpretados con precaución, dado el número de pacientes evaluados, pues es probable que al estudiar un mayor número de pacientes la estimación del efecto de la seropositividad en el desarrollo de anticuerpos anti-ADL cambie en dirección y magnitud.
FinanciaciónAsociación Colombiana de Reumatología, Riesgo de Fractura, CAYRE, IPS.
Conflicto de interesesNinguno.
Asociación Colombiana de Reumatología, Riesgo de Fractura, CAYRE, IPS.