La psoriasis es una enfermedad crónica asociada con múltiples comorbilidades, incluida la enfermedad inflamatoria intestinal. Sin embargo, no existen estudios previos en Colombia sobre la relación de los síntomas gastrointestinales en pacientes con psoriasis.
ObjetivosSe determinó la frecuencia de síntomas sugestivos de enfermedad gastrointestinal y autoanticuerpos asociados en pacientes con psoriasis, y su relación con la actividad de la misma. Además, se comparó con controles sanos.
Materiales y métodosEstudio transversal con componente analítico que incluyó una encuesta de síntomas y el análisis sérico de autoanticuerpos sugestivos de enfermedad gastrointestinal en casos y controles.
ResultadosOchenta y cuatro individuos analizados, distribuidos en 44 casos y 40 controles. El 64% de los casos tenían psoriasis leve y el 36% presentó psoriasis moderada a severa. El 71, el 16 y el 14% fueron tratados con tratamientos tópicos, orales y biológicos, respectivamente. Los principales síntomas gastrointestinales fueron distensión abdominal (45%), estreñimiento (39%) y fatiga (34%). La comparación arrojó una mayor prevalencia de síntomas gastrointestinales en los casos, y la variable fatiga fue estadísticamente significativa (p: 0,04). Solo el perfil de autoanticuerpos antinucleares fue estadísticamente significativo (0 vs. 43%; p: 0,001). No se encontró asociación con actividad de la enfermedad.
ConclusionesLa prevalencia de síntomas y autoanticuerpos sugestivos de enfermedad gastrointestinal en pacientes se considera importante, a pesar de no mostrar diferencias significativas con los controles. Algunos pacientes con síntomas gastrointestinales mostraron autoanticuerpos positivos. Esto sugiere la necesidad de un seguimiento clínico adecuado. El dermatólogo tiene un papel decisivo en el manejo integral de los pacientes.
Psoriasis is a chronic disease associated with multiple comorbidities including inflammatory intestinal disease. There are no previous studies in Colombia regarding the relationship of gastrointestinal symptoms in patients with psoriasis.
ObjectiveTo determine the frequency of symptoms and autoantibodies suggestive of gastrointestinal disease in patients with psoriasis, and to compare the results with healthy controls, as well as their relationship with disease activity.
Materials and methodsCross-sectional study with an analytical component, including a questionnaire on symptoms and serum analysis of antibodies suggestive of gastrointestinal disease in cases and controls.
ResultsThe analysis included 84 individuals, separated into groups of 44 cases and 40 controls. Mild psoriasis was observed in 64% of cases, and the remaining 36% had moderate to severe psoriasis. Topical treatments were given to 71% of cases, with another 16% using oral treatments, and 14% received biological treatment. The main symptoms of gastrointestinal disease were, abdominal distention (45%), constipation (39%), and fatigue (34%). A comparison showed a higher prevalence of gastrointestinal symptoms in cases vs. controls, and fatigue was statistically significant (P=.04). Only the antinuclear autoantibodies in the serum analysis were statistically significant (0 vs. 43%; P=.01).
ConclusionsThe prevalence of symptoms and autoantibodies suggestive of gastrointestinal disease in patients with psoriasis is considered important, even although there are no significant differences when compared with healthy controls. Some patients with gastrointestinal symptoms had positive autoantibodies. This suggests that an adequate clinical follow-up should be carried out. Dermatologists have a decisive role in the integral management of patients.
La psoriasis es una enfermedad multifactorial, inflamatoria, crónica, que se caracteriza por la proliferación exagerada de los queratinocitos. Esta proliferación exagerada es secundaria a una activación del sistema inmune mediado por linfocitos T1,2. Se considera una enfermedad inflamatoria sistémica con un alto impacto en la calidad de vida de los pacientes, se ha relacionado con otras enfermedades concomitantes como la artritis psoriásica, la enfermedad cardiovascular, el hígado graso no alcohólico, la enfermedad inflamatoria intestinal, el linfoma, el cáncer de piel, la ansiedad y la depresión3.
Dentro de las comorbilidades gastrointestinales estudiadas, la enfermedad inflamatoria intestinal (enfermedad de Crohn y colitis ulcerosa) y enfermedad celíaca han mostrado asociación con dicha entidad3.
La enfermedad de Crohn es un trastorno crónico que se asocia a una respuesta inmune inadecuada. Es un trastorno inflamatorio granulomatoso y cicatrizante4. Puede afectar cualquier parte del tubo digestivo desde la boca hasta el ano. Su compromiso suele presentarse de manera segmentaria, aunque su localización más frecuente es el íleon. Sus síntomas principales son la presencia de diarrea y dolor abdominal. Su diagnóstico se basa en la combinación de la sospecha clínica y pruebas de laboratorio como reactantes de fase aguda y marcadores fecales, endoscopia, biopsia y hallazgos radiológicos. En el curso de la enfermedad es común encontrar periodos de actividad que alternan con periodos de remisión4.
Diferentes marcadores serológicos han sido estudiados en asociación con la enfermedad de Crohn, como los anticuerpos antinucleares (ANA), los anticuerpos anti-Saccharomyces cerevisiae (ASCA) y el patrón dirigido contra el citoplasma del neutrófilo (pANCA). Se ha observado una mayor prevalencia de ASCA en los pacientes con enfermedad de Crohn y de pANCA en la colitis ulcerosa5.
La colitis ulcerosa es una enfermedad crónica que se caracteriza por ulceración de las mucosas superficiales y se acompaña de sangrado rectal, diarrea y dolor abdominal. A diferencia de la enfermedad de Crohn, esta se limita a la capa mucosa y afecta el colon de manera continua. Dentro de las manifestaciones extraintestinales, la colangitis primaria esclerosante y las artropatías inflamatorias son las más importantes. Su inmunopatogénesis no está del todo entendida, pero se cree que existen unos mecanismos desregulados mediados por el sistema inmune en respuesta a antígenos en individuos genéticamente predispuestos. Se ha descrito un papel importante de factores ambientales, como la microbiota intestinal y los mecanismos de defensa de la barrera intestinal6. Los autoanticuerpos que han mostrado una mayor relación con la colitis ulcerosa son lo ANCA, encontrándose pANCA y ANCA atípico en el 50-70% de los pacientes6.
La asociación entre psoriasis y enfermedad gastrointestinal ha sido estudiada. Vías inflamatorias y genéticas comunes entre la psoriasis y la enfermedad inflamatoria intestinal han sido descritas7–16, la epidemiología de la relación entre psoriasis y enfermedad inflamatoria intestinal se encuentra pobremente definida. Varios estudios han mostrado un aumento en la prevalencia e incidencia con diferentes grados de asociación y otra ausencia de la misma11,15.
Einarsdottir et al., en 2009 describieron la asociación de variantes de nucleótidos únicos (SNP) en el IL23R en pacientes con enfermedad inflamatoria intestinal con enfermedad de Crohn y la colitis ulcerosa en pacientes con psoriasis encontrando una asociación significativa7.
Cohen et al., reportaron que la psoriasis tiene una asociación más fuerte con la enfermedad de Crohn que con la colitis ulcerosa16. De manera similar, un estudio de cohorte entre mujeres en EE. UU. encontró un aumento en el riesgo de la enfermedad de Crohn entre pacientes con psoriasis (RR: 3,86 [IC 95%: 2,23-6,67]) mientras que el riesgo de colitis ulcerosa se atenuó y no fue estadísticamente significativo (RR: 1,17 [IC 95%: 0,41-3,36])11.
Li et al., en 2013 evaluaron la asociación entre psoriasis, artritis psoriásica, colitis ulcerosa y enfermedad de Crohn en una población de 174.476 mujeres11. La asociación se confirmó por medio de historias clínicas que confirmaran el diagnóstico de psoriasis o artritis psoriásica, y por medio de cuestionarios de enfermedad inflamatoria intestinal y registro médico previo. Se documentaron 188 casos incidentes de enfermedad de Crohn y 240 de colitis ulcerosa. La psoriasis se asoció con enfermedad de Crohn. No se observó un aumento significativo en el riesgo en la asociación de colitis ulcerosa y psoriasis11.
En el estudio previamente mencionado, analizando conjuntamente ambas cohortes, las mujeres con psoriasis experimentaron un aumento significativo del riesgo de enfermedad de Crohn, pero no de colitis ulcerosa. El riesgo de enfermedad de Crohn fue especialmente evidente en pacientes con psoriasis y artritis psoriásica concomitante (RR: 6,43 [IC 95%: 2,04-20,32]). Por lo tanto, existe un aumento en el riesgo de incidencia de enfermedad de Crohn asociado con psoriasis y con artritis psoriásica concomitante11.
Por otro lado, la asociación entre psoriasis y enfermedad celíaca ha mostrado diferentes resultados, predominando un bajo grado de asociación17. Zamani et al., en una población de 328 pacientes con psoriasis reportan una prevalencia del 0,3% de enfermedad celíaca sin encontrar una asociación significativa entre estas 2 enfermedades18. De otro lado, De Bastiani et al., en un estudio multicéntrico de cuidado primario demostraron una alta prevalencia de enfermedad celíaca en pacientes con psoriasis, con mejoría de las lesiones de piel posterior a 6 meses de dieta libre de gluten19.
Por todo lo anterior, se considera importante preguntar a los pacientes con psoriasis acerca de la presencia de síntomas gastrointestinales, incluyendo presencia de diarrea, sangre en heces, dolor durante la deposición, urgencia, tenesmo rectal y presencia de dolor abdominal3. Siempre que exista un síntoma o más se debe remitir al paciente a gastroenterología. Si el paciente presenta enfermedad inflamatoria intestinal y psoriasis se debe hacer un manejo multidisciplinario. Así mismo puede existir un subdiagnóstico de enfermedad inflamatoria intestinal en los pacientes con psoriasis dado que los síntomas gastrointestinales suelen atribuirse a los efectos secundarios de los medicamentos.
Este es el primer estudio en Colombia que buscó determinar la frecuencia de síntomas sugestivos de enfermedad gastrointestinal y de autoanticuerpos como ANA, ASCA, pANCA, anti-transglutaminasa (tGT) y anti-péptido gliadina (DGP) en un grupo de pacientes con psoriasis, asociándolo con su actividad y comparándolo con individuos sanos.
Materiales y métodosSe realizó un estudio de corte transversal con componente analítico en el Hospital Militar Central de Bogotá, Colombia, con 44 pacientes de la consulta externa de la clínica de psoriasis y 40 controles no pareados que presentaran hábitos de vivienda, así como de estilo vida y laborales similares. No se realizó cálculo del tamaño de la muestra, se tomaron los pacientes atendidos por el servicio de dermatología de la institución en un año, que voluntariamente accedieran participar en el estudio, muestreo no probabilístico por conveniencia, excluyéndose cerca de un 30%20.
Los criterios de inclusión de los casos fueron: individuos mayores de 18 años con diagnóstico de psoriasis seleccionados por dermatólogos con más de 5 años de experiencia del Hospital Militar Central1. Los controles fueron varones y mujeres no hospitalarios, elegidos al azar, mayores de 18 años, sin psoriasis, que firmaron el consentimiento informado. Además, los criterios de exclusión tanto de casos como de controles fueron: presencia de enfermedad psiquiátrica o neurológica que intervenga en la decisión de participar en el estudio. Además de individuos con neoplasias autoinflamatorias, enfermedades autoinmunes y tratamiento con antibióticos en los últimos 3 meses, pacientes con diagnóstico de síndrome de intestino irritable, enfermedad inflamatoria intestinal o enfermedad celíaca.
A los casos y controles se les realizó el siguiente interrogatorio en la consulta (síntomas en los últimos 6 meses): presencia de dolor abdominal, diarrea (considerada más de 3 deposiciones al día y la duración en semanas)21, fiebre, pérdida de peso, sangrado en las deposiciones, moco en las deposiciones, incontinencia nocturna, estreñimiento, dolor con la defecación, náuseas o vómito, pérdida de apetito, presencia de distensión abdominal, número de deposiciones diarias, consistencia de las deposiciones, intolerancia a algún alimento y de qué tipo, tratamiento sistémico actual, si los síntomas gastrointestinales iniciaron después de iniciar el medicamento y si tiene un diagnóstico previo gastrointestinal.
A los casos se les realizó la escala Psoriasis Area Severity Index (PASI), y adicionalmente se clasificó la psoriasis según la severidad: psoriasis leve, paciente que se encuentra en tratamiento tópico con PASI menor de 10; psoriasis moderada a severa, paciente con PASI mayor a 10 o en tratamiento con fototerapia o inmunomodulación sistémica tradicional o biológica22.
Se les realizaron análisis de marcadores serológicos en el laboratorio de inmunología del Hospital Militar Central y en el laboratorio Quimiolab Ltda. Se utilizaron pruebas inmunoenzimáticas para la determinación de autoanticuerpos anti-tGT IgG/IgA, autoanticuerpos anti-DGP IgG/IgA y ASCA IgG/IgA. Todas se realizaron en ensayos basados en la técnica ELISA.
La determinación de cada anticuerpo se realizó de manera independiente para determinar cada isotipo específico y, además se cuantificó la IgA total por nefelometría cinética, puesto que algunos pacientes con enfermedades autoinmunes pueden padecer déficit congénito de esta inmunoglobulina indicando que la interpretación de los ASCA y tGT debe hacerse con base en los datos de la cuantificación de IgG. Finalmente, la determinación de ANCA y ANA se realizó por inmunofluorescencia indirecta (IFI).
Determinación de ASCA (AESKULISA®, Ref 3508 y 3507, Aesku Diagnostics, Wendelsheim, Alemania)La determinación de anticuerpos ASCA IgG/IgA se realizó con una técnica basada en ELISA para la detección cuantitativa en suero humano usando un valor de referencia positivo >18IU/ml. Las determinaciones positivas se realizaron de manera independiente (para determinar qué isotipo específico es el que estaba positivo) junto con la cuantificación total de IgA.
Determinación de anti-tTG y anti-DGP (AESKULISA®, Ref 3510, 3511, 3512, 3515, 3513 y 3514, Aesku Diagnostics, Wendelsheim, Alemania)Se usó un método de inmunoanálisis en fase sólida para detectar cuantitativamente anticuerpos IgG e IgA en suero contra neoepítopos de transglutaminasa tisular y anticuerpos dirigidos contra péptidos sintéticos desaminados derivados de gliadina con valores de referencia positivos >24UI/ml.
Determinación de ANCA y ANA por inmunofluorescencia indirecta (AESKULISA®, Ref 54.200, 54.201 y 55.100, Aesku Diagnostics, Wendelsheim, Alemania)Las mediciones de neutrófilos se realizaron en láminas fijadas con etanol y formalina por ensayo IFI para la determinación semicuantitativa de anticuerpos dirigidos contra el citoplasma de neutrófilos en suero humano. Los valores de referencia positivos para ANCA fueron >1:20 y para ANA fueron >1:80. Se confirmaron por ELISA todas las pruebas positivas para ANCA por IFI (AESKULISA®, Ref 3301, Aesku Diagnostics, Wendelsheim, Alemania) (elastasa, lactoferrina, mieloperoxidasa, proteinasa 3, catepsina G, lisozima y proteína que aumenta la permeabilidad bactericida).
Las mediciones de las variables obtenidas a partir del cuestionario de síntomas gastrointestinales, el tipo de severidad de la psoriasis, el PASI y el análisis de autoanticuerpos permitieron construir una base de datos en la hoja de cálculo de Microsoft Office Excel® v. 8.0 para luego ser importada al software estadístico SPSS® 17 para realizar el procesamiento de la información con base en distribución de frecuencias, porcentajes, medidas de tendencia central de dispersión y de relación, según la naturaleza cuantitativa y cualitativa de las variables sociodemográficas.
Para las variables cuantitativas se analizaron medidas de tendencia central, de acuerdo con su distribución, como mediana y medidas de dispersión como rango intercuartílico. Con las variables cualitativas se calcularon frecuencias relativas y proporciones. Se realizó inferencia de la proporción de casos positivos obteniendo intervalos de confianza del 95%. Para la asociación estadística en variables categóricas se utilizó la prueba de Chi-cuadrado, de Pearson o de Fisher, de acuerdo con el número de observaciones obtenidas, con un valor de significación estadística de p<0,05.
El estudio fue aprobado por el Comité de Investigaciones y de Ética del Hospital Militar Central (2014-057).
ResultadosSe analizaron 64 individuos con psoriasis y 55 controles siendo seleccionados 84 individuos (n=84), 44 pacientes con diagnóstico de psoriasis y 40 controles, de los cuales en total el 60% eran varones y el 40% mujeres. La edad promedio de la muestra fue de 48,6±18,1 años. Entre los casos, 30 (68%) eran de sexo masculino y 14 (32%) de sexo femenino, la edad promedio fue de 58,1±16 años. Con respecto a los controles reclutados (n=40), el 52% eran de sexo masculino y el 47% de sexo femenino, con una edad promedio de 38±13 años (tabla 1).
Entre los casos, el PASI absoluto promedio fue de 4,4±5,4, teniendo un PASI>10 en el 11% de los pacientes. Veintiocho (63%) de los pacientes fueron clasificados como psoriasis grado leve y 16 (36,4%) severa. Con respecto al tratamiento el 71% recibía tratamiento tópico, el 16% tratamiento sistémico oral y el 14% tratamiento biológico. Del total de pacientes que recibían tratamiento sistémico 13 (30%), 4 (9,1%) recibían metotrexato, 3 (7,0%) adalimumab, 3 (7,0%) etanercept, uno (2,3%) inflximab y 2 (4,5%) ustekinumab.
En cuanto a la frecuencia de dolor abdominal fue mayor en pacientes sin ser resultado con diferencia estadística (53 vs. 47%; p: 0,95), pérdida de peso (80 vs. 20%; p: 0,21), sangre en deposiciones (56 vs. 44%; p: 0,56), estreñimiento (53 vs. 47%; p: 0,91), pérdida de apetito (60 vs. 40%; p: 0,51), náuseas/vómito (57 vs. 43%; p: 0,55), distensión abdominal (64 vs. 35%; p: 0,08) en pacientes con psoriasis que en los controles, ningún resultado anterior fue estadísticamente significativo. La diarrea fue más prevalente en los controles (30%), al igual que la fiebre (15%), y como síntoma no asociado a trastornos gastrointestinales los pacientes presentaron fatiga en un 71 vs. 29% en los controles, p: 0,04.
Por otro lado, el 20% de los pacientes con psoriasis estaban con tratamiento oral, de los cuales 2 reportaron sangrado en deposiciones, que estaban recibiendo metotrexato.
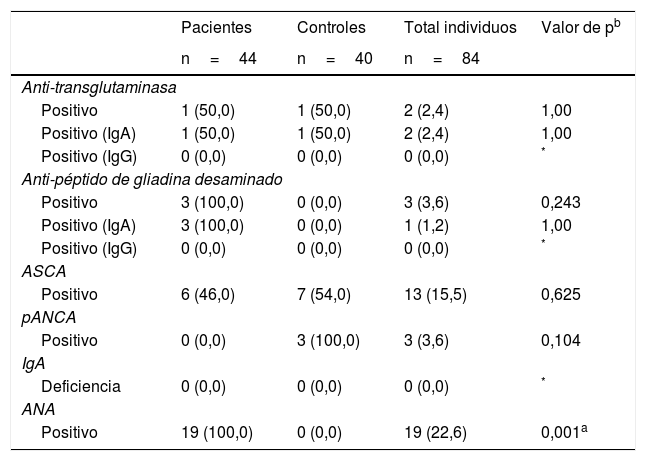
El estudio de autoanticuerpos serológicos en el total de la muestra (casos y controles) reportó que 2 (2%) pacientes fueron positivos para anti-tTG IgA/IgG (los 2 para anti-tTG IgA), 3 (4%) para anti-DGP IgA/IgG (uno positivo para anti-DGP IgA y ninguno para anti-DGP IgG), 13 (16%) tenían ASCA positivo, 3 (4%) pANCA positivos, 19 (23%) ANA positivos y ninguno tenían déficit de IgA.
Al comprar los resultados de autoanticuerpos entre casos y controles no hubo diferencias estadísticamente significativas, con excepción de los ANA los cuales fueron negativos para la totalidad de los controles y positivos para 43% de los casos (p: 0,001) (tabla 2).
Autoanticuerpos asociados a trastornos gastrointestinales en pacientes con psoriasis y controles sanos
| Pacientes | Controles | Total individuos | Valor de pb | |
|---|---|---|---|---|
| n=44 | n=40 | n=84 | ||
| Anti-transglutaminasa | ||||
| Positivo | 1 (50,0) | 1 (50,0) | 2 (2,4) | 1,00 |
| Positivo (IgA) | 1 (50,0) | 1 (50,0) | 2 (2,4) | 1,00 |
| Positivo (IgG) | 0 (0,0) | 0 (0,0) | 0 (0,0) | * |
| Anti-péptido de gliadina desaminado | ||||
| Positivo | 3 (100,0) | 0 (0,0) | 3 (3,6) | 0,243 |
| Positivo (IgA) | 3 (100,0) | 0 (0,0) | 1 (1,2) | 1,00 |
| Positivo (IgG) | 0 (0,0) | 0 (0,0) | 0 (0,0) | * |
| ASCA | ||||
| Positivo | 6 (46,0) | 7 (54,0) | 13 (15,5) | 0,625 |
| pANCA | ||||
| Positivo | 0 (0,0) | 3 (100,0) | 3 (3,6) | 0,104 |
| IgA | ||||
| Deficiencia | 0 (0,0) | 0 (0,0) | 0 (0,0) | * |
| ANA | ||||
| Positivo | 19 (100,0) | 0 (0,0) | 19 (22,6) | 0,001a |
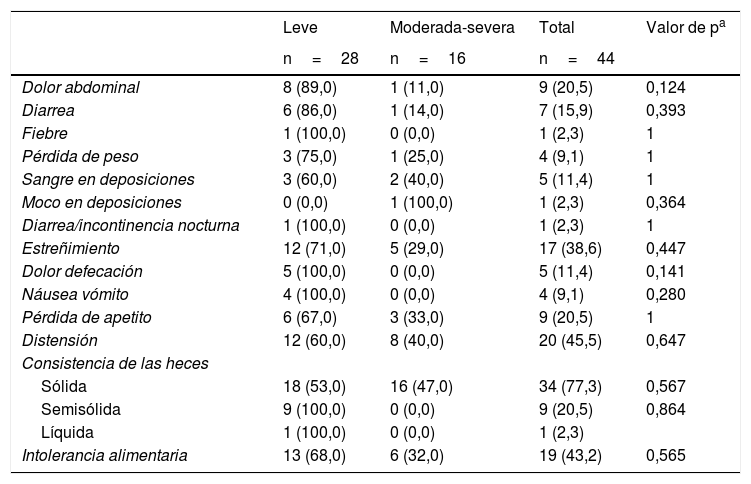
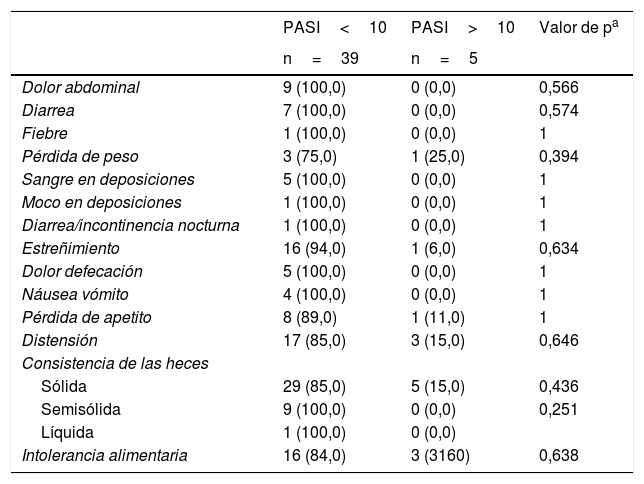
Se contrastaron los síntomas de enfermedad gastrointestinal y autoanticuerpos con la severidad, el PASI y el sexo del paciente. Referente a la severidad, los pacientes con psoriasis leve (PASI<10) presentaron mayor sintomatología gastrointestinal comparados con pacientes con psoriasis moderada-severa (PASI>10) sin presentar hallazgos estadísticamente significativos (tablas 3 y 4).
Asociación entre severidad de psoriasis y síntomas relacionados con enfermedad gastrointestinal
| Leve | Moderada-severa | Total | Valor de pa | |
|---|---|---|---|---|
| n=28 | n=16 | n=44 | ||
| Dolor abdominal | 8 (89,0) | 1 (11,0) | 9 (20,5) | 0,124 |
| Diarrea | 6 (86,0) | 1 (14,0) | 7 (15,9) | 0,393 |
| Fiebre | 1 (100,0) | 0 (0,0) | 1 (2,3) | 1 |
| Pérdida de peso | 3 (75,0) | 1 (25,0) | 4 (9,1) | 1 |
| Sangre en deposiciones | 3 (60,0) | 2 (40,0) | 5 (11,4) | 1 |
| Moco en deposiciones | 0 (0,0) | 1 (100,0) | 1 (2,3) | 0,364 |
| Diarrea/incontinencia nocturna | 1 (100,0) | 0 (0,0) | 1 (2,3) | 1 |
| Estreñimiento | 12 (71,0) | 5 (29,0) | 17 (38,6) | 0,447 |
| Dolor defecación | 5 (100,0) | 0 (0,0) | 5 (11,4) | 0,141 |
| Náusea vómito | 4 (100,0) | 0 (0,0) | 4 (9,1) | 0,280 |
| Pérdida de apetito | 6 (67,0) | 3 (33,0) | 9 (20,5) | 1 |
| Distensión | 12 (60,0) | 8 (40,0) | 20 (45,5) | 0,647 |
| Consistencia de las heces | ||||
| Sólida | 18 (53,0) | 16 (47,0) | 34 (77,3) | 0,567 |
| Semisólida | 9 (100,0) | 0 (0,0) | 9 (20,5) | 0,864 |
| Líquida | 1 (100,0) | 0 (0,0) | 1 (2,3) | |
| Intolerancia alimentaria | 13 (68,0) | 6 (32,0) | 19 (43,2) | 0,565 |
Asociación entre PASI y síntomas relacionados con enfermedad gastrointestinal
| PASI<10 | PASI>10 | Valor de pa | |
|---|---|---|---|
| n=39 | n=5 | ||
| Dolor abdominal | 9 (100,0) | 0 (0,0) | 0,566 |
| Diarrea | 7 (100,0) | 0 (0,0) | 0,574 |
| Fiebre | 1 (100,0) | 0 (0,0) | 1 |
| Pérdida de peso | 3 (75,0) | 1 (25,0) | 0,394 |
| Sangre en deposiciones | 5 (100,0) | 0 (0,0) | 1 |
| Moco en deposiciones | 1 (100,0) | 0 (0,0) | 1 |
| Diarrea/incontinencia nocturna | 1 (100,0) | 0 (0,0) | 1 |
| Estreñimiento | 16 (94,0) | 1 (6,0) | 0,634 |
| Dolor defecación | 5 (100,0) | 0 (0,0) | 1 |
| Náusea vómito | 4 (100,0) | 0 (0,0) | 1 |
| Pérdida de apetito | 8 (89,0) | 1 (11,0) | 1 |
| Distensión | 17 (85,0) | 3 (15,0) | 0,646 |
| Consistencia de las heces | |||
| Sólida | 29 (85,0) | 5 (15,0) | 0,436 |
| Semisólida | 9 (100,0) | 0 (0,0) | 0,251 |
| Líquida | 1 (100,0) | 0 (0,0) | |
| Intolerancia alimentaria | 16 (84,0) | 3 (3160) | 0,638 |
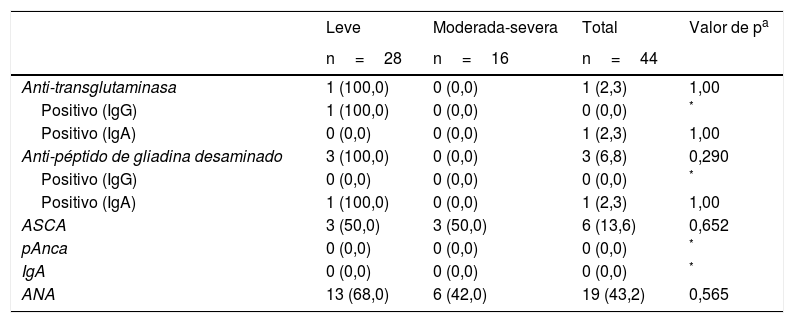
Adicionalmente, el 68% de pacientes con ANA positivos, el 50% de pacientes con ANCA positivos y la totalidad de pacientes con anti-tTG y anti-DGP positivos tenían psoriasis grado leve (tabla 5). Así mismo, el 100% de pacientes con anti-tTG, anti-DGP positivos, el 83% con ASCA positivos y el 84% con ANA positivos tenían PASI<10. Estas diferencias no fueron estadísticamente significativas.
Asociación entre severidad de psoriasis y autoanticuerpos relacionados con enfermedad gastrointestinal
| Leve | Moderada-severa | Total | Valor de pa | |
|---|---|---|---|---|
| n=28 | n=16 | n=44 | ||
| Anti-transglutaminasa | 1 (100,0) | 0 (0,0) | 1 (2,3) | 1,00 |
| Positivo (IgG) | 1 (100,0) | 0 (0,0) | 0 (0,0) | * |
| Positivo (IgA) | 0 (0,0) | 0 (0,0) | 1 (2,3) | 1,00 |
| Anti-péptido de gliadina desaminado | 3 (100,0) | 0 (0,0) | 3 (6,8) | 0,290 |
| Positivo (IgG) | 0 (0,0) | 0 (0,0) | 0 (0,0) | * |
| Positivo (IgA) | 1 (100,0) | 0 (0,0) | 1 (2,3) | 1,00 |
| ASCA | 3 (50,0) | 3 (50,0) | 6 (13,6) | 0,652 |
| pAnca | 0 (0,0) | 0 (0,0) | 0 (0,0) | * |
| IgA | 0 (0,0) | 0 (0,0) | 0 (0,0) | * |
| ANA | 13 (68,0) | 6 (42,0) | 19 (43,2) | 0,565 |
Al relacionar las variables por el sexo dentro de los casos llama la atención, que las mujeres refirieron mayor fiebre (100%), incontinencia fecal nocturna (100%), pérdida de apetito (56%), distensión (55%), dolor abdominal (67%) e intolerancia alimentaria (58%) que los varones, siendo estos 3 últimos síntomas significativos estadísticamente (p: 0,003, p: 0,001, p: 0,003, respectivamente). La comparación del perfil de autoanticuerpos por sexo no arrojó diferencias estadísticamente significativas (tabla 6).
Asociación entre autoanticuerpos y síntomas relacionados con enfermedad gastrointestinal de acuerdo con el sexo
| Masculino | Femenino | Valor de pb | |
|---|---|---|---|
| n=30 | n=14 | ||
| Anti-transglutaminasa | 1 (100,0) | 0 (0,0) | 1,00 |
| Positivo (IgG) | 0 (0,0) | 0 (0,0) | * |
| Positivo (IgA) | 1 (100,0) | 0 (0,0) | 1,00 |
| Anti-péptido de gliadina desaminado | 1 (33,0) | 2 (67,0) | 0,234 |
| Positivo (IgG) | 0 (0,0) | 0 (0,0) | - |
| Positivo (IgA) | 1 (100,0) | 0 (0,0) | 1,00 |
| ASCA | 6 (100,0) | 0 (0,0) | 0,15 |
| pANCA | 0 (0,0) | 0 (0,0) | * |
| IgA | 0 (0,0) | 0 (0,0) | * |
| ANA | 14 (74,0) | 5 (26,0) | 0,495 |
| Dolor abdominal | 3 (33,0) | 6 (67,0) | 0,01a |
| Diarrea | 3 (43,0) | 4 (57,0) | 0,18 |
| Fiebre | 0 (0,0) | 1 (100,0) | 0,318 |
| Pérdida de peso | 3 (75,0) | 1 (25,0) | 1,00 |
| Sangre en deposiciones | 3 (60,0) | 2 (40,0) | 0,647 |
| Moco en deposiciones | 1 (100,0) | 0 (0,0) | 1,00 |
| Diarrea/incontinencia nocturna | 0 (0,0) | 1 (100,0) | 0,318 |
| Estreñimiento | 10 (59,0) | 7 (41,0) | 0,290 |
| Dolor defecación | 3 (60,0) | 2 (40,0) | 0,647 |
| Náusea vómito | 2 (50,0) | 2 (50,0) | 0,581 |
| Pérdida de apetito | 4 (44,0) | 5 (56,0) | 0,086 |
| Fatiga | 11 (73,0) | 4 (27,0) | 0,598 |
| Distensión | 9 (45,0) | 11 (55,0) | 0,003a |
| Consistencia de las heces | |||
| Sólida | 25 (73,0) | 9 (27,0) | 0,197 |
| Semisólida | 5 (56) | 4 (44,0) | 0,185 |
| Líquida | 0 (0) | 1 (100,0) | |
| Intolerancia alimentaria | 8 (42) | 11 (58,0) | 0,003a |
Augustin et al., en el 2010 en Alemania, reportaron los resultados de 2 estudios de corte transversal, el primero realizado en adultos y el segundo en una población pediátrica, se encontró una asociación entre enfermedad de Crohn y psoriasis con una prevalencia del 0,92% PR=2,06 (IC 95%: 1,84-2,31) y del 0,51% PR=3,69 (IC 95%: 2,15-6,35), respectivamente23. Makredes et al., en el 2009 encuentran un aumento en el riesgo de enfermedad de Crohn asociado a psoriasis y a artritis psoriásica con un aumento en este riesgo, cuando estas 2 últimas se presentan de manera concomitante con RR de 1,6 (IC 95%: 1,4-2,0) para psoriasis y RR de 2,1 (IC 95%: 1,3-3,3) para artritis psoriásica18.
De allí el interés por determinar la frecuencia de síntomas sugestivos de enfermedad gastrointestinal y de autoanticuerpos asociados, en un grupo de pacientes colombianos con psoriasis, y asociarla con la actividad clínica además de compararla con controles sanos.
Se encontró mayor frecuencia de síntomas gastrointestinales en los pacientes con psoriasis: dolor abdominal, pérdida de peso, sangre en deposiciones, estreñimiento, pérdida de apetito, náuseas/vómito, sin diferencias estadísticamente significativas, y una tendencia importante para la distensión abdominal, esto está acorde con varias de las publicaciones previamente descritas que asocian la psoriasis con la presencia de síntomas de enfermedad gastrointestinal7–9. Sin embargo, vale la pena comentar que la población general presentó síntomas asociados a trastornos gastrointestinales, lo cual se ha reportado en varios estudios. Identificándose grupos de síntomas como: estreñimiento, flatulencia, presión abdominal, hinchazón abdominal, reflujo ácido, diarrea, pesadez intestinal, dolor intestinal, ardor y dolor gástrico, entre otros. A pesar de ser menores, estos problemas tienen un gran impacto en la vitalidad y la autoimagen, así como en el bienestar emocional, social y físico. Los encuestados consideraron que el estilo de vida, los alimentos y las funciones desordenadas son los principales factores responsables24,25.
Interesantemente, los pacientes con psoriasis leve (PASI<10) presentaron una tendencia a presentar mayor sintomatología gastrointestinal comparada con pacientes con psoriasis moderada-severa (PASI>10). Sin embargo, no se encontraron asociaciones entre el perfil de autoanticuerpos y la severidad de la enfermedad. Todo esto posiblemente dado el tamaño de la muestra analizada.
Como era de esperar, algunos de los pacientes con sintomatología gastrointestinal mostraron positividad en autoanticuerpos. Los ASCA son más comunes en la enfermedad de Crohn y los pANCA en la colitis ulcerosa con una sensibilidad del 45-60% y una especificidad del 85-95%5. Sin embargo, la toma de estos no hace parte del algoritmo diagnóstico de la enfermedad de Crohn5. Dentro de nuestros casos, 8 presentaron ASCA positivos en ausencia de pANCA, siendo este autoanticuerpo el más prevalente entre los casos, sin embargo, ninguno presentó síntomas asociados con enfermedad de Crohn, pero este estudio serológico puede ser útil para inducir la búsqueda de enfermedad inflamatoria en general hacia el diagnóstico clínico en este grupo de pacientes6. Realmente hay bastante controversia en la prevalencia de los estudios previos frente a síntomas gastrointestinales, algunos describen asociaciones entre psoriasis y enfermedad inflamatoria intestinal, reportando hasta 4 veces más que la población general26,27, 2,5 veces más para enfermedad de Crohn y 1,6 para colitis ulcerosa28,29, y muy poco hay reportado sobre los niveles de autoanticuerpos asociados en este tipo de pacientes.
Los ANA fueron negativos para la totalidad de los controles y positivos para el 43% de los casos con psoriasis. Entre los pacientes con psoriasis en placa, los ANA se encontraron en el 25% de los sujetos y en el 80% de los pacientes con artritis psoriásica. Después del tratamiento se encontró un aumento en el título o la aparición de anticuerpos en el 66,7% en el grupo de infliximab, el 18,2% en el grupo de etanercept y el 54,7% en el grupo de adalimumab. En el grupo de pacientes estudiado 7 recibieron terapia con anti-TNF encontrándose dentro del grupo de ANA con títulos positivos 4 de ellos30.
Por otro lado, encontramos 2 pacientes con psoriasis leve con serología sugestiva de enfermedad celíaca dado por positividad de anticuerpos anti-tTG IgA y anti-DPG con ausencia aún de síntomas específicos de la enfermedad, lo cual es una frecuencia baja, y que está acorde con los hallazgos controversiales de asociación entre psoriasis y enfermedad celíaca descritos en la literatura18,19. De Bastiani et al., en el 2015 encontraron que 9/218 (4,1%) pacientes con psoriasis tuvieron anticuerpos tTG IgA en comparación con solo un individuo control (0,4%, p<0,05; OR: 2,03; IC 95%: 1,42-90,11). El diagnóstico de enfermedad celíaca se confirmó histológicamente en los 10 sujetos, a los 6 meses, se asoció con una gran mejoría de las lesiones cutáneas en 7 de 8 pacientes con psoriasis19. Los pacientes que presentaron sintomatología y serología sugestiva de enfermedad gastrointestinal fueron remitidos a gastroenterología para evaluación complementaria.
Dado que el 20% de los pacientes con psoriasis estaban con tratamiento oral con metotrexato, y algunos reportaron sangrado en deposiciones, por lo cual se debe tener en cuenta que medicamentos sistémicos comúnmente utilizados para el manejo de la psoriasis (p. ej., infliximab, adalimumab y metotrexato), el ustekinumab y la ciclosporina, pueden producir síntomas gastrointestinales secundarios al uso de estos13.
Es por esto que es necesario conocer los efectos secundarios gastrointestinales a la hora de iniciar un medicamento sistémico en los pacientes con psoriasis que precedan con síntomas gastrointestinales. Dentro de los efectos secundarios de los medicamentos sistémicos utilizados en el manejo de la psoriasis encontramos los siguientes: infliximab: dolor abdominal, diarrea, náuseas y dispepsia; adalimumab: dolor abdominal, náuseas y vómito; ustekinumab: diarrea; metotrexato: pérdida de apetito, náuseas, vómito, dolor abdominal, úlceras de la mucosa oral, estomatitis y dispepsia; ciclosporina: náuseas, vómito, dolor abdominal y diarrea13.
Es importante mencionar la frecuencia observada de la fatiga en este grupo de pacientes. Al igual que en otras enfermedades inflamatorias, la fatiga constituye un hallazgo clínico relevante en la psoriasis. Múltiples factores se encuentran involucrados en este proceso, dentro de los cuales se proponen interacciones complejas de la inflamación en la enfermedad psoriásica, tanto directamente a través de citoquinas inflamatorias como indirectamente a través de factores psicológicos y fisiológicos31. De otra manera, síntomas inespecíficos gastrointestinales si no se encuentran en un contexto clínico y serológico de enfermedad inflamatoria intestinal o celíaca, podrían encontrarse en enfermedades de mayor prevalencia en la población como el colon irritable (sin embargo, este fue un criterio de exclusión), o en enfermedades que pueden coexistir con mayor frecuencia en enfermedades crónicas inflamatorias como la fibromialgia, lo que podría constituir subgrupos que merecen estudios adicionales32,33.
En conclusión, es importante recalcar la importancia del dermatólogo al realizar el abordaje integral de los pacientes con psoriasis en donde un simple interrogatorio completo puede derivar en el adecuado estudio y manejo de las comorbilidades presentes, en este caso la enfermedad gastrointestinal, este es el primer estudio hasta nuestro conocimiento en Colombia de la frecuencia de síntomas y autoanticuerpos sugestivos de enfermedad gastrointestinal en una cohorte de pacientes con psoriasis. Futuros estudios con mayor número de pacientes en Colombia deben realizarse para el registro de esta interesante asociación y que permitan continuar en la búsqueda del manejo adecuado y mejoría en la calidad de vida de los pacientes con psoriasis.
FinanciaciónEste trabajo fue soportado por Aesku Diagnostics, Quimiolab Ltda y el Hospital Militar Central.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al laboratorio de Inmunología del Hospital Militar Central y a la Universidad El Bosque especialmente a Lorena Chila por el apoyo técnico en la ejecución de autoanticuerpos e inmunoglobulinas. Al señor Alejandro Ramos por la colaboración en la edición del manuscrito.