Entre un 15 y un 20% de los pacientes con fenómeno de Raynaud progresarán a una enfermedad autoinmune sistémica. La presencia de autoanticuerpos o alteraciones capilaroscópicas es fundamental para el diagnóstico temprano.
ObjetivosDeterminar las características de la videocapilaroscopia del lecho ungular y de los anticuerpos antinucleares en una cohorte de pacientes con enfermedad autoinmune sistémica.
Materiales y métodosSe realizó un estudio transversal en sujetos con fenómeno de Raynaud. Estos fueron evaluados con videocapilaroscopia y anticuerpos antinucleares. Las variables cualitativas se describieron con frecuencias absolutas y relativas; las variables cuantitativas, según la distribución de los datos, se reportaron como media o mediana, con desviación estándar y rango intercuartílico, respectivamente.
ResultadosSe incluyeron 58 individuos; el 91,4% eran mujeres. La edad promedio fue 40,9±14,1 años. En 41 sujetos, los anticuerpos antinucleares fueron positivos; el patrón más común fue el moteado (41,5%), con una mediana de dilución de 1:640 (rango intercuartílico 1:320-1:1.280). Se encontró enfermedad autoinmune sistémica en 10 individuos (19,2%), 8 de ellos con esclerosis sistémica. Las alteraciones capilares más frecuentes fueron: megacapilares (n=10), microhemorragias (n=10) y zonas avasculares (n=8).
ConclusionesEn este grupo de pacientes con fenómeno de Raynaud sometidos a videocapilaroscopia, el diagnóstico de enfermedad autoinmune sistémica fue realizado en un porcentaje similar a lo reportado en la literatura. Se encontró una mayor dilución de anticuerpos antinucleares que la descrita.
Between 15 and 20% of patients with Raynaud's phenomenon will progress to a systemic autoimmune disease. The presence of autoantibodies or capillaroscopy alterations are fundamental for early diagnosis.
ObjectivesTo determine the characteristics of nailfold videocapillaroscopy and antinuclear antibodies in a cohort of patients with systemic autoimmune disease.
Materials and methodsA cross-sectional study was conducted in subjects with Raynaud's phenomenon. These were evaluated with videocapillaroscopy and antinuclear antibodies. The qualitative variables were described with absolute and relative frequencies. The quantitative variables, according to the distribution of data, were reported as mean or median, with standard deviation and interquartile range, respectively.
ResultsThe study included 58 individuals, of which 91.4% were women. The mean age was 40.9±14.1 years. Antinuclear antibodies were positive in 41 subjects. The most common pattern was speckled (41.5%), with a median dilution of 1:640 (interquartile range 1:320-1:1,280). A systemic autoimmune disease was found in 10 (19.2%) patients, 8 of them with systemic sclerosis. The most frequent capillary alterations were: mega-capillaries (n=10), micro-haemorrhages (n=10), and avascular zones (n=8).
ConclusionsIn this group of patients with Raynaud's phenomenon subjected to videocapillaroscopy, a diagnosis of systemic autoimmune disease was made in a similar percentage to that reported in the literature. A higher dilution of antinuclear antibodies was found than that described.
El fenómeno de Raynaud (FR) se define como un vasoespasmo secundario a una alteración de la microvasculatura capilar, que genera episodios de cianosis, palidez y eritema reactivo1. Su prevalencia en la población general oscila entre un 3-5% y se divide en: primario (no asociado a enfermedad sistémica) y secundario (a enfermedades: metabólicas, vasculares, neoplásicas o reumatológicas, y a medicamentos); las causas secundarias representan, aproximadamente, un 20% de los casos de FR2.
De las causas de FR secundario, las enfermedades autoinmunes sistémicas (EAS) son las más frecuentes (esclerosis sistémica, lupus eritematoso sistémico, síndrome de Sjögren, enfermedad mixta del tejido conectivo, vasculitis sistémicas y miopatías inflamatorias, entre otras)3. En este grupo de entidades, el FR es, con frecuencia, su evento centinela (esto ocurre en el 90% de los individuos con esclerosis sistémica y el 85% de aquellos con enfermedad mixta del tejido conectivo)4,5.
En las EAS, el comportamiento del FR es agresivo y puede llevar a complicaciones locales (úlceras, necrosis y sobreinfección digitales), con riesgo inminente de amputación. Adicionalmente el FR, en estas enfermedades, se relaciona con compromiso orgánico visceral (especialmente hipertensión arterial pulmonar), manifestación que tiene una considerable morbimortalidad6,7.
Dada la importancia de diferenciar el FR primario del secundario, una de las técnicas no invasivas, reproducible y efectiva para la evaluación de la microcirculación es la videocapilaroscopia del lecho ungular (VLU)8; este procedimiento permite observar anormalidades morfológicas como desorden de la arquitectura capilar, aumento del diámetro de los capilares, hemorragias, disminución del número de capilares y angiogénesis, que apuntan a daño endotelial. Incluso, en 2013, la European League Against Rheumatism y el American College of Rheumatology incluyeron la VLU en los criterios clasificatorios de la esclerosis sistémica9. Este método, junto con los anticuerpos antinucleares (ANA), permite detectar pacientes que progresarán a EAS entre 2 y 10 años antes7,10. Esta detección precoz de EAS permite hacer una vigilancia estricta del paciente y establecer estrategias de tamización de compromiso orgánico visceral, mejorando el tratamiento e impactando la morbimortalidad.
Los trabajos disponibles de VLU y EAS fueron diseñados, en su mayoría, como modelos predictivos y solo se centran en los hallazgos capilaroscópicos con seguimiento a mediano plazo11–15; luego de una extensa búsqueda de la literatura, en América Latina, no se encontró ninguna información relacionada con este tópico; se consultaron las bases de datos: SciELO, Publindex, Latindex, Imbiomed, Lilacs y los términos de búsqueda, en inglés y español, de 2010 a 2017, fueron: enfermedad de Raynaud, angioscopia microscópica, anticuerpos antinucleares y enfermedades autoinmunes.
El objetivo de este estudio fue determinar las características de la VLU y de los ANA en una cohorte de pacientes con EAS del noroccidente colombiano.
MétodosDiseño y población de estudioSe llevó a cabo un estudio transversal, en pacientes con FR, en un centro de alta complejidad, institución de referencia regional en VLU del noroccidente colombiano, que cumplieran los criterios internacionales de consenso vigentes para la clasificación del FR16, entre octubre de 2015 y septiembre de 2016, mayores de 18 años, que aceptaron participar de manera voluntaria en el estudio y que firmaran el consentimiento informado.
Los criterios de elegibilidad específicos para la presencia de FR fueron16:
Respuesta afirmativa a las preguntas:
- •
¿Sus dedos son inusualmente sensibles al frío?
- •
¿Ocurren cambios de color bifásicos durante los episodios de vasoespasmo?
Y cumplir, al menos, 3 de los siguientes 7 criterios:
- •
Presencia de factores precipitantes diferentes al frío.
- •
Compromiso de ambas manos, aunque sea asincrónico y asimétrico.
- •
Episodios acompañados de disestesias o parestesias.
- •
Cambios de coloración persistentes; con un límite bien demarcado entre la piel afectada y la no afectada.
- •
Fotos del paciente compatibles.
- •
Episodios que ocurran en varias partes del cuerpo (nariz, pabellones auriculares, aréolas, pies).
- •
Cambios de color trifásicos durante los episodios.
Se excluyeron sujetos con:
- •
Tabaquismo activo (consumo actual de cualquier cantidad de tabaco).
- •
Diagnóstico previo de EAS.
- •
Causas secundarias (vasculitis, enfermedades vasculares primarias, enfermedades hematológicas, neoplasias sólidas, causas neurovegetativas, enfermedades del sistema nervioso central y endocrinas, medicamentos y tóxicos).
Una vez se obtuvo el aval del comité de investigación en salud de la institución participante, a todos los sujetos se les practicó una VLU con un equipo Optilia, utilizando un lente ×200 y el software OptiPix (Optilia Instruments; Sollentuna, Suecia), verificando el cumplimiento de requisitos previos al procedimiento, tales como: uñas descubiertas de sustancias que reduzcan la visibilidad del lecho capilar (esmaltes, acrílicos, geles) o manipulación de la cutícula (manicura, onicofagia) 2 semanas antes de la VLU.
Este procedimiento se realizó siguiendo los estándares internacionales: evaluación de los dedos índice al meñique de ambas manos, en un cuarto a temperatura ambiente (26-32°C), previa aplicación de acetite de almendras; se tomaron 4 fotos por dedo, de forma consecutiva, en la región central de estos17. Se evitó hacer una presión exagerada sobre la superficie ungular, ya que se podía interrumpir el flujo sanguíneo e interferir en las imágenes. Se evaluó la primera fila de asas capilares, y el conteo de estas, así como su tamaño, fueron acordes a los parámetros internacionales16.
La realización de la VLU, así como su interpretación, fue llevada a cabo por 2 reumatólogos certificados por el Servicio de Capilaroscopia de la Universidad de Génova (Italia), quienes antes del inicio de esta investigación participaron en una prueba de estandarización en la clasificación de los patrones y hallazgos capilaroscópicos, con el fin de establecer la concordancia interobservador; en esta prueba se incluyeron 100 imágenes cegadas, seleccionadas al azar, provenientes tanto de controles sanos como de pacientes con alguna alteración capilaroscópica; el coeficiente kappa, en esta estandarización, fue 0,84 (IC 95% 0,66-1,0), calificándose como muy bueno. Para la calificación de los hallazgos capilares (número, aumento anormal del tamaño, megacapilares, microhemorragias, ramificaciones y desorganización) se utilizó el método semicuantitativo descrito por Sulli et al.18 validado en una cohorte de referencia19.
Con respecto a las pruebas de laboratorio, la velocidad de sedimentación globular (VSG) y los ANA se realizaron en un laboratorio de referencia para la realización de estos procedimientos, utilizándose las técnicas convencionales (Westergren e inmunofluorescencia indirecta, respectivamente).
En el momento de la realización de la capilaroscopia, los investigadores recogieron la información de las variables de interés para este estudio a partir de la anamnesis, el examen físico, los hallazgos en la VLU y los registros de exámenes de laboratorio. Se diseñó un formulario de recogida de datos electrónico utilizando la herramienta MagPi™ y se realizó una prueba piloto en la que se incluyeron los primeros 10 pacientes, con el fin de estimar el tiempo necesario por paciente para la obtención de la información y realizar los ajustes necesarios, garantizando la confiabilidad del proceso.
Se recogieron las siguientes variables: demográficas y epidemiológicas (edad, sexo, antecedentes personales, historia familiar de FR o de EAS); relacionadas con el FR (fecha de inicio, fases, frecuencia de brotes al año, fecha del último brote); paraclínicas (VSG, ANA); capilaroscópicas (número de capilares/mm, presencia de hemorragias, megacapilares, neovascularización y patrón) según la nomenclatura vigente20, y diagnóstico de EAS (esclerosis sistémica, lupus eritematoso sistémico, enfermedad mixta del tejido conectivo, enfermedad indiferenciada del tejido conectivo, miopatías inflamatorias, artritis reumatoide, síndrome de Sjögren y síndrome antifosfolípido) según los criterios clasificatorios vigentes21, confirmados por los reumatólogos participantes.
Una vez finalizada la recogida de la información, esta se exportó a una hoja de cálculo electrónica en Microsoft Excel® 2010, donde se recodificaron las variables que lo requirieron y se exploró la consistencia de los datos antes de su posterior análisis.
Para controlar los posibles sesgos en los que se podía incurrir, se aplicaron las siguientes estrategias: se organizó una discusión entre los investigadores del protocolo y del proceso de recogida de la información; la base de datos se creó con campos con restricciones para evitar errores en la digitación de los datos; además, se evaluó semanalmente la calidad de los datos, se exploró la consistencia interna y, en caso de duda, se confrontó la información con las fuentes primarias. Con respecto a los ANA, solo se consideraron las diluciones iguales o mayores a 1:320, en donde solo el 3% de la población general tendría esta dilución de anticuerpos.
Análisis estadísticoEn la prueba de estandarización previa a este estudio, la concordancia interobservador para la lectura de los patrones capilaroscópicos (normal, alteraciones menores e inespecíficas y esclerosis sistémica) se determinó mediante la estimación del coeficiente kappa ponderado cuadrático y su respectivo intervalo de confianza. Este coeficiente fue interpretado teniendo en cuenta la siguiente guía propuesta por Landis y Koch: pobre o débil para valores menores de 0,40; moderada para valores entre 0,41 y 0,60; buena o sustancial entre 0,61 y 0,80, y excelente o casi perfecto para valores entre 0,81 y 122. Se obtuvo una concordancia interobservador de 0,84 (0,66-1,0), considerada excelente.
Las variables cualitativas se describieron como frecuencias absolutas y relativas; las variables cuantitativas, según la distribución de los datos, se reportaron como medias y medianas, con desviación estándar y rango intercuartílico (RIQ), respectivamente.
Consideraciones éticasEsta investigación se considera de riesgo mínimo y contó con el aval ético institucional del proyecto y del consentimiento informado de cada uno de sus participantes.
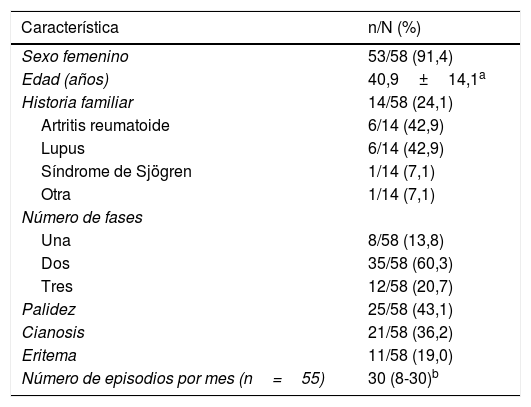
ResultadosCaracterísticas generalesDurante el período de estudio se evaluaron 239 pacientes, de los cuales 58 cumplieron con los criterios de elegibilidad; 53 (91,4%) eran mujeres. La edad promedio fue 40,9±14,1 años; el tiempo de evolución del FR tuvo una mediana de 3,1 años (RIQ 3,1-8,9). Otras características de los sujetos se muestran en la tabla 1.
Características clínicas y demográficas en una cohorte de pacientes con fenómeno de Raynaud
| Característica | n/N (%) |
|---|---|
| Sexo femenino | 53/58 (91,4) |
| Edad (años) | 40,9±14,1a |
| Historia familiar | 14/58 (24,1) |
| Artritis reumatoide | 6/14 (42,9) |
| Lupus | 6/14 (42,9) |
| Síndrome de Sjögren | 1/14 (7,1) |
| Otra | 1/14 (7,1) |
| Número de fases | |
| Una | 8/58 (13,8) |
| Dos | 35/58 (60,3) |
| Tres | 12/58 (20,7) |
| Palidez | 25/58 (43,1) |
| Cianosis | 21/58 (36,2) |
| Eritema | 11/58 (19,0) |
| Número de episodios por mes (n=55) | 30 (8-30)b |
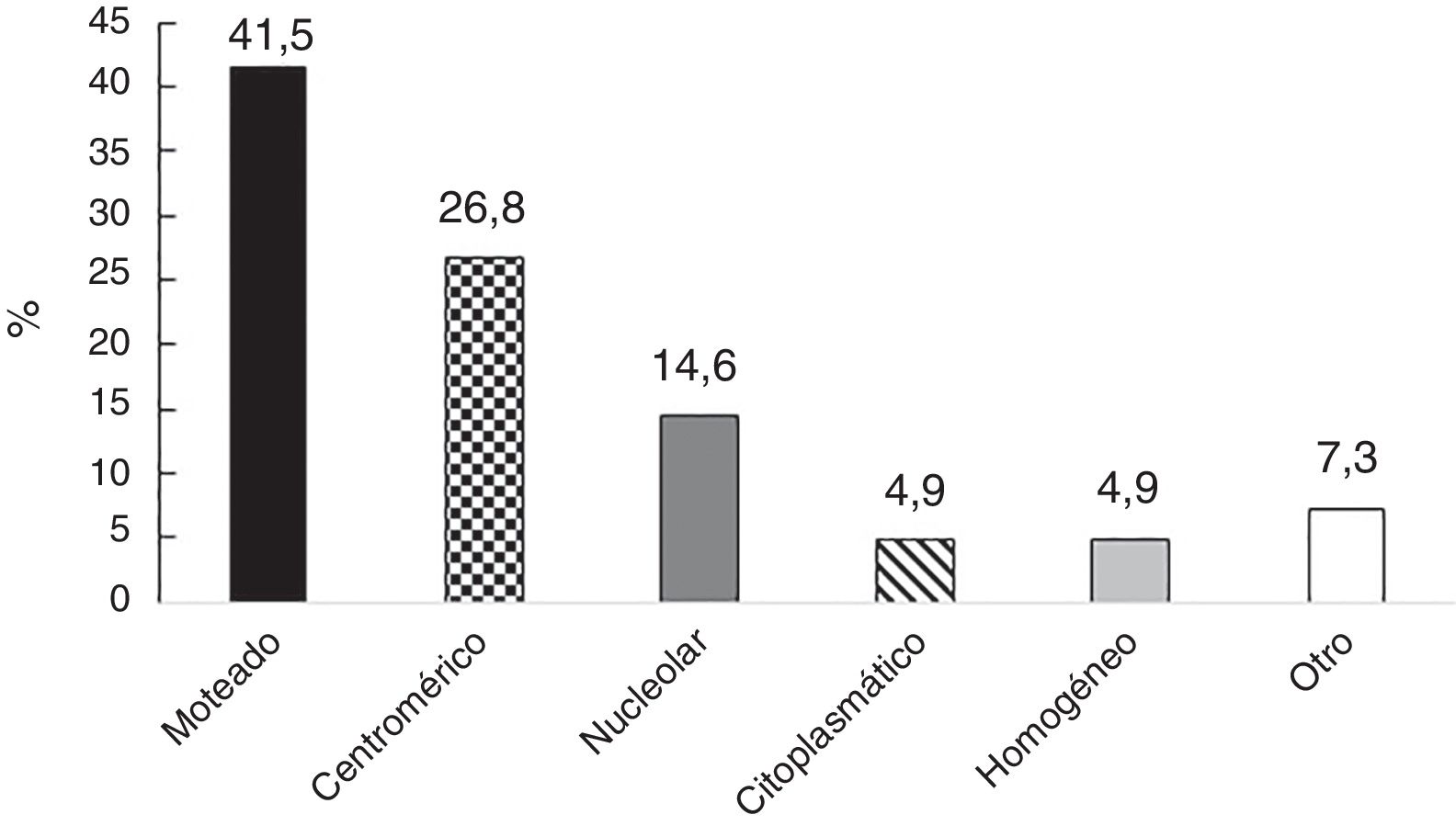
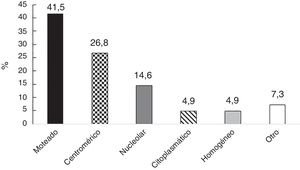
En 41 de 55 individuos (70,7%), los ANA fueron positivos; los patrones más comunes fueron: moteado y centromérico (fig. 1). La información sobre las diluciones de los ANA estuvo disponible en 36 sujetos; en estos, la mediana fue 1:640 (RIQ 1:320-1:1.280). Con respecto a la VSG, la mediana fue de 9mm/h (RIQ 4-13).
Presencia de enfermedad autoinmune sistémicaEn 10 pacientes (19,2%) se encontró EAS: 7 individuos con esclerosis sistémica limitada, 2 con enfermedad mixta del tejido conectivo y uno con esclerosis sistémica difusa. En el caso de los 7 pacientes con esclerosis sistémica limitada, el diagnóstico se basó en el cumplimiento de los criterios clasificatorios de esclerosis sistémica ACR/EULAR de 2013: esclerodactilia, FR, anormalidades capilaroscópicas y autoanticuerpos relacionados positivos; en el caso de esclerosis sistémica difusa, se cumplieron los criterios de: engrosamiento cutáneo proximal a las articulaciones metacarpofalángicas, FR, anormalidades capilaroscópicas y autoanticuerpos relacionados positivos; en los 2 sujetos con diagnóstico de enfermedad mixta del tejido conectivo se cumplieron los criterios de Kahn y Alarcón-Segovia (anti-RNP positivo, edema difuso de manos y dedos, sinovitis y FR).
Al describir algunas características de los pacientes según la presencia o ausencia de EAS, se encontró que ningún individuo con EAS tenía FR unifásico y la frecuencia de FR bifásico fue mayor en los sujetos con EAS que en los pacientes sin EAS (80 vs. 60%); la fase cianótica fue la más frecuente en pacientes con EAS (60 vs. 31,3%). El perfil del patrón de ANA en estos sujetos se muestra en la tabla 2. En este grupo de pacientes, la dilución de los ANA estuvo disponible en 9 de ellos; la mediana fue 1:1.280 (RIQ 1:640-1:2.560).
Perfil de anticuerpos antinucleares en una cohorte de pacientes con enfermedad autoinmune sistémica y fenómeno de Raynaud
| Esclerosis sistémica limitada (n=7) | Esclerosis sistémica difusa (n=1) | Enfermedad mixta del tejido conectivo (n=2) | |
|---|---|---|---|
| ANA positivos | 6 | 1 | 2 |
| Patrón ANA | |||
| Moteado | 1 | 1 | 1 |
| Centromérico | 4 | 1 | |
| Nucleolar | 1 |
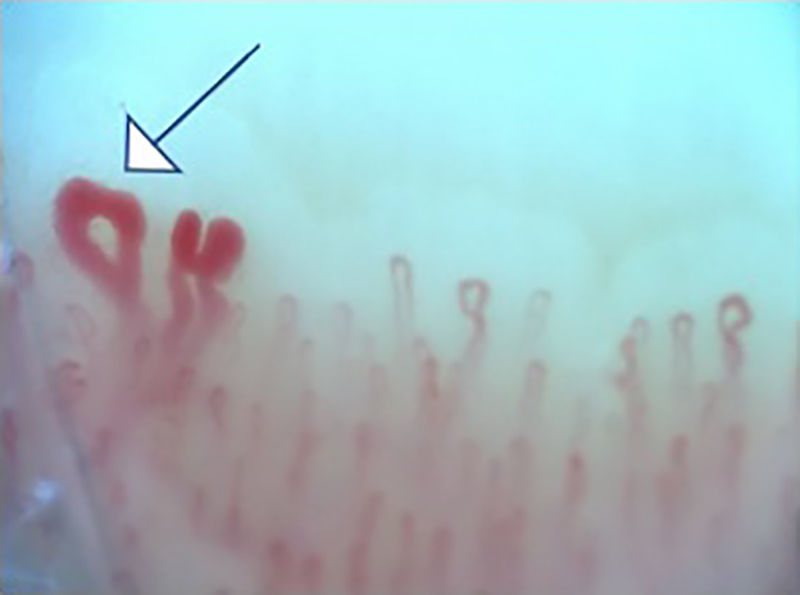
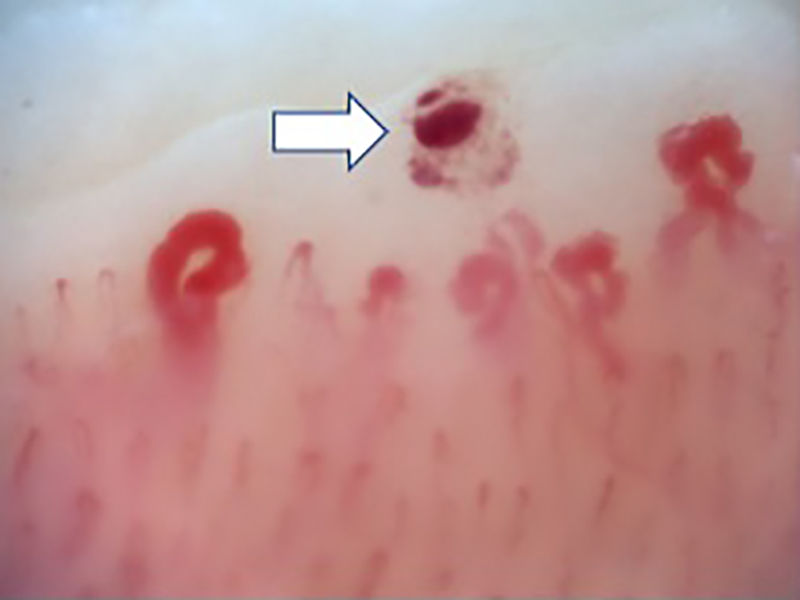
Las alteraciones capilaroscópicas más frecuentes en los pacientes con EAS fueron: presencia de megacapilares (n=10), microhemorragias (n=8), zonas avasculares (n=8), neovascularización (n=6) y desorganización capilar (n=6); en 54 pacientes de la cohorte pudo medirse el diámetro capilar; la mediana fue de 25um (RIQ 16-48).
En los 8 pacientes con esclerosis sistémica, el mayor diámetro capilar encontrado fue de 72,4um (desviación estándar 33,8); la mediana del número de capilares por milímetro fue de 7 (RIQ 6-8) en los sujetos con esclerosis sistémica limitada. Los patrones capilaroscópicos en la cohorte total de pacientes y en los subgrupos según la presencia o no de EAS se describen en la tabla 3. En los sujetos sin EAS, la capilaroscopia fue normal en el 60% de los casos; en los individuos con EAS, el 80% tuvo un patrón de esclerosis sistémica activo y tardío.
Hallazgos capilaroscópicos en una cohorte de pacientes con fenómeno de Raynaud
| Parámetros | Total (n=58) | Enfermedad autoinmune sistémica (n=10) | Sin enfermedad autoinmune sistémica (n=42) |
|---|---|---|---|
| n (%) | n (%) | n (%) | |
| Patrón | |||
| Normal | 28 (48,3) | 0 | 25 (59,5) |
| Alteraciones inespecíficas | 16 (27,6) | 2 (20) | 12 (28,5) |
| Patrón de esclerosis sistémica | |||
| Activo | 5 (8,6) | 3 (30) | 1 (2,4) |
| Temprano | 5 (8,6) | 3 (30) | 2 (4,8) |
| Tardío | 2 (3,4) | 2 (20) | 0 |
| «Scleroderma-like» | 2 (3,4) | 2 (4,8) |
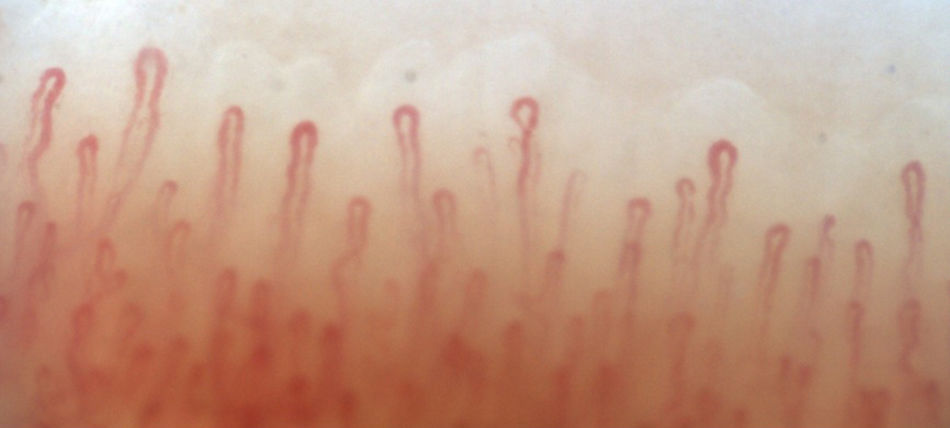
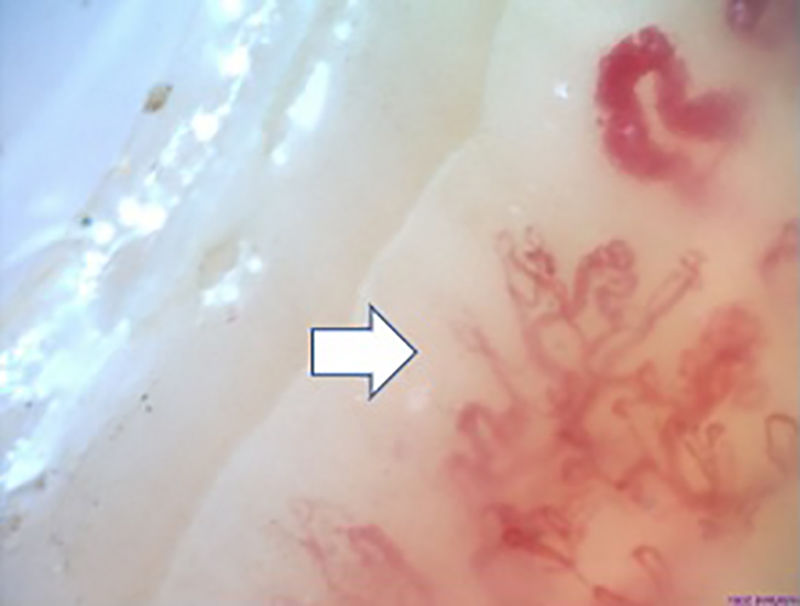
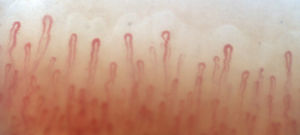
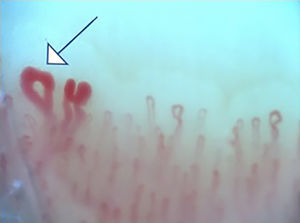
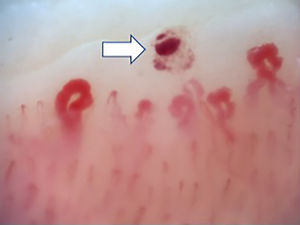
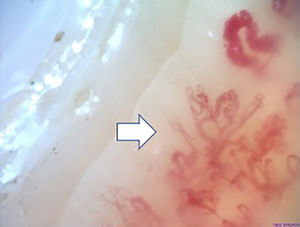
La figura 2 ilustra los hallazgos capilaroscópicos normales en sujetos con FR primario; las figuras 3-5 reflejan los patrones y las anormalidades más llamativas en los pacientes con diagnóstico de EAS.
El principal hallazgo de este estudio fue que, en pacientes con FR, se encontró EAS en un 19,2%, encontrándose hallazgos particulares en la VLU y en los ANA. Este es un resultado llamativo y poco explorado en la literatura; la mayoría de la información se enfoca en modelos pronósticos y de transición de FR primario a secundario que incluyen estas herramientas diagnósticas12,13. Bernero et al. analizaron 2.065 pacientes con FR primario, encontrando que 565 (27,3%) de ellos tenían hallazgos videocapilaroscópicos basales, pero no se hace una descripción de estos y no se mencionan los ANA23. Secchi et al. condujeron un estudio en 120 pacientes italianos con FR primario; la videocapilaroscopia presentó hallazgos no específicos en el 10%; tampoco se detallan estos hallazgos, al igual que no hay información acerca del perfil de anticuerpos24.
Con respecto a las características de esta cohorte, estas son similares a lo publicado en la literatura; Moinzadeh et al., en un estudio de 569 individuos, reportan una edad promedio de 43±13 años, 85% mujeres25, similar a lo reportado por Pavlov-Dolijanovic et al.14. La diferencia principal del presente trabajo con estas series fue el menor tiempo de evolución del FR (mediana de 13 años en el trabajo de Moinzadeh y de 5,3 años en la cohorte de Pavlov-Dolijanovic); se cree que la razón de esta diferencia podría ser que en Colombia, un país tropical, y Medellín, una ciudad con temperaturas templadas, la aparición del FR usualmente genera una pesquisa diagnóstica y los pacientes son remitidos de manera más precoz, a diferencia de Europa, donde, por las variaciones estacionales, el FR es una entidad mucho más frecuente y solo se remite a los sujetos con signos de alarma.
Asimismo, en los criterios de FR primario se incluía la edad menor de 25 años como parte del diagnóstico; aunque es un dato clínico orientador, no es indispensable16; los resultados del presente trabajo corroboran esta afirmación, ya que la edad de inicio del FR fue mayor y no hubo diferencias significativas entre los pacientes con y sin EAS. Otras características, como el número de fases del FR y el número de ataques mensuales, son similares a lo reportado en la literatura.
Con respecto a los ANA, se resalta su alta frecuencia en esta cohorte. Wollersheim et al., en 101 pacientes con FR, encontraron ANA positivos en un 28%26; esta diferencia puede explicarse, tal vez, por las técnicas utilizadas para la determinación de autoanticuerpos (inmunofluorescencia indirecta en el presente estudio vs. inmunoblot en el estudio de Wollersheim et al.). Aunque es llamativa esta frecuencia, no debe olvidarse que los ANA tienen muy baja especificidad para el diagnóstico de FR primario y ya no están incluidos en los criterios clasificatorios16; además, pueden estar presentes hasta en el 30% de la población general a títulos de 1:4027.
De igual manera, otro hallazgo significativo fueron los altos títulos de ANA en los pacientes con EAS; este hallazgo evidencia el hecho de que, a mayores diluciones de ANA, la posibilidad de una EAS aumenta y que la probabilidad de que estos títulos estén presentes en la población general es menor del 3%24. También este hallazgo está en concordancia con lo reportado por Hirschl et al., quienes encuentran que los títulos de ANA mayores de 1:320 se asociaron a un mayor riesgo de desarrollar una EAS en pacientes con FR28.
Por otra parte, también fue llamativo el hallazgo de la VSG normal en la cohorte en general de pacientes con FR y en el grupo de individuos con EAS. Siempre se había planteado, desde los criterios de LeRoy y Medsger en 199229, que una VSG normal se asociaba a FR primario y que valores anormales hacían pensar en un FR secundario; sin embargo, los criterios clasificatorios actuales excluyen esta variable paraclínica, dada su baja especificidad16.
También se resaltan los hallazgos capilaroscópicos específicos en los sujetos con EAS; los resultados obtenidos en el presente estudio son similares a lo publicado en la literatura. Koenig et al.10 describieron las alteraciones basales más frecuentes en individuos con diagnóstico de esclerosis sistémica temprana, siendo las más comunes: la presencia de megacapilares, la pérdida moderada o grave de capilares y las telangiectasias aisladas. Tampoco se encontraron diferencias con respecto a los patrones capilaroscópicos; estos fueron compatibles con el diagnóstico de EAS más frecuente, que fue la esclerosis sistémica; además, los hallazgos individuales corresponden a la secuencia cronológica descrita por Cutolo et al.: aparición temprana de megacapilares y hemorragias; posterior aumento de estas (patrón activo), y, finalmente, pérdida de capilares, desorganización en la arquitectura y neovascularización (patrón tardío)30.
Un hallazgo llamativo fue la presencia, en 2 sujetos, de enfermedad mixta del tejido conectivo, donde el FR forma parte de los criterios clasificatorios, al igual que en la esclerosis sistémica; una serie brasilera describió las alteraciones capilaroscópicas en 63 pacientes utilizando estereomicroscopio; el 65% de ellos tenían un patrón «scleroderma-like», con la presencia de pocas zonas avasculares; los hallazgos capilaroscópicos en los sujetos del presente estudio son acordes con esta descripción31.
Por otra parte, analizando el comportamiento de los ANA con los hallazgos en la VLU, se encontraron mayores diluciones en los pacientes con EAS y cambios capilaroscópicos patológicos, hallazgo ratificado por Schlager et al. en una serie de 2.971 pacientes, donde el 26,9% de ellos tenían ANA positivos con una dilución mayor o igual a 1:160 y, de estos, el 29,5% con anormalidades capilaroscópicas. Hubo correlación de los ANA con la presencia de zonas avasculares, megacapilares, edema pericapilar, reducción de la densidad capilar, ramificaciones, hemorragias y dilataciones32. Moinzadeh et al.25 analizaron 569 pacientes con FR aislado. Se encontró que, en la visita basal, el 7% de estos sujetos tenían ANA positivos y el 17% tenían más de 3 alteraciones en la videocapilaroscopia; además, 7 de 8 individuos que desarrollaron esclerosis sistémica tenían patrón capilaroscópico compatible con este diagnóstico y ANA positivos, siendo ambas herramientas fundamentales para el diagnóstico de esta entidad9.
Se resaltan las fortalezas de este trabajo: hasta donde se sabe, es la primera serie de pacientes colombianos que describe la presencia de EAS en pacientes con FR primario con características particulares de los ANA y de la VLU; se aplicaron criterios clasificatorios estrictos y validados, y se realizó la evaluación capilaroscópica por 2 reumatólogos certificados en esta herramienta.
Se reconocen las limitaciones inherentes al diseño del estudio, ya que, para el diagnóstico específico de EAS, es fundamental el seguimiento clínico y paraclínico; en este momento se está conduciendo un estudio de seguimiento de esta misma cohorte que, se cree, aportará más información del comportamiento clínico y paraclínico de estos sujetos.
ConclusionesEn una cohorte de pacientes con FR, a quienes se les practicó una VLU, se encontró EAS en un 19,2%, frecuencia similar a lo reportado en la literatura. También se encontró una dilución alta de ANA en los pacientes con EAS, valor mayor que lo reportado en diferentes series.
FinanciaciónUniversidad Pontificia Bolivariana y Asociación Colombiana de Reumatología, a través de convocatorias de investigación. El trabajo no fue soportado por ninguna beca o por fondos de la industria farmacéutica.
Conflicto de interesesLos autores declaran la ausencia de cualquier conflicto de intereses.
A los pacientes que participaron en el estudio, cuya participación contribuyó, de manera fundamental, al mayor conocimiento de las enfermedades autoinmunes sistémicas.
A la Asociación Colombiana de Reumatología, por el apoyo económico por la Convocatoria de Investigación de 2015.
A las instituciones participantes.