Realizar una revisión narrativa no sistemática de la literatura sobre las diferentes manifestaciones hepáticas, correlación clínico-serológica y los efectos adversos derivados de la terapia, de las principales enfermedades autoinmunes sistémicas.
Materiales y métodosSe realizó una revisión narrativa no sistemática de la literatura desarrollada en idiomas inglés y español, acorde con el objetivo de estudio, para artículos referenciados entre los años 1964 y 2014, en bases de datos primarios como: Pubmed, Embase y Lilacs. Los términos MESH (medical subject headings) utilizados fueron: liver [Majr]; autoimmune diseases [Majr]; rheumatic diseases [Majr]; hepatotoxicity [Majr]; se combinaron utilizando operadores booleanos (AND, OR). Además, se usó la estrategia de agrupamiento retrógrado.
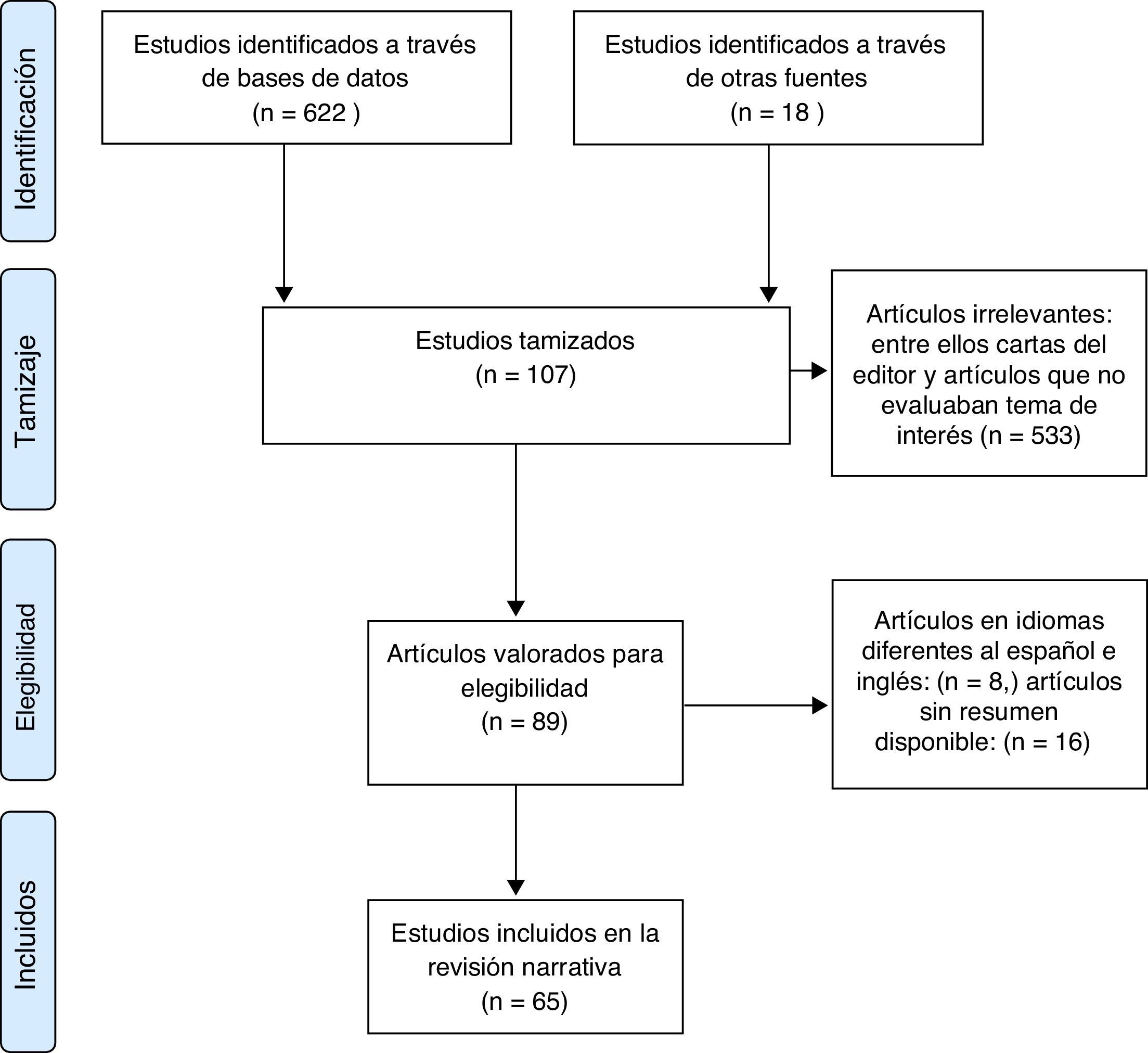
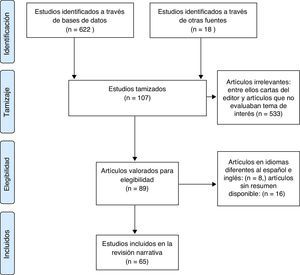
ResultadosSe identificaron 622 artículos para tamizaje: 604 resultados encontrados en bases de datos; 18 artículos por agrupación retrógrada. Después de revisar títulos y resúmenes, se excluyeron 533 artículos irrelevantes, entre ellos cartas del editor y artículos que no evaluaban los datos de interés, artículos en idiomas diferentes al español e inglés: 8, artículos sin resumen disponible: 16. En última instancia se identificaron 65 artículos en texto completo que brindaban la información necesaria para realizar la revisión.
ConclusionesEs importante para el clínico tener en cuenta y monitorizar la función hepática, no solo como parte de la búsqueda de eventos adversos derivados de la farmacoterapia, sino también como búsqueda de compromiso hepático primario que, en muchas ocasiones, puede ser el resultado de diferentes enfermedades autoinmunes sistémicas.
To perform a non-systematic narrative review of the literature, of the hepatic manifestations, clinical and serological correlations, and adverse effects of therapy, of the major systemic autoimmune diseases.
Materials and methodsA non-systematic narrative review of literature was performed, according to the objective of study, including articles by language (English and Spanish), date of publication (referenced articles between 1964 and 2014) in Pubmed, Embase and Lilacs databases. The MESH (medical subject headings) terms used were: liver [Majr]; autoimmune diseases [Majr]; rheumatic diseases [Majr]; hepatotoxicity [Majr]; they were combined using boolean operators (AND, OR). The retrograde grouping strategy was also used.
Results622 articles were identified for screening: 604 articles were found in databases, and 18 by retrograde grouping strategy. 533 articles were excluded: letters to the editor, irrelevant articles which not evaluate the data of interest, 8 articles in different languages to Spanish and English and 16 articles where the abstract were not available. After extensive review of titles and abstracts, 65 full-text articles that provided the information necessary to conduct the review, were identified and analyzed.
ConclusionsIt is important for the clinician to note and monitor the liver function, not only as part of the search for adverse events due to drug therapy, but also to look for primary liver involvement that may be the result of different systemic autoimmune diseases.
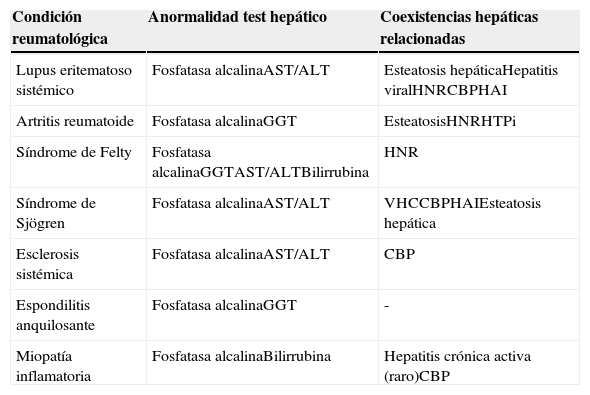
Durante el curso de las enfermedades autoinmunes sistémicas, también denominadas como no órgano específicas, uno de los órganos que puede afectarse con frecuencia es el hígado. La prevalencia, significado, hallazgos patológicos y clínicos varían de acuerdo con la entidad nosológica, infecciones, toxicidad medicamentosa, entre otros factores. Debido a esto es de vital importancia para el clínico estar atento al desarrollo de estas manifestaciones y tratar de realizar el diagnóstico diferencial, teniendo en cuenta que muchas de las enfermedades autoinmunes pueden tener manifestaciones hepáticas (tabla 1).
Anormalidades hepáticas reportadas en las enfermedades autoinmunes sistémicas
| Condición reumatológica | Anormalidad test hepático | Coexistencias hepáticas relacionadas |
|---|---|---|
| Lupus eritematoso sistémico | Fosfatasa alcalinaAST/ALT | Esteatosis hepáticaHepatitis viralHNRCBPHAI |
| Artritis reumatoide | Fosfatasa alcalinaGGT | EsteatosisHNRHTPi |
| Síndrome de Felty | Fosfatasa alcalinaGGTAST/ALTBilirrubina | HNR |
| Síndrome de Sjögren | Fosfatasa alcalinaAST/ALT | VHCCBPHAIEsteatosis hepática |
| Esclerosis sistémica | Fosfatasa alcalinaAST/ALT | CBP |
| Espondilitis anquilosante | Fosfatasa alcalinaGGT | - |
| Miopatía inflamatoria | Fosfatasa alcalinaBilirrubina | Hepatitis crónica activa (raro)CBP |
ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; CBP: cirrosis biliar primaria; GGT: gamma glutamil transferasa; HAI: hepatitis autoinmune; HNR: hiperplasia nodular regenerativa; HTPi: hipertensión portal idiopática; VHC: virus hepatitis C.
Modificada de Schlenker et al.8.
A continuación se exponen las principales patologías autoinmunes y las posibles manifestaciones hepáticas.
Materiales y métodosSe realizó una revisión narrativa no sistemática de la literatura desarrollada en idiomas inglés y español, acorde con el objetivo de estudio, para artículos referenciados entre los años 1964 y 2014, en bases de datos primarios como: Pubmed, Embase y Lilacs. Se utilizaron los siguientes términos en inglés: liver; hepatitis; hepatotoxicity; autoimmune rheumatic disease; lupus erythematosus systemic; rheumatoid arthritis; Sjögren syndrome; Still disease; systemic sclerosis; ankylosing spondylitis; polymyositis. La búsqueda y selección de los artículos se realizó de manera independiente por los diferentes autores y cada uno de ellos realizó lectura, análisis y redacción literaria que posteriormente fue estructurada y condensada en un texto común.
Los términos MESH (medical subject headings) utilizados fueron: liver [Majr]; autoimmune diseases [Majr]; rheumatic diseases [Majr]; hepatotoxicity [Majr]; se combinaron utilizando operadores booleanos (AND, OR). Además, se usó la estrategia de agrupamiento retrógrado (búsqueda en las referencias de los artículos recuperados y revisiones pertinentes).
Objetivo: realizar una revisión narrativa no sistemática de la literatura sobre las diferentes manifestaciones hepáticas, correlación clínico-serológica, y los efectos adversos derivados de la terapia de las principales enfermedades autoinmunes sistémicas.
Resultados: se identificaron 622 artículos para tamizaje: 604 resultados encontrados en bases de datos; 18 artículos por agrupación retrógrada. Después de revisar títulos y resúmenes, se excluyeron 533 artículos irrelevantes, entre ellos cartas del editor y artículos que no evaluaban los datos de interés, artículos en idiomas diferentes al español e inglés: 8; artículos sin resumen disponible: 16. En última instancia se identificaron 65 artículos en texto completo que brindaban la información necesaria para realizar la revisión (fig. 1).
Lupus eritematoso sistémicoEl hígado no es considerado un órgano blanco dentro del componente sistémico del lupus eritematoso sistémico (LES), a pesar que su compromiso ha sido bien documentado en las últimas décadas1–4.
Esta manifestación ha sido poco estudiada en comparación con otros órganos comprometidos, ya que el compromiso hepático sintomático y avanzado es raro, y sus hallazgos histopatológicos, en su mayoría, son inespecíficos, además, al no estar incluidos dentro de los criterios clasificatorios del LES, el clínico tiende a no tener en cuenta este compromiso.
En ocasiones es difícil diferenciar el compromiso hepático en el LES, ya que puede tener múltiples etiologías, entre ellas, el uso de fármacos potencialmente hepatotóxicos y favorecedores de esteatohepatitis, sobreposición con otras enfermedades autoinmunes o ser la manifestación de una hepatitis viral.
Como en las diferentes enfermedades autoinmunes las manifestaciones clínicas pueden tener un espectro amplio, desde cursar asintomáticas, como en general sucede, hasta el compromiso hepático avanzado, manifestado tardíamente como cirrosis hepática, incluso algunas que pueden comprometer la vida del paciente como la falla hepática aguda, con todo su espectro de signos y síntomas4.
La hepatomegalia evidenciada clínicamente tiene una incidencia amplia que varía de acuerdo con la cohorte analizada, pero se estima que oscila en el rango de 12-55%3,5.
Las anormalidades del perfil hepático se han reportado hasta en el 50% de los pacientes con LES, en algún punto de su enfermedad6, la importancia de este compromiso radica en determinar qué tanto de este es atribuible al LES, lo cual frecuentemente no es fácil y antes se deben descartar: condiciones previamente mencionadas, hepatotoxicidad (normalización de pruebas con la suspensión de medicamentos potencialmente tóxicos), esteatosis hepática inducida por fármacos, hepatitis virales (VHA, VHB, VHC, VHE, citomegalovirus, virus de Eptein-Barr, virus de la inmunodeficiencia humana), hepatitis autoinmune (HAI), cirrosis biliar primaria (CBP) y colangitis esclerosante primaria.
Las alteraciones del perfil hepático por lo general son leves (<2 veces el límite superior de lo normal y estas son, principalmente, elevaciones de aminotransferasas y fosfatasa alcalina (FA)7,8.
Además de la vigilancia de efectos adversos medicamentosos, la evaluación periódica de las aminotransferasas en el seguimiento clínico pueden detectar actividad de la enfermedad, pues se ha visto que las elevaciones de estas enzimas se correlacionan con la actividad del LES y mejoran con la inmunosupresión.
Otros posibles compromisos hepáticos en pacientes con LES son las coexistencias, los virajes inmunológicos y la sobreposición. En diferentes cohortes se ha documentado la coexistencia de LES con diferentes entidades clínicas, entre las cuales se encuentran la esteatosis hepática (72,6%), la hiperplasia nodular regenerativa (HNR), (6,8%), las hepatitis virales (4,1%), la CBP (2,7%) y la HAI (2,7%)8. Así mismo, existen reportes aislados de sobreposición de LES con colangitis esclerosante primaria, colangiopatía autoinmune, hepatitis granulomatosa e hipertensión portal idiopática8.
Entre otros grupos de enfermedades autoinmunes, el compromiso hepático puede derivarse de desórdenes vasculares, como en el contexto del síndrome antifosfolípido manifestándose con complicaciones tromboembólicas como el síndrome de Budd-Chiari, trombosis portal, enfermedad venooclusiva, infarto hepático e incluso rotura hepática espontánea8.
La hepatitis lúpica es una manifestación distinta que se presenta entre 6,1 a 24,5% de los pacientes con lupus9–11. Su presentación clínica es usualmente asintomática con un curso subclínico, que muestra una fluctuación paralela a la actividad del LES y en ocasiones simula una hepatitis viral aguda, siendo una entidad relativamente benigna sin progresión a enfermedad hepática terminal.
La apariencia histológica es amplia, aunque ciertos cambios se han identificado como característicos: infiltrado inflamatorio portal leve, sin necrosis lobular e infiltración grasa. Pese a esto, no hay hallazgos histopatológicos específicos de esta manifestación hasta la fecha. La hepatitis lúpica, por lo general, responde de forma favorable a la utilización de dosis, moderadas a altas, de prednisona sin progresión a enfermedad hepática terminal.
Su curso clínico y la respuesta a la terapia han permitido la clasificación en 3 diferentes patrones9:
- •
Remitente: mejoría de los síntomas y normalización de las transaminasas en un periodo de 12 meses, después del inicio del tratamiento y sostenido por al menos 6 meses en terapia de mantenimiento.
- •
No remitente: no evidencia de mejoría en los síntomas o en el nivel de transaminasas después de 12 meses del inicio del tratamiento.
- •
Recurrente: recurrencia de los síntomas después del descenso gradual de tratamiento, que requiere incremento en la inmunosupresión después de estar en remisión.
Zheng et al., analizaron una cohorte de 507 pacientes de los cuales se realizó el diagnóstico de hepatitis lúpica en 47 (9,3%). En esta cohorte la prevalencia de hepatitis lúpica en pacientes con LES activo fue mayor que en aquellos con LES inactivo (11,8 vs. 3,2%, p<0,05). En esta serie se evidenció una mayor preponderancia femenina (38 mujeres vs. 9 hombres), y dentro de las asociaciones clínicas una menor prevalencia de poliartralgias (36,2 vs. 54,8%) en los pacientes con hepatitis lúpica. Adicionalmente, estos pacientes presentaban mayores anormalidades hematológicas como leucopenia y trombocitopenia, además de hipocomplementemia. Los anticuerpos anti-Sm y anti-RNP fueron más prevalentes en los pacientes con hepatitis lúpica. Adicionalmente estos pacientes tuvieron puntajes mayores en índices de actividad como el SLEDAI.
Histopatológicamente la presentación clínica fue miscelánea y no específica, similar a otras enfermedades hepáticas, pero característicamente en la inmunopatología, de la gran mayoría, se observaron depósitos de la fracción C1q del complemento los cuales fueron negativos en otras enfermedades hepáticas. Lo que nos muestra este estudio es que si bien no tiene el compromiso orgánico severo como en la nefritis, su mecanismo patogénico puede ser similar a esta, mediado por la formación y el depósito de complejos inmunes. Una posible explicación para que no se produzca una inflamación y daño orgánico severo, como puede ocurrir en otros sitios afectados, se debe al perfil de inmunotolerancia que posee el hígado12.
Autoanticuerpos asociados a la hepatitis lúpicaCon el fin de caracterizar mejor esta entidad y al igual que sucede con algunos de los compromisos orgánicos del LES, se ha tratado de encontrar una correlación clínico serológica entre los diferentes anticuerpos y la hepatitis lúpica. Entre estos el más estudiado y asociado al compromiso hepático es el anticuerpo anti-p ribosomal, que se ha correlacionado con actividad clínica y compromiso hepático, renal y clásicamente el lupus neuropsiquiátrico13. Por ejemplo, en una cohorte de 61 pacientes con LES, de los cuales 34 tenían alteraciones del perfil hepático y 20 con HAI, los anticuerpos anti-p ribosomal se encontraron en 11 (44%) pacientes con LES sin manifestaciones hepáticas y en 11 (68%) de los 16 pacientes con hepatitis lúpica. Ninguno de los 20 pacientes con HAI presentaba anticuerpos anti-p ribosomal14.
Otros hallazgos serológicos y clínicos a favor de la asociación entre la hepatitis lúpica y la presencia de los anticuerpos anti-p ribosomal, está dada por la relación temporal entre su positivización y el inicio del compromiso paraclínico e histológico de hepatitis crónica activa15.
Un reto diagnóstico en particular consiste en diferenciar la hepatitis asociada al lupus y la HAI, pues pueden tener características clínicas y serológicas que se sobreponen, por lo tanto solo la histología nos permitiría diferenciar entre estas dos entidades, pues los hallazgos histológicos respectivos en la HAI son: inflamación periportal y necrosis segmentaria con densos infiltrados linfoides. Mientras que el LES muestra inflamación leve lobular sin necrosis segmentaria, aunque varios autores han reportado la presencia de esta última2,9,16.
Hepatitis lupoideFue descrita inicialmente por Joske y King en 1955 y formalmente denominada por Mackay en 1956. Los pacientes generalmente son mujeres jóvenes con hepatitis crónica activa y células LE positivas. La definición actual de hepatitis lupoide incluye5:
- -
Patología hepática consistente con hepatitis crónica activa.
- -
Ausencia de hepatitis viral.
- -
ANA positivos.
Otras manifestaciones descritas son: fiebre, artralgias, malestar, pérdida del apetito e ictericia, como característica particular muchos signos típicos del LES (ej.: brotes, compromiso orgánico) están típicamente ausentes5.
La presencia de autoanticuerpos juega un papel central en el diagnóstico y en la clasificación del LES y HAI. Los ANA y ASMA son característicos de HAI tipo 1 pero también están presentes en LES, mientras los anticuerpos anti-ADN de doble cadena (ADNdc), anticuerpos extractables del núcleo (ENAS), y anti-P-ribosomal son asociados con LES y virtualmente ausentes en HAI. Los anticuerpos anti-liver-kidney-microsómico type 1 (anti-LKM) y anti LC-1 (liver citosol type 1) son altamente específicos, definen pacientes con HAI tipo 2 y se encuentran ausentes en los pacientes con LES9,17.
Artritis reumatoideLa artritis reumatoide (AR) es un desorden autoinmune caracterizado por compromiso poliarticular simétrico, con manifestaciones extraarticulares hasta en el 50% de los casos, siendo este compromiso principalmente pulmonar, cardiovascular y hematológico. Aunque el compromiso hepático primario se considera escaso y clínicamente no significativo, se ha evidenciado compromiso hepático clínico, manifestado, principalmente, como hepatomegalia, con una frecuencia aproximada del 22% e incluso se correlaciona con elevaciones en el factor reumatoide18.
Por otra parte, el compromiso paraclínico puede oscilar entre el 5 y el 22% según diferentes reportes8,19.
Las transaminasas y la bilirrubina (casi nunca se encuentran elevaciones >1mg/dl) son por lo general normales en los pacientes con AR20,21.
Por el contrario, la FA (tanto la isoenzima hepática como la ósea) se encuentra elevada en el 18-46% de los pacientes con AR y esta elevación, en la mayoría de los estudios, guarda relación con los índices de actividad de la enfermedad y sus niveles caen con el tratamiento esteroideo.
La gamma glutamil transferasa se encuentra elevada en 23-77% de los pacientes y también se correlaciona con la actividad de la enfermedad22.
Dependiendo del tipo de serie de pacientes que se evalúe (serie de autopsias o de pacientes) la prevalencia del compromiso histológico puede oscilar entre 65-92%23.
Los hallazgos histopatológicos más frecuentemente encontrados en las diferentes series son: fibrosis periportal, inflamación tracto portal, congestión, esteatosis hepática, dilatación sinusoidal, depósito de amiloide y raramente cirrosis, estos hallazgos se correlacionan con la actividad de la enfermedad20,23.
Hasta el 76% de los pacientes con infección por el virus de la hepatitis C (VHC) tienen FR positivo y un subtipo de estos pacientes desarrolla crioglobulinemia mixta esencial, que puede llegar a ser confundida con AR. La artritis por VHC es usualmente mono u oligoarticular, afecta articulaciones de mediano y pequeño tamaño, simétrica, pero usualmente es no erosiva. Un anticuerpo que puede ser de utilidad para diferenciar estas 2 entidades son los anticuerpos antipéptido citrulinado cíclico (anti-CCP) siendo estos positivos en los pacientes con AR y negativos en los pacientes con artritis por VHC24.
El diagnóstico diferencial del compromiso hepático de la AR incluye: hepatitis inducida por drogas, esteatosis hepática, CBP, hepatitis viral y la HAI. Estas dan cuenta en el 40,5, 6,3, 3,8, 1,3 y 1,3% de los casos de compromiso hepático en AR25, respectivamente.
De manera similar a como ocurre en el lupus, diferenciar el compromiso hepático debido a la AR de la HAI, puede ser, en ocasiones, difícil pues esta última posee manifestaciones extrahepáticas que pueden simular una AR y esta a su vez puede tener manifestaciones extraarticulares comunes a la HAI: hipergammaglobulinemia y la presencia de ANA positivos, ambos criterios del Grupo Internacional de Hepatitis Autoinmune (en inglés: International Autoimmune Hepatitis Group). Es en este escenario donde, de nuevo, la presencia de hallazgos histológicos compatibles con HAI nos ayuda a diferenciar entre estas 2 entidades26.
Síndrome de FeltyEste se caracteriza por la tríada diagnóstica de AR, leucopenia y esplenomegalia, presentándose en menos del 1% de los pacientes con AR. La hepatomegalia se presenta entre 42-67% de los pacientes, asociado generalmente a incrementos en la FA, las aminotransferasas, bilirrubina, TP y la GGT. Histológicamente, con igual frecuencia (67%), se ha descrito el hallazgo de HNR, que sumado al aumento del flujo vascular proveniente del lado esplénico puede contribuir a la presentación de hipertensión portal no cirrótica y sus complicaciones, principalmente el sangrado variceal18,27,28.
Enfermedad de Still del adultoEsta es una enfermedad sistémica inflamatoria poco común caracterizada por la tríada de fiebre cotidiana, exantema evanescente color salmón y artritis.
El compromiso hepático está dado, principalmente, por hepatoesplenomegalia y alteraciones del perfil hepático, elevación de transaminasas (2-5 veces el límite superior normal) y FA. Se han descrito casos de falla hepática fulminante asociada a la enfermedad29.
Un hallazgo frecuente es la hiperferritinemia que puede presentarse hasta en menos del 50% de los pacientes, que asociada a la elevación de las transaminasas y artritis, habría que tener en cuenta la hemocromatosis como su principal diagnóstico diferencial.
Esclerosis sistémica/esclerodermaLa esclerosis sistémica es una enfermedad autoinmune multisistémica, caracterizada por fibrosis de la piel y compromiso orgánico múltiple, aunque el compromiso hepático es raro. Este fue descrito, por primera vez, por Milbradt en 19345.
La enfermedad hepática no había sido considerada un compromiso significativo de la esclerosis sistémica, esto debido a que en las primeras descripciones de las grandes series se encontraba también una alta prevalencia de enfermedad hepática en la población control. Pero en estudios posteriores, principalmente post mórtem, de pacientes con esclerodermia comparados con controles, fueron observándose como manifestaciones, cada vez más comunes, de la enfermedad la presencia de hepatomegalia y la cirrosis30. En una revisión de 727 pacientes con escleroderma solo 8 (1,1%) tuvieron compromiso hepático31.
El compromiso hepático, típicamente asociado a la escleroderma es la CBP, descrito por primera vez en 1950, una enfermedad inflamatoria progresiva que causa obliteración de conductos biliares de tamaño mediano, que afecta predominantemente a mujeres de mediana edad, manifestándose como prurito e ictericia progresiva. Se correlaciona serológicamente con la presencia de anticuerpos antimitocondriales, presentes en el 90-95% de los pacientes con CBP e histológicamente por colangitis destructiva no supurativa.
Se estima que la prevalencia de CBP puede oscilar entre el 7-15% de los pacientes de esclerosis sistémica, principalmente asociado a la variedad limitada de la enfermedad, particularmente al CREST (síndrome de Reynolds), presentándose en el 31% de los casos posterior al diagnóstico de la enfermedad y se asocia a la presencia de anticuerpos anticentrómero5. Este tipo de compromiso sindrómico se ha denominado con el acrónimo «PACK» (PBC en inglés para referirse a la CBP, anticuerpos anti-centrómero, CREST, keratoconjuntivitis)5.
Con base en esto, se plantea el papel patogénico (aún no dilucidado) de los anticentrómero en la patogénesis de la CBP, de los 3 antígenos centroméricos: polipéptido de 18 KD (CENP-A), 80 KD (CENP-B) y 140 KD (CENP-C), el epítope contra el cual van dirigidos los anticuerpos anticentrómero, casi universalmente, es el de 18 KD (epítope mayor), presentándose en el 100% de los pacientes con anticuerpos anticentrómero y CBP/CREST. Determinando así un subtipo de pacientes (anticentrómero positivo-CBP/CREST positivo) con características clínico-serológicas específicas (mayor positividad criterios CREST, menor concentración de anticuerpos anti-M2 y bilirrubinas) en comparación con los pacientes anticentrómero negativo-CBP/CREST positivo y CBP/no CREST32.
También se ha descrito la asociación entre la esclerosis sistémica y la HNR, descrita por primera vez en 1973, particularmente con la variedad limitada. En múltiples reportes de caso de la literatura, se ha descrito incluso la asociación de CREST, HNR y CBP5,33–35.
Síndromes de sobreposición mucho más escasos y raros, reportados en la literatura, se han descrito con la HAI con escleroderma limitada y con colangitis esclerosante primaria36,37.
Se recomienda que todos los pacientes que tienen esclerosis sistémica, particularmente los que tienen variedad limitada sean cribados para compromiso hepático autoinmune con anticuerpos antimitocondriales, anticentrómero y antimúsculo liso, algunos de estos incluso pueden ser positivos en fase preclínica. La biopsia hepática puede requerirse en este tipo de pacientes con alteración de las pruebas de función hepática inexplicada.
En cuanto al manejo, los pacientes que tengan un cuadro colestásico pueden ser tratados con ácido ursodeoxicólico38.
Síndrome de Sjögren primarioEL síndrome de Sjögren (SS) primario es una exocrinopatía inflamatoria autoinmune que afecta, principalmente, las glándulas salivares y lacrimales.
En cuanto al compromiso hepático, son pocos los estudios que específicamente han examinado el compromiso hepático primario en SS, siendo descrito, por primera vez, en 1954 por Cristiansson39.
Las causas más comunes de enfermedad hepática en SS son: CBP, HAI, enfermedad hepática no alcohólica y VHC.
La hepatomegalia tiene una frecuencia que puede oscilar entre 11-21% de los pacientes con SS. La anormalidad en las pruebas de función hepática se encuentra entre 10-49%, pero son usualmente leves y de poca significación clínica, predominando el patrón hepatocelular, seguido del colestásico y el mixto40.
La prevalencia de anticuerpos mitocondriales oscila entre 2-7% de los pacientes con SS, de estos 60% tiene FA elevada, mientras que el 82% tiene hallazgos histológicos de CBP. La prevalencia de los determinantes antigénicos contra los cuales se encuentran dirigidos los AMA son, en orden de frecuencia, piruvato deshidrogenasa 22-27% que se correlaciona con elevación de enzimas hepáticas, la aciltransferasa dihidrolipoamida de cadena ramificada (BCKADC-E2 y la subunidad E2 de ketoglutarato deshidrogenasas (KGDC-E2), los que se encuentran en el 1,7 y el 7% de los pacientes, respectivamente41–43.
Los anticuerpos de enfermedades autoinmunes hepáticas específicas pueden coexistir en los pacientes con SS y predecir el desarrollo de sobreposición, algunos con más certeza que otros. En una cohorte de seguimiento prospectivo Csepregi et al., evaluaron la significación clínica de los autoanticuerpos como marcadores serológicos de enfermedad y su poder de predicción, en 180 pacientes con SS primario, encontrando una prevalencia de 39%, de los cuales solo el 3% (n=2) desarrolló HAI. Mientras que la prevalencia de anticuerpos antimúsculo liso es mucho menor 1,6% (n=3) pero con mayor significado patogénico pues el 66% (n=2) desarrolló CPB41.
Se ha encontrado clonalidad hepática de células B en el 77,8% de los pacientes con SS, al parecer benigna, que puede evidenciar una clonalidad benigna derivada de la expansión antigénica, que no se traduce en riesgo de linfoma hepático primario, a excepción de la coinfección por el VHC44,45.
El SS y la CBP comparten muchas características comunes, con mecanismos patogénicos comunes pero con un perfil de autoanticuerpos diferentes. En ambas condiciones la inflamación comienza alrededor de los ductos y ambas poblaciones epiteliales expresan moléculas HLA clase II inapropiadamente, además del predominio de las células CD4+ que predominan en las lesiones de la CBP severa y las lesiones de las glándulas salivales5.
Si bien los síntomas del síndrome seco se encuentran en 35-70% de los pacientes con CBP, la sobreposición con SS puede encontrarse hasta en 18-38% de los pacientes46.
La detección de anticuerpos antimitocondriales en SS primario con o sin aumento de enzimas hepáticas, puede ser indicativa de enfermedad hepática temprana en pacientes con SS temprano46.
Un perfil hepático anormal es un hallazgo sugestivo de enfermedad autoinmune, la prevalencia de los anticuerpos anti-Ro/SSA y anti-La/SSB en pacientes con HCV es de baja frecuencia, según 5 estudios es de aproximadamente 1%, mientras que hasta el 19% de los pacientes con SS tienen HCV demostrando una alta prevalencia de la infección, incluso mayor que en la población general46.
La presencia de síndrome sicca (xeroftalmia y xerostomía), infiltración linfocítica de glándulas salivares y autoanticuerpos, en pacientes con infección por VHC, sugiere que el virus C puede ser incluso causa de SS en algunos casos.
La patogénesis de este SS relacionado con VHC puede ser relacionado con:
- -
Infección directa, proliferación y posible actividad citotóxica del VHC en las glándulas salivares.
- -
Mimetismo molecular entre VHC y glándulas salivares.
- -
Formación de complejos inmunes.
Este grupo de pacientes se caracteriza por tener mayor compromiso neurológico, transaminasas elevadas, factor reumatoide positivo, crioglobulinas positivas y menor frecuencia de anticuerpos Ro y La47,48.
Mientras que los pacientes con SS y VHC se caracterizan por ser de mayor edad, tener enfermedad hepática, crioglobulinas, anticuerpos anticélulas parietales, bajos niveles de complemento, pero particularmente tienen menor frecuencia de anticuerpos Ro y La, parotidomegalia y complicaciones sistémicas del SS como enfermedad pulmonar intersticial crónica o acidosis tubular renal47,48.
Espondilitis anquilosanteLa espondilitis anquilosante es una artropatía inflamatoria de las articulaciones centrales: sacroilíacas, columna y periféricas, que se presenta típicamente con dolor lumbar y rigidez de columna progresiva. No se considera típicamente un desorden sistémico autoinmune aunque algunos órganos pueden afectarse como manifestación extraarticular.
Del panel de función hepática la anormalidad más frecuente es la elevación de la FA que ocurre entre 14 y 47,5% de los pacientes, la cual puede derivarse del hueso, aunque algunos estudios sugieren que puede ser de origen hepático49. El origen se puede esclarecer por medio de la determinación de la gamma glutamil transpeptidasa y la 5-nucleotidasa (5-NT), las cuales aumentan de manera paralela con la FA en los desórdenes hepáticos50.
La elevación de FA de origen hepático en estos pacientes es de significación incierta, pero algunos autores argumentan que la elevación de esta es un reactante de fase aguda no específico, pues se ha visto que se correlaciona con la actividad de la enfermedad y la respuesta al tratamiento51.
Miopatías inflamatoriasLas miopatías inflamatorias idiopáticas polimiositis y dermatomiositis son enfermedades sistémicas autoinmunes caracterizadas por inflamación del músculo esquelético, pero otros órganos son frecuentemente involucrados como: piel en dermatomiositis, y corazón y pulmón en polimiositis y dermatomiositis.
Ambas miopatías se caracterizan por el desarrollo de debilidad muscular simétrica, que se desarrolla lentamente, generalmente en el trascurso de semanas a meses. Se acompaña de síntomas constitucionales vagos como malestar, pérdida de peso y artralgias.
La prueba crítica para establecer o confirmar el diagnóstico es la medición de enzimas musculares, electromiografía y biopsia muscular.
Además la CPK, los niveles de AST, ALT y LDH son anormalmente altos. En ausencia de elevación de CPK, los aumentos de AST y ALT son erróneamente atribuidos a enfermedad hepática que, junto a la sintomatología general, pueden confundirse con un cuadro de hepatitis viral. Esta interpretación errónea puede llevar a retrasos en el diagnóstico y tratamiento de estas entidades5.
En cuanto a los síndromes de sobreposición su asociación más frecuente es con CBP, con varios casos reportados en la literatura, la miopatía en estos casos puede ocurrir posterior al diagnóstico, en la mayoría de los casos, o puede preceder y ocurrir simultáneamente.
El clínico debe sospechar compromiso hepático concomitante de base cuando el incremento en las transaminasas sea mayor que la CPK o se encuentre ante un patrón colestásico52.
HepatotoxicidadLos antiinflamatorios no esteroideos (AINE) y las drogas modificadoras de la AR (DMARD), en general, son los medicamentos hepatotóxicos más frecuentes.
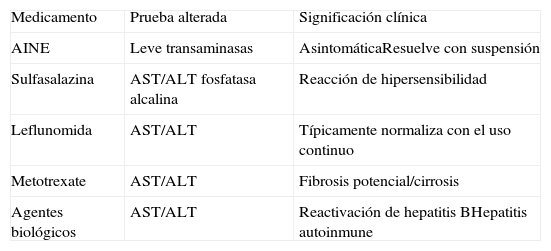
Los medicamentos asociados a hepatoxicidad en las diferentes enfermedades autoinmunes y su patrón de alteración de las pruebas hepáticas se muestran en la tabla 2.
Hepatotoxicidad medicamentosa en pacientes con condiciones reumatológicas
| Medicamento | Prueba alterada | Significación clínica |
| AINE | Leve transaminasas | AsintomáticaResuelve con suspensión |
| Sulfasalazina | AST/ALT fosfatasa alcalina | Reacción de hipersensibilidad |
| Leflunomida | AST/ALT | Típicamente normaliza con el uso continuo |
| Metotrexate | AST/ALT | Fibrosis potencial/cirrosis |
| Agentes biológicos | AST/ALT | Reactivación de hepatitis BHepatitis autoinmune |
ALT: alanino aminotransferasa; AST: aspartato aminotransferasa.
Modificada de Schlenker et al.8.
Casi todos los AINE pueden causar anormalidad en las pruebas hepáticas, que se caracterizan por ser leves incrementos en las transaminasas que suelen ser asintomáticas y que revierten con la suspensión del agente ofensor.
En una revisión sistemática de 64 estudios clínicos controlados de AINE (diclofenaco, naproxeno, ibuprofeno, celecoxib, rofecoxib, valdecoxib y meloxicam) en pacientes con osteoartritis o AR, las tasas de incrementos significativos de transaminasas (>3 veces LSN) fueron muy bajas para la mayoría de los AINE (rango 0,19-0,43%) en comparación con placebo (0,29%).
Diclofenaco (3,55%; 95% IC 3,12-4,03%) y rofecoxib (1,80%; 1,52-2,13%) tuvieron las mayores tasas de elevación, >3 veces el límite superior normal.
Solo un episodio de hospitalización por causas hepáticas (entre 37,671 pacientes) y una muerte relacionada con causa hepática (entre 51,942 pacientes) ocurrió con naproxen53.
Drogas modificadoras de la artritis reumatoideLa presentación clínica de la lesión inducida por DMARD va desde pruebas hepáticas alteradas asintomáticas y síntomas leves (naúseas, pérdida del apetito, disconfort abdominal), hasta severos patrones colestásicos o citolíticos de anormalidades enzimáticas responsables de ictericia, falla hepática aguda y multiorgánica.
Basados en el patrón de la alteración enzimática es posible definir una lesión citolítica cuando la relación ALT/FA es >5 o hay un aumento aislado de ALT; y patrón colestásico cuando la relación ALT/FA es <2 o hay un incremento aislado de la FA54.
Son múltiples los DMARD que causan aumento de enzimas hepáticas y hepatoxicidad, los que con más frecuencia se asocian son el metotrexate (MTX) y la leflunomida.
El MTX causa aumento de las enzimas hepáticas y ha sido asociado con altas tasas de fibrosis y cirrosis en pacientes con terapia de larga data.
La incidencia de aumento de alanino aminotransferasa y aspartato aminotransferasa es de 14 y 8%, respectivamente, en pacientes que reciben MTX. La mayoría de las elevaciones de transaminasas resuelven con un mes de suspensión del medicamento55.
Las guías de las diferentes sociedades difieren en la manera en que estos pacientes deben ser monitorizados para prevenir la fibrosis hepática inducida por MTX53,56:
- -
Biopsia pretratamiento: en pacientes de alto riesgo (historia de uso excesivo de alcohol, transaminitis pretratamiento, hepatitis viral crónica).
- -
Biopsia hepática después de cada 1,5-2g acumulativos de MTX sin importar el perfil hepático.
- -
Monitorización de transaminasa durante el tratamiento, con biopsia reservada para pacientes con transaminasas persistentemente elevadas.
En un estudio abierto, observacional, prospectivo, 27 pacientes fueron seguidos prospectivamente desde el inicio de MTX y fueron seguidos prospectivamente con biopsias hepáticas analizadas con microscopia de luz y electrónica, además de laboratorios a intervalos frecuentes.
Se concluyó, después de los estudios histológicos, que estos pacientes presentan poco deterioro en la arquitectura hepática por microscopia de luz o electrónica, cuando la dosis se ajustó para anormalidades en AST y albúmina, monitorizado a intervalos regulares con un promedio de seguimiento de 8,2 años, lo que demuestra que este último enfoque puede ser seguro en el seguimiento de los pacientes usuarios de MTX57.
El incremento de las transaminasas en pacientes que toman leflunomida oscila entre 5,4 a 14,8%, presentándose de forma predominante durante los primeros 6 meses y, usualmente, normaliza durante el curso del tratamiento58. Si bien la hepatotoxicidad es rara, se han reportado casos fatales. Se sugiere monitorización intensiva durante los primeros meses del tratamiento59.
La azatioprina es usada para el tratamiento de una variedad de desórdenes inflamatorios. En pacientes con AR, reacciones adversas hepáticas ocurren en alrededor del 2% de los pacientes. Sin embargo, elevaciones que requieran hospitalización están en el rango de 1:1000, según una serie de pacientes60.
Los mecanismos implicados en la hepatotoxicidad se han atribuido a la hipermetilación debido a la actividad elevada de la tiopurina metiltransferasa, además del daño inducido por especies reactivas de oxígeno durante la oxidación54.
Dentro de los síndromes de hepatotoxicidad que pueden ser desencadenados se encuentra la HNR y la enfermedad hepática venooclusiva. La temporalidad de la lesión hepática puede ocurrir temprano (2 semanas) o incluso tardíamente (30 meses).
La sulfasalazina es ampliamente utilizada en el tratamiento de la AR, espóndilo artropatías y enfermedad inflamatoria intestinal.
La lesión hepática aguda por sulfasalazina en estos pacientes se presenta, por lo general, por ser acetiladores lentos, ocurre con una frecuencia de 4 en 1000 usuarios, la mayoría de los casos ocurre con el primer mes de tratamiento y se presenta con lesión hepatocelular o colestásica54.
Terapia biológicaAnticuerpos factor necrosis tumoral alfaEl infliximab es un anticuerpo monoclonal quimérico que se une y neutraliza el factor de necrosis tumoral alfa en sus formas soluble y transmembrana. Es útil en el tratamiento de la AR activa, EA y artritis psoriásica. Los casos de hepatotoxicidad que se han presentado han llevado incluso a la rotulación de este evento adverso en la caja del producto. Su incidencia se estima entre 1/16,500 pacientes por año. Se ha implicado en el mecanismo de lesión a la activación de las células de Kupffer que barren complejos inmunes con infliximab y liberación de especies reactivas de oxígeno61.
Hasta en dos tercios de los pacientes se ha descrito la inducción del perfil de autoanticuerpos compatibles HAI tipo 1 (ANA, anti-ADN y anticuerpos antimúsculo liso)62.
TocilizumabSe trata de un anticuerpo monoclonal humanizado que inhibe los receptores de membrana y solubles de IL-6. Aprobado para tratamiento de la AR. La elevación de las transaminasas es común cuando se usa en combinación con DMARD, especialmente MTX63.
No se ha reportado falla hepática fulminante asociada al medicamento. Solo se ha reportado anecdóticamente un caso de necrosis focal sin infiltrados celulares, esteatosis, fibrosis perisinusoidal, sin elevación de transaminasas64.
Anti-TNF e infección por virus de la hepatitis B y C. El VHB es la principal causa de enfermedad hepática aguda y crónica en el mundo, además de ser causa de muerte anticipada relacionada con el hígado. Afecta a 400 millones de personas, mientras que 1,6 billones tienen marcadores de exposición previa al VHB: con antígeno de superficie hepatitis B (AgSVHB) negativo anticuerpos anticore hepatitis B (anti-HBc) positivo. La correcta identificación de la presentación clínica y virológica de la hepatitis B es mandatoria previo a la terapia anti-TNF, pues el riesgo de posibles complicaciones está relacionado con el estatus de infección65.
En las tablas 3 y 4 se muestran los diferentes escenarios clínicos y el manejo de los pacientes con infección por hepatitis B y C.
Recomendaciones para el cribado y tratamiento de la infección por el virus de la hepatitis B en pacientes tratados con anti-TNF
| Escenario clínico | Recomendación |
|---|---|
| Antes de inicio anti-TNF | Cribado con: AgVHBs, anti-VHBs, anti-VHBc, perfil hepático completo (AST, ALT, Bbt, GGT, Alb, INR), pacientes en riesgo de infección deben ser vacunados antes del inicio del tratamiento. Si se diagnostica infección: ADN VHB, AgeVHB, ultrasonido. Para pacientes con VHBAgS o anti-VHBc: positivos deben ser evaluados por el hepatólogo |
| Pacientes con enfermedad activa VHB | Terapia con entecavir o tenofovir antes del inicio de anti-TNF, debe ser continuado por 12 meses después de la descontinuación del tratamiento, sin embargo, en algunos casos la terapia debe ser indefinida |
| Portadores inactivos VHB | Profilaxis con lamivudina antes del inicio de terapia y por al menos 6-12 meses de suspensión. Monitorización reactivación durante varios meses posdescontinuación |
| En portadores ocultos potenciales | Profilaxis antiviral no es necesaria pues el riesgo de seroconversión del AgSVHB es poco probable. Monitorización con AgsVHB cada 3 meses, tratamiento si AgsVHB:+ |
| Monitorización durante terapia anti-TNF | ALT mensual hasta 6 meses después de terminado el tratamiento. En aquellos con cirrosis monitorización más frecuente. En pacientes con tratamiento o profilaxis antiviral anti-ADN (cada 3 meses) y hasta 6-12 meses de la finalización de terapia anti-TNF |
| Consideraciones de seguridad | El uso de anti-TNF no está contraindicado en pacientes con hepatitis crónica pero acarrea riesgo de reactivación que requiere profilaxis o tratamiento en algunos pacientes |
ADN VHB: ADN virus hepatitis B; AgVHBs: antígeno de superficie virus hepatitis B; Alb: albumina; ALT: alanino aminotransferasa; anti-TNF: anticuerpos factor necrosis tumoral alfa; anti-VHBc: anticuerpos antígeno core virus hepatitis B; antígeno E virus hepatitis B; anti-VHBs: anticuerpos contra antígeno superficie hepatitis B; AST: aspartato aminotransferasa; Bbt: bilirrubina total; GGT: gamma-glutamil transferasa; INR: international normalized ratio.
Modificada de Viganò et al.65.
Manejo clínico de anti-TNF en pacientes infectados con VHC
| Evaluación basal antes del inicio de la terapia | AST, ALT, FA, GGT, bilirrubina, albumina, plaquetas, anti-VHC, ARN-VHC (si anti-VHC positivo) |
| Criterios de exclusión | Cirrosis descompensada |
| Seguimiento (cada 3 meses) | AST, ALT, FA, GGT, albumina, plaquetas |
ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; anti-VHC: anticuerpos virus hepatitis C; ARN-VHC: ARN virus hepatitis C; FA: fosfatasa alcalina; GGT: gamma glutamil transferasa.
Modificada de Viganò et al.65.
Pacientes con infección en curso. Son los portadores del AgSVHB+ se definen como:
- 1)
Portadores activos: antígeno e de hepatitis B (AgeVHB) o anticuerpos contra antígeno e (anti-HBe) y carga viral >2000 UI, ALT anormal y signos de enfermedad hepática.
- 2)
Portadores inactivos: anti-HBe+, ALT normal, carga viral <2000 UI.
- 3)
Pacientes con VHB resuelto: AgSVHB: –, con Anti-HBc:+(con o sin anticuerpos antígeno de superficie hepatitis B (anti-AgSVHB) son portadores de anticuerpos anti-core.
Todas estas condiciones virológicas pueden cambiar con la inmunosupresión.
Los portadores activos pueden tener una reactivación, con incremento del ADN, VHB y ALT, portadores inactivos pueden tener una seroconversión (reemergencia AgSVHB) con/sin incremento ADN y ALT y desarrollar posiblemente hepatitis crónica65.
Profilaxis. Administración de drogas anti-VHB a portadores inactivos para prevenir la reactivación y a portadores anti-HBc para prevenir la sero conversión AgSVHB.
Tratamiento. Se refiere al tratamiento de portadores activos o con reactivación de la hepatitis en portadores inactivos previos o seguido a la seroconversión de pacientes anti-VHBc previos65.
Reactivación de VHB en pacientes con AgSVHB+y enfermedad reumática:Hasta la fecha se han reportado 25 casos de pacientes portadores AgSVHB tratados con terapia anti-TNF sin profilaxis. Considerando todos los pacientes descritos las reactivaciones ocurrieron en 13 (52%) llevando a hepatitis fulminante en 3 casos, muerte a uno y a trasplante a uno (65). El 64% eran pacientes tratados con infliximab, de hecho es el que confiere mayor riesgo de reactivación comparado con etanercept y adalimumab65.
Reactivación en portadores AgSVHB/anti-VHBc+: se ha reportado la seroconversión en estos pacientes después de la administración de anti-TNF, pero son más numerosos los reportes (n=214) de pacientes tratados con infliximab, etanercept y adalimumab que mostraron no seroconversión, por lo tanto, se estima que el riesgo es muy bajo.
ManejoAntes del inicio de anti-TNF, la terapia antiviral con análogos de nucleósido/nucleótido de tercera generación debe iniciarse en el paciente con hepatitis B activa crónica.
Mientras, se debe administrar profilaxis universal con lamivudina en portadores inactivos por lo menos hasta 6-12 meses de haber terminado la terapia anti-TNF. Los pacientes AgsVHB –/anti-VHBc+no necesitan profilaxis pero sí vigilancia estricta. (AgsVHB cada 3 meses para detectar seroconversión)65.
Hepatitis C. Es la principal causa de hepatitis viral adquirida parenteral y afecta aproximadamente a 170 millones de personas. La infección aguda es generalmente benigna pero lleva a cronicidad en 60-70% de los casos.
La infección crónica es asintomática hasta la fase tardía de la enfermedad, lo que significa que el diagnóstico es incidental debido al hallazgo de transaminasas anormales o debido a pruebas serológicas de rutina. La infección se confirma por la detección del RNA VHC por ensayos moleculares con PCR en tiempo real. Existen 6 serotipos de VHC del 1 al 6 y cada genotipo tiene a su vez varios subtipos, cuya prevalencia varía y difiere de acuerdo con la presentación geográfica.
El TNF ha mostrado desempeñar un rol muy importante en la patogénesis de la enfermedad, disparando la apoptosis hepatocitaria y perpetuando la inflamación hepática, pues se ha visto una correlación directa entre los niveles de TNF y ALT, siendo asociados sus altos niveles con mayor actividad histológica66.
Algunos autores aducen que la terapia anti-TNF puede ser benéfica en los pacientes con hepatitis C, pues se ha propuesto que la restauración de la proliferación celular de células CD4 por la terapia anti-TNF podría explicar la respuesta virológica en pacientes tratados con anti-TNF, de hecho etanercept ha sido evaluado como terapia adyuvante en el régimen antiviral con interferón y ribavirina, mostrando un mayor decline en la carga viral y la ALT en comparación con placebo67.
En la literatura se han reportado aproximadamente 110 casos de pacientes con infección por VHC, tratados con anti-TNF (infliximab, etanercept, adalimumab), con una duración que oscila entre los 3 y 44 meses, demostrándose elevación de ALT solo en 2 casos (2%), de los cuales solo uno presentó elevación considerable de transaminasas 2 veces por encima del LSN y aumento de 4 veces la carga viral. En el resto de los pacientes no se documentaron cambios significativos en los niveles de transaminasas.
Estos datos demuestran que el tratamiento anti-TNF en pacientes con hepatitis C crónica tiene un perfil de seguridad bueno.
Manejo clínico de anti-TNF en pacientes infectados con VHCSe requiere hacer un perfil hepático completo basal previo al inicio del tratamiento (AST, ALT, FA, GGT, bilirrubinas, albumina y plaquetas, anticuerpos VHC).
Los anti-TNF no están contraindicados en pacientes con hepatitis C, sin embargo, se debe hacer una monitorización exhaustiva cada 3 meses durante el tratamiento. Como no se han hecho estudios en pacientes no cirróticos, se debe hacer un estudio no invasivo previo al inicio del medicamento. Los anti-TNF se encuentran contraindicados en el paciente con cirrosis descompensada CHILD B/C debido a su alto riesgo de infecciones severas. En presencia de una cirrosis compensada deben usarse con precaución evaluando el riesgo/beneficio65.
ConclusionesEs importante para el clínico tener en cuenta y monitorizar la función hepática, no solo como parte de la búsqueda de eventos adversos derivados de la farmacoterapia, pues en muchas ocasiones puede ser el resultado del compromiso hepático primario por las diferentes enfermedades autoinmunes sistémicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.