Existe interés en el papel que desempeña la ultrasonografía (US), particularmente la presencia de señal Doppler poder (DP) e hipertrofia sinovial en la evaluación de actividad subclínica en la artritis reumatoide (AR) en remisión.
ObjetivoExaminar la evidencia que determine la utilidad de la US y el DP en la evaluación del paciente con AR en remisión por clinimetría.
Materiales y métodosSe realizó una revisión sistemática de la literatura de bases de datos electrónicas PubMed, EMBASE, Biomed Central, registro de ensayos clínicos de Cochrane y como fuentes secundarias las referencias de artículos en los cuales se utilizaron términos clave: «arthritis, rheumatoid» o «arthrits» y «ultrasonography» o «ultrasonography, doppler, pulsed» y «remission induction», hasta el 2 de marzo de 2014, sin restricción de idioma. Se incluyeron estudios observacionales de cohorte que evaluaron la prevalencia de actividad subclínica por US de pacientes adultos con AR en remisión clínica. Se verificó la calidad metodológica de los artículos y se extrajo la información relevante de cada uno.
ResultadosSe identificaron 13 estudios para el análisis. Se observó actividad de AR imaginológica en 14,6 a 95% para hipertrofia sinovial por US y 1,2 a 64,5% por DP en pacientes en remisión por clinimetría.
ConclusionesEn pacientes con AR en remisión clínica se observa actividad ecográfica subclínica variable, detectada por hipertrofia sinovial y señal DP intraarticular, esta última permite diferenciar pannus residual, del inflamatorio que correlaciona con recaída y progresión de la enfermedad, además de permitir ajuste terapéutico. Se requieren más estudios que evalúen desenlaces terapéuticos y pronósticos.
There is an interest in the role of ultrasound (US), particularly the presence of power Doppler (PD) signal and synovial hypertrophy in the evaluation of subclinical activity in rheumatoid arthritis patients (RA) on remission.
ObjectiveExamine the evidence to determine the usefulness of US and PD in the evaluation of patients with RA in remission using clinimetric properties.
Materials and methodsA systematic literature search was performed using electronic databases PubMed, EMBASE, BioMed Central, Cochrane registry of clinical trials and secondary reference sources of articles published up to 2 March 2014, with the key terms “arthritis, rheumatoid” or “arthritis” and “ultrasonography” or “ultrasonography, Doppler, pulsed” and “remission induction” were used until March 2, of the 2014, without language restriction. Observational cohort studies that assessed the prevalence of subclinical activity by US and PD in adult patients with RA in clinical remission were included. Methodological quality of the articles was verified and relevant information extracted from each one.
ResultsA total of 13 studies were identified for analysis. RA activity using these imaging techniques was observed in 14.6 to 95% for US synovial hypertrophy and 1.2 to 64.5% for PD in remission patients using clinimetry.
ConclusionsIn RA patients with clinical remission, variable subclinical activity was observed with ultrasound detected by synovial hypertrophy and a positive intra-articular PD signal. The latter enables residual from inflammatory pannus to be differentiated, and to also predict relapse and correlate with disease progression, allowing therapeutic changes. More studies evaluating treatment and prognostic outcomes are required.
La artritis reumatoide (AR) es una artropatía inflamatoria crónica autoinmune, caracterizada por inflamación sinovial que produce destrucción de las estructuras intraarticulares y periarticulares (cartílago articular, hueso, ligamentos, tendones)1. La inflamación sinovial en la AR consiste en una proliferación sinovial o pannus que puede o no tener angiogénesis, situación que se evidencia mediante la evaluación imaginológica con resonancia magnética o ecografía articular, siendo esta última de mayor utilidad por su bajo costo y la posibilidad de evaluar múltiples articulaciones en un solo examen2.
Los parámetros ultrasonográficos comúnmente evaluados son: la escala de grises (EG), (que permite la valoración del líquido articular y la hipertrofia sinovial [HS]) y la presencia de señal Doppler poder (DP) para evaluar la vascularidad intraarticular. Sin embargo, el líquido articular se puede encontrar en padecimientos mecánicos por lo que actualmente no se utiliza como indicador de actividad inflamatoria3. La detección de la sinovitis persistente tiene relación directa con daño estructural y funcional articular, por lo cual es de vital importancia contar con instrumentos diagnósticos que permitan evaluar la presencia o ausencia de sinovitis desde el punto de vista pronóstico y terapéutico4.
El tratamiento de la AR está dirigido al control de la respuesta inflamatoria, disminuyendo la progresión del daño articular, llevando al paciente a remisión o a un estado de baja actividad de la enfermedad de manera sostenida, evaluable por medio de herramientas clinimétricas (DAS, DAS28, criterios remisión ACR, SDAI).
Para controlar la enfermedad se emplean terapias como los DMARD (medicamentos modificadores de la enfermedad, por sus siglas en inglés) y los biológicos. Su elección depende del grado de actividad de la enfermedad y la respuesta a tratamientos previos5.
Para alcanzar con éxito este objetivo se realiza la cuantificación temprana y objetiva de la inflamación por pruebas de laboratorio y hallazgos clínicos, los cuales dirigen el ajuste del tratamiento durante el curso de la enfermedad6,7.
La medición de la remisión se basa en marcadores subrogados de inflamación tales como el conteo articular, la escala de actividad (DAS por sus siglas en inglés y el DAS28), el índice de actividad de la enfermedad simplificado (SDAI por sus siglas en inglés, etc.), propuestos por el Colegio Americano de Reumatología (ACR por sus siglas en inglés) y la liga Europea contra el Reumatismo (EULAR)2,8.
En este sentido, se espera que en la AR la remisión se traduzca en el retorno a la normalidad de los componentes inflamatorios, logrando preservar la función articular a través de la detención del daño articular, lo que busca impactar la calidad de vida de los pacientes.
Sin embargo, a pesar de lograrse la remisión clínica el daño estructural continúa progresando, una posibilidad para explicar este fenómeno es la presencia de una sinovitis subclínica detectada por imágenes.
Esta última se ha asociado con daño estructural radiológico progresivo, desenlaces adversos clínicos y funcionales en AR en remisión, independiente de la escala y criterios de remisión usados2,6,7,9–11.
La US ha demostrado buen rendimiento diagnóstico de sinovitis persistente, comparada con el examen físico e incluso con la artroscopia que es el estándar de oro en pacientes con enfermedad articular avanzada, demostrando ser un instrumento con buena validez y reproducibilidad como lo demuestra un estudio de cohorte de 60 pacientes con diferentes artropatías inflamatorias en rodillas: sensibilidad 98 vs. 85%, especificidad 88 vs. 25%, precisión 97 vs. 77%, valor predictivo positivo 98 vs. 88%, valor predictivo negativo 88 vs. 20% para la detección de sinovitis, esto en pacientes con enfermedad establecida, pero el panorama para el diagnóstico de la enfermedad temprana aún no se ha dilucidado3,12–17. En diferentes estudios se ha confirmado el buen rendimiento de esta prueba, su correlación con la progresión radiológica y la capacidad de predicción de desarrollo de erosiones subsecuentes. Sin embargo, no se ha establecido la prevalencia de sinovitis subclínica mediante valoración ecográfica (HS en EG y presencia de señal DP en los diferentes estudios que han evaluado pacientes con AR en remisión y si esta se ve afectada por: el tipo de escala de clinimetría utilizada, el criterio de definición de remisión y la variabilidad intra- e interobservador de la prueba)18–22.
Por lo planteado anteriormente, desarrollamos una revisión sistemática de la literatura que incluyó estudios de cohorte de pacientes con AR en remisión, con el fin de determinar la prevalencia de sinovitis subclínica mediante ecografía articular por HS en EG o por la presencia de señal DP. También se analizaran vacíos importantes en el conocimiento de las cualidades métricas de esta herramienta diagnóstica no invasiva.
Materiales y métodosSe realizó una revisión sistemática de la literatura de bases de datos electrónicas con el fin de identificar los estudios de cohorte que determinen la prevalencia de actividad subclínica por ecografía tanto en EG como en DP, determinada por la presencia de HS por EG y positividad de señal DP de pacientes con AR en remisión clínica. La población objeto fueron individuos mayores de 18 años con diagnóstico de AR en remisión clínica definida por reumatólogo tratante o por puntajes clinimétricos (DAS<1,6, DAS28<2,6 o SDAI <3,3), o por criterios del consenso del ACR y EULAR. Se excluyeron estudios en menores de 18 años y cohortes en publicaciones duplicadas.
Se realizó una búsqueda exhaustiva y reproducible de trabajos originales en bases de datos electrónicas relacionadas con salud: PubMed, EMBASE, Cochrane Central Register of Controlled Trials (CENTRAL), Biomed Central y mediante la técnica PICO lingüística disponible en: http://babelmesh.nlm.nih.gov/pico.php?in1=SPA utilizando términos en español. Se utilizaron términos MESH para la base de datos de PubMed y EMTREE para EMBASE que incluyeron «Arthritis, Rheumatoid» y «Ultrasonography» o «Ultrasonography, Doppler, Pulsed» y «Remission induction». Para la base de datos Pubmed se utilizó ([«Arthritis, Rheumatoid»{Mesh}] AND [«Ultrasonography» {Mesh} OR «ultrasonography» {Subheading} OR «Ultrasonography, Doppler, Pulsed»{Mesh} AND «Remission Induction»{Mesh}]). Esta búsqueda se realizó sin filtro de idioma y límite de fecha hasta el 2 de marzo de 2014. Se restringió la búsqueda a humanos y estudios de cohorte. Además se utilizó la estrategia de agrupamiento retrógrado (búsqueda en las referencias de los artículos recuperados y revisiones pertinentes).
Dos revisores independientes realizaron la búsqueda en las bases de datos seleccionadas por título y resumen, quienes resolvieron las divergencias por consenso y luego, si eran potencialmente pertinentes, realizaron la revisión del artículo completo.
De los artículos seleccionados, mediante un formato de recolección se obtuvieron datos relevantes respecto a aspectos del diseño y de los sujetos incluidos, el protocolo de ultrasonido, el método de medida desarrollado o aplicado, el número de articulaciones valoradas, duración del protocolo y las medidas de rendimiento. También se evaluaron medidas de confiabilidad como la reproducibilidad intraobservador e interobservador con su respectivo Kappa cuando estuvo disponible. Se evaluó la validez interna y el riesgo de sesgo de los estudios mediante la plantilla de apreciación clínica de estudios de cohorte de Oxford. Se realizaron tablas descriptivas de las características de los pacientes incluidos en las cohortes, el protocolo de ultrasonido utilizado y la valoración metodológica de los estudios.
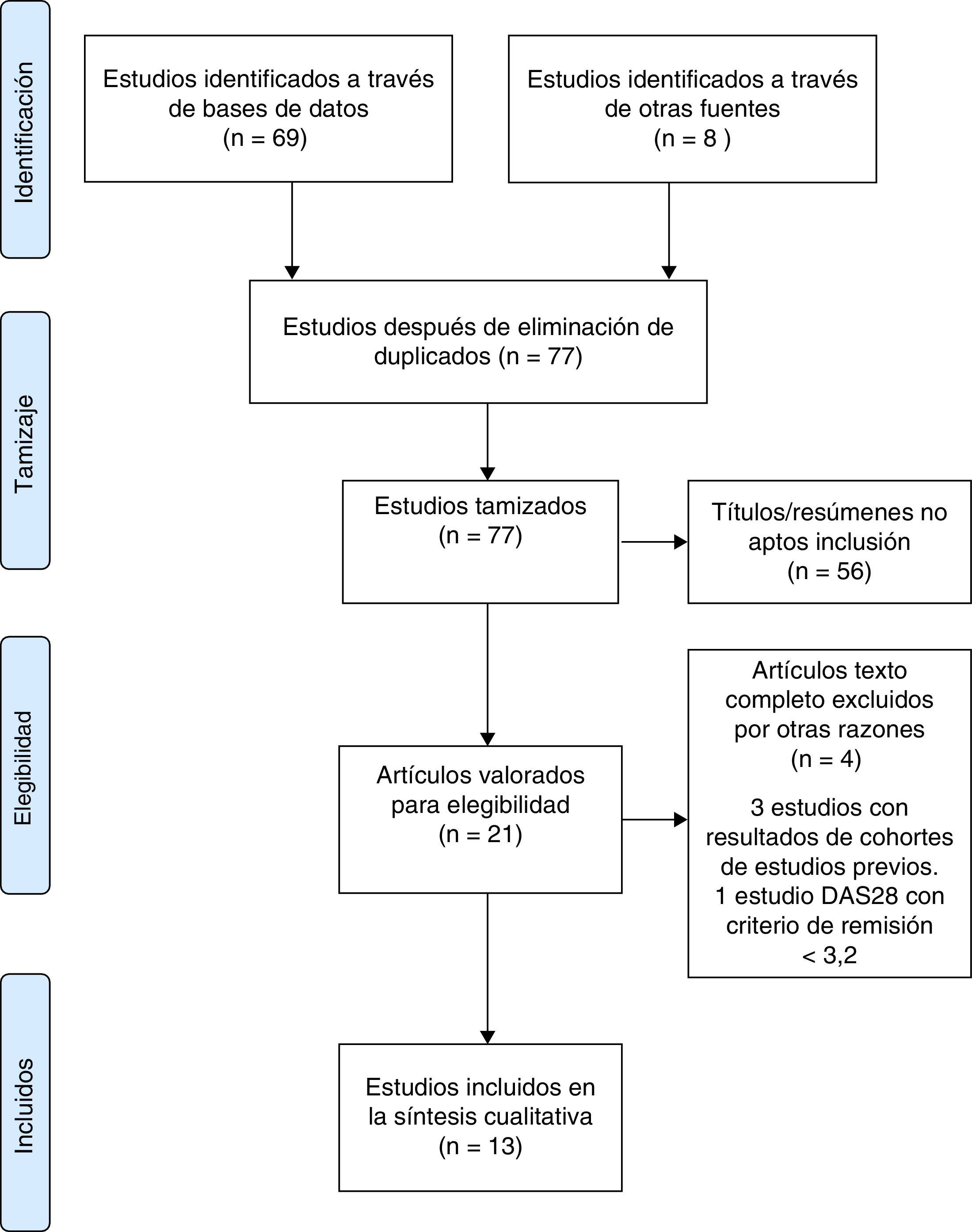
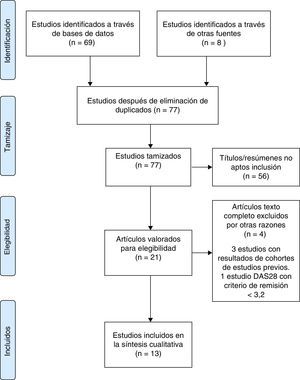
ResultadosSe obtuvieron 69 resultados en las bases de datos electrónicas y 8 por agrupamiento retrógrado o por contacto con expertos (fig. 1). Se excluyeron 56 por título o resumen, 3 por estudios duplicados, uno por DAS28 con criterio de remisión <3,2. Se incluyeron 13 estudios de cohorte para el análisis final (fig. 1). El tamaño muestral varió desde cohortes pequeñas piloto de 10 pacientes hasta 166 pacientes (tabla 1). En la tabla 1 se describen las características de los individuos incluidos en los estudios.
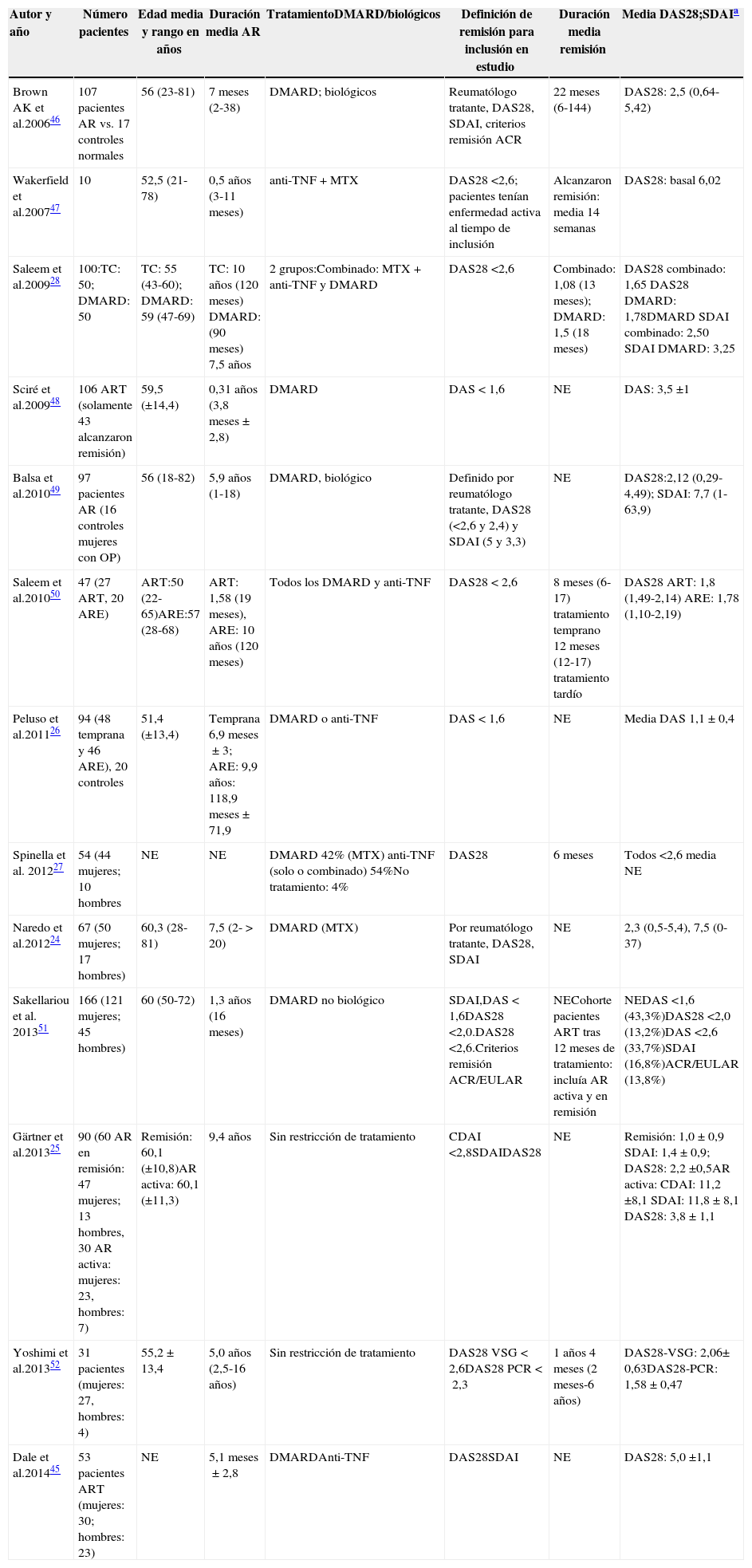
Características basales de los pacientes en las diferentes cohortes
| Autor y año | Número pacientes | Edad media y rango en años | Duración media AR | TratamientoDMARD/biológicos | Definición de remisión para inclusión en estudio | Duración media remisión | Media DAS28;SDAIa |
|---|---|---|---|---|---|---|---|
| Brown AK et al.200646 | 107 pacientes AR vs. 17 controles normales | 56 (23-81) | 7 meses (2-38) | DMARD; biológicos | Reumatólogo tratante, DAS28, SDAI, criterios remisión ACR | 22 meses (6-144) | DAS28: 2,5 (0,64-5,42) |
| Wakerfield et al.200747 | 10 | 52,5 (21-78) | 0,5 años (3-11 meses) | anti-TNF+MTX | DAS28 <2,6; pacientes tenían enfermedad activa al tiempo de inclusión | Alcanzaron remisión: media 14 semanas | DAS28: basal 6,02 |
| Saleem et al.200928 | 100:TC: 50; DMARD: 50 | TC: 55 (43-60); DMARD: 59 (47-69) | TC: 10 años (120 meses) DMARD: (90 meses) 7,5 años | 2 grupos:Combinado: MTX+anti-TNF y DMARD | DAS28 <2,6 | Combinado: 1,08 (13 meses); DMARD: 1,5 (18 meses) | DAS28 combinado: 1,65 DAS28 DMARD: 1,78DMARD SDAI combinado: 2,50 SDAI DMARD: 3,25 |
| Sciré et al.200948 | 106 ART (solamente 43 alcanzaron remisión) | 59,5 (±14,4) | 0,31 años (3,8 meses±2,8) | DMARD | DAS<1,6 | NE | DAS: 3,5 ±1 |
| Balsa et al.201049 | 97 pacientes AR (16 controles mujeres con OP) | 56 (18-82) | 5,9 años (1-18) | DMARD, biológico | Definido por reumatólogo tratante, DAS28 (<2,6 y 2,4) y SDAI (5 y 3,3) | NE | DAS28:2,12 (0,29-4,49); SDAI: 7,7 (1-63,9) |
| Saleem et al.201050 | 47 (27 ART, 20 ARE) | ART:50 (22-65)ARE:57 (28-68) | ART: 1,58 (19 meses), ARE: 10 años (120 meses) | Todos los DMARD y anti-TNF | DAS28<2,6 | 8 meses (6-17) tratamiento temprano 12 meses (12-17) tratamiento tardío | DAS28 ART: 1,8 (1,49-2,14) ARE: 1,78 (1,10-2,19) |
| Peluso et al.201126 | 94 (48 temprana y 46 ARE), 20 controles | 51,4 (±13,4) | Temprana 6,9 meses±3; ARE: 9,9 años: 118,9 meses±71,9 | DMARD o anti-TNF | DAS<1,6 | NE | Media DAS 1,1±0,4 |
| Spinella et al. 201227 | 54 (44 mujeres; 10 hombres | NE | NE | DMARD 42% (MTX) anti-TNF (solo o combinado) 54%No tratamiento: 4% | DAS28 | 6 meses | Todos <2,6 media NE |
| Naredo et al.201224 | 67 (50 mujeres; 17 hombres) | 60,3 (28-81) | 7,5 (2->20) | DMARD (MTX) | Por reumatólogo tratante, DAS28, SDAI | NE | 2,3 (0,5-5,4), 7,5 (0-37) |
| Sakellariou et al. 201351 | 166 (121 mujeres; 45 hombres) | 60 (50-72) | 1,3 años (16 meses) | DMARD no biológico | SDAI,DAS<1,6DAS28 <2,0.DAS28 <2,6.Criterios remisión ACR/EULAR | NECohorte pacientes ART tras 12 meses de tratamiento: incluía AR activa y en remisión | NEDAS <1,6 (43,3%)DAS28 <2,0 (13,2%)DAS <2,6 (33,7%)SDAI (16,8%)ACR/EULAR (13,8%) |
| Gärtner et al.201325 | 90 (60 AR en remisión: 47 mujeres; 13 hombres, 30 AR activa: mujeres: 23, hombres: 7) | Remisión: 60,1 (±10,8)AR activa: 60,1 (±11,3) | 9,4 años | Sin restricción de tratamiento | CDAI <2,8SDAIDAS28 | NE | Remisión: 1,0±0,9 SDAI: 1,4±0,9; DAS28: 2,2 ±0,5AR activa: CDAI: 11,2 ±8,1 SDAI: 11,8±8,1 DAS28: 3,8±1,1 |
| Yoshimi et al.201352 | 31 pacientes (mujeres: 27, hombres: 4) | 55,2±13,4 | 5,0 años (2,5-16 años) | Sin restricción de tratamiento | DAS28 VSG<2,6DAS28 PCR<2,3 | 1 años 4 meses (2 meses-6 años) | DAS28-VSG: 2,06± 0,63DAS28-PCR: 1,58±0,47 |
| Dale et al.201445 | 53 pacientes ART (mujeres: 30; hombres: 23) | NE | 5,1 meses±2,8 | DMARDAnti-TNF | DAS28SDAI | NE | DAS28: 5,0 ±1,1 |
ACR: Colegio Americano de Reumatología; anti-TNF: anti-factor de necrosis tumoral; AR: artritis reumatoide; ARE: artritis establecida; ART: artritis temprana; DAS: Disease Activity Score; DAS28: Disease Activity Score 28 articulaciones; DMARD: drogas modificadoras de la enfermedad; MTX: metotrexate; NE: no especificado; OP: osteoporosis; SDAI: Simplified Disease Activity Index; TC: tratamiento combinado.
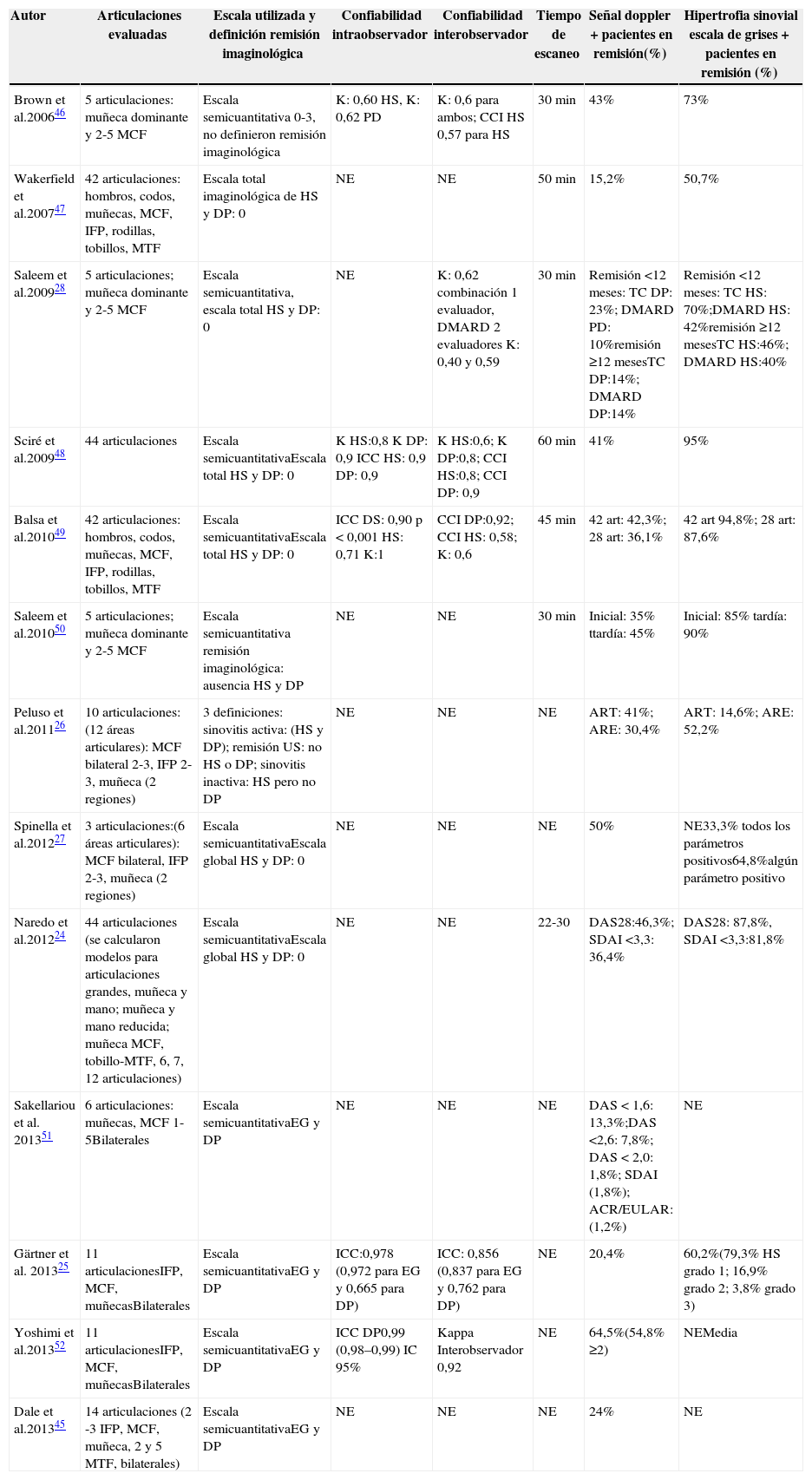
Las características técnicas de los transductores y las máquinas se reportaron consistentemente dentro de la metodología en 11 (85%) de los 13 estudios. Aspectos técnicos como la repetición de pulso, la frecuencia y la ganancia, son 3 de las características que se pueden configurar y alterar por el operador y que pueden cambiar la señal del DP, tan solo se reportaron en 4 (30,7%) de los 13 artículos.
Los hallazgos ecográficos utilizados para valorar la actividad inflamatoria fueron la presencia de HS y la presencia de vascularidad aumentada por medio de señal Doppler, según las definiciones del Outcome Measures in Rheumatology Clinical Trials:
Hipertrofia sinovial grado 0: ausente; grado 1: leve; grado 2: moderado; grado 3: marcada. Señal DP grado 0: ausencia de señal (no flujo sinovial); grado 1: presencia de un vaso en una articulación pequeña y hasta 3 vasos en una articulación grande; grado 2: presencia más de 3 vasos en menos del 50% de la cavidad sinovial; grado 3: compromiso de más del 50% de la cavidad sinovial23.
Las herramientas clinimétricas utilizadas fueron: DAS en 3 estudios, DAS28 en 11 estudios y el SDAI en 7 estudios. Es de particular interés recalcar que en los estudios donde el criterio de remisión fue determinado por criterio del reumatólogo o por DAS28, la media del índice SDAI calculado estaba por fuera del rango normal considerado como remisión (tabla 1).
El protocolo del número de articulaciones evaluadas fue variable entre los estudios, oscilando entre 5 articulaciones (muñeca dominante y 2-5 MCF) y 44 articulaciones, con una duración del protocolo que osciló entre 30 y 60 minutos (incluyendo diligenciamiento de documentación). En el estudio de Naredo et al., se encontró que el protocolo abreviado de 5 articulaciones y el de 12 articulaciones tenían mayor correlación con el método exhaustivo24 (tablas 2 y 3).
Características de los protocolos de evaluación articular por ultrasonido de las diferentes cohortes incluidas en la revisión
| Autor | Articulaciones evaluadas | Escala utilizada y definición remisión imaginológica | Confiabilidad intraobservador | Confiabilidad interobservador | Tiempo de escaneo | Señal doppler+pacientes en remisión(%) | Hipertrofia sinovial escala de grises+ pacientes en remisión (%) |
|---|---|---|---|---|---|---|---|
| Brown et al.200646 | 5 articulaciones: muñeca dominante y 2-5 MCF | Escala semicuantitativa 0-3, no definieron remisión imaginológica | K: 0,60 HS, K: 0,62 PD | K: 0,6 para ambos; CCI HS 0,57 para HS | 30min | 43% | 73% |
| Wakerfield et al.200747 | 42 articulaciones: hombros, codos, muñecas, MCF, IFP, rodillas, tobillos, MTF | Escala total imaginológica de HS y DP: 0 | NE | NE | 50min | 15,2% | 50,7% |
| Saleem et al.200928 | 5 articulaciones; muñeca dominante y 2-5 MCF | Escala semicuantitativa, escala total HS y DP: 0 | NE | K: 0,62 combinación 1 evaluador, DMARD 2 evaluadores K: 0,40 y 0,59 | 30min | Remisión <12 meses: TC DP: 23%; DMARD PD: 10%remisión ≥12 mesesTC DP:14%; DMARD DP:14% | Remisión <12 meses: TC HS: 70%;DMARD HS: 42%remisión ≥12 mesesTC HS:46%; DMARD HS:40% |
| Sciré et al.200948 | 44 articulaciones | Escala semicuantitativaEscala total HS y DP: 0 | K HS:0,8K DP: 0,9 ICC HS: 0,9 DP: 0,9 | K HS:0,6; K DP:0,8; CCI HS:0,8; CCI DP: 0,9 | 60min | 41% | 95% |
| Balsa et al.201049 | 42 articulaciones: hombros, codos, muñecas, MCF, IFP, rodillas, tobillos, MTF | Escala semicuantitativaEscala total HS y DP: 0 | ICC DS: 0,90 p<0,001 HS: 0,71K:1 | CCI DP:0,92; CCI HS: 0,58; K: 0,6 | 45min | 42 art: 42,3%; 28 art: 36,1% | 42 art 94,8%; 28 art: 87,6% |
| Saleem et al.201050 | 5 articulaciones; muñeca dominante y 2-5 MCF | Escala semicuantitativa remisión imaginológica: ausencia HS y DP | NE | NE | 30min | Inicial: 35% ttardía: 45% | Inicial: 85% tardía: 90% |
| Peluso et al.201126 | 10 articulaciones: (12 áreas articulares): MCF bilateral 2-3, IFP 2-3, muñeca (2 regiones) | 3 definiciones: sinovitis activa: (HS y DP); remisión US: no HS o DP; sinovitis inactiva: HS pero no DP | NE | NE | NE | ART: 41%; ARE: 30,4% | ART: 14,6%; ARE: 52,2% |
| Spinella et al.201227 | 3 articulaciones:(6 áreas articulares): MCF bilateral, IFP 2-3, muñeca (2 regiones) | Escala semicuantitativaEscala global HS y DP: 0 | NE | NE | NE | 50% | NE33,3% todos los parámetros positivos64,8%algún parámetro positivo |
| Naredo et al.201224 | 44 articulaciones (se calcularon modelos para articulaciones grandes, muñeca y mano; muñeca y mano reducida; muñeca MCF, tobillo-MTF, 6, 7, 12 articulaciones) | Escala semicuantitativaEscala global HS y DP: 0 | NE | NE | 22-30 | DAS28:46,3%; SDAI <3,3: 36,4% | DAS28: 87,8%, SDAI <3,3:81,8% |
| Sakellariou et al. 201351 | 6 articulaciones: muñecas, MCF 1-5Bilaterales | Escala semicuantitativaEG y DP | NE | NE | NE | DAS<1,6: 13,3%;DAS <2,6: 7,8%; DAS<2,0: 1,8%; SDAI (1,8%); ACR/EULAR: (1,2%) | NE |
| Gärtner et al. 201325 | 11 articulacionesIFP, MCF, muñecasBilaterales | Escala semicuantitativaEG y DP | ICC:0,978 (0,972 para EG y 0,665 para DP) | ICC: 0,856 (0,837 para EG y 0,762 para DP) | NE | 20,4% | 60,2%(79,3% HS grado 1; 16,9% grado 2; 3,8% grado 3) |
| Yoshimi et al.201352 | 11 articulacionesIFP, MCF, muñecasBilaterales | Escala semicuantitativaEG y DP | ICC DP0,99 (0,98–0,99) IC 95% | Kappa Interobservador 0,92 | NE | 64,5%(54,8% ≥2) | NEMedia |
| Dale et al.201345 | 14 articulaciones (2 -3 IFP, MCF, muñeca, 2 y 5 MTF, bilaterales) | Escala semicuantitativaEG y DP | NE | NE | NE | 24% | NE |
AR: artritis reumatoide; ARE: artritis establecida; ART: artritis temprana; CCI: coeficiente de correlación intraclase; DAS: Disease Activity Score; DAS28: Disease Activity Score 28 articulaciones; DMARD: drogas modificadoras de la enfermedad; EG: escala de grises; HS: hipertrofia sinovial; IFP: interfalángicas proximales; K: índice Kappa; MCF: metacarpofalángicas; MTF: metarsofalángicas; NA: no aplica; NE: no especificado; OP: osteoporosis; DP: Doppler poder; SDAI: Simplified Disease Activity Index; TC: tratamiento combinado.
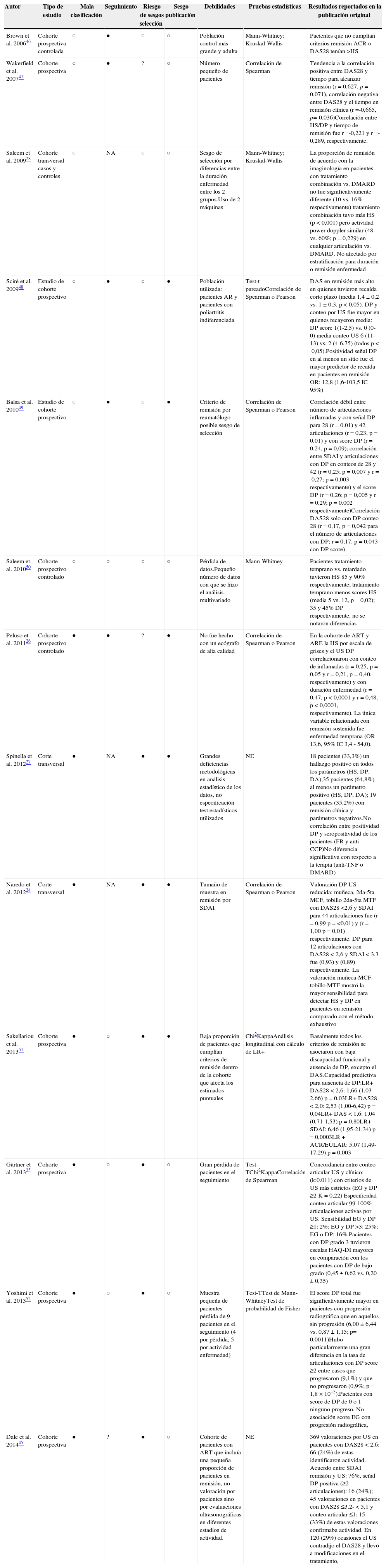
Aspectos metodológicos y la valoración de sesgos de los diferentes estudios
| Autor | Tipo de estudio | Mala clasificación | Seguimiento | Riesgo de sesgos selección | Sesgo publicación | Debilidades | Pruebas estadísticas | Resultados reportados en la publicación original |
|---|---|---|---|---|---|---|---|---|
| Brown et al. 200646 | Cohorte prospectiva controlada | ○ | ● | ○ | ○ | Población control más grande y adulta | Mann-Whitney; Kruskal-Wallis | Pacientes que no cumplían criterios remisión ACR o DAS28 tenían >HS |
| Wakerfield et al. 200747 | Cohorte prospectiva | ○ | ● | ? | ○ | Número pequeño de pacientes | Correlación de Spearman | Tendencia a la correlación positiva entre DAS28 y tiempo para alcanzar remisión (r=0,627, p=0,071), correlación negativa entre DAS28 y el tiempo en remisión clínica (r =-0,665, p= 0,036)Correlación entre HS/DP y tiempo de remisión fue r =-0,221 y r =-0,289, respectivamente. |
| Saleem et al. 200928 | Cohorte transversal casos y controles | ○ | NA | ○ | ○ | Sesgo de selección por diferencias entre la duración enfermedad entre los 2 grupos.Uso de 2 máquinas | Mann-Whitney; Kruskal-Wallis | La proporción de remisión de acuerdo con la imaginología en pacientes con tratamiento combinación vs. DMARD no fue significativamente diferente (10 vs. 16% respectivamente) tratamiento combinación tuvo más HS (p<0,001) pero actividad power doppler similar (48 vs. 60%; p=0,229) en cualquier articulación vs. DMARD. No afectado por estratificación para duración o remisión enfermedad |
| Sciré et al. 200948 | Estudio de cohorte prospectivo | ○ | ● | ○ | ● | Población utilizada: pacientes AR y pacientes con poliartritis indiferenciada | Test-t pareadoCorrelación de Spearman o Pearson | DAS en remisión más alto en quienes tuvieron recaída corto plazo (media 1,4±0,2 vs. 1±0,3, p<0,05). DP y conteo por US fue mayor en quienes recayeron media: DP score 1(1-2,5) vs. 0 (0-0) media conteo US 6 (11-13) vs. 2 (4-6,75) (todos p<0,05).Positividad señal DP en al menos un sitio fue el mayor predictor de recaída en pacientes en remisión OR: 12,8 (1,6-103,5 IC 95%) |
| Balsa et al. 201049 | Estudio de cohorte prospectivo | ○ | ● | ○ | ● | Criterio de remisión por reumatólogo posible sesgo de selección | Correlación de Spearman o Pearson | Correlación débil entre número de articulaciones inflamadas y con señal DP para 28 (r=0.01) y 42 articulaciones (r=0,23, p=0,01) y con score DP (r=0,24, p=0,09); correlación entre SDAI y articulaciones con DP en conteos de 28 y 42 (r=0,25; p=0,007 y r=0,27; p=0,003 respectivamente) y el score DP (r=0,26; p=0,005 y r=0,29; p=0.002 respectivamente)Correlación DAS28 solo con DP conteo 28 (r=0,17, p=0,042 para el número de articulaciones con DP; r=0,17, p=0,043 con DP score) |
| Saleem et al. 201050 | Cohorte prospectivo controlado | ○ | ○ | ○ | ○ | Pérdida de datos.Pequeño número de datos con que se hizo el análisis multivariado | Mann-Whitney | Pacientes tratamiento temprano vs. retardado tuvieron HS 85 y 90% respectivamente; tratamiento temprano menos scores HS (media 5 vs. 12, p=0,02); 35 y 45% DP respectivamente, no se notaron diferencias |
| Peluso et al. 201126 | Cohorte prospectivo controlado | ● | ● | ? | ● | No fue hecho con un ecógrafo de alta calidad | Correlación de Spearman o Pearson | En la cohorte de ART y ARE la HS por escala de grises y el US DP correlacionaron con conteo de inflamadas (r=0,25, p=0,05 y r=0,21, p=0,40, respectivamente) y con duración enfermedad (r=0,47, p<0,0001 y r=0,48, p<0,0001, respectivamente). La única variable relacionada con remisión sostenida fue enfermedad temprana (OR 13,6, 95% IC 3,4 - 54,0). |
| Spinella et al. 201227 | Corte transversal | ● | NA | ● | ● | Grandes deficiencias metodológicas en análisis estadístico de los datos, no especificación test estadísticos utilizados | NE | 18 pacientes (33,3%) un hallazgo positivo en todos los parámetros (HS, DP, DA);35 pacientes (64,8%) al menos un parámetro positivo (HS, DP, DA); 19 pacientes (35,2%) con remisión clínica y parámetros negativos.No correlación entre positividad DP y seropositividad de los pacientes (FR y anti-CCP)No diferencia significativa con respecto a la terapia (anti-TNF o DMARD) |
| Naredo et al. 201224 | Corte transversal | ● | NA | ● | ● | Tamaño de muestra en remisión por SDAI | Correlación de Spearman o Pearson | Valoración DP US reducida: muñeca, 2da-5ta MCF, tobillo 2da-5ta MTF con DAS28 <2.6 y SDAI para 44 articulaciones fue (r=0,99 p=<0,01) y (r=1,00 p=0,01) respectivamente. DP para 12 articulaciones con DAS28<2,6 y SDAI<3,3 fue (0,93) y (0,89) respectivamente. La valoración muñeca-MCF-tobillo MTF mostró la mayor sensibilidad para detectar HS y DP en pacientes en remisión comparado con el método exhaustivo |
| Sakellariou et al. 201351 | Cohorte prospectiva | ● | ○ | ● | ● | Baja proporción de pacientes que cumplían criterios de remisión dentro de la cohorte que afecta los estimados puntuales | Chi2KappaAnálisis longitudinal con cálculo de LR+ | Basalmente todos los criterios de remisión se asociaron con baja discapacidad funcional y ausencia de DP, excepto el DAS.Capacidad predictiva para ausencia de DP:LR+ DAS28<2,6: 1,66 (1,03-2,66) p=0,03LR+ DAS28<2,0: 2,53 (1,00-6,42) p=0,04LR+ DAS<1,6: 1,04 (0,71-1,53) p=0,80LR+ SDAI: 6,46 (1,95-21,34) p=0,0003LR+ACR/EULAR: 5,07 (1,49-17,29) p=0,003 |
| Gärtner et al. 201325 | Cohorte prospectiva | ● | ○ | ● | ○ | Gran pérdida de pacientes en el seguimiento | Test-TChi2KappaCorrelación de Spearman | Concordancia entre conteo articular US y clínico:(k:0.011) con criterios de US más estrictos (EG y DP ≥2 K=0,22) Especificidad conteo articular 99-100% articulaciones activas por US. Sensibilidad EG y DP ≥1: 2%; EG y DP >3: 25%; EG o DP: 16%.Pacientes con DP grado 3 tuvieron escalas HAQ-DI mayores en comparación con los pacientes con DP de bajo grado (0,45±0,62 vs. 0,20±0,35) |
| Yoshimi et al. 201352 | Cohorte prospectiva | ● | ○ | ● | ○ | Muestra pequeña de pacientes-pérdida de 9 pacientes en el seguimiento (4 por pérdida, 5 por actividad enfermedad) | Test-TTest de Mann-WhitneyTest de probabilidad de Fisher | El score DP total fue significativamente mayor en pacientes con progresión radiográfica que en aquellos sin progresión (6,00±6,44 vs. 0,87±1,15; p= 0,0011)Hubo particularmente una gran diferencia en la tasa de articulaciones con DP score ≥2 entre casos que progresaron (9,1%) y que no progresaron (0,9%; p=1,8×10−5).Pacientes con score de DP de 0 o 1 ninguno progreso. No asociación score EG con progresión radiográfica, |
| Dale et al. 201445 | Cohorte prospectiva | ● | ? | ● | ○ | Cohorte de pacientes con ART que incluía una pequeña proporción de pacientes en remisión, no valoración por pacientes sino por evaluaciones ultrasonográficas en diferentes estadios de actividad. | NE | 369 valoraciones por US en pacientes con DAS28<2,6: 66 (24%) de estas identificaron actividad. Acuerdo entre SDAI remisión y US: 76%, señal DP positiva (≥2 articulaciones): 16 (24%); 45 valoraciones en pacientes con DAS28 ≤3.2-<5,1 y conteo articular ≤1: 15 (33%) de estas valoraciones confirmaba actividad. En 120 (29%) ocasiones el US contradijo el DAS28 y llevó a modificaciones en el tratamiento, |
● Buena calidad (bajo riesgo de sesgos); ○ calidad menor (riesgo aumentado de sesgos); ? calidad incierta (riesgo incierto de sesgos).
AR: artritis reumatoide; ARE: artritis establecida; ART: artritis temprana; DA: distensión articular; DAS: Disease Activity Score; DAS28: Disease Activity Score 28 articulaciones; DMARD: drogas modificadoras de la enfermedad; DP: Power Doppler; HS: hipertrofia sinovial; IFP: interfalángicas proximales; MCF: metacarpofalángicas; MTF: metarsofalángicas; NE: no especificado; SDAI: Simplified Disease Activity Index; Tto: tratamiento.
Evaluaciones adicionales pronósticas de la AR, como la presencia de erosiones óseas fue reportada en 5 estudios; seropositividad para el factor reumatoide y anticuerpos antipéptido citrulinado fueron reportados en 13 y 9 estudios respectivamente; así como la valoración del epítope compartido en 2 estudios. El desenlace funcional valorado por HAQ (del inglés Health Assessment Questionnaire) fue reportado en 3 estudios.
En el estudio de Gärdner et al., se realizó el CDAI sonográfico (sCDAI) en el cual se reemplazó el conteo articular de 22 articulaciones valoradas por US (muñecas, IFP, MCP) y 6 de manera clínica (codos, hombros y rodillas) y se calculó según el número de articulaciones activas por US más las clínicamente inflamadas, las clínicamente dolorosas, la valoración global del paciente y actividad global valorada por el evaluador. Cuando se incluyeron todas las articulaciones que demostraron signos de sinovitis en US (HS o DP ≥1) el sCDAI era sustancialmente mayor con una media de 15,7 versus la media de 2,8. Cuando se analizó HS y DP ≥1 la media de sCDAI fue 5,4 y cuando se incluyeron criterios de actividad más estrictos (solo DP grado 3) no hubo diferencia en las medias de los resultados del sCDAI (1,0 versus 1,1 para el CDAI) lo que indicó un comportamiento similar. Cabe resaltar que este estudio puede estar sesgado pues plantea sus propias definiciones de: sinovitis activa, remisión por US y sinovitis inactiva que difiere de los otros estudios25.
En uno de los estudios se observó un 47% de recaídas en los siguientes 12 meses en los pacientes con presencia de señal DP que se encontraban en remisión clínica, comparados con el 20% de recaídas observadas en los pacientes con señal DP negativa (p=0,009)26.
No hubo diferencias significativas en cuanto a frecuencia de pacientes con DP positivo en los estudios que evaluaron el tratamiento de combinación DMARD y DMARD más terapia biológica (principalmente anti-TNFα) en comparación con terapia DMARD simple, lo cual indica que lo relevante del tratamiento es alcanzar remisión sea con monoterapia o en combinación27,28.
DiscusiónLos avances en el manejo de la AR han resultado en un mejor desenlace para los pacientes, haciendo de la remisión clínica una meta posible. Esto ha generado un cambio del método de evaluación de la remisión en pacientes con AR, pasando de criterios clínicos a clinimétricos de rigurosidad progresiva29–31.
Existen varias definiciones de remisión clínica de acuerdo con la herramienta clinimétrica utilizada (DAS, DAS28, criterios ACR, SDAI) en los diferentes estudios clínicos7,32. De todos los índices clínicos, la clasificación de remisión basada en el DAS y su versión abreviada el DAS28 son las más utilizadas. Pero cuando se evalúa el desenlace de correlación con los hallazgos ecográficos, el SDAI fue el que mejor correlación presentó32–35. Se considera que un DAS <1,6 y el SDAI <3,3 son unos criterios de remisión mucho más estrictos que un DAS 28 <2,636.
Se ha descrito que hasta un 20% de los pacientes en remisión, calculada por el DAS28, pueden tener 2 o más articulaciones inflamadas y que el número de articulaciones dolorosas puede llegar a ser superior a 5. Esto reduce su credibilidad y sugiere que muchos pacientes en estado de remisión definido por el DAS28, tienen un estado de baja actividad37,38. El SDAI es un índice que emplea 5 variables (número de articulaciones dolorosas e inflamadas con 28 articulaciones, valoración de la actividad por el paciente y el médico, en una escala de 0 a 10 y la proteína C reactiva en mg/dl). Este índice se correlaciona muy bien con el DAS28, la discapacidad y la progresión del daño estructural en pacientes con enfermedad activa. Sin embargo, la correlación con el DAS28 en los niveles de remisión no es tan buena. Conceptualmente, este índice es mejor que el DAS28 para definir remisión, ya que permite un máximo de 2 articulaciones dolorosas, 2 articulaciones inflamadas o una dolorosa más una inflamada, lo que produce menos falsos positivos. Adicionalmente, tiene valores medios de dolor, valoración de actividad por el paciente y el médico menores que con el DAS28 y obtiene frecuencias de remisión menores que con este último32,35,38,39.
Además, incluye la PCR en vez de la velocidad de sedimentación globular, que es más sensible y específica de inflamación, es menos dependiente de otras situaciones como la edad, el sexo o las características morfológicas o cualicuantitativas de la sangre39.
Teniendo en cuenta lo anterior, los estudios analizados en esta revisión sistemática muestran que entre los pacientes con AR en remisión por clinimetría, valorados por ecografía articular, existe actividad inflamatoria en un grado variable, documentada por la presencia de HS en EG en el 14,6 a 95% de los pacientes y de 1,2 a 64,5% por señal DP. Esto sugiere la posibilidad de que exista discrepancia entre la remisión clínica y lo que se considera remisión imaginológica (ausencia de sinovitis) en la AR.
Los resultados aportan pruebas para considerar que los métodos actuales, clínicos y paraclínicos no necesariamente son indicadores de verdadera remisión inflamatoria y probablemente esto estaría relacionado con la progresión del daño estructural, descrita en los pacientes en remisión clínica.
El hallazgo más importante en la valoración ecográfica en EG es la presencia de HS, sin embargo, es importante tener certeza de que no se trate de un pannus crónico no activo, es aquí donde la señal Doppler y su grado permite discriminar y evaluar una verdadera actividad inflamatoria.
En cuanto a los estudios que compararon el tratamiento con DMARD convencionales y terapia biológica en particular con anti-TNFα (combinado con DMARD), pero con criterios de remisión clínica o clinimétrica similares, estos tienen tasas comparables de sinovitis detectable determinada como presencia de señal DP, lo que sugiere que estructuralmente es más importante alcanzar criterios de remisión clínica y por clinimetría sin importar el tipo de tratamiento usado, sea terapia DMARD o biológica, lo que lleva a suponer que es más importante alcanzar la remisión independientemente del tratamiento utilizado y que la terapia con anti-TNF no ofrece ventaja adicional en cuanto al desenlace de menores puntajes en el DP.
La sola presencia de positividad de la señal DP no debe interpretarse categóricamente como actividad de la enfermedad, debe tenerse en cuenta además el grado de señal presente en la articulación evaluada, dado que se ha documentado la presencia de señal grado 1 hasta en el 11% de las articulaciones de pacientes sin patología inflamatoria, que podrían corresponder a la presencia de vasos fisiológicos detectados por ecógrafos de alta sensibilidad (transductores de alta frecuencia 10-20MHz)40,41. Es aquí donde la distinción entre el nivel de señal que debe considerarse «normal» o «anormal» constituye una limitación de las escalas de la ultrasonografía actual, pues tanto los límites de detección como el rango de referencia para el DP en perfusión sinovial no han sido establecidos. Probablemente, tengan mayor correlación clínica si se consideran como patológicas las señales de DP mayores a 125.
La reproducibilidad y la concordancia de los hallazgos del US, particularmente entre no radiólogos, es una consideración importante con una prueba que es potencialmente dependiente del operador. Este aspecto se convierte en su mayor desventaja, esto sin contar que tanto la interpretación, la exploración o adquisición de imágenes la realiza una misma persona. Con esto en mente, los estudios de confiabilidad de sinovitis semicuantitativa han demostrado, generalmente, niveles aceptables de acuerdo entre 2 lectores en las articulaciones de la mano, muñeca y rodillas, hallazgos que también se han demostrado en estudios de expertos ultrasonografistas, lo ideal para un método diagnóstico es que sean buenos (Kappa entre 0.61-0.80) o muy buenos (Kappa entre 0.81-1.0)3,23,42–44.
En los estudios de esta revisión la reproducibilidad y la fuerza de concordancia fueron buenas, en parte debido a la gran experiencia de los operadores como también al uso de una nomenclatura y semiología estándar en los diferentes estudios.
Se sugiere que la US puede tener utilidad en los pacientes con hallazgos de actividad inflamatoria subclínica para realizar cambios en el tratamiento farmacológico, tal y como lo demuestra el estudio TASER (Targeting Synovitis in Early Rheumatoid Arthritis) en el cual se realizaron cambios de tratamiento en el 29% de los pacientes y está pendiente la presentación de los resultados en cuanto a desenlaces clínicos45.
La ecografía articular muestra tener capacidad como instrumento predictor de recaída entre los pacientes con AR en remisión, lo que pudiera tener implicaciones muy importantes en ajustes de terapia, disminución de dosis de medicamentos y retiro de terapias en busca de una mejor relación de costo-efectividad.
Solo unos pocos estudios han investigado el papel de la US y el DP en pacientes con remisión clínica y la mayoría fueron realizados por un mismo grupo de investigadores, realizando varias evaluaciones sobre la misma cohorte, llevando a un consolidado de pacientes menor, redundancia de análisis y de datos, lo que nos llevó a excluir algunos estudios y a contactar a los investigadores.
En conclusión, en pacientes con AR en remisión por clinimetría puede existir actividad subclínica de la enfermedad confirmada por pruebas imaginológicas, tales como la ultrasonografía a través de la evaluación de la HS y el DP, siendo esta última más sensible en la detección de la actividad inflamatoria.
Pudiera estar esto relacionado con la progresión de la enfermedad a pesar de lograrse metas clínicas en algunos pacientes. Adicionalmente, la ecografía articular, en particular la señal DP, es predictora de recaída en seguimiento a 12 meses, lo que hace pensar que la ecografía musculoesquelética jugará un rol importante como instrumento optimizador de la terapia en AR.
Sin embargo, se requieren más estudios que evalúen el rendimiento de estas pruebas en el diagnóstico de la actividad subclínica de la enfermedad, estos deben tener un adecuado diseño metodológico y cálculo de la muestra según la prevalencia de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Responsabilidades ÉticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Agradecimientos a la doctora Diana Cristina Carrillo por la revisión y corrección de este manuscrito.