La amiloidosis secundaria es una complicación de enfermedades inflamatorias crónicas, sin embargo, no es frecuente su asociación con lupus eritematoso sistémico, siendo pocos casos los reportados en la literatura. Se describe un caso de una paciente de 50 años con lupus eritematoso sistémico, quien presenta linfadenopatías cervicales con compresión extrínseca traqueal, en las que se documenta amiloidosis secundaria.
Secondary amyloidosis is a complication of chronic inflammatory diseases, however it is unusual in systemic lupus erythematosus, and few cases have been reported in medical literature. We present a case report or a 50-year-old female patient, with history of systemic lupus erythematosus who developed neck lymphadenopathies with extrinsic tracheal compression with histopathologic examination showing secondary amyloidosis.
La amiloidosis secundaria (AA) es una complicación descrita dentro de una variedad de enfermedades infecciosas, neoplásicas e inflamatorias crónicas; sin embargo, la asociación de amiloidosis con lupus eritematoso sistémico (LES) es rara, encontrándose pocos casos registrados en la literatura. Este artículo describe un caso de amiloidosis secundaria con compromiso ganglionar, en un paciente con diagnóstico de LES y que presenta la asociación infrecuente de estas dos entidades.
Reporte de casoSe trata de una mujer de 50 años con antecedente de LES, con compromiso cutáneo, articular, presencia de úlceras orales, compromiso de serosas, hematológico e inmunológico (ANA: 1/2560 con patrón moteado, anti-Ro: 116 U, anti-La: 152 U, anti-Sm 190 U, anti-RNP negativos, C3 - C4 consumido), asociado a síndrome de Sjögren. Tratamiento inmunomodulador con cloroquina y prednisolona.
La paciente cursa a finales de 2008 con aparición de adenopatías cervicales, diaforesis nocturna, hiporexia, pérdida de peso de 7kg y aparición de estridor laríngeo, con tomografía axial computarizada (TAC) de cuello, que evidencia conglomerados ganglionares en espacios parafaríngeo y retrotraqueal, con biopsia por aspiración guiada con ecografía que documenta linfadenopatía reactiva, por lo cual no se realizan estudios adicionales en ese momento.
En marzo de 2009 presenta dolor torácico tipo pleurítico basal derecho, asociado a disnea progresiva, tos con expectoración hemoptoica y fiebre de 39°C. A su ingreso, se estudia con hemograma el cual es normal, VSG 55mm/h y PCR en 56mg/L, azoados y pruebas de función hepática normales. Recibe antibiótico inicialmente, por sospecha diagnóstica de neumonía adquirida en la comunidad, con requerimiento de soporte vasopresor y hospitalización en unidad de cuidados intensivos, sin embargo, como diagnóstico diferencial se considera descartar síndrome linfoproliferativo vs. tuberculosis.
En nueva biopsia de adenopatía cervical se reporta linfadenopatía reactiva y se toman baciloscopias seriadas en esputo, las cuales son negativas; la TAC de tórax muestra consolidación de segmentos posteriores de ambos lóbulos inferiores, con presencia de adenomegalias. Se inicia tratamiento empírico tetraconjugado para tuberculosis y se realiza fibrobroncoscopia y lavado broncoalveolar con baciloscopias y tinciones negativas, por lo cual se suspende tratamiento antituberculoso (dosis total 12 días), y se documenta compresión traqueal extrínseca en 3 niveles, lesiones endobronquiales susceptibles de biopsia, pero la paciente no desea realizarse el procedimiento pidiendo retiro voluntario de nuestro hospital.
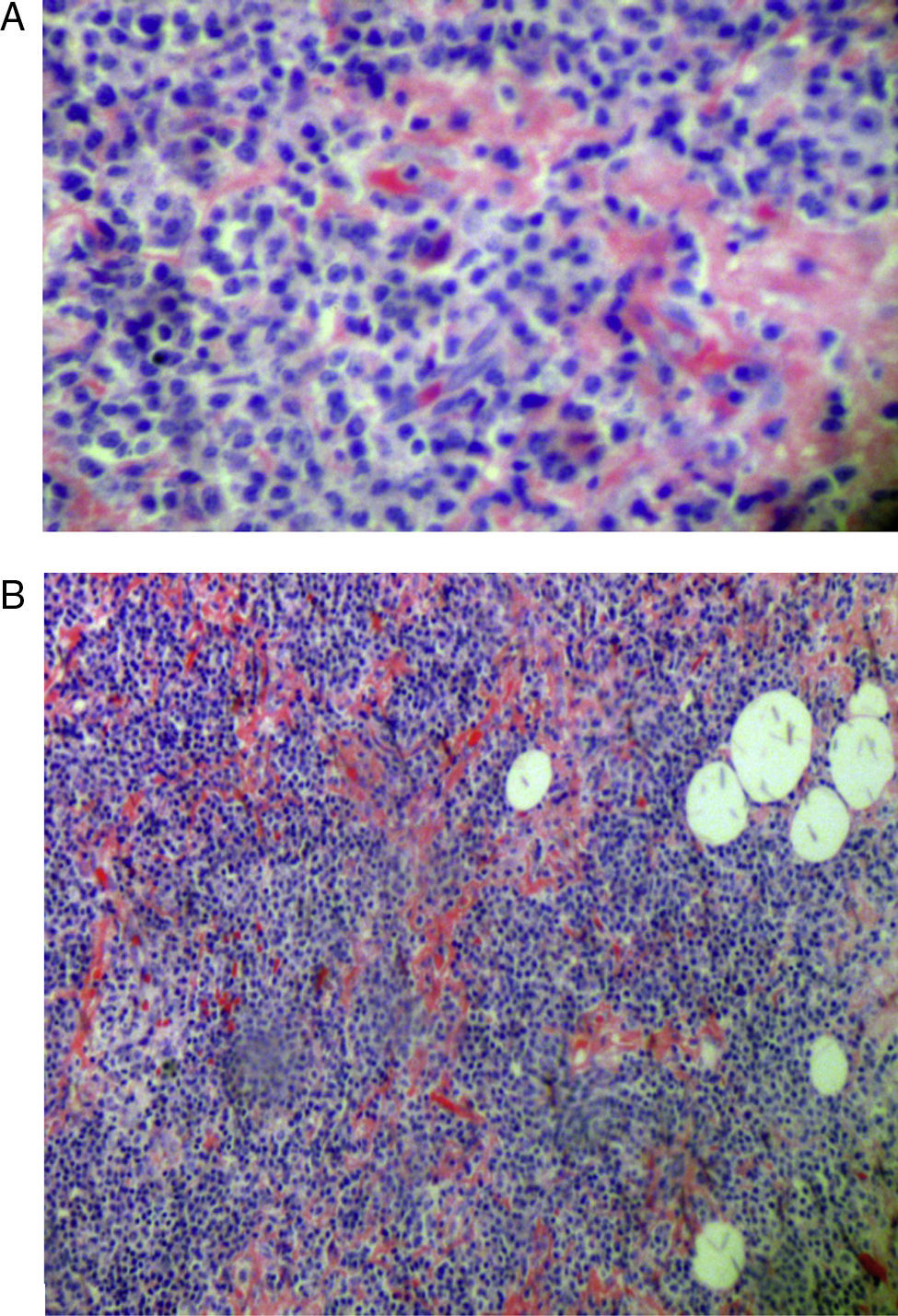
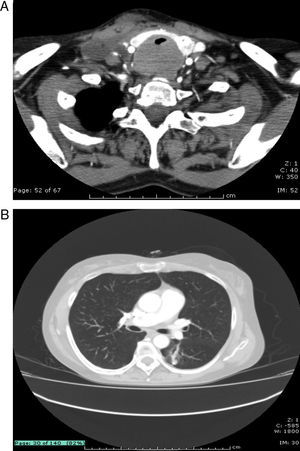
En septiembre de 2010 consulta de nuevo por aumento de disnea y estridor, encontrándose como hallazgos en paraclínicos PCR aumentada (49mg/L), en TAC de cuello compromiso de vía aérea por masa infiltrante localizada a nivel de unión laringotraqueal derecha, de 4×3cm hacia el aspecto posterior de la tráquea, con oclusión del 80% de la luz de la vía aérea (fig. 1A). TAC de tórax con granulomas calcificados, bronquiectasias y enfisema centroacinar (fig. 1 B). Se lleva a biopsia excisional ganglionar la cual evidencia reemplazo de población linfoide por material eosinofílico, amorfo y presencia de células gigantes multinucleadas de tipo cuerpo extraño en la periferia de estos acúmulos. La coloración de rojo Congo fue positiva para la detección de amiloide, sin evidencia de malignidad en el tejido examinado (fig. 2 A y B). Se optimizó tratamiento para lupus asociando azatioprina, con lo que tiene adecuada respuesta clínica, manteniéndose en remisión clínica de su enfermedad.
La amiloidosis AA puede ocurrir como una complicación de diversas enfermedades que cursen con inflamación crónica como infecciones, neoplasias y enfermedades autoinmunes, principalmente en casos de artritis reumatoide, espondiloartritis y enfermedad de Behcet1,2. Dentro de sus manifestaciones, independiente de la asociación etiológica que se tenga, se han registrado el compromiso de riñón, tracto gastrointestinal, hígado, bazo, corazón, pulmón, ganglios y médula ósea, siendo el compromiso renal el más frecuente3,4. Para el caso presentado, consideramos que la causa más probable de amiloidosis fue el LES asociado a síndrome de Sjögren, ya que otras causas inflamatorias, hereditarias o infecciosas fueron excluidas dentro del abordaje clínico.
De los casos revisados en la literatura que reportan la coexistencia de amiloidosis AA y LES, se registra compromiso renal frecuente a modo de síndrome nefrótico5–9, seguido de compromiso pulmonar10–12, y reportes aislados de compromiso en corazón, médula ósea, tracto gastrointestinal y ganglios13–15, siendo este último el registrado en este reporte de caso. Existe una relación temporal variable entre el diagnóstico de LES y la aparición de amiloidosis AA, oscilando entre uno a 35 años, así mismo, la preponderancia femenina en LES disminuye cuando se asocia amiloidosis AA, representando la población masculina cerca del 40% de los casos reportados. Con respecto a la actividad lúpica, esta es variable, teniendo como uno de los componentes más homogéneos, la elevación constante de la proteína C reactiva, como sucedió en el caso de nuestra paciente.
La amiloidosis AA se caracteriza por el depósito de una sustancia amiloide derivada de la proteína amiloide sérica A, un reactante de fase aguda secretado por el hígado en respuesta a estímulos inflamatorios como IL-616. Los depósitos de amiloide se acumulan generando alteración en la estructura y función tisular; sin embargo, para que se generen estos depósitos, se tiene como prerrequisito la persistencia en el tiempo de valores elevados de proteína amiloide sérica A, que es característica de estímulos inflamatorios crónicos. Sin embargo, se desconoce por qué solo un porcentaje bajo de inflamaciones crónicas generan amiloidosis AA17,18.
Para el caso específico del LES, su rara asociación con amiloidosis AA se encuentra en probable relación con los niveles bajos de proteína amiloide sérica A, así exista una actividad importante de la enfermedad7, sin embargo, la medición en la práctica clínica de este biomarcador no es frecuente por lo que varias de las observaciones realizadas con la proteína amiloide sérica A se han extrapolado al comportamiento de la proteína C reactiva9. Es así como se postula, que pacientes con elevación crónica de la proteína C reactiva y proteína amiloide sérica A, son los más proclives al desarrollo de amiloidosis AA.
ConclusiónLa amiloidosis AA o amiloidosis secundaria es una complicación infrecuente en LES, pero debe tenerse en cuenta pues su presencia puede empeorar el pronóstico de la enfermedad autoinmune. El control estricto de la actividad lúpica y, probablemente, la reducción de los niveles de proteína C reactiva y de proteína amiloide sérica A, pueden ser estrategias útiles en la prevención de la amiloidosis secundaria a LES.
Responsabilidades éticasDerecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Protección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.