La isquemia mesentérica aguda es una urgencia médica que se presenta en menos de 1/1.000 ingresos hospitalarios. Es una entidad clínica infrecuente, predominante en adultos mayores de 50 años con afectación cardíaca, en quienes la presencia de dolor abdominal agudo es la manifestación cardinal y debería hacer sospechar dicho diagnóstico. La presentación en adolescentes es inusual, por lo que, en estos casos, la posibilidad de una trombofilia subyacente debe formar parte del diagnóstico diferencial. Presentamos el caso de una paciente joven con deficiencia de proteínas C y S como agente causal de trombosis mesentérica.
Acute mesenteric ischaemia is a medical emergency that accounts for less than 1/1,000 hospital admissions. The disease affects adults older than 50 years predominantly with cardiac compromise, in whom the presence of acute abdominal pain is the cardinal manifestation, and should make the clinician suspect this entity. Its presentation in adolescents is unusual; therefore, in these cases, the possibility of an underlying thrombophilia should be part of the differential diagnosis. The case is presented here of a young female with a protein C and S deficiency as the cause of mesenteric thrombosis.
La isquemia mesentérica aguda es una condición clínica que aparece cuando el flujo sanguíneo de los vasos mesentéricos es insuficiente para las demandas metabólicas tisulares, generando lesiones que dependen del vaso afectado, el grado de oclusión, el mecanismo de la isquemia (oclusiva o no oclusiva), su duración y la presencia de circulación colateral. La mucosa y la submucosa, que en condiciones normales reciben el 70% del flujo vascular, son las capas más vulnerables a los efectos de la hipoxia, de ahí que las lesiones iniciales se asienten en la mucosa, donde se aprecian áreas de edema, hemorragia submucosa, ulceración y, finalmente, necrosis. Solo en casos de isquemia persistente, el daño puede comprometer todas las capas del tejido intestinal (isquemia transmural), existiendo la posibilidad de perforación, peritonitis y sepsis derivadas1.
Las posibles causas pueden ser divididas en 4 grandes grupos: 1) trombofilias hereditarias, tales como la deficiencia de antitrombina iii, la deficiencia de plasminógeno, la deficiencia de proteína C, la deficiencia de proteína S, la hiperfibrinogenemia, la mutación del factor v de Leiden, la anemia de células falciformes, así como algunas alteraciones genéticas infrecuentes, como la mutación G20210A de la protrombina y la mutación JAK2 V617F; 2) trombofilias adquiridas y estados de hipercoagulabilidad sistémica, entre las que se encuentran el embarazo, el uso de anticonceptivos orales, el consumo de cocaína (u otras sustancias con potencial de causar vasoespasmo), el síndrome de anticuerpos antifosfolípidos, la coagulación intravascular diseminada, las gammapatías monoclonales, la hemoglobinuria paroxística nocturna, la policitemia vera, el síndrome nefrótico, la trombocitemia esencial y el embolismo, entre otras; 3) causas intraabdominales: anomalías congénitas, cirrosis, enfermedad intestinal inflamatoria, infección intraabdominal, pancreatitis, traumatismos, vólvulo intestinal y estados posquirúrgicos, y 4) causa idiopática que pudiera dar cuenta hasta del 49% de los casos dependiendo de la serie2–4, representando uno de cada 1.000 ingresos hospitalarios y hasta el 5% de la mortalidad hospitalaria. El no reconocimiento oportuno de esta enfermedad puede llevar a complicaciones catastróficas, con una tasa de mortalidad de hasta el 80% de los afectados5,6.
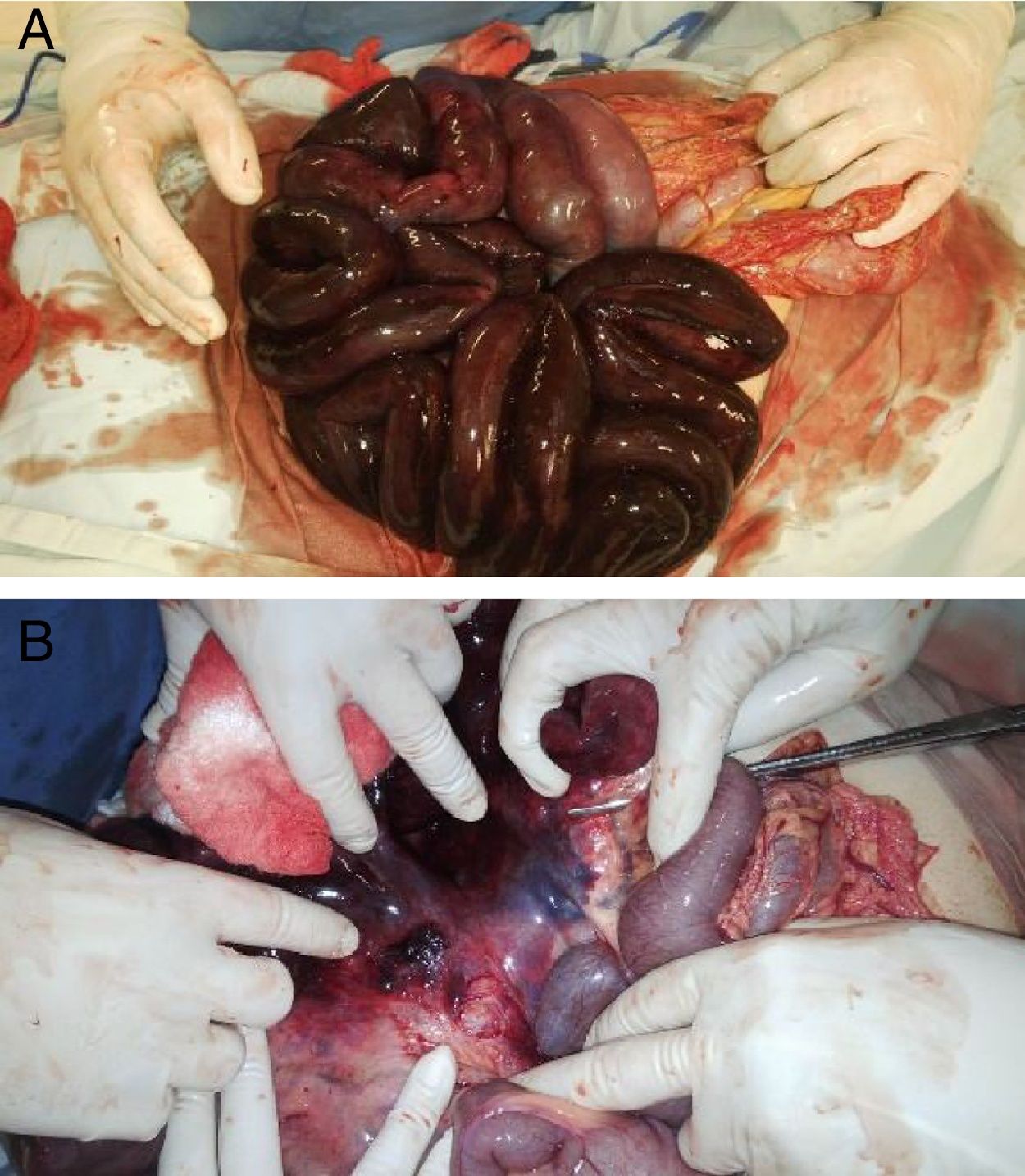
Presentación del casoPaciente femenina de 15 años, quien ingresa al Servicio de Urgencias de un hospital de referencia por presentar dolor abdominal difuso asociado a múltiples episodios eméticos, hipotensión (60/30mmHg), taquicardia (160lpm), taquipnea (22rpm) y leucocitosis (25.590/dl), en ausencia de fiebre. Es llevada a cirugía de urgencia por sospecha de sepsis de origen abdominal (apendicitis), encontrándose una isquemia intestinal aguda secundaria a trombosis de la vasculatura mesentérica superior (arterial y venosa), con compromiso del intestino delgado desde el duodeno hasta el íleon terminal, requiriendo resección de esta zona debido a necrosis (resección del 75% de su extensión) (fig. 1). En la anamnesis, refiere la paciente estar previamente sana, sin antecedentes personales o familiares importantes.
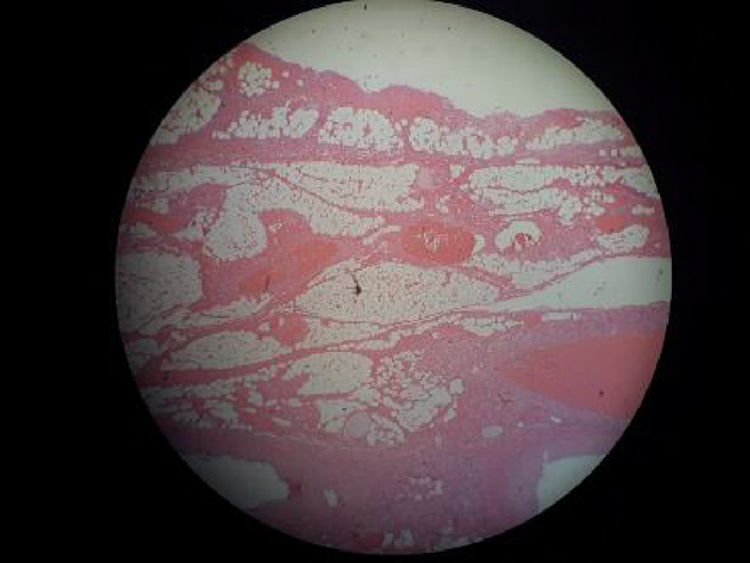
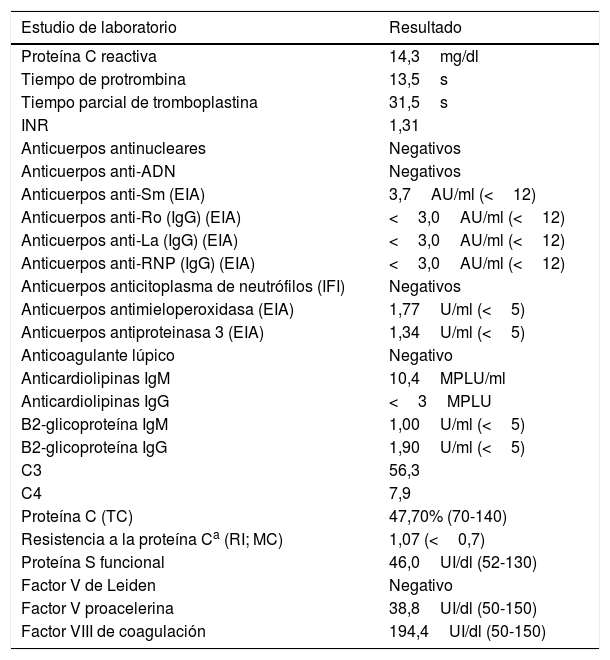
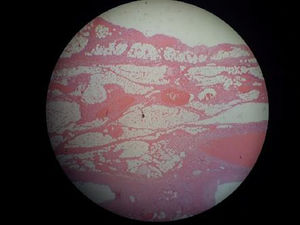
Posterior a la intervención quirúrgica, la paciente fue llevada a la Unidad de Cuidado Intensivo, donde fue estabilizada y anticoagulada, y se solicitaron estudios complementarios para descartar estados de hipercoagulabilidad y causas autoinmunes (tabla 1). El material quirúrgico fue enviado para estudio histopatológico e inmunohistoquímico, reportándose isquemia intestinal oclusiva transmural con compromiso arterial y venoso (fig. 2).
Resultados de laboratorio
| Estudio de laboratorio | Resultado |
|---|---|
| Proteína C reactiva | 14,3mg/dl |
| Tiempo de protrombina | 13,5s |
| Tiempo parcial de tromboplastina | 31,5s |
| INR | 1,31 |
| Anticuerpos antinucleares | Negativos |
| Anticuerpos anti-ADN | Negativos |
| Anticuerpos anti-Sm (EIA) | 3,7AU/ml (<12) |
| Anticuerpos anti-Ro (IgG) (EIA) | <3,0AU/ml (<12) |
| Anticuerpos anti-La (IgG) (EIA) | <3,0AU/ml (<12) |
| Anticuerpos anti-RNP (IgG) (EIA) | <3,0AU/ml (<12) |
| Anticuerpos anticitoplasma de neutrófilos (IFI) | Negativos |
| Anticuerpos antimieloperoxidasa (EIA) | 1,77U/ml (<5) |
| Anticuerpos antiproteinasa 3 (EIA) | 1,34U/ml (<5) |
| Anticoagulante lúpico | Negativo |
| Anticardiolipinas IgM | 10,4MPLU/ml |
| Anticardiolipinas IgG | <3MPLU |
| B2-glicoproteína IgM | 1,00U/ml (<5) |
| B2-glicoproteína IgG | 1,90U/ml (<5) |
| C3 | 56,3 |
| C4 | 7,9 |
| Proteína C (TC) | 47,70% (70-140) |
| Resistencia a la proteína Ca (RI; MC) | 1,07 (<0,7) |
| Proteína S funcional | 46,0UI/dl (52-130) |
| Factor V de Leiden | Negativo |
| Factor V proacelerina | 38,8UI/dl (50-150) |
| Factor VIII de coagulación | 194,4UI/dl (50-150) |
EIA: inmunoanálisis enzimático; IFI: inmunofluorescencia indirecta; INR: razón internacional normalizada; MC: método coagulométrico; RI: razón normalizada; TC: técnica cromogénica.
La paciente fue diagnosticada con una isquemia mesentérica aguda secundaria a una deficiencia combinada de proteínas C (47,70%) y S (46,0UI/dl), descartando causas como lupus eritematoso sistémico, síndrome de anticuerpos antifosfolípidos, vasculitis sistémica primaria de grandes, medianos y pequeños vasos, así como otras trombofilias (tabla 1). Debido a la resección extensa del intestino delgado, se planteó la posibilidad de realizar un trasplante intestinal, razón por la que se remitió a la paciente a una institución con capacidad de realizar este tipo de procedimientos e implementar un manejo interdisciplinario adecuado. No obstante, a la fecha de redacción de este reporte de caso, el trasplante ha sido diferido debido a la excelente respuesta que ha tenido la paciente a la nutrición enteral, continuando terapia antitrombótica.
DiscusiónLa deficiencia de las proteínas C y S predispone a trombosis venosas en los miembros inferiores, particularmente en la adolescencia temprana, y en general la presentación inicial ocurre antes de los 40 años. A pesar de esto, la deficiencia de una u otra puede ocasionar la formación de trombos en diversos lechos vasculares, particularmente en forma de trombosis venosa de los miembros inferiores7. La presentación como isquemia mesentérica es bastante inusual y el compromiso arterial asociado podría considerarse exótico, con pocos casos reportados en la literatura mundial a la fecha.
Clínicamente es imposible distinguir entre la deficiencia de proteína C, S u otras causas de trastornos hipercoagulables primarios. Se debe sospechar la posibilidad de uno de estos desórdenes cuando se presenta un paciente con uno o más de los siguientes criterios: 1) trombosis venosa a edad temprana (<50 años), especialmente cuando no haya una causa precipitante o esta sea débil; 2) historia familiar fuerte para trombosis venosa (familiares en primer grado afectados a edades tempranas); 3) eventos trombóticos recurrentes, especialmente a edades tempranas, y 4) trombosis venosa en sitios inusuales, tales como el lecho esplácnico o cerebral8.
Otro de los aspectos a considerar es la existencia de enfermedad autoinmune subyacente o de novo, particularmente en mujeres en edad reproductiva. En el caso presentado, se realizaron estudios de tamizaje para enfermedades, tales como lupus eritematoso sistémico, con reportes de ANA, ENA y anti-ADN negativos, síndrome de anticuerpos antifosfolípidos (anticoagulante lúpico, anticardiolipinas IgM e IgG, B2-glicoproteínas IgM e IgG, así como IgG para los siguientes fosfolípidos: fosfatidiletanolamina, fosfatidilserina, fosfatidilglicerol, ácido fosfatídico y fosfatidilinositol, siendo todos estos negativos), vasculitis sistémica primaria (arteritis de Takayasu, sin ausencia de pulsos, sin diferencia>10mmHg de presión arterial entre extremidades, sin carotidinia ni soplos carotídeos o subclavios; también fueron descartadas la enfermedad de Kawasaki, la poliarteritis nudosa y la vasculitis de pequeños vasos; los anticuerpos para vasculitis sistémicas y sus especificidades fueron negativos). Es importante mencionar este aspecto, ya que este tipo de entidades, en especial las vasculitis de grandes vasos, pueden ocasionar, no de forma infrecuente, isquemia mesentérica9,10.
Nuestra paciente tuvo estudios negativos para trombofilias, tales como la mutación del factor v de Leiden y mutaciones del factor viii de la coagulación, siendo estos los más frecuentemente encontrados en enfermedades autoinmunes. Los únicos estudios positivos en este caso fueron las deficiencias cuantitativas de las proteínas C y S. Es importante mencionar que los niveles de las proteínas anticoagulantes pueden encontrarse disminuidas tras un evento trombótico, así como con el uso de anticoagulantes orales, particularmente la warfarina7. A pesar de esto, se realizaron estudios confirmatorios posteriores al periodo de convalecencia, obteniendo nuevamente una deficiencia cuantitativa de las 2 moléculas ya mencionadas.
Si bien dentro de las causas más comunes de trombosis arterial y venosa se encuentran las vasculitis sistémicas, las cuales constituyen un diagnóstico diferencial para tener en cuenta en pacientes jóvenes previamente sanos, las trombofilias primarias forman parte del diagnóstico diferencial a tener en cuenta. Existen pocos reportes en la literatura de deficiencia de proteína C o S con esta presentación clínica; la mayor parte de los casos ha tenido desenlaces desfavorables, por lo que es indispensable tener en cuenta estas entidades como posibles causas, con el fin de realizar un tratamiento oportuno y mejorar la calidad de vida de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Mónica Duque, especialista en cuidado intensivo pediátrico en la Clínica Los Rosales, Pereira, Risaralda.