Los pacientes hospitalizados con enfermedades reumáticas o autoinmunes sistémicas (ERAS) generan gran impacto en términos clínicos.
ObjetivosCaracterizar a la población y estimar factores de riesgo asociados con la presencia de desenlaces adversos en pacientes evaluados hospitalariamente por reumatología en la Clínica Imbanaco durante los años 2013-2019.
MetodologíaSe analizó una cohorte histórica de pacientes hospitalizados que fueron evaluados por reumatología. La población se clasificó así: grupo 1, pacientes con ERAS diagnosticada de novo; grupo 2, pacientes con ERAS diagnosticada conocida; grupo 3, pacientes sin ERAS diagnosticada; y grupo 4, pacientes con sospecha no confirmada de ERAS. Se definió un desenlace adverso compuesto si se presentó al menos uno de los siguientes casos: 1) mortalidad hospitalaria; 2) ingreso a la unidad de cuidado intensivo; 3) infección intrahospitalaria; 4) reingreso.
ResultadosEn un total de 327 eventos de hospitalización (307 pacientes), la mediana de edad fue 48 (34-63) años y 222 (72,3%) fueron mujeres. El desenlace adverso compuesto se presentó en 136 (41,5%) eventos. El grupo 2 tuvo mayor número de desenlaces adversos (61/128; 47,6%). Las variables asociadas con peores resultados fueron: diagnóstico inicial cardiovascular (OR=4,63; IC: 1,60-13,43; p=0,005), mayor estancia hospitalaria (OR=1,04; IC: 1,01-1,07; p=0,005) y tener una especialidad tratante diferente a medicina interna (OR=2,79; IC: 1,26-6,17; p=0,011). El sexo masculino (OR=0,29; IC: 0,12-0,66; p=0,004), pertenecer a un régimen especial de salud (OR=0,39; IC: 0,15-0,99; p=0,047) y tener hemoglobina >11,4g/dL (OR=0,82; IC: 0,69-0,99; p=0,039) fueron factores asociados con menor oportunidad de desarrollar el desenlace compuesto.
ConclusionesEn esta cohorte histórica se encontró que porcentualmente el grupo de pacientes con ERAS diagnosticadas conocidas presentó mayor número de desenlaces adversos, entre los que se destacan para el mismo grupo, el ingreso a UCI y el reingreso hospitalario.
Hospitalized patients with systemic autoimmune rheumatic diseases (SARDs) generate high impact in clinical terms.
ObjectivesTo characterize the study population and estimate risk factors associated with the presence of adverse outcomes in hospitalized patients consulting rheumatology at Clínica Imbanaco between January 2013 and December 2019.
MethodsWe analysed a historical cohort of hospitalized patients who were evaluated by rheumatology. The population was classified as follows: group 1, patients with new onset diagnosed SARDs; group 2, patients with known diagnosed SARDs; group 3, patients without diagnosed SARDs; and group 4, patients with unconfirmed suspicion of SARDs. A composite adverse outcome was defined if at least one of the following occurred: 1) hospital mortality, 2) admission to the intensive care unit, 3) hospital infection, or 4) readmission.
ResultsInformation was collected from 327 hospitalization events (307 patients). The median age was 48 (34-63) years and 222 (72.3%) were women. The composite adverse outcome occurred in 136 (41.5%) hospitalization events. Group 2 had the highest number of adverse outcomes (61/128; 47.6%). The variables associated with the worst outcomes were cardiovascular diagnosis at admission (OR=4.63; CI: 1.60-13.43; p=.005), longer hospital stay (OR=1.04; CI: 1.01-1.07; p=.005), and atreating specialty other than internal medicine (OR=2.79; CI: 1.26-6.17; p=.011). Male sex (OR=.29; CI: .12-.66; p=.004), having special health coverage (OR=.39; CI: .15-.99; p=.047), and haemoglobin>11.4g/dL (OR=.82; CI: .69-.99; p=.039) were the factors associated with lower odds of developing the composite outcome.
ConclusionsIn this historical cohort, the group of patients with known diagnosed SARDs presented a higher number in percentage terms of adverse outcomes. The most frequent adverse outcomes were admission to the ICU and hospital readmission.
Las enfermedades reumáticas pueden acompañarse de compromiso sistémico multiorgánico por autoinmunidad1. Se caracterizan por dolor, inflamación crónica y persistente, alteración de la capacidad funcional y deterioro de la calidad de vida. Algunas de estas enfermedades se asocian con disminución de la expectativa de vida2. Las enfermedades autoinmunes afectan alrededor de 3-5% de los seres humanos, especialmente a las mujeres; el 80% de ellas en edad reproductiva3.
La Organización Mundial de la Salud y la Liga Internacional de Asociaciones de Reumatología han implementado estrategias para impactar en la identificación, la prevención y el control de estas enfermedades, las cuales se consideran un problema de salud pública4–6. En Colombia, las enfermedades reumáticas más frecuentes, según los estimados de prevalencia, son la osteoartritis (10,81%) y la lumbalgia mecánica (7,24%). De las enfermedades reumáticas inflamatorias, la artritis reumatoide (AR) es la más prevalente en la población adulta (1,49%), en tanto que son menos prevalentes la gota (0,56%), el síndrome de Sjögren (0,08%) y el lupus eritematoso sistémico (LES) (0,05%)7. Puesto que la AR es una de las enfermedades reumáticas más prevalentes en Colombia, es relevante destacar que esta se ha priorizado como una enfermedad de alto costo, porque existe una mayor probabilidad de complicaciones, requiere un consumo más elevado de recursos del sistema de salud y genera un gasto de bolsillo en los pacientes8.
Con respecto a pacientes hospitalizados con enfermedades reumáticas o autoinmunes sistémicas (ERAS), se ha demostrado previamente el impacto que tiene la estancia hospitalaria en términos clínicos y económicos9–11. Varios estudios describen el curso y analizan los desenlaces hospitalarios de ERAS aisladas, como LES y esclerosis sistémica12–14, pero son escasas las publicaciones que reportan los desenlaces hospitalarios en pacientes con ERAS en general por fuera de la unidad de cuidados intensivos (UCI)10,11,15,16. La mortalidad en UCI de pacientes con ERAS oscila entre el 17 y el 55% (datos de Colombia, Argentina, Estados Unidos, España, Francia y China), siendo las infecciones y la actividad de la misma enfermedad las principales causas17–25. Lo anterior destaca la importancia de los estudios en este tipo de enfermedades, así como la relevancia que tienen las estrategias implementadas para abordar el problema de salud pública que representan.
En la literatura revisada se encontró poca información nacional y latinoamericana con respecto a la caracterización de la interconsulta hospitalaria de reumatología, incluyendo pacientes en UCI y por fuera de esta15,26. Se desconocen los factores de riesgo asociados con desenlaces adversos en población colombiana con ERAS hospitalizada por fuera de UCI. Se considera relevante conocer el curso de la hospitalización en pacientes evaluados por reumatología, con el fin de tomar medidas que impliquen mejoramiento en la atención, además de promover más investigación al respecto. Teniendo en cuenta lo expuesto, el presente estudio tuvo como objetivo realizar una caracterización de los pacientes evaluados por reumatología hospitalariamente y determinar factores de riesgo asociados con la presencia de desenlaces adversos como infección intrahospitalaria, ingreso a UCI, mortalidad o reingreso.
MetodologíaSe realizó un estudio tipo cohorte histórica. Se incluyeron los registros disponibles de pacientes ≥18años hospitalizados que requirieron ser evaluados por reumatología en la Clínica Imbanaco (CI) de Cali, Colombia, durante los años 2013-2019. En la CI reumatología es una subespecialidad interconsultante. Cada episodio de hospitalización fue definido como un evento independiente; es decir, si durante el tiempo de estudio un mismo paciente ingresó a hospitalización 3 veces, se analizó en la base de datos cada uno de los eventos. Un reingreso (hospitalización por la misma causa en los 30 primeros días después del egreso) no se interpretó como un nuevo evento, sino como un desenlace adverso.
Clasificación de la poblaciónLa población se clasificó de la siguiente manera: grupo 1, pacientes con ERAS diagnosticada de novo; grupo 2, pacientes con ERAS diagnosticada conocida; grupo 3, pacientes sin ERAS diagnosticada; grupo 4, pacientes con sospecha no confirmada de ERAS. Los pacientes con enfermedades autoinmunes limitadas a un solo órgano no se incluyeron como ERAS (e. g., enfermedad inflamatoria ocular, anemia hemolítica autoinmune, lupus subagudo cutáneo, pioderma gangrenoso, psoriasis sin manifestaciones articulares, enfermedad tiroidea, hepática, pancreática, inflamatoria intestinal o suprarrenal autoinmune sin manifestaciones sistémicas). Algunos de los pacientes quedaron en el grupo 4 cuando presentaban hallazgos de compromiso sistémico por confirmar o establecer en el tiempo; la mayoría se asignó al grupo 3.
Desenlaces adversosSe consideró la presencia del desenlace adverso compuesto cuando los pacientes presentaron al menos uno de los siguientes eventos relacionados: 1) mortalidad hospitalaria; 2) ingreso a UCI en cualquier momento de la estancia hospitalaria (en caso de varios ingresos a UCI en una misma hospitalización se evaluó el motivo y la estancia inicial); 3) infección intrahospitalaria, definida como aquella infección identificada después de las primeras 48h a partir del ingreso27; y 4) reingreso hospitalario, definido como ingreso hospitalario que ocurriera en los primeros 30 días posteriores al egreso, por la misma causa de la hospitalización inicial. La elección de estos desenlaces se dio a partir de la revisión de la literatura. Algunos de estos parámetros se reconocen ampliamente como indicadores de calidad hospitalaria28.
Recolección de la informaciónSe incluyeron todas las historias clínicas electrónicas disponibles, a partir de registros propios del servicio de reumatología y la base de datos suministrada por el área de informática de la CI. Durante el procedimiento para la recolección de la información, las fuentes primarias fueron las historias clínicas electrónicas de los pacientes que cumplieron con los criterios de elegibilidad. No se incluyó la totalidad de registros de los reumatólogos de la institución por limitaciones en la captura de dichos datos. La recolección de la información se realizó con la aplicación de organización de datos Magpi+ (DataDyne Group LLC. Copyright© 2020 Magpi. Versión 6.1.12 (6198)), la cual permaneció disponible en teléfonos móviles y computadores del equipo de investigadores. No se realizaron intervenciones sobre los pacientes incluidos.
Análisis estadísticoTodos los datos se analizaron mediante el paquete estadístico Stata 13 (StataCorp. 2013. Stata Statistical Software: Release 13. College Station, TX: StataCorp LP). Se realizó un análisis descriptivo para todas las variables. Las variables cuantitativas se describieron en medianas (p25-p75) y las cualitativas se resumieron a partir de medidas de frecuencias absolutas y relativas. Se llevó a cabo un análisis bivariado mediante la comparación de las variables entre los cuatro grupos del estudio, por medio de las pruebas de chi-cuadrado o Fisher para las variables cualitativas. En las variables cuantitativas se utilizó la prueba de Mann-Whitney para la comparación de dos grupos y la de Kruskal-Wallis para más de dos grupos.
El análisis de los factores asociados con el desenlace adverso compuesto se realizó por medio de un modelo de regresión logística condicional, considerando que los cuatro grupos del estudio presentaban riesgos diferentes para desarrollar el evento adverso. La magnitud de asociación entre las variables se describe por odds ratio (OR), ajustada por los grupos del estudio. Valores de p<0,05 fueron considerados estadísticamente significativos.
Consideraciones éticasEl proyecto de investigación contó con la aprobación de los comités de investigación y ética de la Universidad Libre de Cali y de la CI. Este fue un estudio retrospectivo analítico sin ningún tipo de intervención en pacientes. Solo se revisaron los registros electrónicos de los pacientes evaluados por reumatología de forma hospitalaria. Se mantuvo la confidencialidad de la información, siguiendo los principios de la declaración de Helsinki y los parámetros establecidos en la Resolución 8430 de 1993 expedida por el Ministerio de Salud de Colombia.
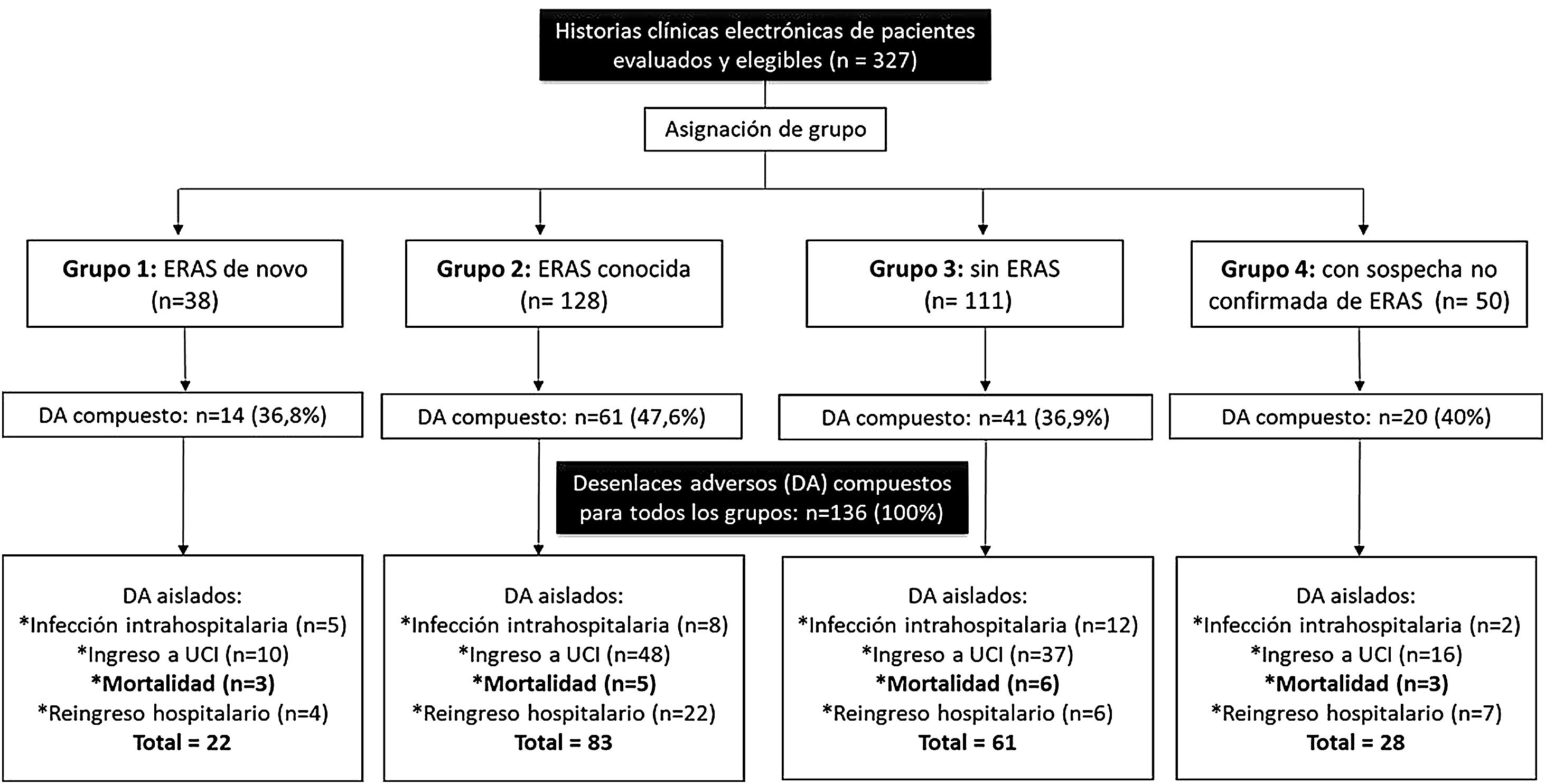
ResultadosPara el periodo comprendido entre enero del 2013 y diciembre del 2019, se logró obtener información de 327 eventos hospitalarios entre 307 pacientes vistos por reumatología en la CI. La figura 1 representa esquemáticamente la estructura general del estudio en cuanto a la conformación de los grupos y la presencia de los desenlaces adversos evaluados: 136 compuestos y 194 aislados. Algunos pacientes presentaron más de uno de los desenlaces adversos aislados durante su hospitalización; por tanto, el sumatorio de ellos no resulta igual al del desenlace adverso compuesto para cada grupo del estudio.
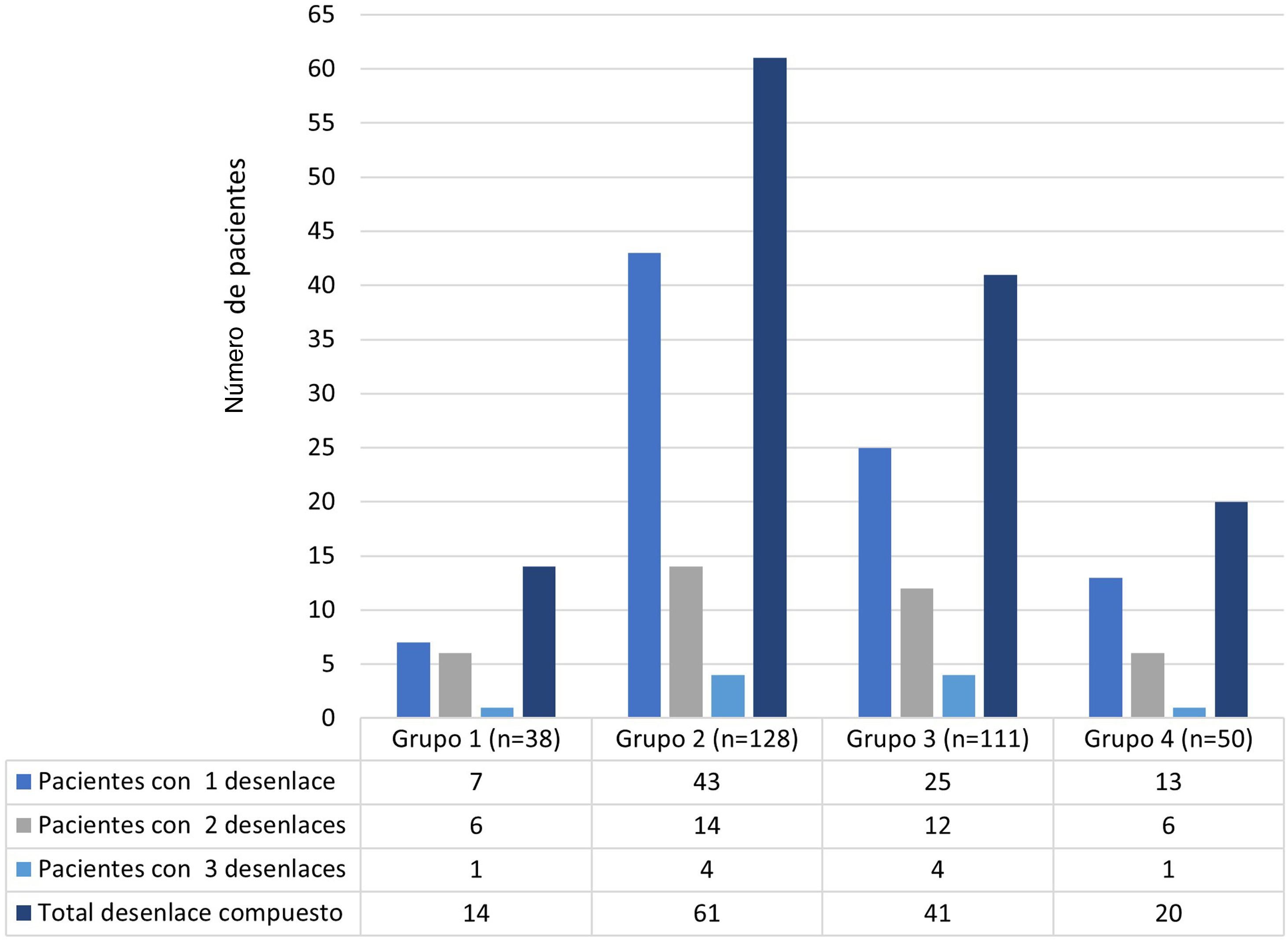
La distribución de los eventos de hospitalización entre los grupos del estudio resultó de la siguiente forma: grupo 1, 38 (11,6%); grupo 2, 128 (39,2%); grupo 3, 111 (33,9%); y grupo 4, 50 (15,3%) eventos. El desenlace adverso compuesto se presentó en 136 (41,5%) eventos hospitalarios. Del total de eventos, las frecuencias de los desenlaces fueron: ingreso a UCI 33,9% (n=111); reingreso 11,9% (n=39); infección intrahospitalaria 8,2% (n=27) y mortalidad hospitalaria 5,2% (n=17). La figura 2 complementa la distribución de los desenlaces adversos aislados que presentaron los pacientes por cada grupo.
En cuanto a las características generales, la mediana de edad fue de 48 (34-63) años y 222 (72,3%) participantes fueron mujeres. La mayoría de los pacientes eran mestizos (78,5%). El 30,9% de la población tenía estudios universitarios. Con respecto al tipo de régimen de atención en salud, el 59% de los pacientes pertenecía a un régimen especial, el cual incluía medicina prepagada, particular y pólizas de seguro médico. En la tabla 1 se muestran las características generales de la población. El origen de la derivación fue demanda espontánea para el 64,5% de los eventos; el resto procedía de consulta externa o de otros hospitales.
Características generales de la población
| Variables | Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | General | Valor de p |
|---|---|---|---|---|---|---|
| n (%) | 38 (12,4) | 112 (36,5) | 110 (35,8) | 47 (15,3) | 307 (100) | |
| Sexo | 0,806 | |||||
| Femenino | 25 (65,8) | 82 (73,2) | 81 (73,6) | 34 (72,4) | 222 (72,3) | |
| Masculino | 13 (34,2) | 30 (26;8) | 29 (26,4) | 13 (27,6) | 85 (27,7) | |
| Edad (años)a | 53 (30-59) | 51 (35-68) | 44 (34-62) | 46 (31-65) | 48 (34-63) | 0,348 |
| Etniab | 0,066 | |||||
| Mestizo | 28 (73,8) | 85 (75,9) | 92 (83,7) | 36 (76,7) | 241 (78,5) | |
| Afrodescendiente | 4 (10,5) | 11 (9,8) | 6 (5,4) | 1 (2,1) | 22 (7,2) | |
| Indígena | 1 (2,6) | 2 (1,8) | - | 2 (4,2) | 5 (1,6) | |
| Otro | 1 (2,6) | - | - | - | 1 (0,3) | |
| Sin dato | 4 (10,5) | 14 (12,5) | 12 (10,9) | 8 (17) | 38 (12,4) | |
| Escolaridad | 0,005 | |||||
| Universitaria | 5 (13,1) | 35 (31,2) | 46 (41,8) | 9 (19,2) | 95 (30,9) | |
| Secundaria | 11 (28,9) | 26 (23,3) | 21 (19) | 15 (31,9) | 73 (23,8) | |
| Primaria | 4 (10,5) | 11 (9,8) | 6 (5,4) | 1 (2,1) | 22 (7,2) | |
| Técnica | - | - | 1 (0,9) | 2 (4,2) | 3 (1) | |
| Sin dato | 18 (47,4) | 40 (35,7) | 36 (32,7) | 20 (42,6) | 114 (37,1) | |
| Régimen de salud | 0,012 | |||||
| Especial | 18 (47,4) | 65 (58) | 75 (68,2) | 23 (48,9) | 181 (59) | |
| Contributivo | 7 (18,4) | 31 (27,7) | 16 (14,5) | 16 (34,1) | 70 (22,8) | |
| Subsidiado | 13 (34,2) | 16 (14,3) | 19 (17,3) | 8 (17) | 56 (18,2) | |
| Procedencia | 0,591 | |||||
| Cali | 26 (68,4) | 79 (70,5) | 88 (80) | 35 (74,5) | 228 (74,3) | |
| Valle del Cauca (no Cali) | 6 (15,8) | 17 (15,2) | 14 (12,7) | 5 (10,6) | 42 (13,7) | |
| Colombia (fuera del Valle del Cauca) | 5 (13,1) | 14 (12,5) | 8 (7,3) | 6 (12,8) | 33 (10,7) | |
| Otro país | 1 (2,6) | 2 (1,8) | - | 1 (2,1) | 4 (1,3) | |
| Comorbilidadesc | ||||||
| HTA | 11 (28,9) | 63 (49,2) | 26 (23,4) | 13 (26) | 113 (34,5) | <0,001 |
| Hipotiroidismo | 7 (18,4) | 36 (28,1) | 19 (17,1) | 9 (18) | 71 (21,7) | 0,183 |
| Cardiopatíad | 5 (13,1) | 23 (17,9) | 8 (7,2) | 5 (10) | 41 (12,5) | 0,086 |
| ERCe | 4 (10,5) | 26 (20,3) | 6 (5,4) | 2 (4) | 38 (11,6) | 1,000 |
| Diabetes mellitus | 3 (7,8) | 14 (10,9) | 11 (9,9) | 3 (6) | 31 (9,5) | 0,830 |
| Dislipidemia | 4 (10,5) | 7 (5,4) | 8 (7,2) | 5 (10) | 24 (7,3) | 0,539 |
| Cáncerf | 1 (2,6) | 9 (7,0) | 8 (7,2) | 1 (2) | 19 (5,8) | 0,499 |
| Trastorno depresivo | 3 (7,8) | 5 (3,91) | 7 (6,3) | 4 (8) | 19 (5,8) | 0,534 |
| Obesidad | 1 (2,6) | 5 (3,9) | 5 (4,5) | 2 (4) | 13 (3,9) | 1,000 |
| EPOC | 1 (2,6) | 4 (3,1) | 6 (5,4) | 2 (4) | 13 (3,9) | 0,812 |
| Insuficiencia venosa de MMII | - | 5 (3,9) | 2 (1,8) | 1 (2) | 8 (2,4) | 0,683 |
| Osteoporosis | 1 (2,6) | 1 (0,7) | 2 (1,8) | 2 (4) | 6 (1,8) | 0,356 |
| Tuberculosis | - | 2 (1,5) | 3 (2,7) | - | 5 (1,5) | 0,724 |
| ECV | 1 (2,6) | 2 (1,5) | - | 1 (2) | 4 (1,2) | 0,304 |
| Infección por VIH | - | - | 2 (1,8) | - | 2 (0,6) | 0,461 |
| Otrasg | 4 (10,5) | 5 (3,9) | 15 (13,5) | 10 (20) | 34 (10,4) | 0,005 |
ECV: enfermedad cerebrovascular; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; HTA: hipertensión arterial; MMII: miembros inferiores; VIH: virus de inmunodeficiencia humana.
Si se consideran todos los eventos de hospitalización, entre los pacientes del grupo 2, el diagnóstico de base más común fue LES (42,1%), seguido por AR (26,5%), síndrome de Sjögren (11,7%), esclerosis sistémica (10,1%), vasculitis (6,2%), artropatía cristalina (gota y artropatía por cristales de pirofosfato de calcio) (4,6%) y otros diagnósticos como enfermedad muscular inflamatoria, sarcoidosis y síndrome antifosfolípido (10,1%). En el mismo grupo, el 75% tenía seguimiento previo por reumatología y el 82,8% recibía tratamiento inmunomodulador: esteroides (66,4%), antimaláricos (30,4%), azatioprina (15,6%) y biológicos (12,5%).
La mediana de la estancia hospitalaria para los cuatro grupos fue de 11 (6-22) días. Las características generales de la hospitalización por grupos se muestran en la tabla 2. La mediana del tiempo entre el inicio de los síntomas y el ingreso fue de 6 (2-14) días (oportunidad de consulta) y la mediana del tiempo entre la solicitud de la interconsulta a reumatología y la respuesta a ella fue de 9,5 (4-31) horas. Con relación a la sala en la cual permanecieron los pacientes durante la mayor parte de su estancia, 295 (90,2%) de todos los eventos se dieron en hospitalización general, 23 (7%) en UCI y el resto en otras salas como la unidad de cuidado coronario o ginecobstetricia.
Características de la población durante la hospitalización
| Variables | Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | General | Valor de p |
|---|---|---|---|---|---|---|
| n (%) | 38 (11,6) | 128 (39,1) | 111 (33,9) | 50 (15,2) | 327 (100) | 0,862 |
| Diagnóstico inicial principala | ||||||
| Cardiovascular | 8 (21) | 27 (21) | 18 (16,2) | 6 (12) | 59 (18) | |
| Infeccioso | 4 (10,5) | 28 (21,8) | 5 (4,5) | 12 (24) | 49 (14,9) | |
| Neuromuscular u ocular | 4 (10,5) | 12 (9,3) | 28 (25,2) | 4 (8) | 48 (14,7) | |
| Respiratorio | 5 (13,1) | 11 (8,5) | 14 (12,6) | 4 (8) | 34 (10,5) | |
| Musculoesquelético | 5 (13,1) | 10 (7,8) | 7 (6,3) | 11 (22) | 33 (10) | |
| Hematooncológico | 6 (15,7) | 5 (3,9) | 12 (10,8) | 5 (10) | 28 (8,5) | |
| Fiebre como signo no asociado con un sistema | 1 (2,6) | 10 (7,8) | 12 (10,8) | 1 (2) | 24 (7,4) | |
| Gastrointestinal o hepático | 1 (2,6) | 7 (5,4) | 7 (6,3) | 2 (4) | 17 (5,3) | |
| Renal | 3 (7,8) | 6 (4,6) | 5 (4,5) | 1 (2) | 15 (4,6) | |
| Actividad/brote de la enfermedad reumática | 1 (2,6) | 10 (7,8) | - | - | 11 (3,4) | |
| Otro | - | 2 (1,5) | 3 (2,7) | 4 (8) | 9 (2,7) | |
| Recibió esquema inmunosupresor | 26 (68,4) | 65 (50,7) | 33 (29,7) | 21 (42) | 145 (44,3) | <0,001 |
| Ingreso a UCI | 10 (26,3) | 48 (37,5) | 37 (33,3) | 16 (32) | 111 (33,9) | 0,637 |
| Requerimiento de TRR de novo | 7 (18,4) | 6 (4,6) | 3 (2,7) | 21 (42) | 21 (18,9) | 0,352 |
| Días de estancia hospitalariab | 17 (7-32) | 11 (7-21) | 12 (7-19) | 9 (5-22) | 11 (6-22) | 0,172 |
| Reingreso hospitalario | 4 (10,5) | 22 (17,1) | 6 (5,4) | 7 (14) | 39 (11,9) | 0,032 |
| Exámenes de laboratoriob,c | ||||||
| Recuento de leucocitos (cel/μL) | 9.170 (6.820-13.170) | 8.920 (5.830-12.859) | 10.130 (6.930-13.230) | 9.515 (6.790-13.670) | 9.130 (6.695-13.085) | 0,704 |
| Recuento de linfocitos (cel/μL) | 1.100 (740-1.560) | 1.200 (700-1.770) | 1.840 (1.080-2.700) | 1.580 (970-2.050) | 1.390 (850-2.180) | 0,001 |
| Hemoglobina (g/dL) | 9,4 (8-10,4) | 10,1 (8,4-11,9) | 11,4 (9,5-13,1) | 10,9 (8,4-12,8) | 10,4 (8,6-12,4) | 0,001 |
| Plaquetas (cel en miles/μL) | 217 (152-306) | 244 (145-347) | 271 (177-348) | 264 (201-339) | 259,5 (170,5-340,5) | 0,313 |
| Creatinina (mg/dL) | 1 (0,65-2) | 0,9 (0,7-1,28) | 0,77 (0,62-1,01) | 0,75 (0,68-1,07) | 0,81 (0,67-1,15) | 0,006 |
| PCR (mg/L) | 65,8 (20,9-122) | 59,6 (23,6-133) | 58,7 (7,4-126,8) | 41 (13,6-121) | 58,6 (14,3-130,5) | 0,539 |
Cel: células; PCR: proteína C reactiva; TRR: terapia de reemplazo renal; UCI: unidad de cuidado intensivo.
La mitad de toda la población tuvo como especialidad tratante a medicina interna. Las otras especialidades clínicas tratantes incluyeron neurología y otras subespecialidades de medicina interna. El principal motivo de la interconsulta a reumatología fue la actividad de la enfermedad reumática de base (los siguientes motivos más frecuentes fueron síndrome articular, alteraciones neuromusculares u oculares y alteraciones hematoncológicas) (en la tabla S1 del material adicional se muestran porcentualmente las causas de la interconsulta a reumatología). Entre los eventos de hospitalización de los grupos 1 y 2 del estudio, los diagnósticos reumatológicos finales más frecuentes fueron LES, 70/166 (42,2%); AR, 29/166 (17,5%); vasculitis, 14/166 (8,4%); síndrome de Sjögren, 14/166 (8,4%); esclerosis sistémica, 13/166 (7,8%); artropatía por cristales, 10/166 (6%) y otros, 16/166 (9,6%). Los diagnósticos principales que motivaron la hospitalización fueron cardiológicos, siendo los más frecuentes: insuficiencia cardiaca, síndrome coronario, taquiarritmia auricular o ventricular y miocardiopatía.
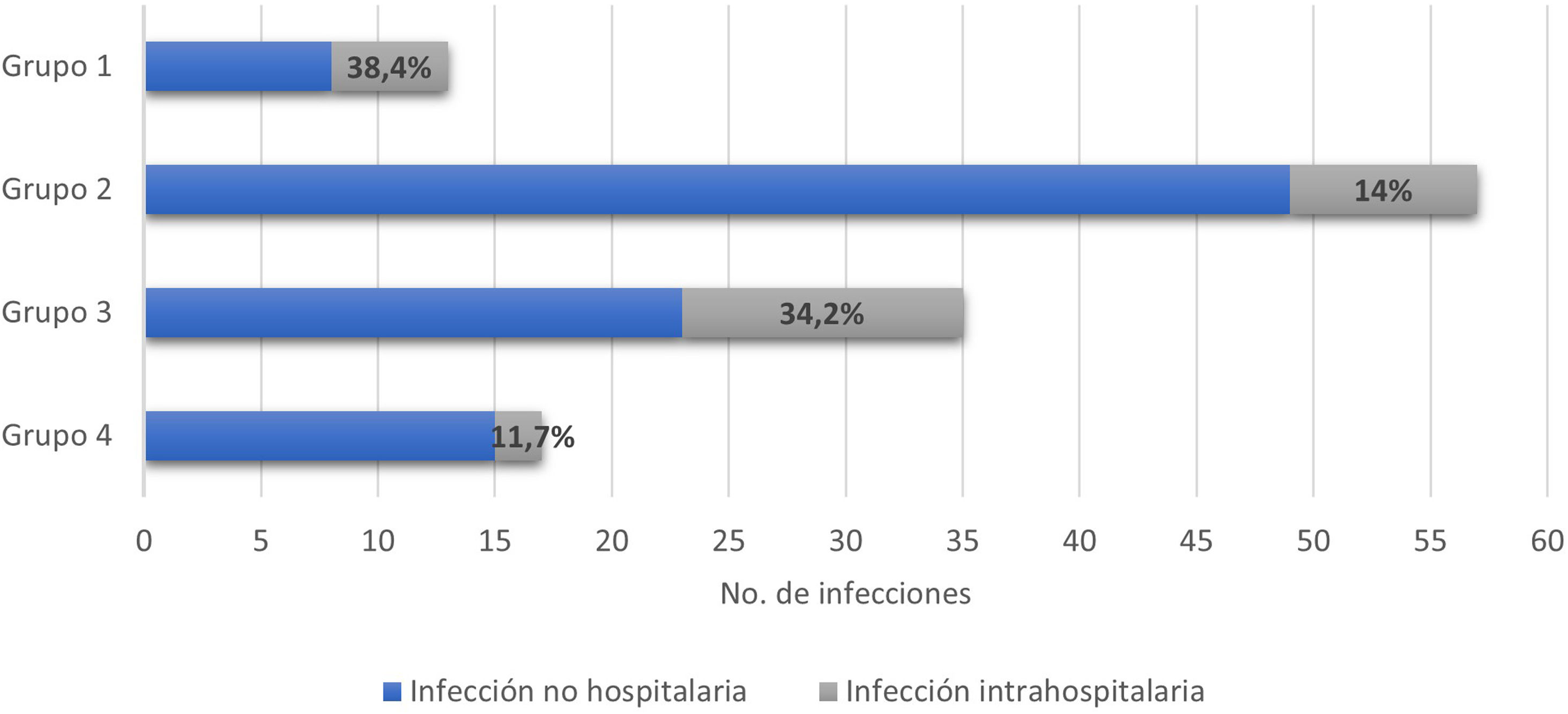
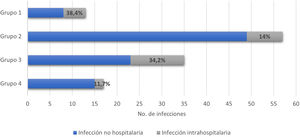
En 122 eventos (37,3%) se presentaron infecciones asociadas con la hospitalización, entre estas el 22,1% (27/122) correspondió a infecciones intrahospitalarias. La figura 3 muestra la distribución por grupos de los pacientes que presentaron infecciones. En el 41,2% de todos los eventos hospitalarios se usó tratamiento antibiótico, con distribución por grupos de la siguiente manera: grupo 1, 14/38 (36,8%); grupo 2, 60/128 (46,8%); grupo 3, 41/111 (36,9%); y grupo 4, 20/50 (40%).
Con referencia a los eventos repetidos para un mismo paciente, 18 pacientes tuvieron 2 ingresos registrados como eventos diferentes en el estudio, mientras que un paciente presentó 3 ingresos registrados como eventos independientes. Entre ellos, la mayoría (14/19 pacientes) perteneció al grupo 2 durante los 2 o 3 eventos hospitalarios. En cuanto a la mortalidad, entre los 327 registros, 17 pacientes fallecieron, distribuidos así: grupo 1, 3 (7,8%); grupo 2, 5 (3,9%), grupo 3, 6 (5,4%); y grupo 4, 3 (6%) (en la tabla S2 del material adicional se caracterizan los pacientes que fallecieron).
Entre los grupos de estudio no se identificó que alguno de ellos presentara mayor oportunidad de desarrollar el desenlace adverso compuesto. Sin embargo, los factores asociados con la presencia de los eventos adversos fueron ajustados por los cuatro grupos. Se encontró que las variables asociadas con peores resultados fueron: diagnóstico inicial cardiovascular (OR=4,63; IC: 1,60-13,43; p=0,005), estancia hospitalaria>8días (OR=1,04; IC: 1,01-1,07; p=0,005) y haber sido tratado por una especialidad diferente a medicina interna (OR=2,79; IC: 1,26-6,17; p=0,011). Mientras que el sexo masculino (OR=0,29; IC: 0,12-0,66; p=0,004), pertenecer a un régimen especial de salud (OR=0,39; IC: 0,15-0,99; p=0,047) y tener hemoglobina (Hb)>11,4g/dL (OR=0,82; IC: 0,69-0,99; p=0,039) fueron factores asociados con menor oportunidad de desarrollar el evento adverso compuesto, tal como se muestra en la tabla 3. Se excluyeron del análisis multivariado las variables que tenían una pérdida de la información mayor del 20% y en las que no existía relevancia clínica ni estadística.
Análisis multivariado de asociación con el desenlace adverso compuesto
| Variables | Presencia del desenlace adverso compuesto | OR | Valor de p | |
|---|---|---|---|---|
| Sí | No | |||
| n (%) | 136 (41,6) | 191 (58,4) | ||
| Sexo | ||||
| Masculino | 25 (18,3) | 64 (33,5) | 0,29 (0,12-0,66) | 0,004 |
| Femenino | 111(81,6) | 127 (66,4) | Ref. | |
| Edad (años)a | 46 (34-63) | 51 (34-65) | 1,02 (0,99-1,04) | 0,172 |
| Régimen de salud | ||||
| Contributivo | 30 (22) | 44 (23) | 1,23 (0,43-3,50) | 0,692 |
| Especial | 140 (102,9) | 52 (27,2) | 0,39 (0,15-0,99) | 0,047 |
| Subsidiado | 21 (15,4) | 40 (20,9) | Ref. | |
| Comorbilidades | ||||
| Hipertensión arterial | 61 (44,8) | 52 (27,2) | 1,07 (0,46-2,4) | 0,877 |
| Cardiopatía | 25 (18,3) | 16 (8,3) | 1,73 (0,56-5,32) | 0,339 |
| DMT2 | 25 (13,3) | 13 (6,8) | 0,67 (0,49-2,11) | 0,491 |
| ERC | 9 (6,6) | 10 (5,2) | 1,39 (0,39-4,95) | 0,608 |
| Seguimiento previo por reumatología | 50 (36,7) | 66 (34,5) | 0,58 (0,19-1,72) | 0,327 |
| Oportunidad de consulta (días)a,b | 4 (1-14) | 7 (3-15) | 0,98 (0,96-1,00) | 0,223 |
| Especialidad tratante | ||||
| Otra especialidad clínica | 55 (40,4) | 48 (25,1) | 2,79 (1,26-6,17) | 0,011 |
| Especialidad quirúrgica | 29 (21,3) | 30 (15,7) | 1,76 (0,71-4,40) | 0,223 |
| Medicina interna | 52 (38,2) | 113 (59,1) | Ref. | |
| Diagnóstico inicial principalc | ||||
| Cardiovascular | 38 (27,9) | 21 (10,9) | 4,63 (1,60-13,43) | 0,005 |
| Infeccioso | 23 (16,9) | 26 (13,6) | 1,39 (0,54-3,54) | 0,493 |
| Tenía tratamiento reumatológico previo | 59 (43,3) | 65 (34) | 1,22 (0,39-3,87) | 0,734 |
| Requerimiento de TRR de novo | 19 (13,9) | 2 (1) | 3,46 (0,64-18,61) | 0,148 |
| Días de estancia hospitalariaa | 18 (10-31) | 8 (5-15) | 1,04 (1,01-1,07) | 0,005 |
| Hemoglobina (g/dL)a | 9,1 (8-11) | 11,4 (9,9-12,9) | 0,82 (0,69-0,99) | 0,039 |
| Creatinina (mg/dL)a | 0,91 (0,6-1,74) | 0,78 (0,68-1,06) | 0,94 (0,74-1,19) | 0,605 |
| PCR (mg/L)a | 83,6 (40,3-156.7) | 35,1 (8,9-108,3) | 1,00 (1,00-1,01) | 0,102 |
Ref: grupo que se utilizó como comparador para establecer la OR; DMT2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; OR: odds ratio; PCR: proteína C reactiva; TRR: terapia de reemplazo renal.
En nuestra cohorte encontramos factores de riesgo y factores protectores asociados con la presentación de un desenlace adverso compuesto en los pacientes hospitalizados evaluados por reumatología. El desenlace adverso compuesto tuvo una distribución equitativa entre los 4 grupos. Sin embargo, porcentualmente, el grupo de pacientes con ERAS diagnosticadas conocidas (grupo 2) presentó más desenlaces adversos y nuevas hospitalizaciones. Lo anterior podría estar en relación con el daño acumulado en ese grupo, que no fue medido en este estudio. Para los pacientes con ERAS de novo, los hallazgos sugieren que, si su atención se hace de forma adecuada, los resultados podrían ser alentadores, a pesar de haber presentado una estancia hospitalaria más prolongada.
La mayor edad, el mayor número de días de estancia en la UCI y la afectación cardiovascular al ingreso se han identificado previamente como factores asociados con la mortalidad17,18. En nuestro análisis, la edad no resultó ser un factor asociado con los desenlaces adversos, lo que se podría relacionar con la inclusión de una población más joven que las reportadas en otras cohortes, en las cuales el promedio de edad varió entre 52 y 62años15,29, mientras que en esta investigación la mediana fue de 48 (34-63) años. Además, encontramos un predominio del sexo femenino, hallazgo que coincide con lo descrito para ERAS. El sexo masculino se asoció con menor oportunidad de desarrollar el desenlace adverso compuesto, lo cual debiera corroborarse en estudios donde se incluya una población masculina más grande y diversa en cuanto a diagnósticos principales.
En estudios de pacientes con LES se ha demostrado que la alta carga de comorbilidad, principalmente de origen cardiovascular o neoplásica, tiene un impacto negativo en el curso de la enfermedad30. A pesar de las limitaciones para la comparación con lo encontrado en nuestra cohorte, siendo esta una población de múltiples patologías y con una mayoría de los pacientes por fuera de UCI, lo encontrado se correlaciona con la evidencia disponible en pacientes con ERAS. Sin embargo, la presencia de neoplasia no se encontró como variable asociada con el desenlace adverso.
Previamente, se ha puesto en evidencia que el motivo más frecuente de consulta al servicio de urgencias en pacientes con ERAS es cardiovascular (25%), seguido de una causa infecciosa (15%)31, lo que concuerda con lo reportado en nuestro estudio, donde la patología cardiaca fue la causa más común de ingreso. En los pacientes con ERAS, la arterioesclerosis precoz y la enfermedad cardiovascular son importantes causas de morbimortalidad y dependen de la inflamación crónica, la terapia inmunosupresora, así como la duración y la actividad de la ERAS. Lo anterior es independiente de la prevalencia de factores de riesgo cardiovascular clásicos en este tipo de pacientes32,33. Sin embargo, las comorbilidades más comunes en los pacientes de todos los grupos fueron: hipertensión arterial, cardiopatía, enfermedad renal crónica, diabetes mellitus tipo 2 y dislipidemia.
En cuanto a la distribución de los pacientes vistos por reumatología, se podría decir que la mitad de la población evaluada tenía efectivamente una ERAS, mientras que la otra mitad no, o no cumplía con suficientes criterios para ser clasificada como tal. Este hallazgo fue similar al realizado en una cohorte de pacientes chilenos hospitalizados y evaluados por reumatología (57%)15, mientras que en un estudio colombiano con pacientes mayores de 13 años, hospitalarios y ambulatorios, se encontró que el 43% presentaba enfermedades sistémicas y el 57% órgano-específicas26.
En el 20,2% de los eventos, el motivo de la interconsulta a reumatología fue por actividad de ERAS conocida. En pacientes sin ERAS, los motivos de consulta más comunes fueron las alteraciones neuromusculares u oculares y el síndrome articular. Lo anterior resulta similar a lo reportado por Pacheco et al., donde el 24,3% de las interconsultas fueron de pacientes con actividad de ERAS, mientras que en aquellos sin una ERAS conocida la causa fue dolor musculoesquelético o artritis15. Esto plantea la relevancia que tendría el enfoque de los pacientes por una especialidad clínica de base como medicina interna. En esta cohorte se identificó que no tener una especialidad tratante como medicina interna se asoció con mayor oportunidad de presentar el desenlace adverso compuesto.
La mediana de hospitalización en nuestra población fue de 11 (6-22) días, menor que lo reportado en una población similar, cuyo promedio fue de 18 (2-58) días15. Entre pacientes con ERAS se ha demostrado que una estancia hospitalaria mayor de 14 días se relaciona con la gravedad de la enfermedad y complicaciones graves16. Sin embargo, cuando la atención de los pacientes con patologías reumáticas la lleva a cabo un equipo multidisciplinario, se reduce la estancia hospitalaria10.
Las infecciones y las exacerbaciones o complicaciones de las ERAS son las causas más comunes y potencialmente reversibles de ingreso a la UCI17–24. En esta investigación las infecciones intrahospitalarias se presentaron en el 8,26% de la población y fueron más comunes en los grupos 1 y 3. Dicho porcentaje fue menor que el registrado en un estudio de pacientes con LES (12,5%), en el que también se evidenció que existía una mayor probabilidad de infección intrahospitalaria cuando la estancia hospitalaria era mayor de 7 días34.
Los pacientes con ERAS a menudo tienen comorbilidades y terapias farmacológicas coexistentes que tienen un impacto en el curso de la enfermedad. Se ha informado que la mortalidad no es diferente o aumenta en comparación con los pacientes de la UCI sin ERAS35. En nuestra investigación un tercio de los pacientes ingresó a la UCI, siendo este el desenlace adverso más común. Aproximadamente la mitad de los ingresos a UCI se presentaron en pacientes de los grupos 1 y 2, y el LES fue el diagnóstico más común, lo cual es similar a lo reportado en cohortes de pacientes con ERAS en UCI. En estos pacientes, la mortalidad fue del 10,3%, un porcentaje menor comparado con lo encontrado en otras series, que osciló entre 17 y 55%22–24.
La tasa de reingresos a los 30 días para diferentes patologías varía entre 5 y 19,6%36. El reingreso, que fue el segundo desenlace adverso más frecuente en esta cohorte, se presentó en el 11,9% de los eventos hospitalarios. Lo anterior es similar a lo encontrado en un estudio en el que las enfermedades de órganos hematopoyéticos y del sistema inmunológico demostraron ser las de mayor probabilidad de reingreso a los 30 días, lo que se asoció con mayor impacto económico37. Los reingresos hospitalarios, en cualquier patología, son eventos costosos, relacionados con alta morbimortalidad y potencialmente prevenibles38.
En este estudio, la mortalidad global fue del 5,2%. Bernal-Macias et al.21 reportaron un valor de Hb<8g/dL como marcador relevante para mortalidad de los pacientes con ERAS en UCI (OR=16,1; p=0,001). En nuestra investigación, la Hb>11,4g/dL se asoció con menor oportunidad de desarrollar el desenlace adverso compuesto. El 47% de los pacientes fallecidos pertenecía a los grupos 1 y 2. Se encontró que, si bien no hubo diferencias estadísticamente significativas con relación a la presencia del desenlace compuesto entre grupos, porcentualmente el grupo 2 presentó más desenlaces adversos. Además, se asoció con mayor número de nuevas hospitalizaciones y más reingresos hospitalarios. Lo anterior se podría relacionar con la presencia de daño acumulado en ERAS, concepto que se ha aplicado principalmente en LES y vasculitis39,40.
En nuestra cohorte, los pacientes con ERAS de novo tuvieron una mediana de 17 (7-32) días de estancia, mayor que los otros grupos, lo cual pudiera estar en relación con la gravedad de la enfermedad. Sin embargo, este mismo grupo presentó menos desenlaces adversos que los pacientes del grupo 2, lo cual puede sugerir que si la atención de un paciente con ERAS de novo se hace de forma adecuada, los resultados podrían ser alentadores y que el daño acumulado genera un impacto significativo en los pacientes con ERAS conocidas.
La investigación tuvo algunas limitaciones: primero, los registros eran incompletos en algunas de las historias clínicas electrónicas, principalmente en cuanto a las características sociodemográficas, en especial la etnia, en la que se tuvo una pérdida de información mayor del 20%; segundo, lograr agrupar pacientes con sospecha no confirmada de ERAS implicó cierta complejidad en algunos casos, porque durante la hospitalización no se tuvo información suficiente para definir la existencia o no de un compromiso sistémico; tercero, algunos eventos de hospitalización no se pudieron incluir en la muestra porque el sistema no permitió exportar el 100% de las interconsultas realizadas por los reumatólogos de la clínica; cuarto, la validez externa de esta investigación deberá ser interpretada de acuerdo con cada población, considerando que se realizó en un solo centro y que las condiciones de la población podrían ser diferentes, así como los modelos de atención médica en cada hospital.
ConclusionesLas comorbilidades cardiovasculares representaron una condición clave para el curso de la hospitalización y la presencia de desenlaces adversos en los pacientes con o sin ERAS. Esta cohorte mostró la importancia que tiene la presencia de una especialidad clínica como la medicina interna en la prevención de los desenlaces adversos hospitalarios. La enseñanza en la aproximación diagnóstica y terapéutica de las ERAS debe ser parte de la formación del talento humano en salud.
La caracterización que este estudio presenta de los pacientes evaluados por reumatología hospitalariamente puede servir como base para una nueva línea de investigación que busque resolver las brechas del conocimiento en el continuo de la atención en reumatología. En nuestro conocimiento, esta cohorte colombiana es la primera que muestra la interconsulta hospitalaria en reumatología sin excluir pacientes fuera de UCI y aquellos sin ERAS. Es necesario que la validez externa de estos hallazgos se corrobore en otros estudios.
FinanciaciónLa presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial ni sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses en el presente trabajo.