Los criterios de clasificación del síndrome de Sjögren (SS) (ACR/EULAR-2016) incluyen la biopsia de glándula salival menor (BGSM), la cual utiliza el puntaje de focos (Focus Score [FS]), pero en algunos casos sigue basándose en Chisholm y Mason (CM). Nuestro objetivo fue evaluar la frecuencia de SS en pacientes con síntomas secos, mediante el uso de FS y CM y el grado de concordancia inter- e intraobservador de la lectura por ambos métodos.
Materiales y métodoEstudio transversal. Se incluyeron todos los pacientes con síntomas secos y estudios para realizar los criterios de clasificación SS (2016). Dos lectores hicieron la evaluación independiente. Se utilizó estadística descriptiva para el cálculo de la frecuencia de SS. Se analizó la concordancia interobservadores e intraobservadores (kappa de Cohen) (STATA) para cada prueba (CM y FS). Se obtuvo aprobación ética.
ResultadosSe incluyeron 92 pacientes. Se clasificó SS en el 26,1% de los pacientes en quienes se empleó FS y en el 34,8% en quienes se empleó CM. El grado de concordancia intraobservador fue perfecto y moderado-alto para los observadores. La concordancia interobservador fue sustancial, con valores de kappa de 0,77 FS y 0,75 CM.
ConclusionesEl método FS es una puntuación más detallada y específica que facilita una correcta clasificación. El uso de CM como método de clasificación histopatológica para SS incluye más pacientes en comparación con FS. Estos resultados son relevantes para unificar la lectura de la BGSM en los servicios que atienden pacientes con SS.
The criteria for Sjögren's syndrome (SS) classification (ACR/EULAR 2016), include labial salivary gland (LSG) biopsy using the focus score (FS). But, in some cases it continues to be based on Chisholm and Mason (CM). Our objective was to evaluate the frequency of SS in patients with dry symptoms using FS and CM and to evaluate the degree of inter and intra-observer concordance of the histopathological reading by both methods.
Materials and methodCross-sectional study design. All patients with dry symptoms and studies to perform the SS classification criteria (2016) were included. The samples were independently evaluated by two readers. Descriptive statistics was used for the calculation of SS frequency. Agreement (Cohen's kappa coefficient) was analysed (STATA) for each test (CM and FS). Ethics approval was obtained.
Results92 patients were included. According to the 2016 criteria, SS was reported in 26.1% patients in whom FS was used and in 34.8% patients in whom CM was used. The degree of intra-observer concordance for the diagnosis of FLS was perfect and moderate-high for observers. Inter-observer agreement was substantial, with kappa values of .77 FS and .75 CM.
ConclusionsFS method is a more detailed and specific score that facilitates correct classification. The use of CM as a histopathological classificatory method for SS includes more patients when compared with FS. These results are of relevance to standardise the reading of LSG biopsy in specialized services attending SS patients.
El síndrome de Sjögren (SS) es una enfermedad autoinmune que principalmente causa inflamación en las glándulas exocrinas, en las glándulas lacrimales y en las glándulas salivares. Su principal presentación clínica es el síndrome seco (xeroftalmia, xerostomía), pero también puede presentarse como una enfermedad autoinmune sistémica, hasta condición linfoproliferativa. Con respecto a su epidemiología, aproximadamente de 200 pacientes que consultan anualmente por síndrome seco, cerca del 54% tiene SS, y su prevalencia se encuentra entre el 0,01% y 0,72%. Afecta de manera predominante a las mujeres, en comparación con los hombres (tasa 10/1)1,2.
En la actualidad los criterios utilizados para el diagnóstico de esta enfermedad son los propuestos por el Colegio Americano de Reumatología (ACR) y la Liga Europea contra las Enfermedades Reumáticas (EULAR)3,4 del 2016 que incluyen medición objetiva del flujo salival, xeroftalmia medida por puntaje de tinción ocular (fluoresceína y lisamina) y el test de Schirmer, así como los anticuerpos contra antígeno RO (anti-RO/SSA) y la biopsia de glándula salival menor (BGSM) en búsqueda de sialoadenitis linfocítica focal (SLF) leída mediante el método del puntaje de foco (FS, por el inglés Focus Score). A cada ítem se le asigna un puntaje, la suma de los puntajes mayor o igual a 4 puntos es indicativa de SS. Cabe aclarar que los criterios de anti-RO/SSA y BGSM cuentan con un indicativo de 3 puntos cada uno, lo que hace relevante y denota la importancia del componente inmunológico de estos dos aspectos utilizados para el diagnóstico de SS.
Con respecto a la BGSM, se debe resaltar su importancia para el diagnóstico y el pronóstico en el SS. La definición de foco, de acuerdo con Greenspan y Daniels5, se refiere al acúmulo de 50 o más células mononucleares. Más recientemente se introdujo el cálculo de FS6–8, que se refiere al número de focos en un área de 4mm2 de tejido de aspecto normal. Al hallazgo ≥1 foco en 4mm2 de tejido glandular se le denomina SLF. La presencia de FS≥1 se considera la manifestación histológica característica de SS8,9. Para la lectura de las BGSM se han propuesto diferentes metodologías. A pesar de que el FS es el método sugerido, no se lleva a cabo de rutina, ya que en algunos casos se continúa tomando como base el Chisholm y Mason (CM), a pesar de que este método no distingue la SLF de la sialoadenitis crónica no específica, un trastorno inflamatorio no típicamente asociado con autoinmunidad8, lo cual genera dificultad para llegar a un diagnóstico preciso del SS, dado que los criterios clasificatorios que se utilizan en la actualidad usan como base el método de FS.
A partir de lo mencionado en los acápites precedentes, es de importancia contar con una estandarización con respecto al método de lectura de la BGSM, ya que en conjunto con el resto de síntomas y hallazgos paraclínicos típicos del SS pueden generar impacto en la prevalencia e incidencia de la enfermedad.
El objetivo de este estudio es evaluar la frecuencia del SS en pacientes con síntomas secos en un hospital de Bogotá, Colombia, mediante dos métodos histopatológicos (FS y CM), entre septiembre del 2019 y junio del 2020, y, adicionalmente, evaluar el grado de concordancia inter- e intraobservador de la lectura histopatológica de la BGSM por medio de FS y CM para el diagnóstico de SLF.
Material y métodosSe realizó un estudio de corte transversal, con muestreo no probabilístico. De manera consecutiva, se seleccionaron pacientes con síntomas secos que asistieron a realizarse la BGSM al Hospital de San José (Bogotá-Colombia) entre septiembre del 2019 y junio del 2020.
Se incluyeron todos los pacientes con al menos un síntoma de sequedad ocular u oral, definido como una respuesta positiva al menos a una de las preguntas sobre presencia de sequedad (tabla 1) definidas según los criterios clasificatorios para síndrome de Sjögren ACR/EULAR (2016)4, y que tuvieran disponibilidad de las pruebas clínicas (tinciones oculares, test de Schirmer y test de flujo salival no estimulado) y paraclínicas (anticuerpos anti-Ro) para poder aplicarlas y así determinar qué pacientes cumplirían o no dichos criterios. Se excluyeron pacientes con muestras de biopsia de glándula salival que no cumplieran los criterios de calidad para la lectura de esta (material en bloque de parafina no apto para estudio [material insuficiente o agotado, alteraciones por archivo y/o manipulación] o material histológico con glándula salival con menos de 4 lóbulos separados quirúrgicamente [o 6 lóbulos si estos eran pequeños o con área de superficie menor de 8mm])7.
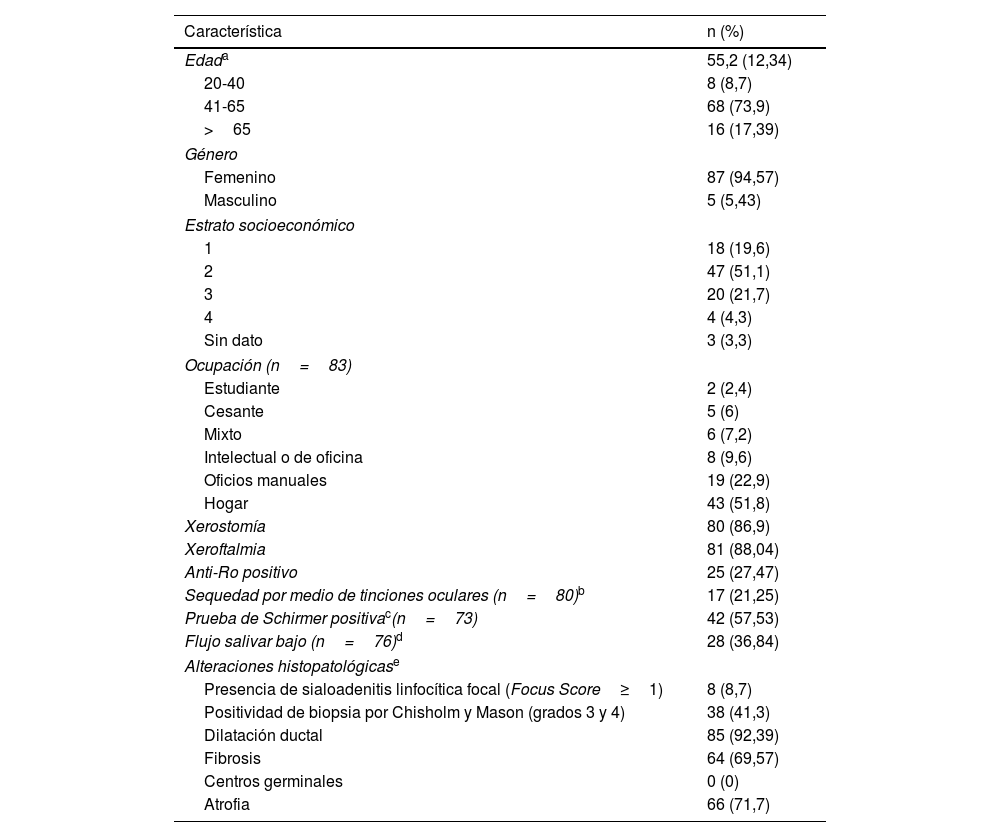
Características de los individuos incluidos y frecuencia del síndrome de Sjögren según las dos técnicas histopatológicas
| Característica | n (%) |
|---|---|
| Edada | 55,2 (12,34) |
| 20-40 | 8 (8,7) |
| 41-65 | 68 (73,9) |
| >65 | 16 (17,39) |
| Género | |
| Femenino | 87 (94,57) |
| Masculino | 5 (5,43) |
| Estrato socioeconómico | |
| 1 | 18 (19,6) |
| 2 | 47 (51,1) |
| 3 | 20 (21,7) |
| 4 | 4 (4,3) |
| Sin dato | 3 (3,3) |
| Ocupación (n=83) | |
| Estudiante | 2 (2,4) |
| Cesante | 5 (6) |
| Mixto | 6 (7,2) |
| Intelectual o de oficina | 8 (9,6) |
| Oficios manuales | 19 (22,9) |
| Hogar | 43 (51,8) |
| Xerostomía | 80 (86,9) |
| Xeroftalmia | 81 (88,04) |
| Anti-Ro positivo | 25 (27,47) |
| Sequedad por medio de tinciones oculares (n=80)b | 17 (21,25) |
| Prueba de Schirmer positivac(n=73) | 42 (57,53) |
| Flujo salivar bajo (n=76)d | 28 (36,84) |
| Alteraciones histopatológicase | |
| Presencia de sialoadenitis linfocítica focal (Focus Score≥1) | 8 (8,7) |
| Positividad de biopsia por Chisholm y Mason (grados 3 y 4) | 38 (41,3) |
| Dilatación ductal | 85 (92,39) |
| Fibrosis | 64 (69,57) |
| Centros germinales | 0 (0) |
| Atrofia | 66 (71,7) |
| Frecuencia del síndrome de Sjögren según las dos técnicas histopatológicasf | ||
|---|---|---|
| Síndrome Sjögren incluyendo criterio de BGSM con Focus Scoren=24 (26,09%) | Síndrome Sjögren incluyendo criterio de BGSM con Chisholm y Masonn=32 (34,78%) | |
| Género | ||
| Femenino | 24 (100) | 32 (100) |
| Masculino | 0 (0) | 0 (0) |
| Edad | ||
| 20-40 | 2 (8,3) | 2 (6,2) |
| 41-65 | 20 (83,3) | 25 (78,1) |
| >65 | 2 (8,3) | 5 (15,6) |
BGSM: Biopsia de glándula salivar menor.
Se aplicaron las siguientes preguntas (respuesta positiva al menos a una) para incluir a los pacientes con sequedad ocular u oral y proceder a determinar la presencia o ausencia de síndrome de Sjögren, de acuerdo con el cumplimiento de los criterios del 2016, utilizando cada una de las dos técnicas histopatológicas para establecer la positividad o la negatividad del criterio de biopsia de glándula salival menor (se presentan la mediana y el rango intercuartil [RIQ] en meses de la duración de la sintomatología en los casos en que la respuesta fue positiva): 1) ¿Ha tenido de manera diaria, persistente, molestia de ojos secos durante más de 3 meses? (12 RIQ 30). 2) ¿Ha tenido una sensación recurrente de arena o gravilla en los ojos? (12 RIQ 23). 3) ¿Usa sustitutos de lágrimas más de 3 veces al día? (3 RIQ 12). 4) ¿Ha tenido una sensación diaria de boca seca durante más de 3 meses? (12 RIQ 18). 5) ¿Con frecuencia bebe líquidos para ayudar a tragar alimentos secos? (12 RIQ 24).
Fuente: elaboración propia.
Las placas histológicas fueron evaluadas de forma independiente por dos médicos residentes de segundo año de patología, con entrenamiento previo durante sus dos años de formación, por médico patólogo experto en lectura de BGSM. Estos residentes tuvieron un entrenamiento específico en su primer y segundo año de residencia en la lectura de la BGSM y en los dos métodos histopatológicos. Durante las sesiones de formación, la lectura de las placas histopatológicas fue revisada por el docente patólogo experto para aclarar los términos, las dudas y la estandarización de la lectura. Al final de cada entrenamiento, los residentes tuvieron una prueba, la cual debía contener todas las preguntas resueltas de manera correcta, para que se considerara aprobada su formación en esta lectura. Los evaluadores permanecieron ciegos a los datos clínicos y de identificación de los pacientes durante cada lectura. Las placas se codificaron con números aleatorios, de modo que el lector no tuviera sesgo de memoria para las siguientes lecturas de la misma placa. Las lecturas se llevaron a cabo en intervalos de una semana, para un total de 4 por cada lector (dos por el método FS y dos por CM). Para el análisis de la concordancia interobservador se utilizó la primera lectura realizada por cada observador con cada uno de los métodos, en tanto que en el caso del diagnóstico definitivo de SLF y de las alteraciones histopatológicas (tabla 1) se evaluaron los desacuerdos sobre las primeras lecturas, y estos fueron resueltos por el médico patólogo experto en BGSM para diagnóstico definitivo.
Se definió SLF como la presencia de agregados focales de 50 o más linfocitos, células plasmáticas y macrófagos que reemplazan la estructura acinar, siendo presente cuando era ≥1foco/4mm2, y ausente cuando se tuvo <1foco/4mm2, siguiendo las medidas de estandarización para lectura de la BGSM propuestas por el grupo de estudio europeo del SS (EULAR Sjögren's Syndrome Study Group)7. A su vez, para la evaluación por medio del método de CM, se consideró como la presencia de agregados focales de 50 o más linfocitos, células plasmáticas y macrófagos que reemplazan la estructura acinar, siendo presente en los grados 3 y 4 y ausente en los grados 0, 1 y 2 (de acuerdo con el número de focos/mm2, donde 0=ninguno, 1=infiltrado escaso, 2=infiltrado moderado, 3=un foco (≥50 células) y 4: ≥2 focos)10. Se describieron otras características en el momento de la lectura patológica, como presencia de atrofia, fibrosis, dilatación ductal y de centros germinales.
Se obtuvieron las variables sociodemográficas (sexo, edad, ocupación, estrato) de la historia clínica, así como todas las variables concernientes a los criterios ACR/EULAR 20164.
Se hizo el cálculo de la frecuencia de SS mediante la proporción de pacientes que cumplieron criterios clasificatorios del ACR/EULAR 2016 sobre el total de la población estudiada, al involucrar los dos métodos histopatológicos, con cálculo en conjunto con las demás variables de los criterios evaluados por un médico reumatólogo epidemiólogo. Se consideró positividad para SS un puntaje ≥4, de acuerdo con los criterios ACR/EULAR 20164.
Análisis estadísticoSe realizó un análisis descriptivo de las variables de interés mediante frecuencias absolutas y relativas para las variables cualitativas y mediante medidas de tendencia central y dispersión para las variables cuantitativas. Asimismo, se utilizó media y desviación estándar, o bien mediana y rango intercuartílico (RIC, definido por el primer y tercer cuartil) en función de la normalidad de su distribución. Esta normalidad se evaluó por medio de las pruebas de Shapiro Wilks y de Kolmogorov-Smirnov.
La concordancia se evaluó mediante el coeficiente kappa de Cohen. Se analizó el acuerdo inter- e intraobservador para cada prueba (CM y FS), luego de la resolución de desacuerdos por un tercer observador. Para clasificar la fuerza de la concordancia se utilizó la escala descrita por Landis y Koch (valor de kappa 0,00-0,20, débil; 0,21-0,40, leve; 0,41-0,60, moderada; 0,61-0,80, sustancial o alta; y 0,81-1,00, casi perfecta).
El análisis de datos se llevó a cabo mediante el software STATA.
Se contó con la aprobación del comité de ética de la institución (CEISH, acta 0457-2018) y se obtuvo el consentimiento informado de los pacientes. El equipo de investigadores se acogió a la declaración de Helsinki y a la normativa nacional en ética en investigación (Resolución 8430 de 1993).
ResultadosSe incluyeron 92 pacientes con síntomas secos que cumplieron los criterios de selección, con una edad promedio de 55,2 (desviación estándar, DE=12,34) años, la mayoría de sexo femenino (n=87; 94,57%).
Se observó presencia de xerostomía en 80 (86,96%) pacientes y xeroftalmia en 81 (88,04%) de estos. La mediana de la duración de la sintomatología seca en la mayoría de las 5 preguntas relacionadas con sequedad fue de 12 meses; el detalle de su duración se encuentra en el pie de la tabla 1. Cerca de una cuarta parte de los pacientes tenía anti-RO positivo (27,4%) y el 36% presentó flujo salival no estimulado menor de 1ml/min. Adicionalmente, el 21% y el 57% de los pacientes presentaban positividad para las pruebas de tinción ocular y de Schirmer, definidas según los criterios del ACR/EULAR 2016, respectivamente. Las características sociodemográficas, clínicas e histopatológicas generales se presentan en la tabla 1.
Del total de los pacientes con síntomas secos se encontró SLF en 8 (8,7%) de ellos (véanse figs. 1 y 2), según FS (el puntaje por focos se encontró entre 1 y 2 en 7 de los pacientes y en uno solo fue mayor de 2), mientras que 38 (41,30%) tuvieron biopsia positiva por CM (grados 3 y 4). Todos los pacientes que tuvieron positividad por medio del método de CM, pero que fueron negativos para SS cuando se utilizó la clasificación de FS, tuvieron sialoadenitis crónica no específica por medio de dicho método, excepto uno que presentó sialoadenitis crónica esclerosante. De acuerdo con los puntajes de los criterios ACR/EULAR (2016), se determinó la frecuencia de SS en 24 (26,09%) pacientes cuando se utilizó el método FS para BGSM (esta frecuencia incluyó a los 8 con positividad para SLF según FS) y en 32 (34,78%) pacientes cuando se utilizó el método CM; todos los casos se registraron en mujeres. Los 6 pacientes restantes con positividad para CM fueron clasificados como pacientes con síndrome seco, que si bien tenían positividad por medio de esta lectura en la BGSM, no tuvieron positividad en los demás criterios para SS. Con respecto a la edad, la mayor frecuencia de SS fue entre los 41 y los 65 años para los dos métodos histopatológicos (FS: 83,3%; CM: 78,3%).
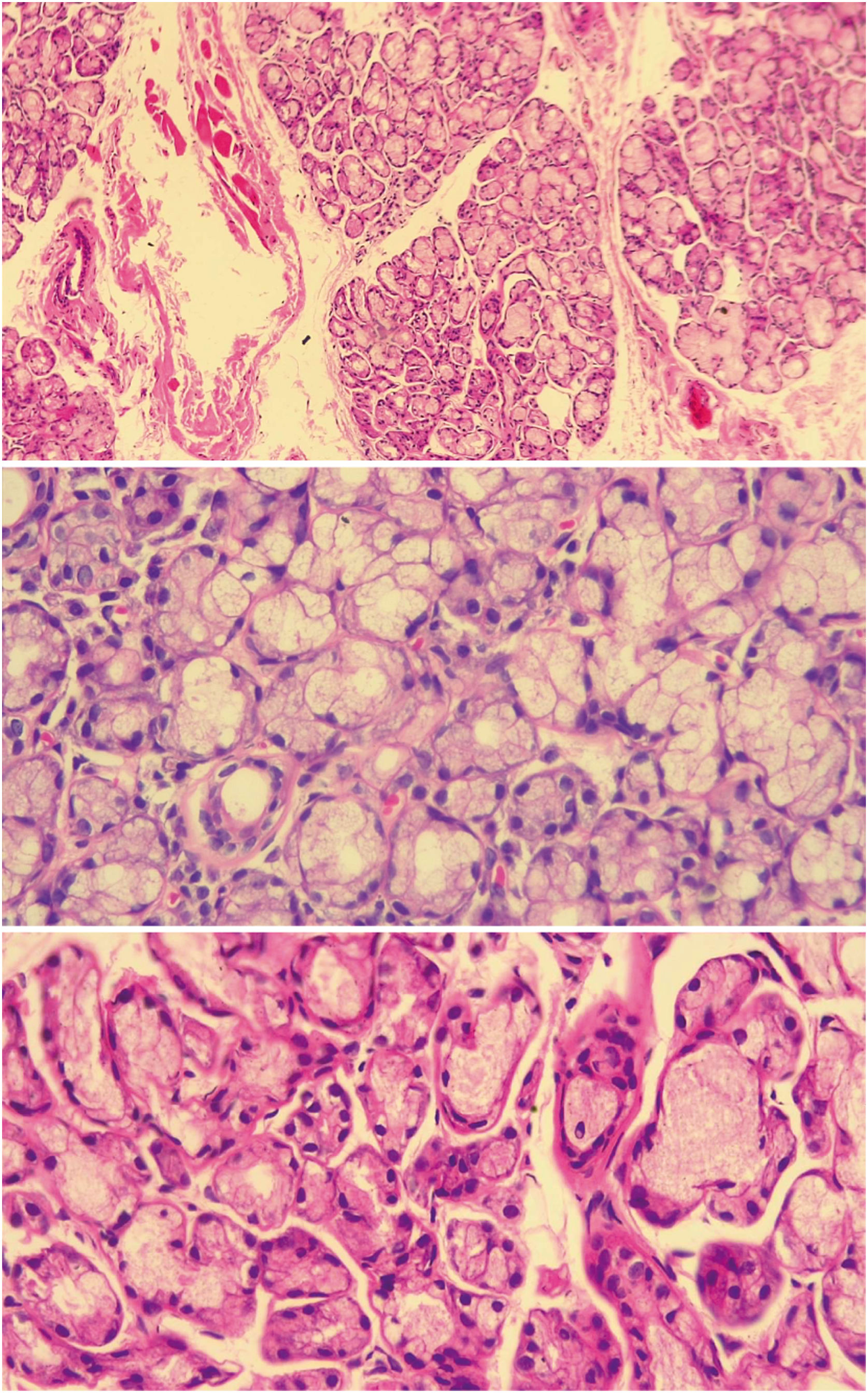
Histología de glándula salival menor normal. En los tres cortes se observa glándula salival de histología normal de un paciente incluido en el estudio, en los que se ven acinos mucinosos con células mioepiteliales y ductos. La imagen superior en aumento de 10× y las imágenes inferiores en aumento de 40×. Fuente: elaboración propia.
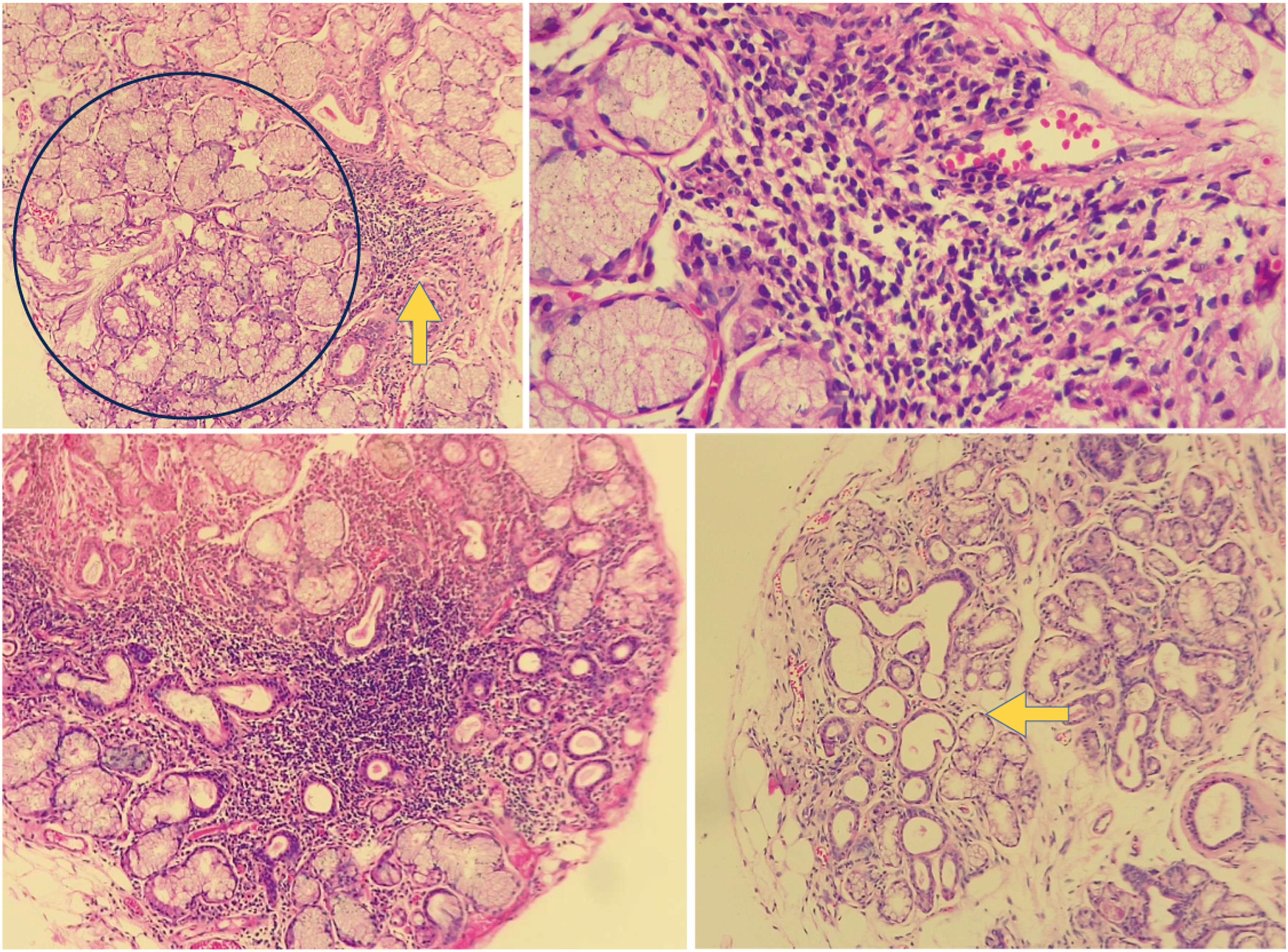
Histología de Glándula Salival menor alterada. En la imagen superior izquierda se observa una biopsia de glándula salival de un paciente incluido en el estudio, en un corte de 10× con un agregado de células linfoides (flecha amarilla) adyacente a glándula salival de apariencia normal (circulo azul). En la imagen superior derecha se observa el mismo agregado en un aumento de 40×. Este agregado se puede contar como un foco. En la imagen inferior izquierda se observa un agregado denso de linfocitos en un fondo de glándula salival de uno de los pacientes analizados en el estudio, con atrofia y dilatación ductal. En la imagen inferior de la derecha podemos ver una biopsia de glándula salival con ectasia ductal (flecha) y atrofia. Fuente: elaboración propia.
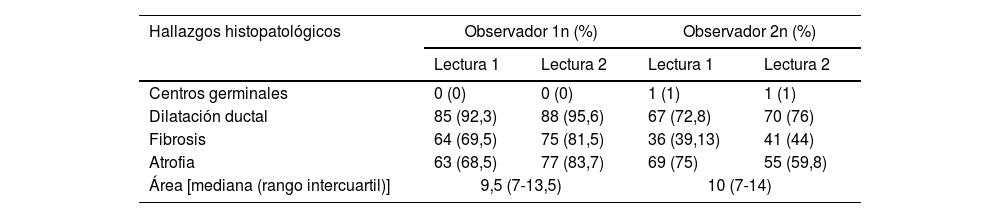
Al evaluar el grado de concordancia intraobservador para la lectura histopatológica de la biopsia de glándula salival menor mediante los métodos FS y CM para el diagnóstico de SLF, se observó una concordancia perfecta con los 2 métodos para el observador 1 y concordancia sustancial o alta para el observador 2, con valores de kappa de 0,76 y 0,80 para la lectura cuando se utilizó FS y CM, respectivamente.
Con respecto al grado de concordancia interobservador, se encontraron porcentajes de acuerdo simple del 95,65% para la lectura con FS y 88,04% para la lectura con CM, con una concordancia sustancial, con valores de kappa de 0,77 y 0,75, respectivamente (tabla 2).
Frecuencia de hallazgos histopatológicos entre observadores y acuerdo intra- e interobservador
| Hallazgos histopatológicos | Observador 1n (%) | Observador 2n (%) | ||
|---|---|---|---|---|
| Lectura 1 | Lectura 2 | Lectura 1 | Lectura 2 | |
| Centros germinales | 0 (0) | 0 (0) | 1 (1) | 1 (1) |
| Dilatación ductal | 85 (92,3) | 88 (95,6) | 67 (72,8) | 70 (76) |
| Fibrosis | 64 (69,5) | 75 (81,5) | 36 (39,13) | 41 (44) |
| Atrofia | 63 (68,5) | 77 (83,7) | 69 (75) | 55 (59,8) |
| Área [mediana (rango intercuartil)] | 9,5 (7-13,5) | 10 (7-14) | ||
| Acuerdo intraobservador | ||
| Acuerdo intraobservador y kappa para Focus Score | 100% k=1 (p<0,001) | 94,57% k=0,76 (p<0,001) |
| Acuerdo intraobservador y kappa para Chisholm y Mason | 100% k=1 (p<0,001) | 90,22% k=0,80 (p<0,001) |
| Acuerdo interobservador | |
| Acuerdo interobservador para Focus Score | 95,65% k=0,77 (p<0,001) |
| Acuerdo interobservador para Chisholm y Mason | 88,04% k 0,75 (p<0,001) |
Fuente: elaboración propia.
El diagnóstico de SS es complejo, debido a la variedad de alteraciones clínicas y paraclínicas. La BGSM es un criterio importante para la clasificación precisa de la enfermedad, pero esta puede verse influida por el método de interpretación histológica y la experiencia del patólogo, pudiendo generar una sub- o sobreestimación de pacientes con SS6,11.
En estudios previos, que utilizaban diferentes criterios clasificatorios (2002 o 2012)3,12 para evaluar la prevalencia de SS, se han demostrado prevalencias13–15 de aproximadamente el 20 al 30%. En el presente estudio se analizó la frecuencia de SS (26,09% mediante FS y 34,78% CM), y se encontró una tendencia a concluir una mayor frecuencia de SS con el método de CM. En la actualidad no existen estudios que evalúen la frecuencia de SS, comparando los dos métodos histopatológicos mencionados.
Para la interpretación de la BGSM existen diferentes métodos (tabla 3)6: el CM (1968) incluye 5 grados, según la presencia de infiltración linfocítica leve o moderada y/o foco de linfocitos10; Greenspan y Daniels (1974)5, que agregaron el concepto de Focus Score (FS) utilizado actualmente en los criterios para SS4; y Tarpley (1974)16, que introdujo los conceptos de destrucción acinar y fibrosis. Hasta el momento no hay estudios que comparen de manera directa la sensibilidad y la especificidad de estos métodos. A pesar de que el FS es el método estandarizado dentro de los criterios clasificatorios actuales para SS, el método CM todavía se utiliza en algunos centros17,18, si bien el número de estudios que utilizaban este sistema de puntuación era mayor antes de los criterios clasificatorios ACR/EULAR 201619,20.
Criterios morfológicos de dos métodos histopatológicos de diagnóstico de síndrome de Sjögren en biopsia de glándula salival menor
| Chisholm y Mason | |
|---|---|
| Grado | Linfocitos en 4mm2 |
| 0 | Ausentes |
| 1 | Infiltrado escaso |
| 2 | Infiltrado moderado |
| 3 | Formación de un foco |
| 4 | Formación de 2 o más focos |
| Foco: 50 o más células mononucleares en área periductal o perivascular | |
| Focus Score | |
| Atrofia | Pérdida del parénquima glandular |
| Adiposis | Reemplazo del parénquima por adipocitos |
| Ectasia ductal | Dilatación de la luz del ducto y aplanamiento del epitelio de recubrimiento |
| Fibrosis | Fibras de colágeno alrededor de los conductos o acinos |
| Centros germinales | Infiltrado bien circunscrito de linfocitos B, linfocitos T en menor cantidad, macrófagos con cuerpos tingibles y células dendríticas foliculares |
| Sialoadenitis linfocítica focal | Presencia de uno o más focos que contienen agregados densos de 50 o más linfocitos (la mayoría tiene varios cientos o más) que normalmente se encuentran en lugares perivasculares o periductales. Estos focos deben ser adyacentes a acinos mucosos de apariencia normal. Los lóbulos o lobulillos deben carecer de dilatación ductal del conducto y contener escasas células plasmáticas. Este diagnóstico se asigna cuando estos focos son la única inflamación presente en una muestra, o la característica más prominente. Cuando la sialoadenitis linfocítica focal está presente se puede calcular el Focus Score |
| Puntaje de focos (Focus Score) | Número total de focos en la muestra por el área total de la glándula en mm2, multiplicando el resultado por 4. Se considera puntaje de focos positivo para síndrome de Sjögren cuando es ≥1 foco/4mm2 |
Fuente: modificado y adaptado de Parra-Medina et al.6.
Algunos estudios han evaluado la concordancia entre FS y CM. Peña Carvajalino et al.8, la evaluaron, y encontraron que el acuerdo entre las 2 pruebas para SLF era débil (kappa 0,13), acuerdo que no fue calculado en el presente estudio. Adicionalmente, en el estudio en mención los autores encontraron acuerdos interobservadores para FS moderado (k=0,47) y para CM alto (k=0,65), datos que concuerdan con los encontrados en nuestro estudio. Asimismo, Costa et al.19 evaluaron la confiabilidad intraobservador e interobservador de la BGSM en SS en 14 hospitales universitarios en Francia; el acuerdo interobservador entre los patólogos locales y los patólogos capacitados fue moderado para FS (k=0,71) y CM (k=0,64). Es de notar que, en el presente estudio, el acuerdo fue ligeramente mayor para FS que para CM (0,77 vs. 0,75), lo cual contrasta con los resultados del estudio de Costa et al.19. Sin embargo, los autores resaltan que la mayoría de los patólogos locales basaron sus diagnósticos en la lectura de CM, si bien en las lecturas cotidianas aportaban datos con los cuales se podría calcular el FS a posteriori. Por último, el grado de concordancia intraobservador fue casi perfecto (k=1) para FS y sustancial para CM (k=0,8), con resultados similares a los del presente estudio.
En algunos estudios8 se han evaluado las discrepancias entre los hallazgos de SLF cuando se realiza mediante FS, en comparación con CM, donde se resalta que esta última no distingue entre los patrones de inflamación de la SLF frente al hallazgo de sialoadenitis crónica no específica. En nuestro estudio solo el 8,7% de los casos evaluados tuvo SLF evaluados por medio de FS, en contraste con el 41,3% de los casos diagnosticados como SLF con CM. Estas diferencias pueden sobreestimar la frecuencia de SS, como lo observado en nuestro estudio. Para la realización correcta del cálculo del FS, se deben considerar agregados linfoides que no estén adyacentes a tejido con cambios crónicos, con alteraciones como atrofia, fibrosis o dilatación ductal, ya que estos hallazgos no favorecen un cálculo adecuado. Es de resaltar que esto ha sido controversial, dado que dichos hallazgos pueden ser frecuentes en la población general y también se pueden presentar en el síndrome de SS6. En la estandarización para la interpretación histopatológica de la BGSM en ensayos clínicos, propuesta por Fisher et al.7, se concluye que no se puede considerar el hallazgo de SLF cuando la apariencia histológica de las glándulas es predominantemente atribuible a sialoadenitis crónica no específica (fibrosis, dilatación ductal y atrofia) y sin evidencia de focos adyacentes a parénquima normal. En tal caso no se podrá calcular el FS. Es posible que estas precisiones para el cálculo del FS, las cuales no contempla el sistema de puntuación CM, influyan en una menor proporción de individuos clasificados como SS en comparación con la clasificación CM, cuando se tienen en cuenta dentro de los criterios clasificatorios para SS, como en nuestro estudio.
En un estudio reciente18 con población similar a la nuestra, en el que se evaluaron retrospectivamente los reportes de patología de cerca de mil pacientes con síntomas secos que fueron llevados a BGSM, se encontró que la escala de CM fue las más utilizada por los patólogos (55,1%), seguida por la escala de Greenspan (46,5%), y en la cuarta parte de los pacientes se informaron las dos escalas. Cuando se comparó la concordancia interobservador entre reumatólogos y patólogos, al interpretar los hallazgos descritos en el reporte de patología con respecto a puntaje de CM 3 o 4, se encontró que esta fue moderada (k=0,57); los patólogos asignaron más frecuentemente un puntaje de 3, mientras que los reumatólogos asignaron un puntaje de 4. Es de resaltar que en dicho estudio el hallazgo de fibrosis se reportó en un 25,4%, así como atrofia en un 19% y los dos hallazgos en un 7,7%, lo cual contrasta con nuestro estudio, en el cual encontramos fibrosis en el 69,5% y atrofia en el 71%. Esto es de importancia ya que en el momento de evaluar el puntaje de FS, como se mencionó, cuando la apariencia de la glándula es predominantemente atribuible a sialoadenitis crónica no específica (fibrosis, atrofia, etc.) no se podrá calcular de manera adecuada el FS. Esto, por ende, podría reflejar la baja frecuencia de SLF evaluada mediante FS en el presente estudio.
Es llamativo que en el presente estudio no se encontraron centros germinales, lo cual ha sido descrito como presente en cerca de un 30 a 40% de los pacientes con SS en un metaanálisis previo11. Sin embargo, en ese estudio no encontraron asociación de dicho hallazgo con manifestaciones clínicas específicas, mas sí encontraron asociación con un subfenotipo serológico característico (positividad para anti-Ro, anti-La y factor reumatoide). Nuestro hallazgo de ausencia de centros germinales es similar al estudio de Vivas et al.18, realizado en población similar a la nuestra. Algunos autores21 han considerado que la presencia de los centros germinales se asocia con un estadio tardío de la enfermedad y a su vez con puntajes por foco elevados. En el presente estudio la mediana de síntomas secos no fue mayor de un año (tabla 1) y el puntaje por focos fue bajo, lo que en parte podría explicar la ausencia de centros germinales en los pacientes analizados.
Por otra parte, Tavoni et al.17, en un estudio realizado en diferentes centros italianos y que involucró 50 BGSM evaluadas en la práctica rutinaria diaria, encontraron una concordancia interobservador moderada (k=0,75) cuando se evaluó el hallazgo histopatológico final como consistente o no consistente con SS mediante CM, pero cuando se evaluaron los puntajes independientes las discrepancias fueron mayores, lo cual impactó en el diagnóstico final del SS. En nuestro estudio se encontró algo similar, dado que la proporción de pacientes clasificados como SS fue mucho mayor cuando se utilizó el sistema de CM. Es de destacar que los autores de dicho estudio17 resaltan su debilidad al utilizar el puntaje de CM, siendo este antiguo y menos específico y reproducible que el sistema de puntuación de FS; sin embargo, para la fecha diversos centros italianos continuaban utilizándolo.
Por otro lado, Carubbi et al.22, un año antes de la publicación de los nuevos criterios clasificatorios para SS ACR/EULAR 20164, evaluaron de manera retrospectiva el valor pronóstico de la BGSM en 794 pacientes con SS, cuando esta fue analizada tanto por CM y por FS, y encontraron que el FS permitió la identificación de una serie de diferencias en el espectro de la enfermedad, así como el valor pronóstico, ya que observaron asociación entre el valor de FS y las variables clínico-serológicas. Por el contrario, cuando los pacientes se dividieron de acuerdo con el sistema de calificación de CM no observaron ninguna diferencia significativa entre los subgrupos.
El presente estudio tiene varias debilidades. Entre ellas se encuentra la evaluación de los sistemas de puntuación por parte de residentes de patología, si bien se aclara que tuvieron un entrenamiento específico y los desacuerdos se resolvieron con el patólogo experto. Sin embargo, no se realizó una concordancia interobservador entre los residentes y el experto antes de iniciar el estudio. Además, no se analizó la concordancia entre los dos métodos de lectura, como sí lo han hecho otros estudios disponibles en población similar a la analizada aquí8; sin embargo, no lo consideramos dado que a priori se podría esperar que fuera buena, ya que el método de FS se deriva del método de CM23. Es de aclarar que el diseño de nuestro estudio impide establecer una conclusión con respecto al rendimiento diagnóstico, puesto que no fue un estudio de pruebas diagnósticas y debe ser analizado a la luz de su diseño y el objetivo de establecer la frecuencia del SS.
ConclusiónEl método FS es una puntuación más detallada y específica que facilita una correcta clasificación. De otro lado, el uso de CM como método histopatológico cuando se compara con el FS para criterio clasificatorio incluye más pacientes como SS; sin embargo, este sistema de puntuación tiene varias debilidades, entre ellas el no contemplar las alteraciones propias de la sialoadenitis crónica no específica, el sobreestimar en algunos casos el hallazgo positivo para SS cuando se compara con el método de FS, y, por otro lado, la ausencia de asociación como determinante de factor pronóstico. Por tanto, consideramos que estos resultados son relevantes para unificar la lectura de la BGSM en los servicios que atienden pacientes con SS, utilizando el FS, el cual es la calificación recomendada por los actuales criterios clasificatorios para el SS.
FinanciaciónEste trabajo fue financiado por la convocatoria Fomento a la Investigación de la Fundación Universitaria de Ciencias de la Salud (FUCS) (acta n.° 13 del 6 de diciembre del 2019 DI-I-1387-19).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado con la elaboración de este artículo.
Agradecemos a todo el personal de apoyo y a los técnicos en histología del Hospital de San José, quienes ayudaron a la recolección de los materiales histológicos de biopsia de glándula salivar menor, necesarios para los procesos de realizados en este estudio.