La psoriasis es una enfermedad que va más allá de la afectación exclusivamente cutánea, cada día se reconoce más la importancia del compromiso sistémico, en especial por las comorbilidades asociadas. Dichas comorbilidades se explican por la marcada respuesta inflamatoria sistémica crónica mediada por citoquinas proinflamatorias (principalmente TNF-α, IL-23 e IL-17), las cuales desempeñan un papel importante en la inducción de la resistencia a la insulina, la disfunción endotelial, la aterosclerosis acelerada y el aumento del riesgo de eventos cardio-cerebrovasculares. La relación con estos desenlaces ha sido demostrada, y es allí donde surge el concepto de marcha psoriásica, un término que cobra cada día más importancia, cuyo objetivo es mantener y reforzar el enfoque de una enfermedad cutánea con compromiso sistémico, morbimortalidad asociada que puede ser prevenible y manejable. Los mecanismos fisiopatológicos que explican estos fenómenos son variables, sin embargo, se han dilucidado nuevos conceptos que han permitido mejorar el enfoque actual de la enfermedad, y así establecer mecanismos para disminuir el riesgo cardiovascular en pacientes con psoriasis.
Psoriasis is a disease that is not limited to skin involvement, the importance of systemic compromise is recognized more than ever, especially because of the associated comorbidities, which are explained by the marked chronic systemic inflammatory response mediated by pro-inflammatory cytokines (mainly TNF-α, IL23, IL 17), which play an important role in the induction of insulin resistance, endothelial dysfunction, accelerated atherosclerosis and the increased risk of cardio-cerebrovascular events. The relationship with these outcomes has been demonstrated and hence the concept of psoriatic march, a term that is gaining increasing importance aimed at maintaining and reinforcing the approach to a skin disease with systemic compromise, associated morbidity and mortality that can be preventable and manageable. The pathophysiological mechanisms that explain these phenomena are variable, however, new concepts have been identified, which have made it possible to improve the current approach to the disease and thus establish mechanisms to reduce cardiovascular risk in patients with psoriasis.
La psoriasis (Pso) es una enfermedad sistémica crónica, mediada por mecanismos inmunes, factores ambientales1 y susceptibilidad genética, dentro de la que se destaca el gen PSORS1 como principal determinante genético y HLA Cw6 como factor de susceptibilidad para el inicio temprano de la enfermedad2,3 (tabla 1). Su prevalencia global oscila en torno al 2-3%, sin diferencias en distribución por género, en tanto que su incidencia tiene un pico bimodal, el primero entre los 18 y los 39 años y el segundo entre los 50 y los 69 años2. Se caracteriza por la afectación cutánea heterogénea y las lesiones más frecuentes son de tipo placa eritematosa, bien definidas, con escama gris plateada, mientras que otras formas incluyen pápulas y placas en forma de gotas, pústulas, entre otras, con un grado de extensión variable que se puede localizar en cualquier parte del cuerpo1. Técnicas de imagen como la resonancia magnética y la ecografía musculoesquelética con Doppler pulsado han permitido documentar sitios de inflamación más allá de la piel4, entre ellos el órgano de la entesis (el lugar de inserción al hueso de tendones, ligamentos, cápsula articular, fascia, anillo fibroso de disco intervertebral), que es el sitio inicial de inflamación en la artritis psoriásica (Psa)5, la cual puede presentarse hasta en un 30% de los pacientes con Pso3. En la actualidad, la Organización Mundial de la Salud (OMS) considera que se trata de un problema de salud global, por lo cual forma parte del plan de acción para la prevención y el control de enfermedades no transmisibles6.
Factores involucrados en la psoriasis
| Factor asociado | Rol fisiopatológico |
|---|---|
| Medicamentos (betabloqueadores, litio, antimaláricos, antiinflamatorios no esteroideos, IECA, interferones, terbinafina) | Interfiere en sistema inmune, vías de señalización y secreción de citoquinas |
| Radiación ultravioleta (p. ej., fototerapia) | Efecto inmunorregulador y proapoptóticoRegulación a la baja de IL-23/Th17 |
| Tabaquismo | Estrés oxidativo |
| Dieta, obesidad | Sobrexpresión de citoquinas |
| Infecciones (estreptococo beta hemolítico, Staphylococcus aureus, Porphyromonas gingivalis, Candida albicans, Chlamydia psittaci, virus de hepatitis C y VIH | Inducción de autoinmunidad, rotura de tolerancia inmunológica |
| Genética | Predisposición a psoriasisPSORS y HLACw6, entre otros |
| Estrés | Alteración en la regulación del sistema inmune y activación anormal de células T |
Más allá de las manifestaciones en piel y uñas, es una enfermedad sistémica que se asocia con múltiples comorbilidades7. Los pacientes con Pso tienen cerca de 2 veces mayor riesgo de diabetes mellitus tipo 28 y otros desórdenes metabólicos relacionados con resistencia a la insulina (obesidad, dislipidemia, síndrome metabólico), y se ha encontrado mayor riesgo en aquellos pacientes con mayor extensión y gravedad del compromiso cutáneo9. Asimismo, se observa incremento en el riesgo de hipertensión arterial y enfermedad cardiovascular, enfermedad inflamatoria intestinal, depresión y cáncer (principalmente tumores de piel, linfoma) entre otros10–12.
Entre los mecanismos etiopatogénicos se han propuesto la predisposición genética y la interacción con el medio como eventos iniciadores de la enfermedad. Existen interacciones genéticamente programadas, principalmente aquellos genes involucrados en la función de la barrera cutánea (LCE3, DEFB4, GJB2), además de genes que participan en la respuesta inmune innata como la cascada de señalización del factor nuclear-κB (TNFAIP3, TNIP1, NFKBIA, REL, FBXL19, TYK2, NOS2, CARD14) y la señalización de la vía de interleucina 23 (IL-23)/IL-17 (HLA-C, IL12B, IL23R, IL23A, TRAF3IP2, ERAP1), como también otras moléculas de señalización biológica desencadenadas por factores ambientales (IFN-α, TNF-α, IL-36, NF)13–15.
Se ha establecido que en Pso la respuesta inflamatoria sistémica crónica establecida es similar a aquella que se observa en los pacientes con artritis reumatoide o enfermedad de Crohn16, debido a la elevación persistente de biomarcadores inflamatorios séricos inespecíficos como la proteína C reactiva y la haptoglobina17–18. Adicionalmente, se evidencia un aumento de los niveles séricos de TNF-α, IFN-γ, IL-6, IL-8, IL-12, IL-1819 e IL-2620. Esta inflamación sistémica lleva al proceso de disfunción endotelial y ateroesclerosis acelerada, mediante el desarrollo de placas de ateroma en la capa íntima de las arterias, proceso subyacente que tiene como desencadenante final el desarrollo de eventos cardiovasculares. Esta aterogénesis es causada por la inflamación crónica de bajo grado como resultado de una interacción entre los mecanismos inmunitarios y las anomalías metabólicas dentro de la pared del vaso21.
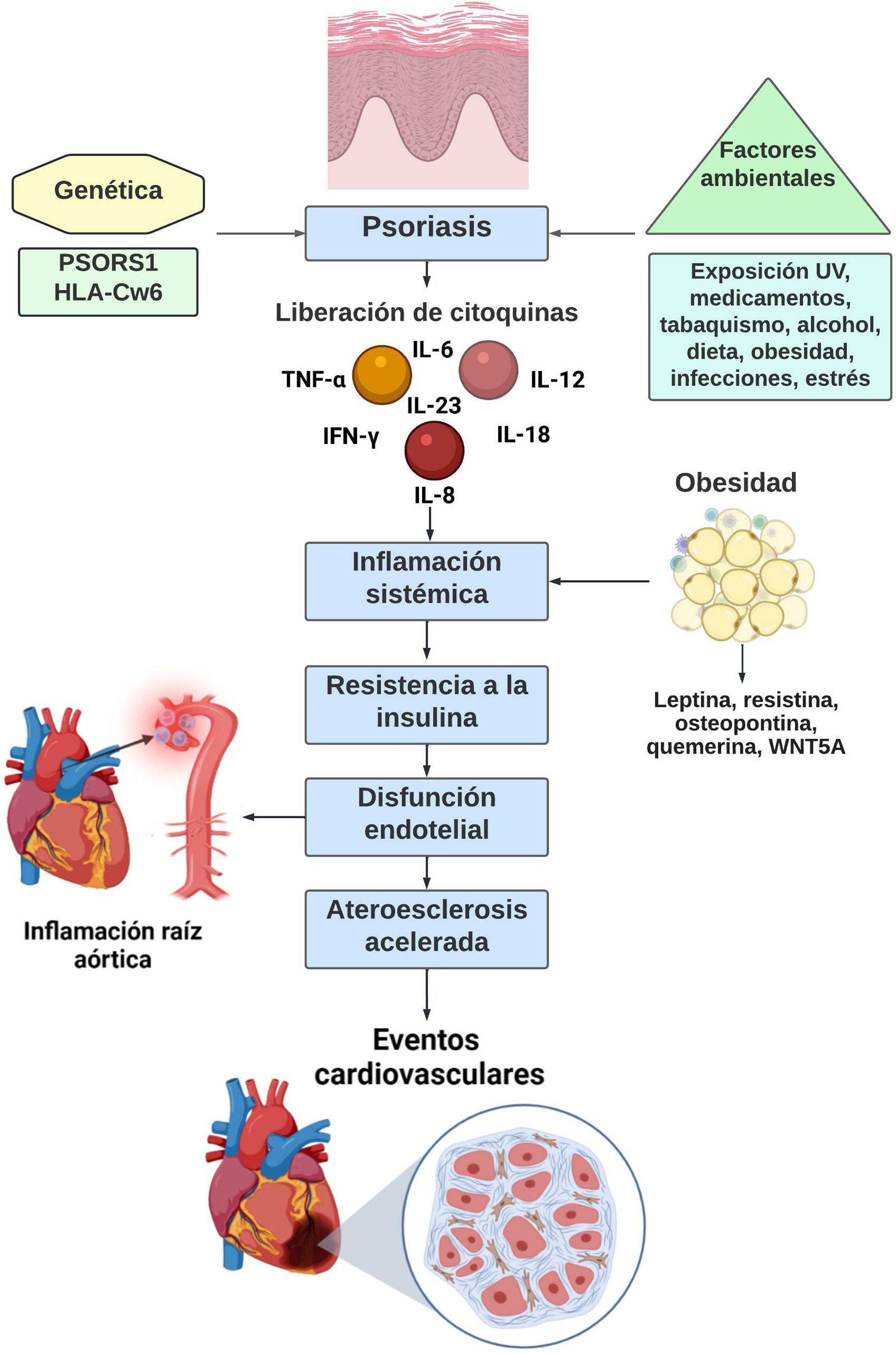
Por medio de este concepto de inflamación sistémica-ateroesclerosis acelerada, se ha llegado a la hipótesis de marcha psoriásica, un término acuñado por Wolf-Henning Boehncke en el 201022, que resume la intrincada relación entre Pso, inflamación crónica y riesgo cardiovascular, así como la vía bidireccional entre Pso e inflamación sistémica, con la posterior inducción de resistencia a la insulina, disfunción endotelial, ateroesclerosis y evento cardiovascular (ataque cerebrovascular e infarto de miocardio14,13,22,23 (fig. 1).
Marcha psoriásica, secuencia de eventos fisiopatológicos: 1er paso: predisposición genética; 2° paso: interacción con el medio ambiente e inducción de respuesta inmune innata y adaptativa; 3er paso: expresión de la enfermedad; 4° paso: inflamación sistémica crónica que conlleva a resistencia a la insulina, disfunción endotelial, ateroesclerosis acelerada y aumento del riesgo cardiovascular.
Desde el inicio, la Pso se entendió como una enfermedad cutánea hiperqueratósica, no obstante, a lo largo del tiempo este concepto ha cambiado, y hoy se considera una enfermedad sistémica mediada por células T23. Se ha encontrado que existe una alteración en la proporción Th1/Th2, con predominio de la respuesta inmune celular Th1, Th17 y Th22, favorecido por un aumento marcado en la producción de IL-23 generada por queratinocitos, células presentadoras de antígeno, células de Langerhans e intestino que polariza la respuesta hacia Th17 (encargadas de la producción de IL-17 A, principalmente)11,24, lo cual estimula la secreción de IL-1, IL-6, TNF-α, y da lugar a la cascada inflamatoria que va a producir activación y proliferación de queratinocitos, liberación de quimioquinas que promueve reclutamiento de células inflamatorias en la lesión, y que favorecen la angiogénesis y la hipervascularización en la dermis papilar25.
Al igual que en pacientes con obesidad y enfermedad coronaria, en Pso se han encontrado niveles séricos elevados de TNF-α, IL-6, moléculas de adhesión como la molécula de adhesión celular 1 (ICAM-1) y la E-selectina, factores angiogénicos como el factor de crecimiento endotelial (VEG-F), y durante los periodos de actividad de la enfermedad se ha demostrado su producción local en piel, tejido adiposo y tejido cardiovascular26. Estas moléculas favorecen la amplificación de la respuesta inflamatoria, de manera que se facilita la activación de células inflamatorias (neutrófilos, macrófagos), como también la diferenciación y la supervivencia de los linfocitos T citotóxicos y de las células asesinas naturales. Además, favorecen la angiogénesis y la quimiotaxis de otras células inflamatorias. Por otra parte, se presenta una alteración de la vía de señalización de la insulina (inhibición de la tirosina-cinasa del receptor de insulina, activación del receptor activado de la proliferación de peroxisomas delta, activación de la fosfatasa de tirosina, activación de la cinasa de proteína de monofosfato de adenosina) y del metabolismo de lípidos-adipogénesis que lleva a incremento del tejido adiposo, dislipidemia y proliferación epidérmica. Con respecto al VEG-F, se ha demostrado que su elevación es persistente en el tiempo incluso en pacientes sin datos de actividad clínica, y se ha llegado a la conclusión de que en Pso existe inflamación crónica de bajo grado más que una inflamación recurrente27.
Otro papel importante en la patogenia de la enfermedad está mediado por los linfocitos T citotóxicos CD8+ de memoria en la unión epidérmica que expresan el antígeno 1 muy tardío (VLA-1), uniéndose así al colágeno tipo IV, lo cual permite la entrada en la epidermis, y contribuye a la inflamación mediante la liberación local de citocinas proinflamatorias del fenotipo Th1 y Th1724.
Igualmente, se ha destacado el papel proinflamatorio de la activación del inflamasoma NLRP3, complejo molecular activador de caspasa 1 y promotor de inflamación mediante la liberación de múltiples citoquinas. En Pso se ha encontrado una regulación al alta de este, de manera que se activa la caspasa-1 y con ello aumentan los niveles de IL-1β, lo que desencadena respuestas inflamatorias de la pared vascular que conducen a la progresión de la aterosclerosis. Este complejo es activado por diversas señales de peligro, como cristales de colesterol, cristales de fosfato cálcico y lipoproteínas de baja densidad oxidadas en macrófagos, para iniciar respuestas inflamatorias en la lesión aterosclerótica28,29.
Rol de la célula dendríticaComo es bien conocido, diferentes poblaciones de células dendríticas (CD) se encuentran en la piel humana inactiva y se han dividido en 3 subconjuntos: las células epidérmicas de Langerhans (CL), las mieloides dérmicas y las plasmocitoides30.
Las CD hacen parte del arsenal de células presentadoras de antígeno, y son las encargadas de iniciar y estimular la respuesta inmune tanto innata como adaptativa. De igual manera, desempeñan un papel crucial en las etapas iniciales de la enfermedad, y durante las exacerbaciones, al activarse en la dermis y en la epidermis. Tras esta activación, favorecen la producción de factor de necrosis tumoral alfa (TNF-α) y de IL-23, lo que a su vez promueve el desarrollo de las subpoblaciones de linfocitos T (polarizando la respuesta hacia Th1 y Th17), que van a favorecer cambios vasculares y epidérmicos presentes en la Pso, como también el reclutamiento de células inflamatorias hacia la dermis y la epidermis, de manera que se perpetúa el fenómeno inflamatorio sistémico31.
Además, en enfermedad psoriásica, se ha descrito la acumulación hasta 30 veces superior de CD dérmicas mieloides en tejidos crónicamente inflamados con respecto a la piel normal, con un incremento en la relación entre CD y células T que demuestra un fenotipo inmaduro (CD11c+ BDCA-1−); ello favorece la proliferación y la supervivencia de células T y la polarización a Th1 y Th1732. Por otra parte, se ha encontrado alteración en la migración de CL, lo cual conlleva su retención a nivel dérmico y facilita una mayor respuesta inflamatoria33.
Receptores tipo TollLos receptores tipo Toll (TLR, por sus siglas en inglés) hacen parte de proteínas transmembranales tipo I, cuya función es el reconocimiento de patrones moleculares (PRR), entre ellos proteínas, ácidos nucleicos y lipopolisacáridos que desempeñan un rol fundamental en la barrera cutánea como parte de la respuesta inmune innata, bien sea contra microorganismos, o participando en enfermedades autoinmunes o inflamatorias (como la enfermedad psoriásica)34.
Los TLR2 y TLR3 se expresan constitutivamente en queratinocitos normales y en mayor cantidad que otros receptores de esta misma familia. La activación de TLR2 conduce a la producción de TNF-α e IL-6 y, asimismo, mejora la función de la barrera de las uniones estrechas en la epidermis tras la invasión de patógenos. Por su parte, TLR3 es parte fundamental de la reparación normal de la barrera cutánea después del daño tisular, induciendo así la expresión y la función de los componentes de unión estrecha, y favoreciendo la reepitelización, la granulación y la neovascularización necesarias para la cicatrización de las heridas35.
En Pso se ha demostrado una sobreexpresión de TLR2, TLR5 y TLR9. En población asiática se ha encontrado que el polimorfismo de nucleótido simple rs3804099 de TLR2 confiere susceptibilidad para el desarrollo de Pso vulgar36.
TLR2 favorece la expresión de TLR4 en las CD epidérmicas y dérmicas. Esta vía TLR2/4 facilita la translocación nuclear del factor nuclear kappa B (NF-kB) y el aumento de la expresión de TNF-α e IL-8 en queratinocitos psoriásicos, promoviendo el fenómeno inflamatorio en la placa, y esto último sugiere un rol determinante de TLR2 en la patogénesis de Pso37.
Disfunción endotelialLa disfunción endotelial consiste en un desequilibrio en la liberación de factores vasodilatadores (óxido nítrico, prostaciclina) y vasoconstrictores (endotelina y angiotensina II). En pacientes con Pso se ha evidenciado aumento de endotelina producida al parecer por queratinocitos, lo que altera el balance y favorece la vasoconstricción y la vía aterogénica22.
Adicionalmente, en Pso la disfunción endotelial se ha correlacionado con la obesidad. Esta estrecha relación se ha explicado por las adipoquinas, proteínas producidas a nivel de tejido adiposo cuyos niveles son directamente proporcionales al tamaño de las células adiposas y a la acumulación de tejido adiposo. Pueden tener fenotipo proinflamatorio (leptina, resistina, osteopontina, quemerina, WNT5A, entre otros) o antiinflamatorias (adiponectina, SRFP5, omentina, ghrelina y lipocalina 2) y se ha encontrado que los pacientes con Pso tienen niveles bajos de adiponectina, lo que constituye un factor de riesgo para disfunción endotelial33.
Otro factor importante en la disfunción endotelial es el incremento en la activación de plaquetas y su asociación con eventos cardiovasculares, en relación con la interacción con quimiocinas, principalmente ligando de quimioquina 2 y 5 (CCL2, CCL5)38,39, por tal motivo, se ha estudiado como posible blanco terapéutico. Así, en un ensayo clínico, Garshick et al. mostraron que dosis bajas de aspirina redujeron la producción de tromboxano B2 y esto redujo la expresión de la transcripción proinflamatoria, lo que sugiere un posible efecto benéfico en pacientes con Pso. No obstante, se requieren estudios clínicos con desenlaces cardiovasculares para demostrar el efecto terapéutico40.
Alba et al., en un estudio de microdiálisis intradérmica, demostraron perturbación en la función endotelial de la microcirculación, específicamente una alteración en la vasodilatación dependiente de óxido nítrico e independiente del estrés oxidativo aumentado, con un descenso en la biodisponibilidad de óxido nítrico41. Asimismo, se ha encontrado una relación entre IL-23 y disfunción endotelial. En tal sentido, Sherlock et al. demostraron en un modelo murino que esta induce inflamación en la raíz aórtica por medio de la activación de linfocitos CD3+ CD4− CD842.
Obesidad y resistencia a la insulinaLa obesidad constituye un factor predisponente para la aparición de Pso, con una prevalencia estimada del 23,5%. No es solo que la obesidad pueda preceder a la Pso, existe una relación recíproca entre las dos: al comparar con cohortes de pacientes sin Pso, se ha observado un aumento del riesgo relativo para el diagnóstico de novo de obesidad en aquellos pacientes que tienen de base Pso (HR: 1,18; IC 95%: 1,14-1,23)43. Además, se constituye en factor pronóstico. Se ha demostrado empeoramiento de Pso en pacientes obesos15,23, y se asocia con mayor riesgo de compromiso cutáneo moderado a grave, medido con PASI (OR: 2,23; IC 95%: 1,63-3,05)44.
La inflamación sistémica sostenida induce resistencia a la insulina. Okin et al. encontraron que la inflamación suprime la enzima de la biosíntesis de ácido biliar CYP7A1, lo que lleva a la acumulación de 2 metabolitos pirofosfato de farnesilo (FPP) y pirofosfato de geranilgeranilo (GGPP) de la vía del mevalonato hepático, y esto último conlleva una glucosa en ayunas elevada, que es reversible al suprimir FPP y GGPP en modelos de ratones45. El estado proinflamatorio es deletéreo para las células pancreáticas. Grieco et al. demostraron, en este sentido, que la IL-17 produce un estado proapoptótico en los islotes pancreáticos y genera un microambiente que inhibe la secreción de insulina, favoreciendo así el estado hiperglucémico y la subsecuente resistencia a la insulina46. Boehncke et al. encontraron una relación directamente proporcional entre la gravedad de Pso (medida por el PASI) y la resistencia a la insulina, con el consecuente mayor riesgo de desarrollar diabetes mellitus tipo 247. Además, en un metaanálisis llevado a cabo por Coto-Segura et al. se encontró que los pacientes con Pso tienen mayor riesgo de presentar diabetes mellitus tipo 2 durante el seguimiento (OR: 1,76; IC 95%: 1,59-1,96)48. Sumado a lo anterior, experimentan mayor riesgo de complicaciones micro y macrovasculares asociadas con la enfermedad49.
Se ha encontrado que la resistencia a la insulina contribuye directamente al fenotipo epidérmico, lo que ocasiona hiperproliferación y diferencia alterada de queratinocitos. Sin embargo, la relación entre psoriasis y enfermedades metabólicas también ha sido puesta en evidencia por la inflamación crónica conocida, y en este sentido se observa cómo la resistencia a la insulina y los factores secretados por adipocitos (adipoquinas) son factores conductores50. Por ejemplo, la resistencia a la insulina y a HDL disfuncional ocurre concomitante con el desarrollo de la inflamación del tejido adiposo51.
Adicionalmente, la Pso se ha relacionado con varios factores de riesgo metabólico, entre ellos dislipidemia, hígado graso no alcohólico e hipertensión y eventos cardiovasculares52,53. Mutairi et al. han demostrado que los pacientes con psoriasis moderada-grave tienen mayor riesgo de enfermedad coronaria (OR: 2,97; IC 95%: 1,88-4,69), obesidad (OR: 2,356; IC 95%: 1,934-2,87), diabetes mellitus tipo 2 (OR: 3,137; IC 95%: 2,675-3,68), hipertensión arterial (OR: 3,597; IC 95%: 3,015-4,29), dislipidemia (OR: 3,379; IC 95%: 2,631-4,34) y síndrome metabólico (OR: 2,619; IC 95%: 2,092-3,279). Este riesgo se encuentra relacionado de manera directa con la gravedad de la afectación cutánea54.
Adipoquinas en PsoLas adipoquinas proinflamatorias desempeñan un papel fundamental en el fenómeno inflamatorio crónico, la disfunción endotelial y la ateroesclerosis acelerada55. La leptina, una proteína codificada por el gen de la obesidad en el cromosoma 7, participa en el control del peso corporal regulando la ingesta de alimentos y el gasto calórico. Adicionalmente, regula los procesos de vasoconstricción mediados por angiotensina II y vasodilatación mediados por óxido nítrico56; asimismo, regula la expresión de moléculas de adhesión, la angiogénesis y la proliferación de queratinocitos57. La obesidad induce un estado de hiperleptinemia, las células del sistema inmune (CD, macrófagos, neutrófilos, células T efectoras y reguladores) poseen receptores para leptina. Corriente abajo, esta estimulación promueve la proliferación y la supervivencia celular e incrementa la producción de TNF-α, IL-1β, IL-12, IL-17, lo que favorece el fenotipo proinflamatorio58.
En pacientes con Pso y Psa se ha demostrado elevación de leptina en comparación con individuos sanos y se correlaciona con la actividad de la enfermedad59. Sin embargo, el inicio de la terapia sistémica en Pso (tanto sintética como biológica) no ha demostrado la disminución de los niveles de leptina y otras adipoquinas60, y ello sugiere que el fenómeno inflamatorio crónico en la obesidad sea un factor independiente de Pso. No obstante, todavía es tema de intenso debate61.
Ateroesclerosis aceleradaLa inflamación sistémica crónica de bajo grado, resultado de la interacción entre los mecanismos inmunes y las anomalías metabólicas dentro de la pared del vaso, ocasiona el proceso de aterogénesis acelerada. En pacientes con Pso se ha encontrado de forma temprana un cambio cualitativo en la capa íntima de las arterias (disfunción endotelial)18.
Asimismo, se ha demostrado inflamación de la raíz aórtica en comparación con personas sin Pso, como un marcador subrogado de eventos cardiovasculares mayores62. Está inflamación de la raíz aórtica tiene directa relación con la severidad de la estenosis de las arterias coronarias epicárdicas, lo que confirma el mayor riesgo de eventos cardiovasculares en esta población63.
Engrosamiento íntimaEl uso de ultrasonido para la evaluación del engrosamiento de íntima-media de la arteria carotídea provee un método útil para la evaluación de la ateroesclerosis subclínica64. Se ha encontrado relación en estudios analíticos entre Pso e incremento del grosor de la íntima media carotídea que contribuye a ateroesclerosis y posteriores desenlaces cardiovasculares, como lo demostraron Argote et al., quienes hallaron un promedio de engrosamiento de íntima carotídea medido por ecografía de 0,7mm en 40 pacientes con Pso65. Abrahão-Machado et al., en un estudio de 50 pacientes con Pso en placa, encontraron correlación fuerte positiva entre puntaje de riesgo de Framingham y medición cuantitativa de engrosamiento de íntima-media de carótida. Esto lo convierte en una herramienta útil en la evaluación de riesgo cardiovascular en pacientes con Pso64.
Eventos cardiovascularesLa asociación entre Pso y el aumento del riesgo cardiovascular es muy conocida. En 1974 McDonald y Calabresi describieron el aumento de la incidencia de la enfermedad vascular oclusiva en 253 pacientes con Pso sin tratamiento sistémico específico, y encontraron que el 11,5% de los individuos presentaban uno o más eventos oclusivos arteriales (ataque cerebrovascular, infarto de miocardio, tromboflebitis y embolismo pulmonar)66, y esto ha sido corroborado con varios estudios epidemiológicos a lo largo del tiempo67-70.
Es importante destacar que el riesgo cardiovascular elevado no solo se debe a factores intrínsecos. La dieta rica en ácidos grasos saturados también tiene un efecto deletéreo en la amplificación de la inflamación de la Pso, ya que puede cambiar la composición de la membrana celular y alterar la señalización interna celular que lleva a una activación de la protein quinasa C y las MAP quinasas. Esto último produce un aumento en la secreción de la IL-6 e IL-871,72, lo que resalta la importancia de la dieta en el control de la enfermedad. Herbert et al. demostraron que la dieta baja en ácidos grasos y rica en omega 3, junto con el tratamiento convencional, disminuye la gravedad de la psoriasis73.
Un estilo de vida poco saludable, aunado a la inflamación sistémica crónica y el aumento de los niveles sistémicos y locales (piel y articulaciones) de TNF-α e IL-6 74, es deletéreo y favorece la aterosclerosis temprana, fomentando la aparición de eventos adversos cardiovasculares75. Gelfand et al. demostraron que los pacientes con Pso grave experimentan un 50% de aumento del riesgo de muerte, que se mantiene incluso después de ajustar los factores de riesgo para mortalidad (tabaquismo; índice de masa corporal; infarto de miocardio; insuficiencia cardiaca congestiva; enfermedad vascular periférica; enfermedad cerebrovascular; demencia; enfermedad pulmonar crónica; enfermedad reumatológica; enfermedad de úlcera péptica; enfermedad hepática; diabetes mellitus y complicaciones crónicas; hemiplejía o paraplejía; enfermedad renal; neoplasia maligna; tumor sólido metastásico y sida), siendo esta prematura entre los 3 y los 6 años, en comparación con personas sin Pso76. La mortalidad debido a eventos cardio-cerebrovasculares está asociado con la Pso como factor de riesgo independiente77-79. Raaby et al. demostraron que el riesgo depende de la gravedad y la extensión del dominio cutáneo: a mayor extensión, mayor riesgo de eventos cerebrovasculares (HR: 1,10 y 1,38 para psoriasis moderada y grave, respectivamente; infarto agudo al miocardio; HR: 1,20 y 1,70 para psoriasis moderada y grave, respectivamente)80. Lo anterior resalta la importancia de identificar ágilmente a los pacientes con afectación extensa con mayor riesgo cardiovascular que se beneficien del inicio temprano de terapia sistémica.
Artritis psoriásicaLa Psa afecta hasta el 30% de los pacientes con Pso y ocasiona graves limitaciones físicas y discapacidad. Se han descrito algunos factores fundamentales implicados en el desarrollo de la Psa80-82 (tabla 2), y al igual que la Pso conlleva un mayor riesgo de enfermedad cardiovascular (prevalencia de obesidad, hipertensión, dislipidemia y diabetes). Polachek et al. demostraron que los pacientes con Psa experimentan un aumento del riesgo de eventos cardiovasculares (OR: 1,43; IC 95%: 1,24-1,66), infarto agudo de miocardio (OR: 1,68; IC 95%: 1,31-2,15), ataque cerebrovascular (OR: 1,22; IC 95%: 1,05-1,41) y falla cardiaca (OR: 1,32; IC 95%: 1,11-1,57), en comparación con la población general y equiparable al de Pso con afectación grave. Ello sugiere que, a mayor inflamación sistémica indicada por la actividad de la enfermedad, mayor riesgo cardiovascular83. Entre los predictores clínicos asociados con mayor riesgo cardiovascular se encuentran la dactilitis (riesgo relativo [RR]: 1,20; IC 95%: 1,10-1,35) y el número de articulaciones dolorosas (RR: 1,94; IC 95%: 1,15-3,27)84.
Factores involucrados en la artritis psoriásica
| Factor involucrado | Rol fisiopatológico |
|---|---|
| Tabaquismo | Aumenta actividad y gravedad de artritis psoriásica |
| Predisposición genética | Susceptibilidad para el desarrollo de la artritis psoriásica (HLA-Cw*0602, HLA-B27, HLA-B38, HLA-B39, gen IL23R) |
| Gravedad de psoriasis | Mediado por Th1 (secreción crónica de TNF-α por macrófagos), Th17 y linfocitos T CD8+ citotóxicos autorreactivos (inflamación y daño tisular) |
| Infección por estreptococo β-hemolítico | Reactividad cruzada entre estos Ag y los presentes en la piel |
| Obesidad | Inflamación crónica, hiperleptinemia (factor proinflamatorio) y TNF-α (activación y reclutamiento de células inmunitarias en la sinovia) |
Los estudios en pacientes con Psa demuestran mayor disfunción endotelial85, ateroesclerosis subclínica y rigidez arterial86, por lo que el mecanismo fisiopatológico es similar al menos en parte a lo expuesto en relación con el concepto de marcha psoriásica.
Evaluación y disminución del riesgo cardiovascularA pesar de la relación demostrada entre Pso, Psa y mortalidad cardiovascular, no existe una recomendación dirigida a esta población para prevenir y manejar el riesgo cardiovascular, por lo que el manejo se lleva a cabo de acuerdo con las guías de manejo de riesgo en población general, lo que puede potencialmente subestimar el riesgo y limitar las intervenciones agresivas en esta población. No obstante, entender la psoriasis, su fisiopatología compleja y la relación con la multimorbilidad, permite tener objetivos más ambiciosos para lograr un mejor control de la actividad en el dominio cutáneo, articular (tanto periférico como axial), de entesitis y dactilitis, tratamiento intensivo y temprano de comorbilidades, y de esta forma impactar en los desenlaces cardiovasculares87.
En relación con el uso de la terapia sistémica y su impacto en desenlaces cardiovasculares en Pso, aún es materia de estudio, a diferencia de otras enfermedades inflamatorias sistémicas como la artritis reumatoide, para la cual se ha demostrado el impacto del uso de la terapia sintética y biológica en la disminución del riesgo cardiovascular88,89. En Pso un metaanálisis encontró evidencia limitada con relación a la disminución de riesgo de todos los eventos cardiovasculares con uso de terapia sistémica (antinflamatorios no esteroides, corticoesteroides, metotrexate, anti-TNF-α)83, mientras que en Psa, Roubille et al. demostraron que el uso de terapia sistémica (biológica y sintética) disminuía el riesgo de todos los eventos cardiovasculares (HR: 0,75; IC 95: 0,63-0,91). Desde el punto de vista clínico, es fácil intuir que el adecuado control de la actividad en los dominios de la enfermedad, aunado al control de los factores de riesgo tradicionales modificables, tiene un impacto significativo en la disminución del riesgo cardiovascular que se demostrará en el largo plazo89.
Con relación al uso de estatinas, grupo farmacológico pilar del tratamiento de hiperlipidemia, se ha demostrado un efecto inmunomodulador (favorecen la respuesta mediadas por Th1, inhiben la inducción del complejo mayor de histocompatibilidad II, evitan la liberación de citocinas y la degranulación de los mastocitos e inhiben las interacciones entre quimiocinas proinflamatorias). Por tal efecto, se ha estudiado su utilidad en Pso. Un metaanálisis que incluyó 5 estudios demostró en pacientes con Pso grave que recibieron estatinas vs. placebo, una mejoría en el PASI estadísticamente significativa, una diferencia de medias de 2,76, (IC 95%: 0,49-5,04). Sin embargo, no es claro si el uso rutinario de estatinas en pacientes con Pso sin hiperlipidemia tiene un impacto en la disminución del riesgo de enfermedad coronaria u otras enfermedades ateroscleróticas. Teóricamente, deberían beneficiarlos dado que está comprobado que disminuyen el riesgo de manifestaciones clínicas del proceso aterosclerótico en pacientes con alto riesgo cardiovascular, no obstante, se requieren estudios bien diseñados que demuestren a largo plazo el impacto clínico con el uso cotidiano90.
Con relación al uso de ácido acetilsalicílico, se necesitan investigaciones adicionales para evaluar su eficacia en la prevención primaria y la reducción del riesgo cardiovascular en psoriasis28.
Además de las medidas terapéuticas previamente descritas, se recomienda el adecuado control de los factores de riesgo tradicionales, así como el control del peso, la suspensión del tabaquismo y hacer ejercicio físico, lo cual ha demostrado que disminuye la concentración de citoquinas como TNF-α, IL6, IL8 y proteína quimioatrayente de monocitos, y reduce la PCR, lo que podría traducirse en una disminución del riesgo cardiovascular y la gravedad de la psoriasis, así como una mejoría de la calidad de vida91-93.
ConclusionesLa psoriasis es una enfermedad compleja. Más allá de la afectación cutánea, se debe entender como una enfermedad sistémica que se asocia con mayor riesgo de mortalidad cardiovascular. El término marcha psoriásica hace referencia a la relación entre Pso, actividad de la enfermedad, inflamación sistémica, resistencia a la insulina, ateroesclerosis acelerada y riesgo cardiovascular. Los mecanismos fisiopatológicos que explican estos fenómenos son variables y no se han dilucidado por completo. Entender estos mecanismos de inflamación es de vital importancia para influir en el manejo sistémico y multimodal de la enfermedad. Es imperativa la evaluación individual del riesgo cardiovascular en Pso y Psa, como también el tratamiento intensivo de la actividad de la enfermedad y los factores de riesgo cardiovascular tradicionales para disminuir la morbimortalidad, sin embargo, se requiere mayor evidencia acerca de la evaluación del riesgo y el impacto de estas intervenciones en los desenlaces cardiovasculares.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.