Realizar un metaanálisis de experimentos clínicos controlados comparando tasas de respuesta en remisión completa y parcial, además de efectos secundarios entre micofenolato (MF) y tacrolimus comparado con ciclofosfamida (CY), para el manejo de nefritis lúpica.
Materiales y métodosSe identificaron experimentos clínicos a través de bases de datos de MEDLINE usando buscadores de PubMed, OVID y de Cochrane, LILACS, EMBASE, Academia de Medicina de Nueva York y resúmenes de congresos del ACR, EULAR, GLADEL. Los datos fueron extraídos independientemente por 2 revisores.
ResultadosPara la comparación MF vs. CY se obtuvieron 9 experimentos clínicos, para un total de 812 pacientes, evidenciando que MF tiene similar eficacia que CY en términos de remisión completa y parcial. No hubo diferencia en síntomas gastrointestinales, leucopenia ni en muertes. Hay menor riesgo de irregularidades menstruales (RR: 0,38; IC del 95%: 0,20-0,73), infecciones (RR: 0,64; IC del 95%: 0,45-0,91) y menor riesgo de alopecia, (RR: 0,25; IC del 95%: 0,16-0,38) en el grupo de MF. Para la comparación tacrolimus vs. CY, se obtuvieron 3 experimentos clínicos, para un total de 146 pacientes, evidenciando que tacrolimus tiene similar eficacia que CY en remisión completa y parcial; en el desenlace respuesta (remisión completa+parcial) se evidencia mayor beneficio de tacrolimus sobre CY (RR: 1,21; IC del 95%: 1,02-1,45). No hubo diferencia en toxicidad entre tacrolimus y CY.
ConclusionesMF, tacrolimus y CY tienen similares tasas de remisión; sin embargo, hay mayor beneficio en respuesta al comparar tacrolimus vs. CY. Comparando MF con CY hay menor riesgo de irregularidades menstruales, infecciones y alopecia.
To perform a meta-analysis of controlled clinical trials to compare response rates of complete response and partial remission rates, as well as the adverse effects of immunosuppressive treatments, such as mycophenolate (MF) and tacrolimus, compared with cyclophosphamide (CY), for the management of lupus nephritis.
Materials and methodsClinical trials were identified through MEDLINE database using PubMed, OVID and Cochrane search engines, LILACS, EMBASE, New York Academy of Medicine and conference proceedings from the ACR, EULAR, and GLADEL. Data were extracted independently by 2 reviewers.
ResultsFor the comparison between MF and CY, 9 clinical trials were obtained, with a total of 812 patients, showing that MF has similar efficacy with CY in terms of complete and partial remission. There was no significant difference in gastrointestinal symptoms, leukopenia or deaths. There is less risk of menstrual abnormalities (RR: 0.38, 95% CI: 0.20-0.73), infections (RR: 0.64; 95% CI: 0.45-0.91) and less risk of hair loss (RR: 0.25, 95% CI: 0.16-0.38) in the MF group. For the comparison between tacrolimus and CY, 3 clinical trials were obtained, with a total 146 patients, showing that tacrolimus and CY have similar efficacy in complete and partial remission. In the outcome response (complete and partial remission), it was found that tacrolimus had a greater benefit than CY (RR: 1.21, 95% CI: 1.02-1.45). There was no significant difference in terms of toxicity between tacrolimus and CY.
ConclusionsPatients treated with MF, tacrolimus and CY have similar rates of remission; however there is greater benefit in outcome response when comparing tacrolimus and CY. Comparing MF with CY showed a lower risk of menstrual abnormalities and reduced risk of alopecia.
La nefritis lúpica (NL) es el principal predictor de mal pronóstico en pacientes con lupus eritematoso sistémico1. Aproximadamente el 40% de los pacientes con lupus eritematoso sistémico presentan alteración en el parcial de orina o tasa de filtración glomerular2,3.
A lo largo de las últimas décadas las opciones terapéuticas para la NL se han incrementado, lo que ha llevado a porcentajes de supervivencia actual por encima del 90% a 5 años, en contraste con los resultados de las primeras series en los años 50 donde la supervivencia a 3 y 5 años era del 0%4.
Aunque la supervivencia es mayor, su tratamiento estándar ciclofosfamida (CY) está asociado con efectos adversos y tasa de recaídas del 45%, después de 10 años de seguimiento5,6. Debido a esto se iniciaron estudios con otros medicamentos inmunosupresores usados para evitar el rechazo en el trasplante de órganos sólidos, entre los que están, micofenolato (MF) y tacrolimus; se llevaron a cabo experimentos clínicos controlados, mostrando no inferioridad en eficacia en comparación con CY y con menos efectos adversos7–10.
Esto ha creado en los últimos años discrepancias en el manejo de la NL11,12. Por esto es importante conocer si existe evidencia suficiente para recomendar estos 2 últimos inmunosupresores en el tratamiento de la NL, con igual eficacia que la CY y mayor seguridad.
Los objetivos del presente trabajo son evaluar la eficacia de MF o tacrolimus comparados con CY para el tratamiento de la NL proliferativa evaluando las tasas de remisión completa, remisión parcial o respuesta (remisión completa+remisión parcial) y cuantificar el número de efectos adversos de las 2 terapias en este grupo de pacientes.
MetodologíaSe realizó una revisión sistemática y metaanálisis de experimentos clínicos controlados, y los criterios de inclusión fueron: pacientes mayores de 18 años, biopsia renal confirmatoria de NL proliferativa, comparación entre MF y CY, o tacrolimus y CY, como tratamiento de inducción, y que se reportaran los desenlaces en términos de remisión completa, remisión parcial y efectos adversos.
La búsqueda la realizaron 2 revisores, a través de bases de datos de MEDLINE usando buscadores de PubMed, OVID y de Cochrane Central Register of Randomized Controlled Trials, LILACS, EMBASE, literatura gris tomada de la Academia de Medicina de Nueva York, y resúmenes de congresos del ACR, EULAR, GLADEL.
Los términos de búsqueda usados fueron: «mycophenolate mofetil», «mycophenolic acid», «cyclophosphamide», «tacrolimus», «FK506», «lupus erythematosus systemic», «glomerulonephritis», «nephritis» y «lupus nephritis». Se tuvieron en cuenta trabajos realizados sin límite de fecha de inicio y hasta el 1 de julio de 2012. Los marcadores booleanos usados fueron: AND, NOT y OR.
De los estudios seleccionados se leía el resumen del artículo, y los datos los extraían independientemente 2 revisores; en el caso de alguna diferencia de opinión en los estudios, se evaluó por un tercero y se resolvió por discusión y consenso. Se valoró la calidad de los estudios seleccionados en 6 dominios: generación de la secuencia de aleatorización, encubrimiento de la asignación aleatoria, enmascaramiento, datos incompletos de los resultados de interés, descripción selectiva de los resultados de interés y otros específicos del tema; se clasificaron según la herramienta de Colaboración Cochrane en riesgo bajo de sesgo, riesgo poco claro de sesgo y riesgo alto de sesgo. Además, se diseñó un plan de análisis; así, para los resultados dicotómicos de los desenlaces se utilizó el riesgo relativo (RR), como medida del efecto. Para estos cálculos se utilizó el software gratuito RevMan13.
En la evaluación de la heterogeneidad se utilizó la prueba absoluta I2 basada en la formula estadística Q, siendo I2: (Q-df/Q)*100 y un nivel de significación de 0,1; cuando se halló heterogeneidad significativa (valores de I2 mayores del 30%) no se combinaron los resultados de los estudios en el metaanálisis y se intentó determinar las razones potenciales por las cuales se presentaba, mediante la evaluación de las características de los estudios individuales y de los subgrupos, usando un modelo de efectos aleatorios descritos por DerSimonian y Laird14; además, para estos casos de heterogeneidad, se realizó el análisis de sensibilidad excluyendo estudios con alto riesgo de sesgo de acuerdo con el gráfico de Galbraith. Cuando los datos eran homogéneos (I2 entre cero y 30%) se utilizó un modelo de efectos fijos de Haenszel. La síntesis de los datos se realizó con los programas RevMan13 y Epidat15.
ResultadosSelección de los estudiosSe identificaron 598 referencias. Tras la lectura de resúmenes fueron eliminados 573 artículos debido a que el tema no era de interés, no eran experimentos clínicos aleatorizados y no se utilizaban los tratamientos que se evaluaban en este estudio (anexo 1). Se obtuvieron 25 estudios, de los cuales 23 se encontraron en texto completo y 2 solo en resumen, ya que eran pósteres de congresos internacionales (los cuales fueron incluidos). De estos 25 estudios, se excluyeron: 2 artículos por ser análisis de subgrupos, 2 estudios por no ser experimentos clínicos aleatorizados, un estudio por no medir los desenlaces buscados, un estudio por no ser la población objeto y un estudio porque en el grupo experimental se mezclaban los 2 inmunosupresores estudiados. Adicionalmente, se retiraron 6 artículos que evaluaban el tratamiento en fase de mantenimiento y lo buscado por los autores era en fase de inducción. Finalmente, se obtuvieron 9 artículos de MF comparado con CY (anexo 2) y 3 artículos de tacrolimus comparado con CY (anexo 3); esos fueron los trabajos incluidos en el metaanálisis y de estos se extrajo la información.
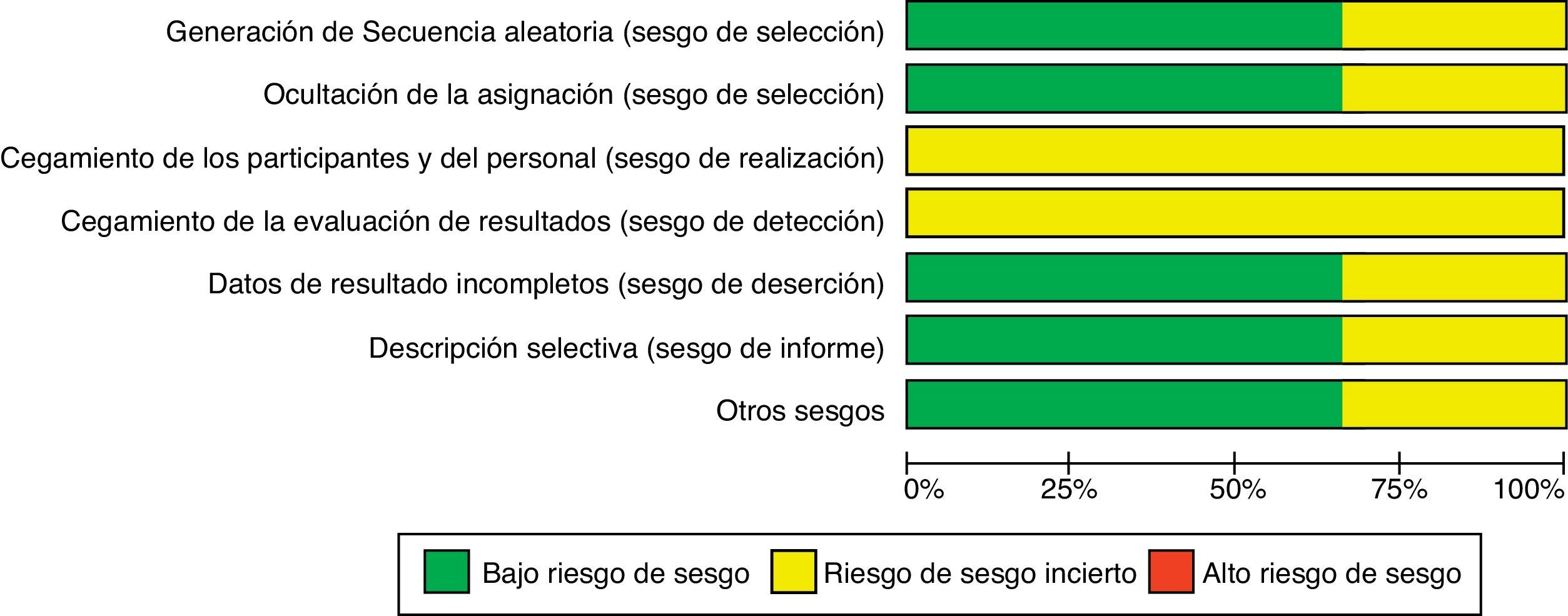
En la evaluación de la calidad metodológica, para la comparación de MF con CY: 8 estudios se calificaron como de bajo riesgo de sesgo en la secuencia de asignación aleatoria, 9 estudios fueron calificados como de riesgo poco claro de sesgo en las variables «adecuado ocultamiento de la asignación», y «enmascaramiento de los participantes, proveedores y asesores externos». El análisis de los datos por intención de tratar (intention-to-treat analysis) se pudo realizar en 8 de los estudios incluidos en el metaanálisis. En solo 4 estudios se informó sobre el cálculo de la muestra; 8 estudios fueron evaluados como de bajo riesgo de sesgo en la variable «los estudios están libres de descripciones selectivas de desenlaces de interés y el estudio está aparentemente libre de problemas de sesgo». Solo un estudio se obtuvo en forma de abstract, razón por la cual las variables fueron catalogadas como de riesgo incierto (fig. 1).
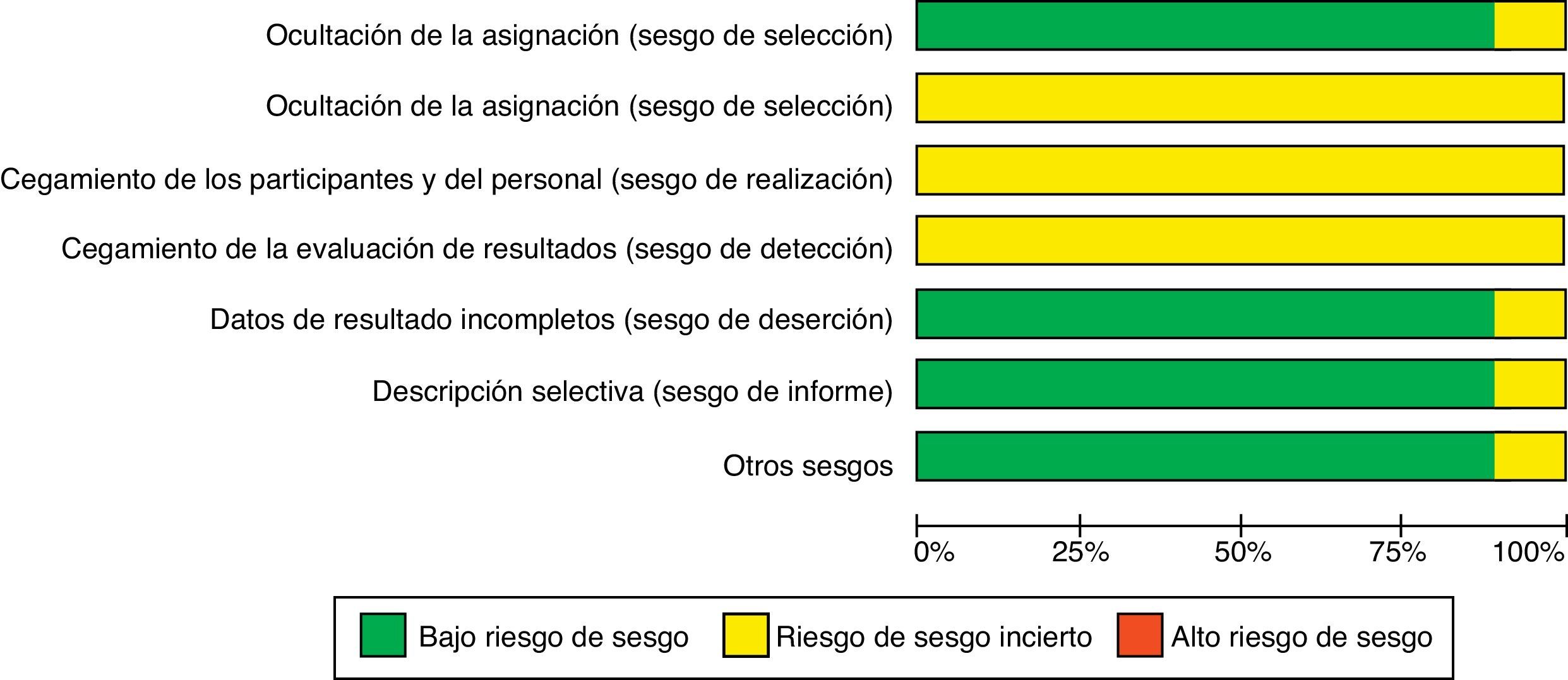
Para la comparación tacrolimus con CY: 2 estudios se calificaron como de bajo riesgo de sesgo en la secuencia de asignación aleatoria, 3 estudios fueron calificados como de riesgo poco claro de sesgo en las variables «adecuado ocultamiento de la asignación» y «enmascaramiento de los participantes, proveedores y asesores externos». El análisis de los datos por intención de tratar se pudo realizar en 3 de los estudios incluidos en el metaanálisis. Un estudio fue evaluado como de bajo riesgo de sesgo en la variable «los estudios están libres de descripciones selectivas de desenlaces de interés y el estudio está aparentemente libre de problemas de sesgo» (fig. 2).
Micofenolato versus ciclofosfamidaPara la comparación MF vs. CY, fueron seleccionados 9 experimentos clínicos aleatorizados, con un total de 812 pacientes, 407 en el grupo de MF y 405 en el grupo de CY, con un promedio de edad de 32 años y un porcentaje de hombres del 11%. Dos estudios6,7 solo evaluaron NL clase iv, el resto valoraron todas las nefropatías proliferativas.
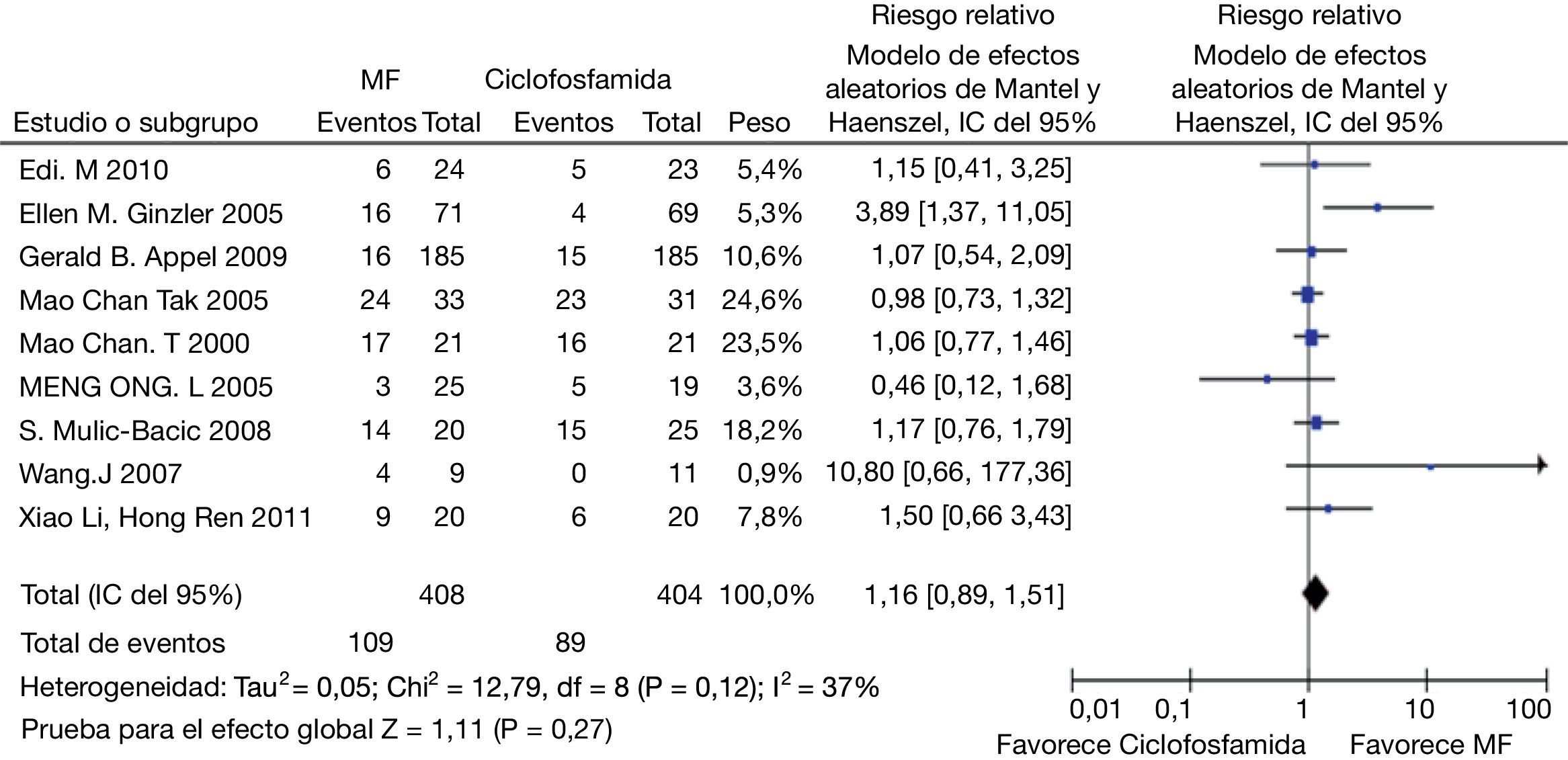
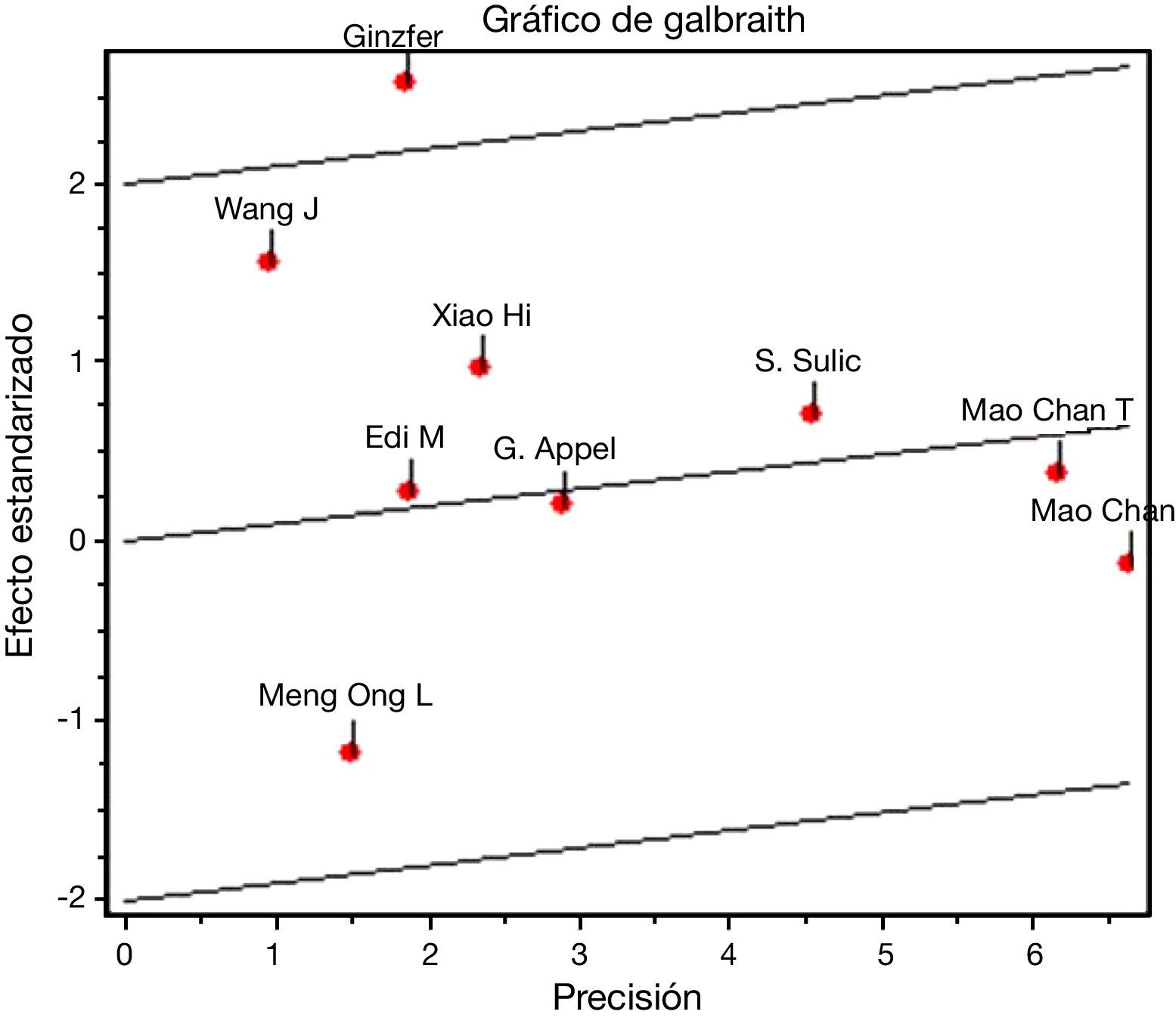
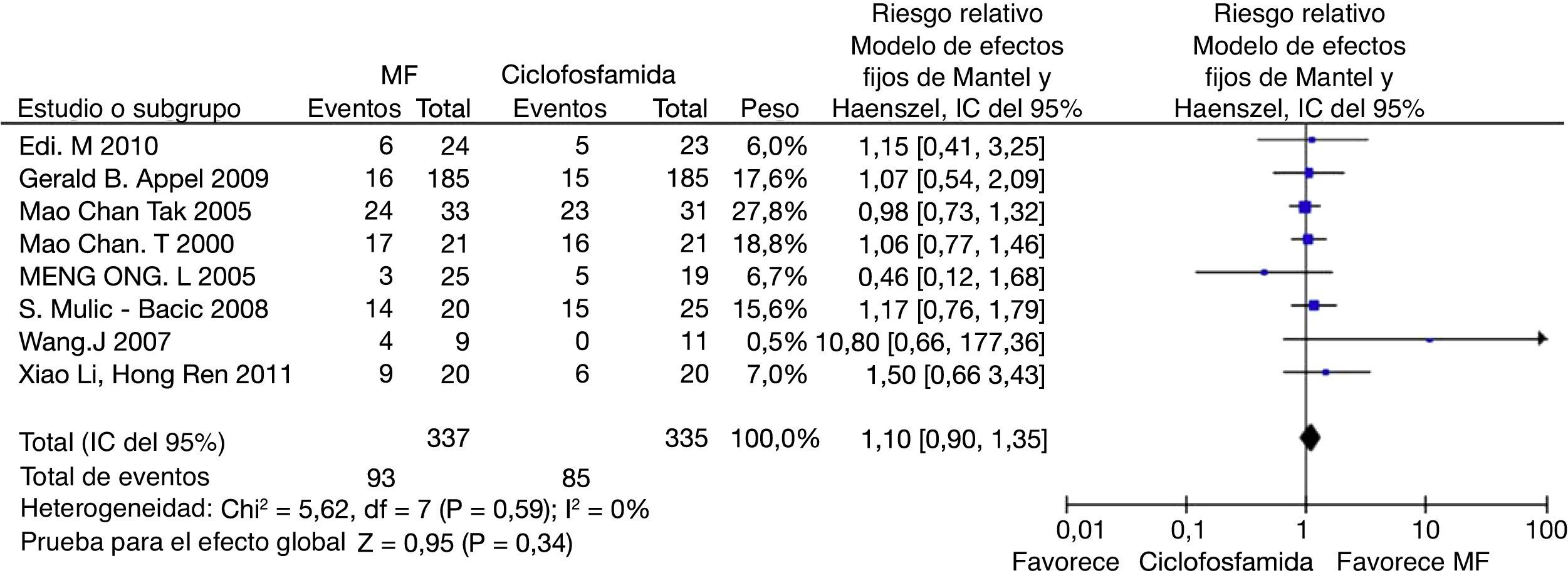
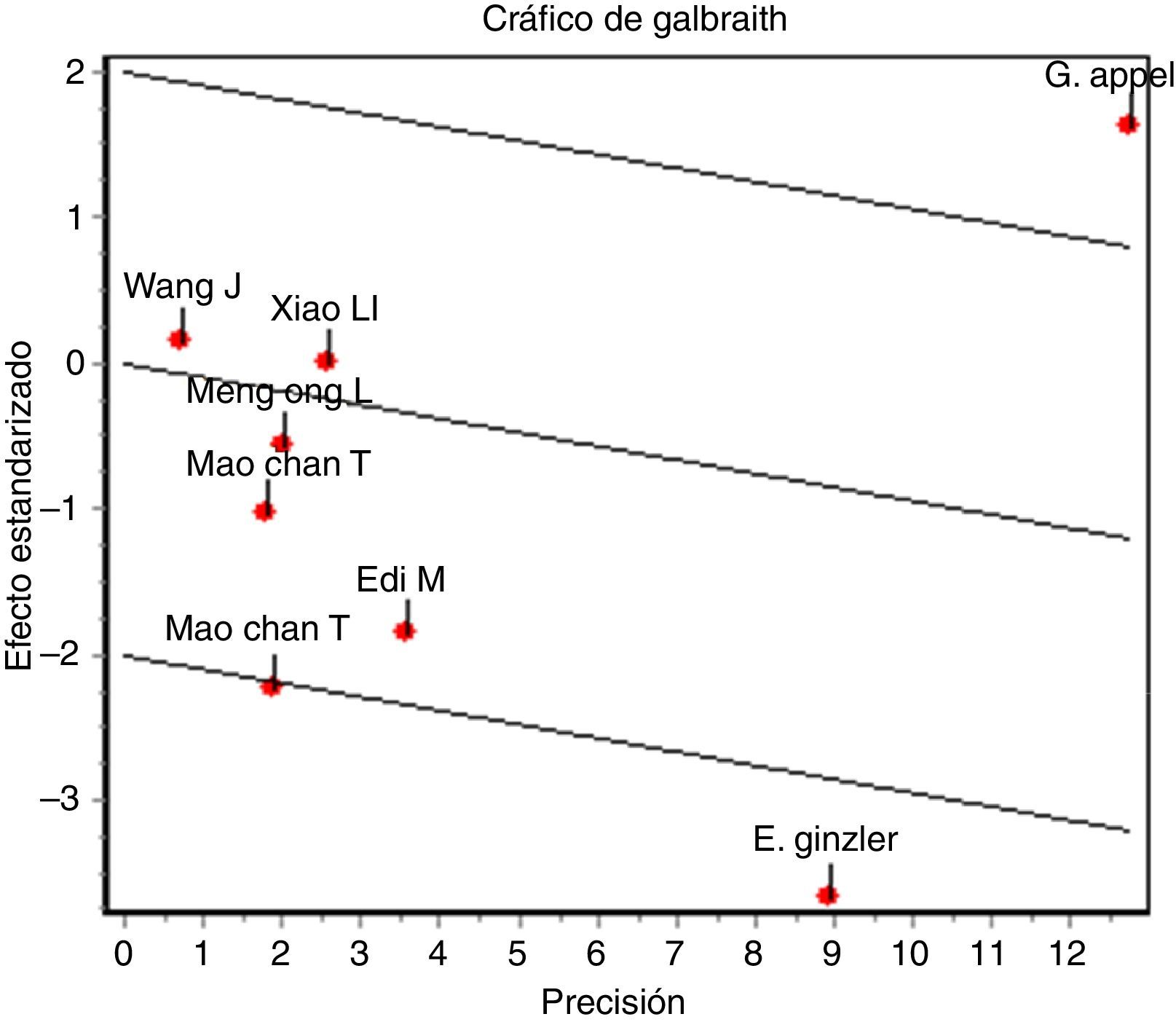
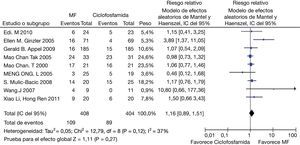
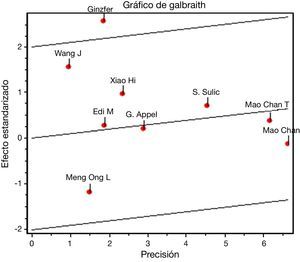
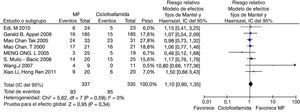
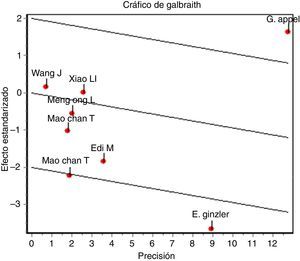
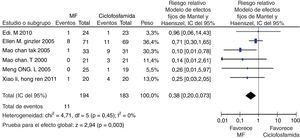
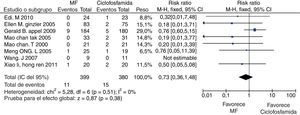
En el desenlace remisión completa, la evaluación estadística de la heterogeneidad arrojó un I2 del 37% (fig. 3) lo que se consideró heterogeneidad moderada; se revisó el gráfico de Galbraith (fig. 4) que pone de manifiesto que los estudios no son homogéneos, con una clara influencia del estudio de Ginzler et al.16, por caer fuera de las bandas de confianza del gráfico; se decidió realizar un análisis de sensibilidad excluyendo este último artículo y no se observó una diferencia estadísticamente significativa al comparar MF con CY en el análisis de efectos aleatorios (RR: 1,10; IC del 95%: 0,90-1,35) (fig. 5). Para el desenlace remisión parcial se obtuvo un RR de 1,06 y un IC del 95%: 0,90-1,24 sin ser estadísticamente significativo; en términos de respuesta, no se observó una diferencia estadísticamente significativa al comparar MF con CY (RR: 1,07; IC del 95%: 0,95-1,21).
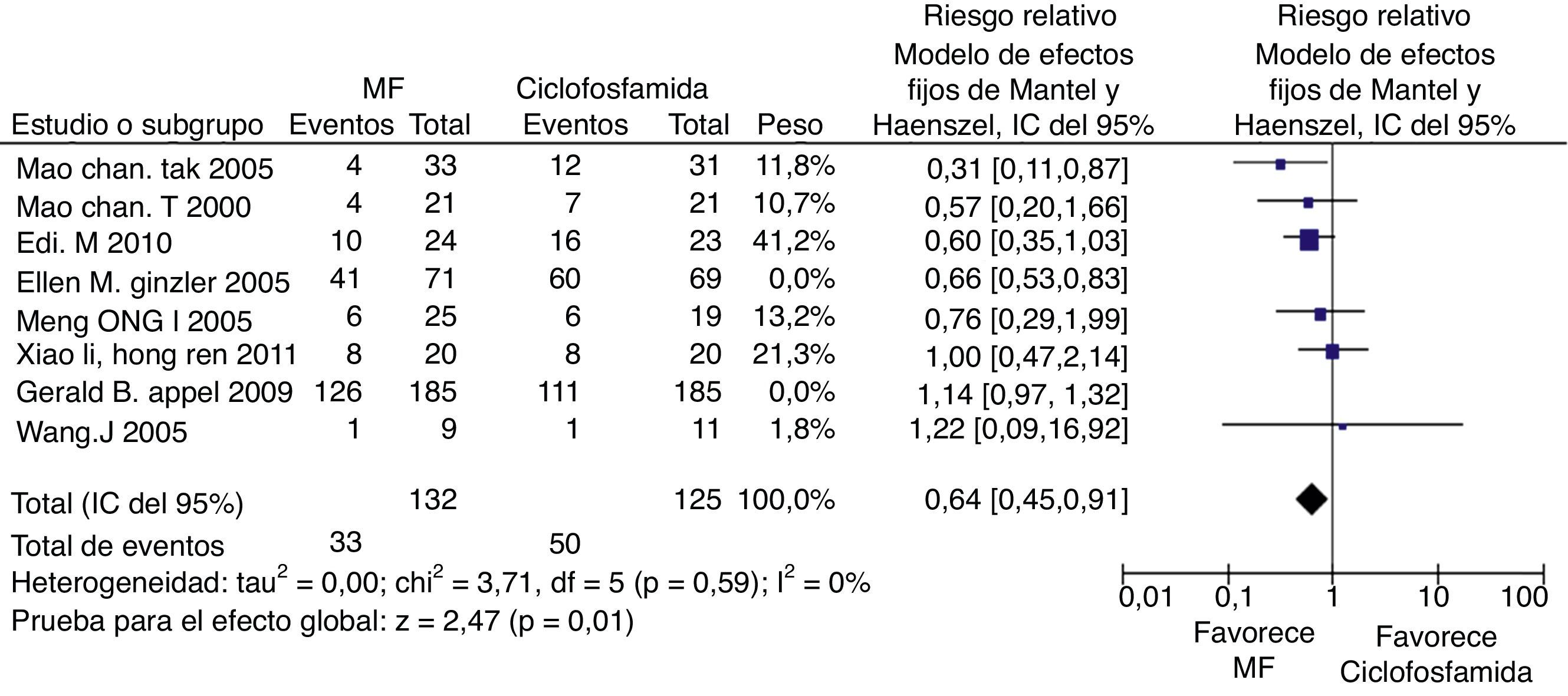
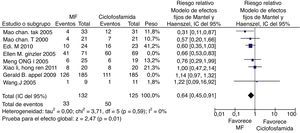
Cuando se evalúo la tasa de infecciones, se utilizaron 8 ensayos clínicos, se excluyó el estudio de Mulic-Bacic et al.17 por no contar con esta información. La evaluación estadística de la heterogeneidad arrojó un I2 del 70% por lo que se consideró una heterogeneidad significativa de los estudios; se revisó el gráfico de Galbraith (fig. 6) y los estudios de Appel et al.18 y Ginzler et al.16, caen por fuera de las bandas de confianza del gráfico, por lo tanto se presenta el análisis de sensibilidad excluyendo estos 2 artículos. Se observó una diferencia estadísticamente significativa al comparar MF con CY en el análisis de efectos aleatorios con RR: 0,64; IC del 95%: 0,45-0,91 (fig. 7).
En cuanto al desenlace síntomas gastrointestinales, se obtuvo un RR de 0,92 y un IC del 95% de 0,79-1,08, sin diferencia estadísticamente significativa; y las tasas de leucopenia tuvieron un RR: 0,74 y un IC del 95% de 0,39-1,41, igualmente sin ser estadísticamente significativo (figs. 8 y 9).
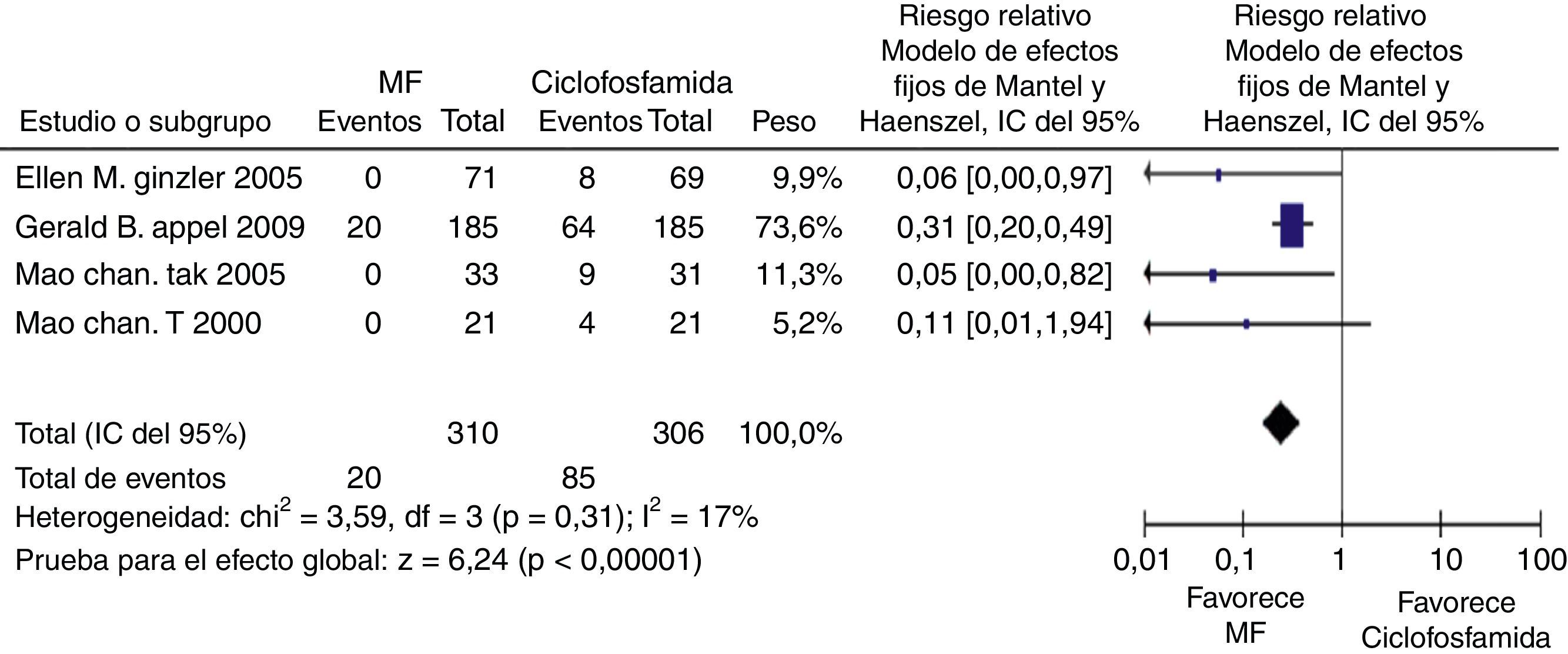
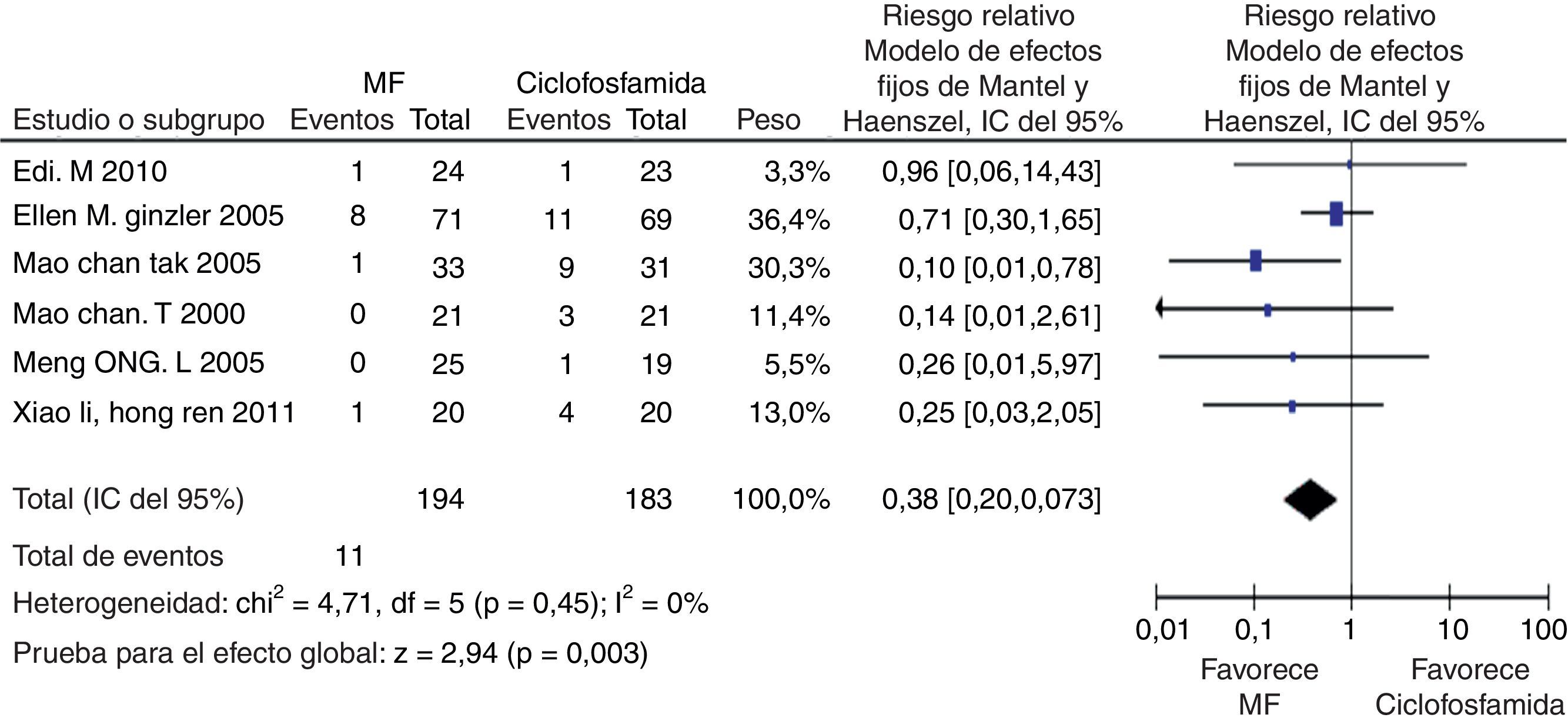
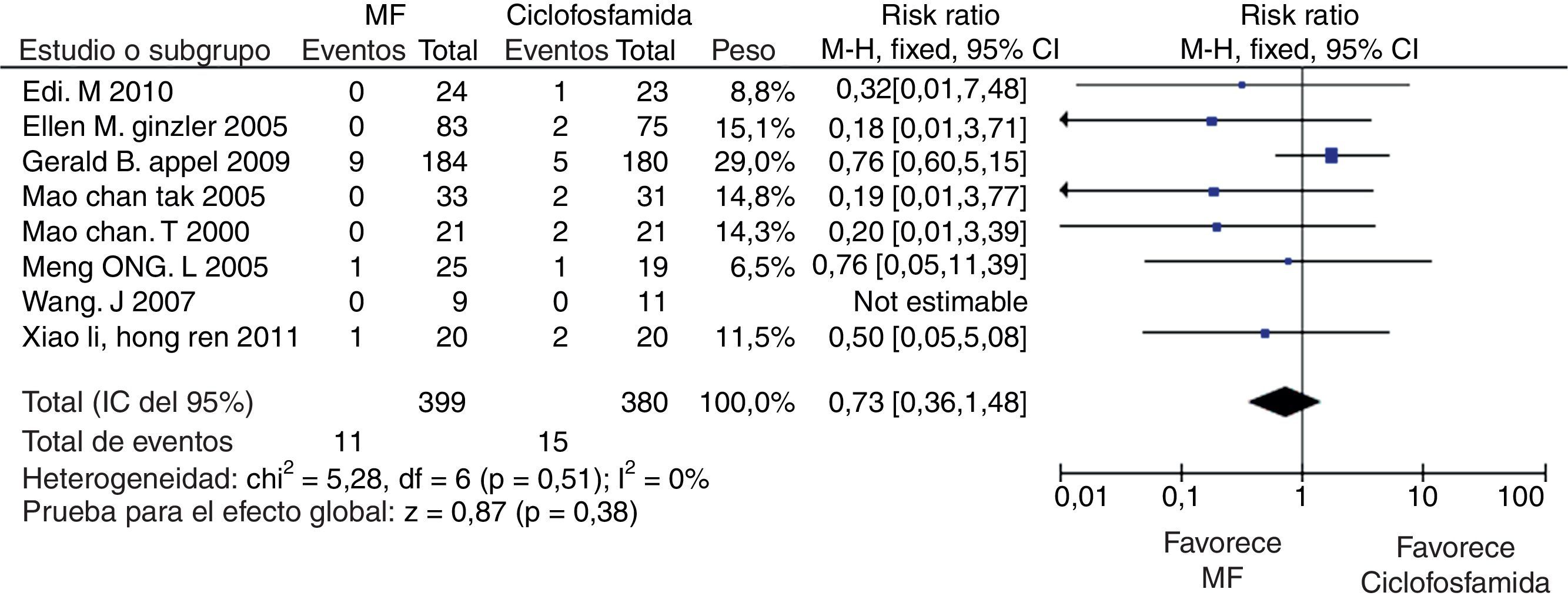
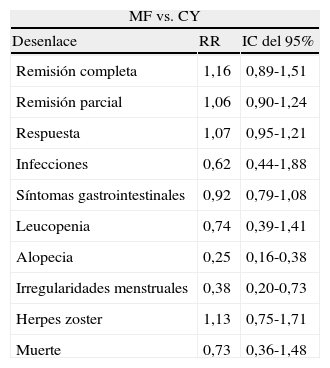
En los desenlaces alopecia y amenorrea se evidenció una diferencia estadísticamente significativa con RR de 0,25 e IC del 95%: 0,16-0,38; y RR de 0,38 e IC del 95%: 0,20-0,73, respectivamente (figs. 8 y 9). No se encontró diferencia significativa para el desenlace herpes zoster (RR: 1,13; IC del 95%: 0,75-1,71), ni para el desenlace muerte (RR: 0,73; IC del 95%: 0,36-1,48) (fig. 10). El resumen de los desenlaces es mostrado en la tabla 1.
Desenlaces en MF vs. CY
| MF vs. CY | ||
| Desenlace | RR | IC del 95% |
| Remisión completa | 1,16 | 0,89-1,51 |
| Remisión parcial | 1,06 | 0,90-1,24 |
| Respuesta | 1,07 | 0,95-1,21 |
| Infecciones | 0,62 | 0,44-1,88 |
| Síntomas gastrointestinales | 0,92 | 0,79-1,08 |
| Leucopenia | 0,74 | 0,39-1,41 |
| Alopecia | 0,25 | 0,16-0,38 |
| Irregularidades menstruales | 0,38 | 0,20-0,73 |
| Herpes zoster | 1,13 | 0,75-1,71 |
| Muerte | 0,73 | 0,36-1,48 |
CY: ciclofosfamida; MF: micofenolato.
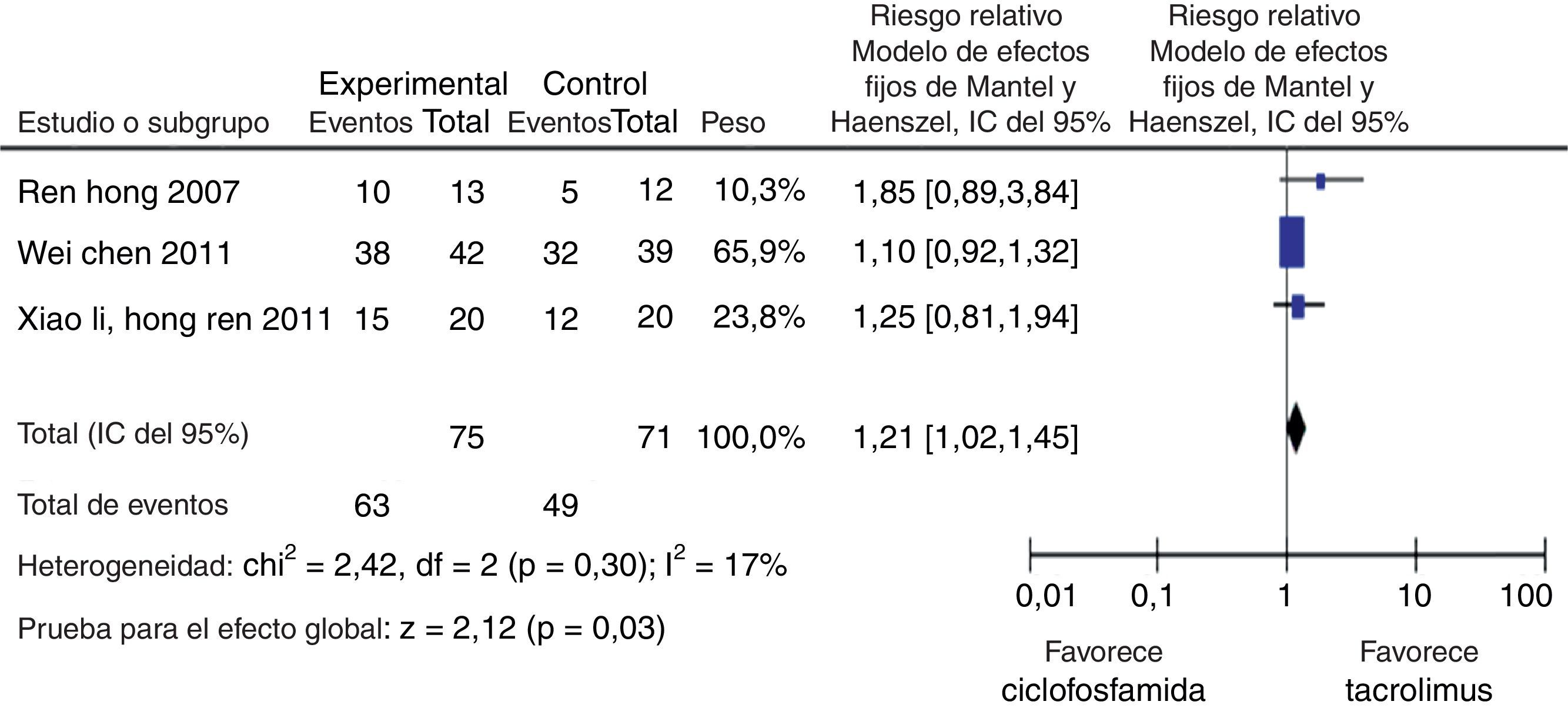
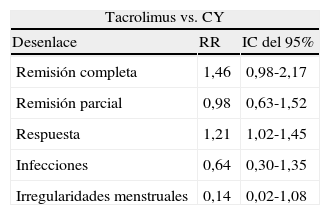
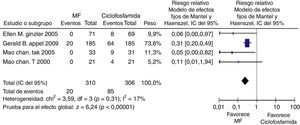
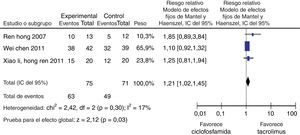
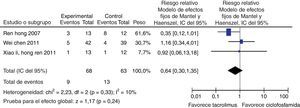
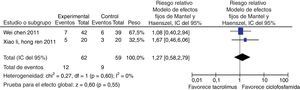
Para la comparación tacrolimus vs. CY, 3 experimentos clínicos aleatorizados fueron seleccionados, con un total de 146 pacientes, 75 en el grupo de tacrolimus y 71 en el grupo de CY, con un promedio de edad de 30,2 años y un porcentaje de hombres del 13,2%. En el desenlace remisión completa, no se observó una diferencia estadísticamente significativa (RR: 1,46; IC del 95%: 0,98-2,17); para el desenlace remisión parcial se obtuvo un RR de 0,98 e IC del 95%: 0,63-1,52, sin ser estadísticamente significativo. En términos de respuesta, se observó una diferencia estadísticamente significativa a favor de tacrolimus comparado con CY (RR: 1,21; IC del 95%: 1,02-1,45) (fig. 11).
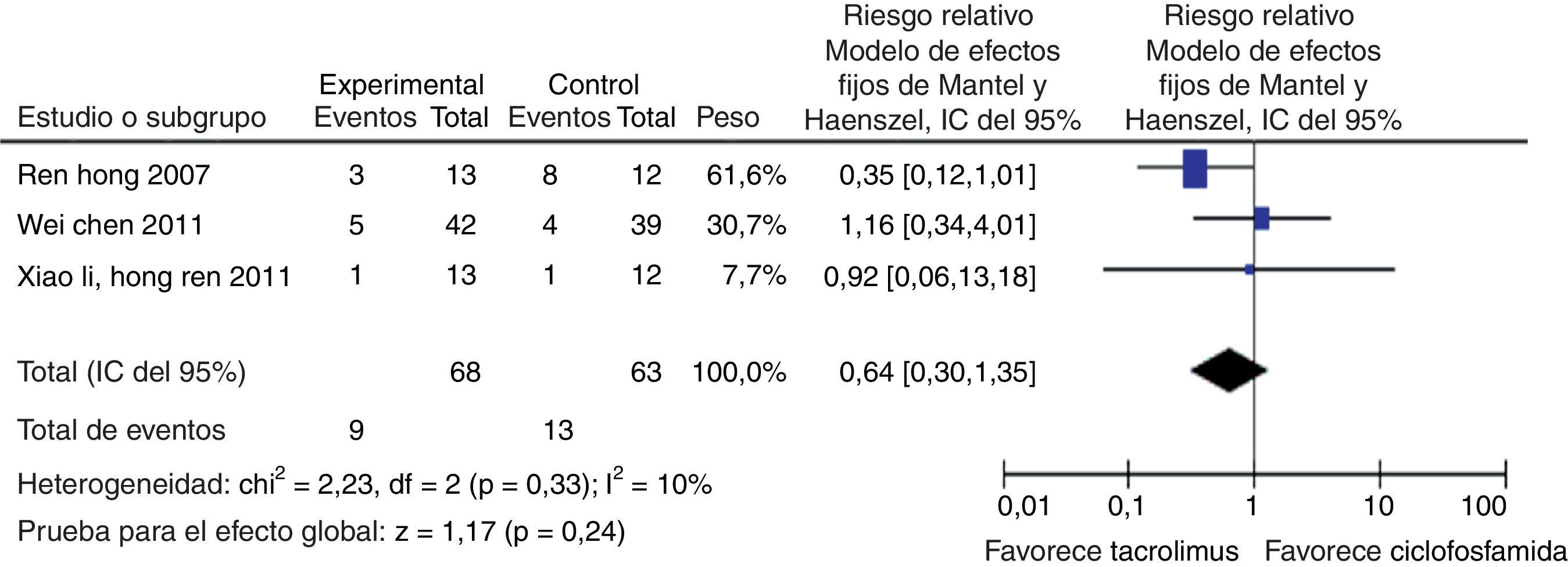
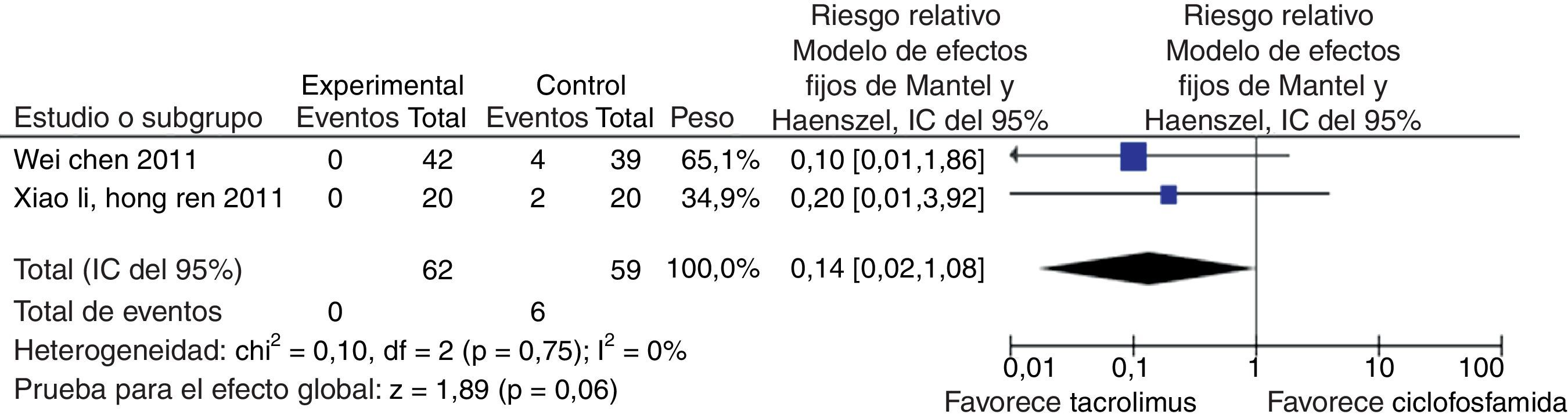
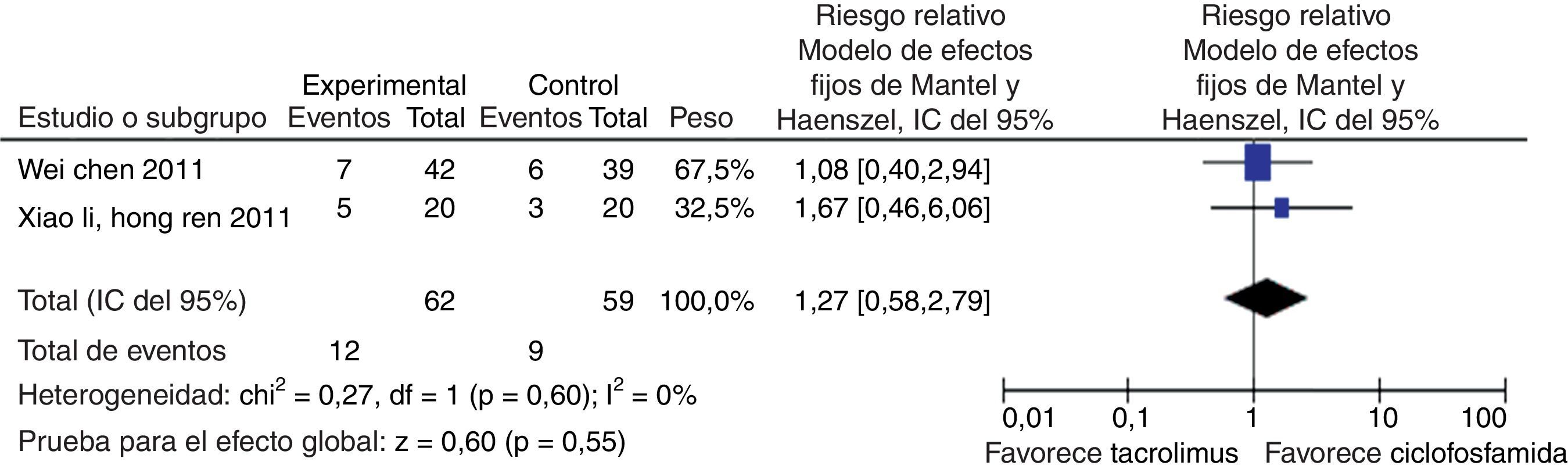
En el desenlace infecciones no se observó una diferencia estadísticamente significativa al comparar tacrolimus con CY (RR: 0,64; IC del 95%: 0,30-1,35) (fig. 12). Al evaluar las tasas de irregularidades menstruales se tuvo un RR de 0,14 e IC del 95%: 0,02-1,08, no siendo estadísticamente significativo (fig. 13); y para la aparición de hiperglucemia tampoco se obtuvo diferencia estadísticamente significativa entre tacrolimus y CY (RR: 1,27; IC del 95%: 0,58-2,79) (fig. 14). El resumen de los desenlaces de tacrolimus vs. CY es mostrado en la tabla 2.
El tratamiento de la NL consiste en una terapia de inducción intensa, seguida de una de mantenimiento de menor intensidad. Hasta el momento el estándar de tratamiento es CY+corticosteroides, sin embargo, hay otras terapias como MF y tacrolimus.
En este metaanálisis se combinaron los datos clínicos obtenidos de 9 experimentos clínicos aleatorizados, que comparaban MF con CY para terapia de inducción en NL. Se encontró que MF tiene similar eficacia que CY en términos de remisión completa y remisión parcial, además no se observó una diferencia significativa en síntomas gastrointestinales, en el riesgo de leucopenia ni en la cantidad de muertes. Se encontró un menor riesgo de infecciones, irregularidades menstruales y riesgo de alopecia en el grupo de MF comparado con el de CY.
Estos resultados son similares a los demás metaanálisis realizados hasta el momento, sin embargo, se observó que uno de los problemas de estos estudios es la heterogeneidad presentada. El estudio de Mak et al., que es metaanálisis y metarregresión, observó que la heterogeneidad está dada por los pacientes afroamericanos19. Mohan y Radhakrishnan realizaron un metaanálisis comparando estudios asiáticos y no asiáticos; en el primero no encontraron una diferencia estadísticamente significativa, pero en el segundo hallaron una respuesta a favor en términos de remisión completa de MF sobre CY20.
En este metaanálisis no fue posible realizar un análisis en cuanto a grupos étnicos, debido a la poca cantidad de estudios que realizaban esta clasificación.
Un inconveniente ha sido la baja calidad de los artículos incluidos en el presente estudio, la mayoría de los artículos no fueron sometidos a enmascaramiento doble y la calidad era evaluada como indeterminada. Otra deficiencia encontrada fue el corto período de seguimiento en los distintos estudios, un máximo de 12 meses.
Para el metaanálisis de tacrolimus vs. CY se combinaron los datos clínicos obtenidos de 3 experimentos clínicos aleatorizados para la terapia de inducción en NL. Se encontró que tacrolimus tiene similar eficacia que CY en términos de remisión completa y remisión parcial; sin embargo, en el desenlace respuesta (remisión parcial+remisión completa) se evidencia un claro beneficio de tacrolimus sobre CY. El único metaanálisis de experimentos clínicos comparando estas 2 terapias fue publicado por Xin y Gu como trabajo de póster en un congreso de la especialidad, el cual demostró mayor eficacia en términos de remisión completa y remisión parcial21.
Una limitación adicional en el presente estudio fue la falta de inclusión de estudios publicados en lengua china, lo que puede explicar las diferencias encontradas entre este estudio y el trabajo de Xin y Gu. Adicionalmente, existen pocos experimentos clínicos aleatorizados que comparen tacrolimus con CY en terapia de inducción de NL, por lo cual la muestra es pequeña y se reduce la validez del metaanálisis.
En los desenlaces infecciones, irregularidades menstruales e hiperglucemia no se evidencia diferencia estadísticamente significativa, lo cual es similar a lo reportado por Xin y Gu21.
Al igual que en el caso de MF, se evidenció un corto período de seguimiento en los 3 experimentos clínicos (6 meses). Además, se pudieron identificar problemas de heterogeneidad en los experimentos clínicos incluidos en el metaanálisis.
ConclusionesEn este metaanálisis se puede concluir que MF es tan efectivo como CY en términos de eficacia en inducir remisión renal, prevención y beneficio en supervivencia en pacientes con NL; sin embargo, se pudo observar una diferencia significativa en cuanto a los efectos indeseables de las 2 terapias, siendo menos probable presentar infecciones, alopecia e irregularidades menstruales en los pacientes tratados con MF.
Además, se concluye que tacrolimus es superior en términos de respuesta (remisión parcial+remisión completa) a CY, sin poder observar ninguna diferencia significativa en cuanto a efectos adversos de alguna de estas 2 terapias.
Se concluye que el tratamiento de NL debe ser individualizado siempre, teniendo en cuenta la experiencia médica, la edad y el género de los pacientes, el grupo étnico al cual pertenecen, la capacidad financiera y los efectos adversos de las distintas modalidades de tratamiento.
Son necesarios más ensayos clínicos aleatorizados con mayor tiempo de seguimiento y análisis de costo-efectividad, para poder dar una directriz en cuanto al tratamiento de los pacientes con NL proliferativa, ya que hasta el momento los resultados no demuestran superioridad significativa de alguna de las terapias existentes.
FinanciaciónEl presente trabajo fue financiado únicamente por sus autores, no tuvo el sostenimiento ni el apoyo financiero de la industria farmacéutica.
Conflicto de interesesLos autores declaran no tener conflicto de intereses en la realización de este trabajo
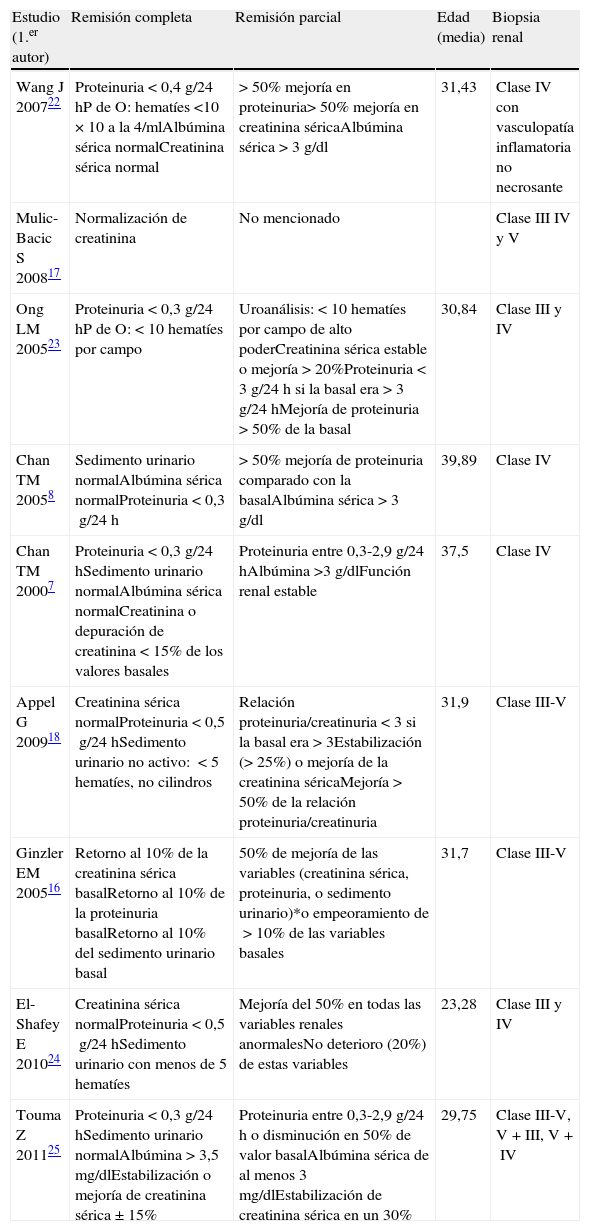
Variables evaluadas en los estudios incluidos (MF con CY)
| Estudio (1.er autor) | Remisión completa | Remisión parcial | Edad (media) | Biopsia renal |
| Wang J 200722 | Proteinuria<0,4g/24hP de O: hematíes<10×10 a la 4/mlAlbúmina sérica normalCreatinina sérica normal | >50% mejoría en proteinuria>50% mejoría en creatinina séricaAlbúmina sérica>3g/dl | 31,43 | Clase IV con vasculopatía inflamatoria no necrosante |
| Mulic-Bacic S 200817 | Normalización de creatinina | No mencionado | Clase III IV y V | |
| Ong LM 200523 | Proteinuria<0,3g/24hP de O:<10 hematíes por campo | Uroanálisis:<10 hematíes por campo de alto poderCreatinina sérica estable o mejoría>20%Proteinuria<3g/24h si la basal era>3g/24hMejoría de proteinuria>50% de la basal | 30,84 | Clase III y IV |
| Chan TM 20058 | Sedimento urinario normalAlbúmina sérica normalProteinuria<0,3g/24h | >50% mejoría de proteinuria comparado con la basalAlbúmina sérica>3g/dl | 39,89 | Clase IV |
| Chan TM 20007 | Proteinuria<0,3g/24hSedimento urinario normalAlbúmina sérica normalCreatinina o depuración de creatinina<15% de los valores basales | Proteinuria entre 0,3-2,9g/24hAlbúmina>3g/dlFunción renal estable | 37,5 | Clase IV |
| Appel G 200918 | Creatinina sérica normalProteinuria<0,5g/24hSedimento urinario no activo: <5 hematíes, no cilindros | Relación proteinuria/creatinuria<3 si la basal era>3Estabilización (>25%) o mejoría de la creatinina séricaMejoría>50% de la relación proteinuria/creatinuria | 31,9 | Clase III-V |
| Ginzler EM 200516 | Retorno al 10% de la creatinina sérica basalRetorno al 10% de la proteinuria basalRetorno al 10% del sedimento urinario basal | 50% de mejoría de las variables (creatinina sérica, proteinuria, o sedimento urinario)*o empeoramiento de>10% de las variables basales | 31,7 | Clase III-V |
| El-Shafey E 201024 | Creatinina sérica normalProteinuria<0,5g/24hSedimento urinario con menos de 5 hematíes | Mejoría del 50% en todas las variables renales anormalesNo deterioro (20%) de estas variables | 23,28 | Clase III y IV |
| Touma Z 201125 | Proteinuria<0,3g/24hSedimento urinario normalAlbúmina>3,5mg/dlEstabilización o mejoría de creatinina sérica±15% | Proteinuria entre 0,3-2,9g/24h o disminución en 50% de valor basalAlbúmina sérica de al menos 3mg/dlEstabilización de creatinina sérica en un 30% | 29,75 | Clase III-V, V+III, V+IV |
| Intervención | N.o pacientes | Seguimiento (meses) | % Hombres | |
| Wang J 200722 | MF 1,5-2g/d+esteroidesCY 0,75-1g/m2 mensual+esteroides | 911 | 6 | – |
| Mulic-Bacic S 200817 | MF 2g/d+esteroidesCY 0,5g/m2 mensual+esteroides | 2520 | 6 | – |
| Ong LM 200523 | MF 2g/d+esteroidesCY 0,75-1g/m2 mensual+esteroides | 1925 | 6 | 15,9 |
| Chan TM 20058 | MF 2g/d+esteroidesCY oral 2,5mg/kg/d+esteroides | 3331 | 12 | 18,75 |
| Chan TM 20007 | MF 2g/d+esteroidesCY oral 2,5mg/kg/d+esteroides | 2121 | 12 | 4,76 |
| Appel G 200918 | *MF 1-3g/d+esteroidesCY 0,75-1g/m2 mensual+esteroides | 185185 | 12 | 15,4 |
| Ginzler EM 200516 | MF 1-3g/d+esteroidesCY 0,75-1g/m2 mensual+esteroides | 7169 | 6 | 10 |
| El-Shafey E 201024 | MF 2g/d+esteroidesCY 0,5-1g/m2 mensual+esteroides | 2423 | 6 | 4,2 |
| Touma Z 201125 | MF 1,5-2g/d+esteroidesCY 0,5-0,75g/m2 mensual+esteroides | 2020 | 6 | 11,65 |
CY: ciclofosfamida; MF: micofenolato.
Variables evaluadas en los estudios incluidos (tacrolimus con CY)
| Estudio (1.er autor) | Remisión completa | Remisión parcial | Edad (media) | Biopsia renal |
| Chen W 201126 | Proteinuria<0,3g/24 hSedimento urinario normalAlbúmina sérica normalCreatinina sérica normal | Proteinuria entre 0,3 a 2,9g/24hFunción renal estableAlbúmina sérica de al menos 3g/dl | 32±10 | Clase III, IV, V+III y V+IV |
| Hong R 200727 | Proteinuria<0,4g/24hAlbúmina sérica normalCreatinina sérica normalSedimento urinario normal | Proteinuria entre 0,4 y 2g/24hAlbúmina entre 3 y 3,5g/dlCreatinina sérica entre 0 y 50% del rango de normalidad | 30,7±5 | Clase IV (OMS) |
| Li X 201128 | Albúmina sérica normalProteinuria<0,3g/24hSedimento urinario normalEstabilización±15% o mejoría de la creatinina sérica basal | Proteinuria entre 0,3 a 2,9g/24hEstabilización±creatinina sérica basalAlbúmina sérica de al menos 3g/dl | 28 | Clase III, IV, V+III y V+IV |
| Intervención | N.o pacientes | Seguimiento (meses) | % Hombres | |
| Chen W 201126 | Tacrolimus: 0,05mg/kg/d dividido en 2 dosis+esteroidesCY 0,75-1g/m2 mensual+esteroides | 4239 | 6 | 14,8% |
| Hong R 200727 | Tacrolimus: 0,1mg/kg/d dividido en 2 dosis+esteroidesCY 0,5-0,75g/m2 mensual+esteroides | 1312 | 6 | – |
| Li X 201128 | Tacrolimus: 0,08-0,1mg/kg/d dividido en 2 dosis+esteroidesCY 0,5-0,75g/m2 mensual+esteroides | 2020 | 6 | 11,65 |
CY: ciclofosfamida.