La polimialgia reumática es una enfermedad inflamatoria crónica común en la población geriátrica. Su cuadro clínico se caracteriza por dolor en la cintura escapular, región cervical y caderas, asociado frecuentemente a rigidez de estas áreas articulares posterior a periodos de reposo. El diagnóstico de esta patología es clínico y debe hacerse posterior a descartar otras entidades como artritis reumatoide o espondiloartropatía de aparición tardía. Hasta el momento, no hay criterios de clasificación estandarizados y aceptados, por lo que recientemente se desarrollaron unos criterios provisionales por parte del Colegio Americano de Reumatología y de la Liga Europea Contra el Reumatismo. La polimialgia reumática se asocia hasta en un 30% de los pacientes con arteritis de células gigantes. El principal tratamiento es con dosis bajas de glucocorticoides, con lo cual los pacientes presentan rápida mejoría sintomática.
Polymyalgia rheumatica is an inflammatory disease common in the geriatric population. The clinical profile is characterized by pain, mainly in the shoulder girdle, hip and cervical region. The diagnosis of this disease is clinical, and should be made to rule out another diseases such as late onset rheumatoid arthritis and spondyloarthritis. Although no standardized classification criteria have been accepted, although there are some, yet to be evaluated, provisional classification criteria that have recently been developed by the American College of Rheumatology and European League Against Rheumatism. The polymyalgia rheumatica is associated with up to 30% of patients with giant cell arteritis. The main treatment is low-dose glucocorticoids, with which patients have rapid symptomatic improvement.
Se realizó una búsqueda de literatura en las siguientes bases de datos: Medline, colaboración Cochrane y CRD Data base. La búsqueda se restringió a los idiomas inglés y español, artículos tipo revisión de tema, revisión sistemática y artículos originales que hubiesen sido publicados hasta marzo de 2014. Los términos mesh empleados fueron los siguientes: «polymyalgia rheumatica”[Mesh], «glucocorticoids»[Mesh], «Myalgia»[Mesh]. Se utilizaron los operadores booleanos AND/OR para cada uno de los términos. Se obtuvieron 171 artículos, de los cuales se escogieron 53 por consenso del grupo de autores, considerándose que estos brindaban información acerca de los tópicos necesarios para realizar la presente revisión. Con base en la información obtenida se realizó una revisión narrativa acerca del diagnóstico y tratamiento de la polimialgia reumática (PMR) (fig. 1).
EpidemiologíaLa PMR es una enfermedad típica de pacientes ancianos. Se produce casi exclusivamente en mayores de 50 años y la edad promedio de inicio es de 73 años1. Su prevalencia se estima en 700/100.000 habitantes mayores de 50 años2. Setecientas once mil personas en Estados Unidos presentan la enfermedad y la tasa de incidencia es de 58,7 personas por cada 100.000 personas/año3. Su incidencia se incrementa con la edad y varía según la región geográfica estudiada, encontrando mayor incidencia en países escandinavos y en personas descendientes del norte de Europa1,4. Durante el primer año de diagnóstico, los pacientes utilizan más los servicios de salud y están propensos a infarto del miocardio, enfermedad arterial periférica y eventos cerebrovasculares5.
La PMR se asocia con arteritis de células gigantes en el 30% de los pacientes. Clínicamente, 40-60% de los pacientes con arteritis de células gigantes tienen síntomas de PMR en el momento del diagnóstico6. La PMR y la arteritis de células gigantes tienen muchas similitudes (edad de inicio, predominio en mujeres, distribución geográfica similar y, en ambas, documentación de un estado inflamatorio crónico), lo cual sugiere que las dos entidades podrían representar diferentes tipos de una misma enfermedad.
EtiopatogeniaLa causa de la PMR es desconocida y se ignora la razón de su mayor frecuencia entre la población geriátrica. En la patogénesis de la enfermedad los estudios sugieren una base genética asociada a factores ambientales7. Dentro de los polimorfismos genéticos relacionados con la regulación inmune y asociados con riesgo y gravedad de la enfermedad, se encuentran: la molécula de adhesión intercelular 1, los antagonistas del receptor de interleucina 1 y la interleucina 68,9. La asociación con algunos antígenos, como el HLA DR4 y HLA DRB1, así como con agentes infecciosos, tales como Mycoplasma pneumoniae, parvovirus B19 y Chlamydia pneumoniae, tienen resultados controversiales en los estudios y no pueden ser justificados aun dentro de la patogénesis de la enfermedad10.
Se ha documentado como un importante mecanismo en la fisiopatología de la PMR, el aumento en la producción local de citocinas proinflamatorias detectadas en el intersticio de los músculos y en sangre de pacientes con la enfermedad, principalmente interleucina 6 y cuyos valores disminuyen de forma significativa con la remisión de los síntomas, posterior al tratamiento con corticosteriodes11. Así mismo, el proceso de endocrino-senescencia que produce disminución en los niveles de dehidroepiandrosterona o androstenodiona y las alteraciones en el eje hipotalámico-pituitario-gonadal con insuficiencia adrenal y disminución de la secreción de cortisol en respuesta al estado inflamatorio, se han postulado como mecanismos etiopatogénicos de importancia12.
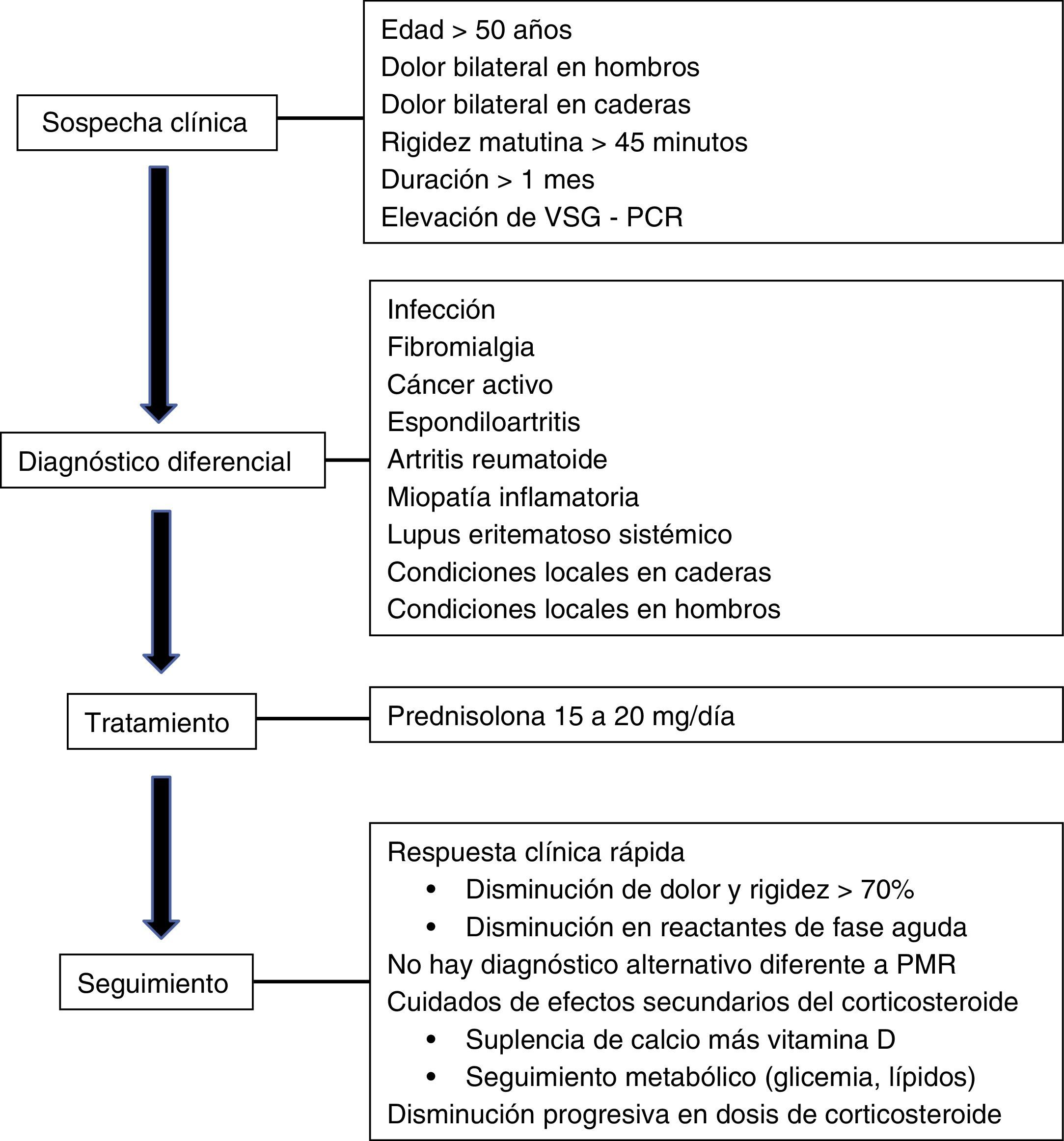
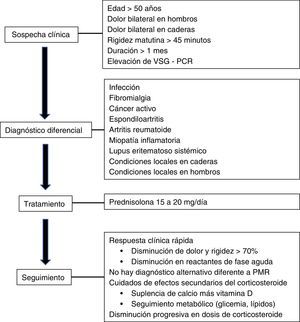
Manifestaciones clínicasLa PMR se caracteriza por dolor y rigidez de la cintura escapular, pélvica y región cervical. El cuadro clínico característico es, por lo general, de duración mayor a un mes, consistente en dolor en la cintura escapular, bilateral, de predominio nocturno, que aumenta con el reposo, asociado a rigidez matinal que dificulta la realización de las actividades de la vida diaria, acompañándose de síntomas constitucionales como fatiga, malestar general, anorexia, pérdida de peso y fiebre que pueden ocurrir en el 40-50% de los pacientes13.
Dada la asociación entre la PMR y la arteritis de células gigantes, es obligado identificar síntomas tales como cefalea, claudicación mandibular, sensibilidad del cuero cabelludo, carotidinia, alteraciones visuales y claudicación de extremidades14.
En el examen físico se puede encontrar rigidez y dolor en cintura escapular con incapacidad del individuo para la elevación activa de las extremidades superiores, mientras que la movilización pasiva es normal. Adicionalmente, puede aparecer dolor en la palpación de los músculos sin tumefacción articular y la sinovitis articular puede verse en el 25% de los pacientes, la cual es transitoria, oligoarticular, de articulaciones periféricas, principalmente compromiso de rodillas, carpos y metacarpofalángicas, de intensidad leve a moderada y sin producción de erosiones ni destrucción articular15.
DiagnósticoEl diagnóstico de la PMR es fundamentalmente clínico. Se debe realizar una exhaustiva historia clínica y un cuidadoso examen físico para distinguirla de otras entidades (tabla 1).
Diagnóstico diferencial de la polimialgia reumática
| Enfermedades reumáticas |
| Artritis reumatoide |
| Espondiloartropatías |
| Artritis por cristales |
| Lupus eritematoso sistémico |
| Vasculitis |
| Miopatías inflamatorias |
| Enfermedades musculoesqueléticas no inflamatorias |
| Fibromialgia |
| Capsulitis adhesiva |
| Enfermedad articular degenerativa |
| Enfermedad del manguito rotador |
| Endocrinopatías |
| Enfermedades tiroideas |
| Alteraciones de la glándula paratiroidea |
| Infecciones |
| Virales |
| Bacterias |
| Micobacterias |
| Enfermedades malignas |
| Sólidas, hematológicas |
| Misceláneos |
| Parkinsonismo |
| Depresión |
| Hipovitaminosis D |
| Drogas inductoras de miopatía. Ej. estatinas |
En la literatura se mencionan varios criterios de clasificación de PMR (Bird, Jones y Hazleman, Chuang y Healey) ninguno de los cuales ha logrado estandarización y aceptación13,16,17. Con el objetivo de lograr unos mejores criterios clasificatorios de PMR, se desarrolló una iniciativa internacional a cargo de la Liga Europea Contra el Reumatismo y del Colegio Americano de Reumatología, entidades que desarrollaron unos criterios de clasificación provisional que se publicaron en abril de 201218 (tabla 2). Estos criterios no han sido validados como criterios diagnósticos pues se trata de criterios de clasificación, útiles para distinguir la polimialgia de otros trastornos y su aplicabilidad está orientada, fundamentalmente, al campo de la investigación. Se reporta una sensibilidad de 66% y especificidad de 81% para discriminar pacientes con la enfermedad, comparados con sujetos control19.
Criterios provisionales de clasificación de polimialgia reumática
| Criterios clínicos |
| Rigidez matinal >45 minutos 2 |
| Dolor o limitación en cadera 1 |
| FR o anti CCP negativo 2 |
| Ausencia de otra afección articular 1 |
| Criterios ultrasonográficos |
| Al menos un hombro con bursitis subdeltoidea o tenosinovitis bicipital o sinovitis 1 glenohumeral y al menos una cadera con sinovitis o bursitis trocantérica |
| Ambos hombros con bursitis subdeltoidea, tenosinovitis bicipital o sinovitis glenohumeral 1 |
| Criterios requeridos: edad ≥50 años, dolor de hombros bilateral, aumento de VSG o PCR |
| Con solo criterios clínicos una puntuación ≥4 tiene una sensibilidad de 68% y una especificidad de 78% para diferenciar PMR de otros trastornos |
| Con la combinación de criterios clínicos y ecográficos una puntuación ≥5 tiene una sensibilidad de 66% y especificidad de 81% para diferenciar PMR de otros trastornos |
Los hallazgos de laboratorio son inespecíficos y similares a los de un proceso de inflamación sistémica. Lo más característico es la elevación de la velocidad de sedimentación globular por encima de 40mm/h, sin embargo, valores bajos (≤30mm/h) o normales han sido reportados en 6-20% de los pacientes con la enfermedad20,21. La proteína C reactiva es un marcador más sensible de inflamación en esta patología22,23. El factor reumatoide, los anticuerpos antinucleares y los anticuerpos contra el péptido cíclico citrulinado son negativos y su positividad debe hacer reconsiderar el diagnóstico24.
En cuanto a las imágenes diagnósticas, la radiología convencional de las articulaciones afectadas suele ser normal, lo cual también sucede con los estudios electromiográficos. La ultrasonografía frecuentemente detecta anormalidades de las estructuras periarticulares y, de acuerdo con los nuevos criterios clasificatorios, mejora la especificidad para la clasificación de PMR (tabla 2), siendo de utilidad en casos de pacientes con polimialgia y marcadores inflamatorios normales25.
La resonancia nuclear magnética muestra anormalidades de estructuras periarticulares tales como bursitis subdeltoidea, subacromial y trocantérica, así como sinovitis26.
El Pet Scan es un estudio costoso y no se usa de rutina en pacientes con PMR. Se puede usar en la valoración en pacientes con síntomas inexplicados o refractarios y sospecha de neoplasia oculta o vasculitis27.
La biopsia sinovial demuestra sinovitis, en menor grado que en la artritis reumatoide. La biopsia de arteria temporal no está indicada de rutina y debe realizarse solamente ante sospecha de arteritis de células gigantes6.
TratamientoEl tratamiento de elección en PMR son los glucocorticoides en dosis bajas, con los que se logra una rápida resolución de los síntomas, por lo general entre 24 a 72 horas, siendo considerados, incluso, como una prueba terapéutica para ayudar a confirmar el diagnóstico, dada la excelente y rápida respuesta que usualmente tienen los pacientes con este tipo de tratamiento.
La dosis recomendada es de 15 a 20mg de prednisolona/día. Dosis altas rara vez son necesarias a menos que exista sospecha de arteritis de células gigantes28. La dosis inicial de glucocorticoides debe mantenerse durante 2 a 4 semanas, para reducirla lentamente a razón de 2,5mg cada 2 a 4 semanas hasta una dosis de 10mg/día; esta dosis se utiliza como mantenimiento durante un mes, con posteriores reducciones progresivas en la dosis hasta suspenderla28,29.
La mayoría de los pacientes requieren tratamiento durante 12 a 24 meses. En ocasiones, tras la reducción de la dosis, reaparecen los síntomas, requiriendo aumentar nuevamente la dosis hasta llegar a la que elimine los síntomas y, en algunos casos, dosis bajas de glucocorticoides a largo plazo podrían ser necesarias para prevenir estas recaídas. En los casos leves o en pacientes con varias comorbilidades, la metilprednisolona intramuscular a dosis inicial de 120mg cada 3 a 4 semanas, durante 3 meses, seguida de una reducción de 20mg cada 2 a 3 meses puede ser considerada30,31. Junto con la respuesta clínica, los marcadores de inflamación también se deben normalizar en pocas semanas de iniciado el tratamiento, si esto no sucede deben considerarse otros diagnósticos.
El uso crónico de glucocorticoides aumenta el riesgo de osteoporosis32,33, por lo que en los pacientes ancianos está indicado administrar tratamiento profiláctico para pérdida de masa ósea con calcio y vitamina D, así como terapia con bisfosfonatos en pacientes de alto riesgo34,35.
En cuanto al uso de inmunomoduladores en pacientes con PMR y alto riesgo de desarrollar efectos adversos relacionados con el uso crónico de glucocorticoides o en pacientes con enfermedad recurrente, podría considerarse su uso36,37.
El más estudiado de los antirreumáticos en PMR es el metotrexate, sin embargo, debe tenerse en cuenta que este medicamento ha sido probado en 3 ensayos clínicos aleatorizados, encontrándose resultados diferentes; en 2 estudios se demostró eficacia38,39 y en el tercero no se logró probar un efecto ahorrador de corticosteroides40. En cuanto a azatioprina solo se dispone de un estudio, el cual se realizó en forma aleatorizada, doble ciego y controlado con placebo, demostrándose una disminución en la dosis de prednisolona a la semana 52, pero con un incremento en la frecuencia de efectos adversos relacionados con la azatioprina, pero debe tenerse en cuenta que se trató de un estudio pequeño (31 pacientes) y solo el 65% de los sujetos en estudio completaron el tiempo de seguimiento41.
Por otra parte, hasta el momento no existe evidencia que recomiende el uso de terapia biológica, pero se investiga su uso en pacientes con recaídas, como es el caso de infliximab, el cual se probó en un ensayo clínico, multicéntrico, aleatorizado, comparado con placebo en 40 pacientes con PMR, a quienes se les administró infliximab y prednisolona vs. placebo y prednisolona, documentándose igual tasa de recaídas en ambos grupos42. Otros blancos terapéuticos para terapias biológicas están siendo actualmente investigados, como es el caso de terapias contra la IL-1, IL-6 e IL-17.
PronósticoLa calidad de vida de los pacientes con PMR usualmente se ve comprometida desde el comienzo de la enfermedad, pero mejora sustancialmente con el inicio del tratamiento43,44. La respuesta al tratamiento se valora teniendo en cuenta la mejoría sintomática y de los marcadores de inflamación. Se debe tener en cuenta que el 50% de los pacientes puede presentar recaídas45,46. El tratamiento inicial con dosis altas de esteroides o su rápido retiro, el sexo femenino y los niveles elevados de PCR e IL 6 se asocian con riesgo de recaídas47,48. Por otra parte, el aumento en el riesgo de enfermedad vascular periférica genera la posibilidad de complicaciones vasculares49, sin embargo, la supervivencia de los pacientes con PMR es similar a la de la población general50,51.
ConclusiónLa PMR es una enfermedad inflamatoria de causa desconocida, muy rara en personas menores de 50 años. La incidencia aumenta con la edad con un pico en personas entre 70 y 80 años, por lo cual debe sospecharse en todo paciente anciano con dolor osteomuscular en la cintura escapular o pélvica. No hay exámenes específicos de la enfermedad y el diagnóstico se fundamenta en la presentación clínica y la usual elevación de los reactantes de fase aguda (fig. 1). Se debe tener en cuenta su asociación frecuente con arteritis de células gigantes. Finalmente, cabe recordar que el diagnóstico de PMR es de exclusión, es decir, primero deben considerarse y descartarse otras enfermedades que pueden presentar sintomatología similar tales como artritis reumatoide y espondiloartropatías de aparición tardía, enfermedades malignas, enfermedades metabólicas e infecciosas. El tratamiento se basa en el uso de corticoides, a dosis bajas, con los cuales la mejoría clínica suele ser rápida y marcada (fig. 2).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.