Colombia es un país endémico para tuberculosis (TB), con una prevalencia de 26 casos por millón. Sin embargo, no se cuenta con datos recientes y claros respecto a la prevalencia de tuberculosis latente (TBL) en la población con artritis reumatoide (AR) candidata a terapia biotecnológica.
MetodologíaEstudio de corte transversal con componente analítico para determinar la prevalencia de TBL en pacientes con AR candidatos a terapia biotecnológica.
ResultadosLa prevalencia de TBL en pacientes con AR candidatos a terapia biotecnológica es alta, del 18,3% (IC 95% 14,7-21,9), y en los cruces exploratorios se encontró una relación entre TBL y la variable género masculino (p≤0,001), hallazgos anormales en la radiografía de tórax (p=0,039) y el tabaquismo (p=0,028).
ConclusiónLa prevalencia de TBL en pacientes con AR candidatos a terapia biotecnológica es alta. Se requieren estudios prospectivos para evaluar la incidencia de TB en este grupo de pacientes y así corroborar su asociación.
Although tuberculosis (TB) is endemic in Columbia, with a prevalence of 26 cases per million, there are no recent and clear data regarding the prevalence of latent tuberculosis (LBT) in the population with rheumatoid arthritis (RA), candidates for biotechnological therapy.
MethodologyA cross-sectional study with an analytical component to determine the prevalence of LBT in patients with RA who are candidates for biotechnological therapy.
ResultsThe prevalence of LTB in RA patients who are candidates for biotechnological therapy is high, 18.3% (95% CI: 14.7-21.9). In the exploratory analysis, a relationship between LBT and male gender was found (P<.001), as well as abnormal findings on chest radiography (P=.039), and smoking (P=.028).
ConclusionThe prevalence of LTB in patients with RA who are candidates for biotechnological therapy is high. Prospective studies are needed to evaluate the incidence of TB in this group of patients and corroborate this association.
La tuberculosis (TB) afecta a un tercio de la población mundial, es una emergencia sanitaria global declarada por la Organización Mundial de la Salud (OMS) desde 1993, y Colombia es un país endémico de esta enfermedad. La incidencia de todas las formas de TB en Colombia es de 26 casos por 100.000 habitantes1, el 81% corresponde a la forma pulmonar y el 19% restante a formas extrapulmonares2. En el caso específico de la tuberculosis latente (TBL), que se presenta en personas sin signos ni síntomas, no suele haber reporte y los datos epidemiológicos disponibles de prevalencia son determinados principalmente por estudios de investigación en poblaciones especiales3.
Existen múltiples grupos poblacionales considerados de alto riesgo, en los cuales la prevalencia de TBL y su progresión a TB activa es mayor, entre los cuales se destacan: individuos sanos en contacto estrecho con casos de TB, trabajadores de la salud, infección por virus de inmunodeficiencia humana (VIH), terapia dialítica, usuarios de drogas endovenosas, prisioneros, trasplantados, diabetes mellitus (DM), alcohólicos, fumadores, sujetos obesos y pacientes en terapia con agentes antifactor de necrosis tumoral (anti-TNF)3. Hay pocos estudios acerca de la prevalencia de TBL en pacientes con artritis reumatoide (AR) que serán llevados a terapia biotecnológica; en Latinoamérica, la mayoría de los estudios se han realizado en Brasil, país endémico para TB, y han reportado prevalencias que van desde el 4% hasta el 32,7%4,5.
En países endémicos como Colombia se realiza derivado proteico purificado (PPD, por sus siglas en inglés) a todos los pacientes con AR que van a ser llevados a terapia biotecnológica, con independencia del mecanismo de acción del medicamento que se inicie. No obstante, aunque se dispone de algunos datos epidemiológicos que estiman incidencia, prevalencia y mortalidad de TBL a escala mundial, en Colombia no se cuenta con información reciente y suficiente que permita cuantificar y calcular la magnitud de esta condición. De igual manera, no se conoce el comportamiento de la TBL en grupos poblacionales de riesgo, como lo son aquellos individuos con enfermedades reumatológicas. Por tal razón, este trabajo busca determinar la prevalencia de TBL en una población específica (pacientes candidatos a terapia biotecnológica) con AR.
MetodologíaEstudio de corte transversal para determinar la prevalencia de TBL en una población con AR, cuyos integrantes son candidatos a inicio de terapia biotecnológica, en 2 centros clínicos de tercer nivel entre los años 2015 y 2018.
Se incluyó a pacientes mayores de 18 años con diagnóstico de AR, de acuerdo con los criterios del American College of Rheumatology (ACR) 2010, con registro de PPD previamente al inicio de la terapia biotecnológica, radiografía de tórax reportada y registro en la historia clínica del reporte completo de PPD. Los criterios de exclusión incluyeron la presencia de otras enfermedades autoinmunes diferentes a síndrome de Sjögren, pacientes que hubieran recibido tratamiento para TBL o TB activa antes de la toma de la PPD y pacientes con diagnóstico de TB activa en la historia clínica.
El diagnóstico de TBL se determinó con un resultado de la primera PPD registrada mayor de 5mm, en el contexto de pacientes inmunosuprimidos, de conformidad con las recomendaciones vigentes6,7. En los anteriores grupos debía presentarse la ausencia de síntomas o signos de TB activa (ausencia de síntomas respiratorios, radiografía de tórax normal o con nódulo pulmonar benigno o hallazgos no sugestivos de compromiso intersticial o alveolar agudo). Las variables incluidas en el estudio fueron diámetro de PPD, valor de ensayo de liberación de interferón gamma (IGRA, por sus siglas en inglés), hallazgos en la radiografía de tórax, tratamiento y actividad de la AR medida por Disease Activity Score (DAS) 28, factor reumatoide (FR), anticuerpos anticitrulina (anti-CCP) y comorbilidades.
El tamaño de muestra se calculó con la fórmula para un intervalo de confianza (IC) de una proporción; considerando un tamaño poblacional de 2.562 pacientes con AR, para una proporción esperada del 50%, nivel de confianza del 95% y precisión absoluta del 5%, se requirió un mínimo de 335 sujetos. Inicialmente, se realizó un muestreo aleatorio simple del listado de historias clínicas obtenidas en la búsqueda en el sistema de información. Las historias clínicas aleatorizadas que no cumplían con los criterios de inclusión fueron reemplazadas.
Los datos se recolectaron directamente de las historias clínicas de los pacientes, por parte de personal capacitado con conocimiento del diagnóstico y del manejo de la patología de estudio. Estos datos fueron transcritos a un formulario electrónico de manera anonimizada que finalmente los transfería a una hoja de cálculo de Microsoft Excel.
Análisis de datosUna vez se completó la recolección de datos, estos se analizaron en el programa SPSS20, licenciado por la Universidad de La Sabana, Bogotá, Colombia. Se realizó un análisis descriptivo en el cual las variables cualitativas se resumieron en frecuencias y porcentajes y las variables cuantitativas en promedios y desviación estándar, si su distribución fue normal, o mediana y rango intercuartil si la distribución fue no normal.
Se consideró como caso positivo una PPD mayor de 5mm y se dividió el número de casos positivos sobre el total de sujetos evaluados para el cálculo de prevalencia. Asimismo, se describió la prevalencia de TBL por comorbilidad (DM) y tabaquismo, para lo cual se realizaron cruces exploratorios adicionales entre estas variables y el sexo, hallazgos radiológicos y tratamiento con la presencia o no de TBL. A estos efectos se consideró una p estadísticamente significativa menor de 0,05 y se calculó el intervalo de confianza para la prevalencia general.
La autorización para el desarrollo del presente estudio y la revisión de las historias clínicas fueron evaluadas y aprobadas por el Comité de Investigación de la Universidad de La Sabana y los comités de ética de cada institución.
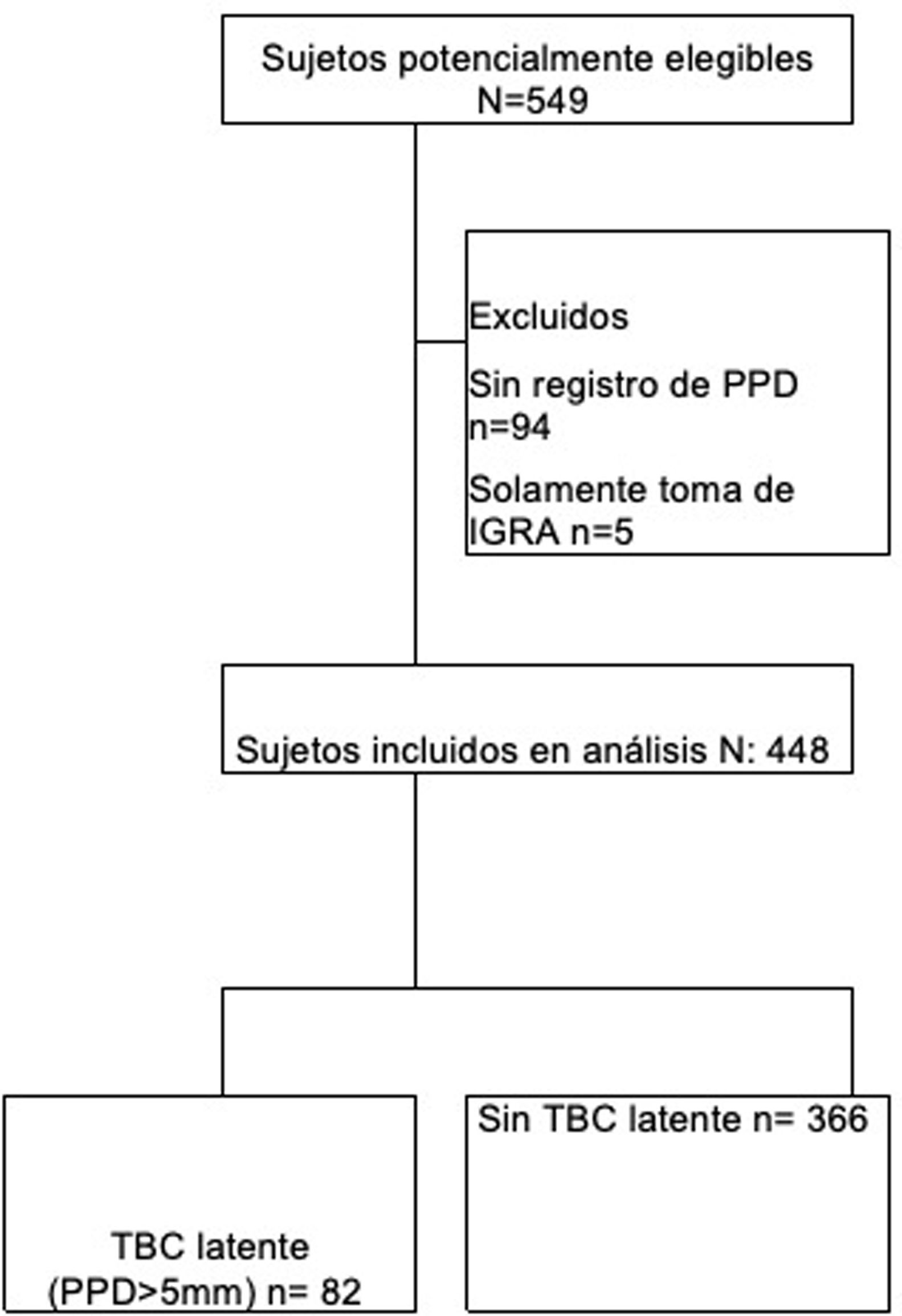
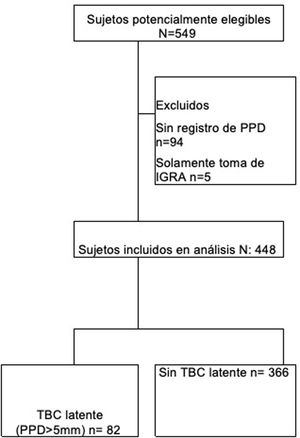
ResultadosSe recolectaron 549 pacientes de los 2 centros de estudio, de los cuales se excluyeron 101, ya que 94 carecían de registro de PPD y 5 solamente tenían registro de IGRA. Por consiguiente, ingresaron al análisis 448 pacientes (fig. 1). El promedio de edad fue de 55 años y el 80% de los pacientes fueron mujeres; la presencia de comorbilidades en los sujetos estudiados fue menor del 15% (tabla 1).
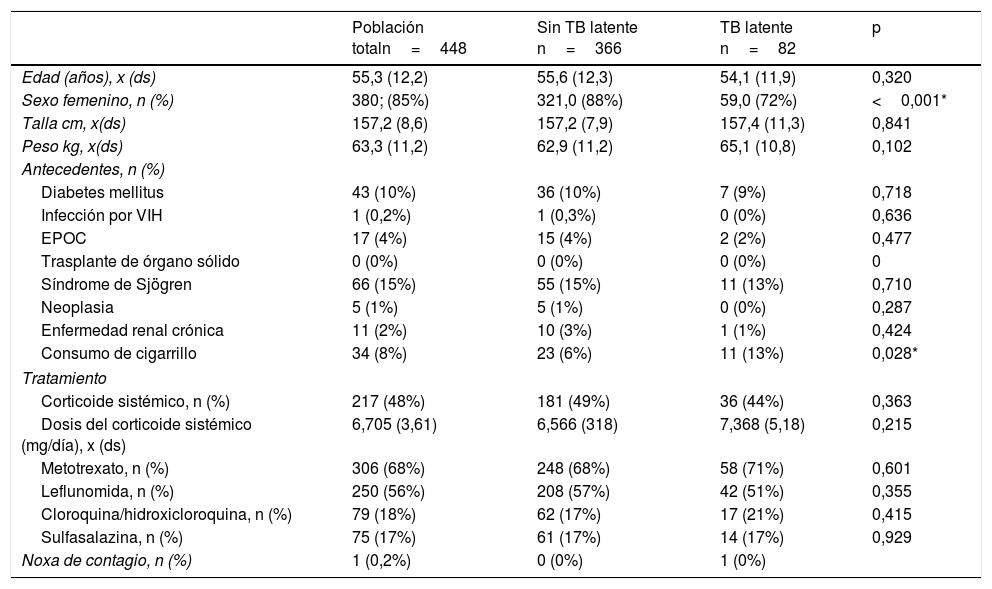
Características generales de la población total, sujetos con tuberculosis latente y sin tuberculosis latente
| Población totaln=448 | Sin TB latente n=366 | TB latente n=82 | p | |
|---|---|---|---|---|
| Edad (años), x (ds) | 55,3 (12,2) | 55,6 (12,3) | 54,1 (11,9) | 0,320 |
| Sexo femenino, n (%) | 380; (85%) | 321,0 (88%) | 59,0 (72%) | <0,001* |
| Talla cm, x(ds) | 157,2 (8,6) | 157,2 (7,9) | 157,4 (11,3) | 0,841 |
| Peso kg, x(ds) | 63,3 (11,2) | 62,9 (11,2) | 65,1 (10,8) | 0,102 |
| Antecedentes, n (%) | ||||
| Diabetes mellitus | 43 (10%) | 36 (10%) | 7 (9%) | 0,718 |
| Infección por VIH | 1 (0,2%) | 1 (0,3%) | 0 (0%) | 0,636 |
| EPOC | 17 (4%) | 15 (4%) | 2 (2%) | 0,477 |
| Trasplante de órgano sólido | 0 (0%) | 0 (0%) | 0 (0%) | 0 |
| Síndrome de Sjögren | 66 (15%) | 55 (15%) | 11 (13%) | 0,710 |
| Neoplasia | 5 (1%) | 5 (1%) | 0 (0%) | 0,287 |
| Enfermedad renal crónica | 11 (2%) | 10 (3%) | 1 (1%) | 0,424 |
| Consumo de cigarrillo | 34 (8%) | 23 (6%) | 11 (13%) | 0,028* |
| Tratamiento | ||||
| Corticoide sistémico, n (%) | 217 (48%) | 181 (49%) | 36 (44%) | 0,363 |
| Dosis del corticoide sistémico (mg/día), x (ds) | 6,705 (3,61) | 6,566 (318) | 7,368 (5,18) | 0,215 |
| Metotrexato, n (%) | 306 (68%) | 248 (68%) | 58 (71%) | 0,601 |
| Leflunomida, n (%) | 250 (56%) | 208 (57%) | 42 (51%) | 0,355 |
| Cloroquina/hidroxicloroquina, n (%) | 79 (18%) | 62 (17%) | 17 (21%) | 0,415 |
| Sulfasalazina, n (%) | 75 (17%) | 61 (17%) | 14 (17%) | 0,929 |
| Noxa de contagio, n (%) | 1 (0,2%) | 0 (0%) | 1 (0%) | |
%: porcentaje; ds: desviación estándar; n: número; x: promedio.
Los títulos de anticuerpos anticitrulina (anti-CCP) fueron en promedio de 279U, con un porcentaje de títulos débiles del 3,5%, moderados 4,38% y fuertes 72,8%. El factor reumatoide (FR) fue positivo (>20UI/mL) en el 86,8% de los pacientes. El 53,3% del total de la muestra se encontraba en remisión por DAS 28. Únicamente 17 pacientes contaban con IGRA, cuyo valor promedio fue de 0,17 (negativo) (tabla 2).
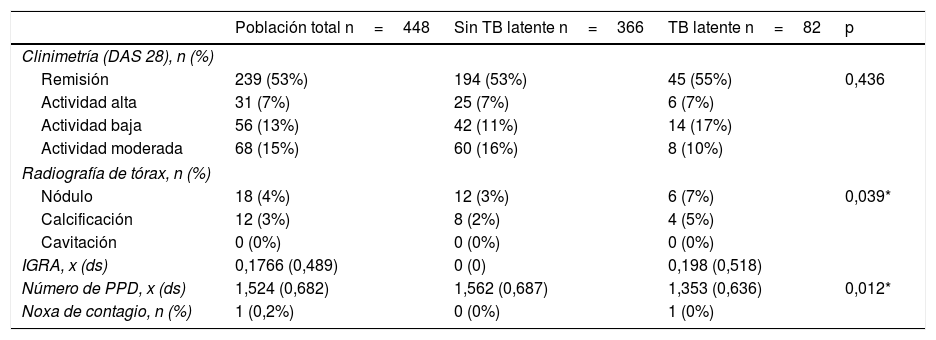
Características de clinimetría y paraclínicos en la población general, sujetos con tuberculosis latente y sin tuberculosis latente
| Población total n=448 | Sin TB latente n=366 | TB latente n=82 | p | |
|---|---|---|---|---|
| Clinimetría (DAS 28), n (%) | ||||
| Remisión | 239 (53%) | 194 (53%) | 45 (55%) | 0,436 |
| Actividad alta | 31 (7%) | 25 (7%) | 6 (7%) | |
| Actividad baja | 56 (13%) | 42 (11%) | 14 (17%) | |
| Actividad moderada | 68 (15%) | 60 (16%) | 8 (10%) | |
| Radiografía de tórax, n (%) | ||||
| Nódulo | 18 (4%) | 12 (3%) | 6 (7%) | 0,039* |
| Calcificación | 12 (3%) | 8 (2%) | 4 (5%) | |
| Cavitación | 0 (0%) | 0 (0%) | 0 (0%) | |
| IGRA, x (ds) | 0,1766 (0,489) | 0 (0) | 0,198 (0,518) | |
| Número de PPD, x (ds) | 1,524 (0,682) | 1,562 (0,687) | 1,353 (0,636) | 0,012* |
| Noxa de contagio, n (%) | 1 (0,2%) | 0 (0%) | 1 (0%) | |
%: porcentaje; ds: desviación estándar; n: número; x: promedio.
Con respecto al manejo farmacológico, el 48% se encontraba en manejo con corticoide sistémico, con promedio de dosis de 6,7mg/día; el 68% con metotrexato; el 55% con leflunomida; el 17% con hidroxicloroquina/cloroquina y el 16% con sulfasalazina.
El número promedio de pruebas de tuberculina por paciente fue de 1,5 y solamente un caso presentó noxa de contagio. La prevalencia de TBL en los pacientes con AR candidatos a terapia biotecnológica fue del 18,3% (IC 95% 14,7-21,9) (tablas 1 y 2). La prevalencia de TBL en los sujetos con DM, en comparación con los no DM, fue del 16,3% vs. 18,5%, en tanto que la prevalencia de TBL en sujetos con tabaquismo vs. no tabaquismo fue del 32,4% vs. 17,1%. En los cruces exploratorios se encontró una razón de prevalencia mayor de 1 en la relación de TBL y sexo masculino (p≤0,001), hallazgos anormales en la radiografía de tórax (p=0,039) y tabaquismo (p=0,028). No se encontró asociación con variables de tratamiento u otras comorbilidades o actividad de la enfermedad incluidas en el estudio.
DiscusiónLa prevalencia calculada de TBL en este estudio fue del 18,3% (IC 95% 14,7-21,9). Bonfiglioli et al., en un estudio de corte transversal en sujetos con AR tratados con anti-TNF, reportaron una prevalencia de TBL del 32,7%4. Por el contrario, Callado et al. describen una prevalencia del 13% de TBL en una población reumatológica, que incluía pacientes con AR, espondilitis anquilosante (EA) y artritis psoriásica que usaban infliximab5. Las características de la población de estos estudios son similares a las encontradas en este estudio, con una edad alrededor de los 50 años, mayor proporción de sexo femenino y terapia antiinflamatoria y medicamentos modificadores. La diferencia en las prevalencias encontradas por algunos autores podría ser explicada por la dosis de esteroide utilizada: dosis mayores de 15mg al día por más de 3 meses podrían aumentar la tasa de falsos negativos de PPD y de esta manera subestimar la prevalencia de TBL en estos pacientes. No obstante, esto no ha sido totalmente demostrado8.
La ciudad en la que se realizó el estudio de Bonfiglioli et al. fue Sao Paulo, Brasil, donde se reporta una incidencia de TB de 49,5/100.000 habitantes9. Por otro lado, Callado et al. realizaron su estudio en la ciudad de Fortaleza, Brasil, donde la incidencia de TB es de 91,87/100.000 habitantes5. En comparación, en Bogotá la incidencia es de 8,2/100.000 habitantes10, lo que puede influir en la variabilidad de la prevalencia de TBL reportada. Sin embargo, se esperaría para poder afirmarlo con mayor certeza que a mayor prevalencia de TB se presenta una mayor prevalencia de TBL, lo que no se ve reflejado en los datos obtenidos. Se pueden considerar entonces factores adicionales, desconocidos hasta el momento, que pudieran explicar estas diferencias. En el estudio en población con enfermedad reumatológica de Callado et al., la prevalencia de TBL (PPD>5mm) difiere según el tipo de enfermedad reumatológica, y alcanzan un 26% en EA y un 4% en AR5.
La diferencia de prevalencia encontrada puede explicarse también por aspectos metodológicos únicos de cada tipo de estudio; no se pueden descartar del todo condiciones individuales que puedan influir en ella11. En este estudio se encontró que el sexo masculino y el antecedente de tabaquismo aumentarían la prevalencia de TBL en esta población. Aunque es cierto que el tipo de estudio de corte transversal impide hacer asociaciones por carecer de temporalidad, resultados similares entre el sexo masculino se han reportado en estudios sudafricanos; la explicación de los autores ha sido la mayor noxa de contagio en los hombres12. Por otro lado, la asociación de TBL y tabaquismo puede explicarse fisiopatológicamente por la alteración en la función del TNF alfa por acción de la nicotina, importante en la TBL y en la reactivación de TB activa13. También se ha descrito que la exposición al cigarrillo altera la activación de los linfocitos T CD4 y reduce el número de células T CD4 y CD8 activadas, lo que afecta la neutralización de microorganismos virales y bacterianos14.
No encontramos diferencias en la frecuencia de TBL en nuestra población según comorbilidades. La frecuencia de estas en nuestro estudio fue baja (<15%), y esta situación afectó su análisis, contrariamente a lo encontrado en un estudio observacional realizado en 12 centros de India, con una muestra de 195 pacientes con enfermedades reumáticas que recibían manejo con terapia biotecnológica, en el que se reportó relación entre el desarrollo de TB y la presencia de comorbilidades como DM, hipotiroidismo y enfermedad cardiovascular, con un riesgo 1,5 veces mayor, y el uso de esteroides con un riesgo 4,6 veces mayor para desarrollar la enfermedad15. Entre otros factores asociados se encuentran la noxa de contagio y algunos medicamentos modificadores4,16.
Se han encontrado asociaciones con otros medicamentos diferentes al grupo de anti-TNF, usados en los pacientes con AR y TBL, como es el caso de la leflunomida que se relaciona con infecciones oportunistas, principalmente gérmenes intracelulares17. En un estudio que evaluó el riesgo de infección por micobacterias asociado a medicación antirreumática, se encontró respecto al uso de leflunomida un odds ratio de 4,02 (1,08-15,0) (p=0,04), el segundo más alto, únicamente superado por el uso de anti-TNF con un odds ratio de 5,04 (1,27-20,0) (p=0,02)16. En contraste, en el presente estudio, el manejo farmacológico no se relacionó con la aparición de TBL.
En el análisis de variables como la actividad de la enfermedad, niveles de factor reumatoide, anti-CCP y hallazgos en la radiografía de tórax, se encontró relación con esto último. Los hallazgos de nódulo pulmonar o calcificación pueden estar relacionados con la presencia de TBL, ya que pueden corresponder a complejos de Ghon en sujetos, previo desarrollo de enfermedad reumatológica, o inicio de terapia biotecnológica. Este hallazgo quizá se relacione más con el diagnóstico que la posible asociación con la enfermedad, lo cual limita su interpretación6.
Entre las fortalezas de este estudio se encuentra el tamaño de muestra para determinar la prevalencia de TBL y la rigurosidad en la obtención de datos de las historias clínicas, así como la verificación en el diagnóstico de AR y TBL y un adecuado intervalo de confianza. Sin embargo, es necesario reconocer que al ser retrospectivo y tratarse de una muestra obtenida en hospitales de alta complejidad, no está exento de posible sesgo de selección al elegir pacientes con espectro más grave de la enfermedad que puede sobrestimar el cálculo de la prevalencia. De igual manera, existe la probabilidad de incurrir en sesgo de información debido a que depende de la información consignada en historias clínicas.
Por otra parte, el diagnóstico de TBL por PPD tiene limitaciones. En primer lugar, puede tener una alta tasa de falsos positivos al intentar medir una reacción de hipersensibilidad celular retardada mediante el derivado proteico purificado, que contiene una mezcla de antígenos para Nycobacteria poco específico, siendo más relevante en personas vacunadas con el bacilo de Calmette-Guérin. Segundo, su sensibilidad es menor en pacientes inmunocomprometidos, dada una posible alteración en la función de linfocitos T e inmunidad celular. Adicionalmente, la variabilidad interobservador y factores relacionados con dificultades en el desplazamiento del paciente a la lectura del examen pueden modificar el reporte final de la lectura18. La especificidad para el diagnóstico de TBL en población de alto riesgo, como trabajadores de la salud o población endémica para TB o VIH, es del 93% (90-96%) (valor predictivo positivo 90%), en tanto que la sensibilidad es del 57% (43-71%) (valor predictivo negativo 65%)19, lo que podría reflejarse también en diferentes valores de prevalencia.
ConclusiónLa prevalencia de TBL en pacientes con AR que serán llevados a terapia biotecnológica es alta: 18,3%, y es posible que exista una relación entre el tabaquismo y el sexo masculino. Se requiere desarrollar estudios de cohorte o de casos y controles que verifiquen estas asociaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.