El uso de TNFi es cada vez más frecuente en los pacientes con espondiloartritis. Identificar tempranamente aquellos que los requerirán o poder predecir su uso puede ayudar a hacer un tratamiento más efectivo y oportuno racionalizando su uso.
ObjetivoDeterminar los factores qué mejor explican la indicación de TNFi en la población en estudio.
Material y métodosLa asociación entre el uso de medicamentos anti-TNFα y las variables categóricas demográficas, clínicas, de laboratorio, radiológicas y de tratamiento se exploró por prueba exacta de Fisher. La asociación con las variables cuantitativas fue evaluada con t de Student o U de Mann Withney, de acuerdo con su distribución. Aquellas variables con p < 0,25 fueron ingresadas a modelos univariante de regresión logística explicativa para construir los OR crudos; aquellas con p < 0,25 se incluyeron en el modelo multivariante para construir OR ajustados.
Resultados y discusiónLa población está constituida por 181 pacientes. Modelo univariante: la artritis reactiva, uretritis y compromiso periférico fueron factores protectores para el uso de TNFi. Espondiloartritis axial, lumbalgia inflamatoria, dolor glúteo alternante, rigidez matinal sacroilitis demostrada por cualquier método, tratamiento con inhibidores COX-2, tiempo de evolución de tres años o más y los puntajes de BASDAI y BASFI se asociaron con el uso de TNFi. Modelo multivariante: artritis reactiva (OR 0,1, IC 95% 0,012-0,86, p = 0,036), lumbalgia inflamatoria (OR 13,63, IC 95% 1,36-136, p = 0,026), sacroilitis (OR 7,71, IC 95% 1,04-57, p = 0,045, uso de coxib (OR 10,1, IC 95% 2,71-37,62, p = 0,001) y el puntaje máximo de BASDAI (4-6: OR 6,1, IC 95% 1,3-28,7, p = 0,022, mayor de 6: OR 15,8, IC 95% 2,2-113, p = 0,006) se asociaron independientemente con el uso de TNFi. El uso de coxib se asoció con la indicación de usar TNFi tanto en los pacientes con espondiloartritis axial (OR 4,2, IC 95% 1,74-10,11, p = 0,001) como periférica (OR 4, IC 95% 1,85-8,62, p < 0,001).
ConclusionesEl inicio de la enfermedad en la forma de artritis reactiva se comportó como un factor protector para la necesidad posterior de usar TNFi, mientras que presentar lumbalgia inflamatoria, sacroilitis demostrada por cualquier método, el tratamiento con coxib y el puntaje máximo de BASDAI mayor de 4 se asociaron con el uso de estos medicamentos.
The use of tumor necrosis factor (TNF) alpha inhibitors is increasing in patients with spondyloarthritis. Early identification of those that would require them, or the ability to predict their use, could lead to a more effective and timely treatment by rationalizing their use.
ObjectiveTo determine factors that better explain the indication of TNFi in the study population.
Material and methodsThe association between anti-TNFα use and categorical demographic, clinical, laboratory, radiological and treatment variables was explored using Pearson's Chi2 or Fisher's exact test. The association with the quantitative variables was evaluated using Student's t test or Mann Whitney U test, depending on their distribution. Those variables with P < 0.25 were entered into univariate models of explanatory logistic regression to construct crude ORs, and those with P < 0.25 were included in the multivariate model to construct adjusted ORs.
Results and discussionThe study population includes 181 patients. In the univariate model: reactive arthritis, urethritis, and peripheral involvement were protective factors for the use of TNFi. Axial spondyloarthritis, inflammatory lumbalgia, alternating gluteal pain, morning stiffness, sacroiliitis demonstrated by any method, treatment with COX-2 inhibitors, evolution time of three years or more, and BASDAI and BASFI scores were associated with the use of TNFi. Multivariate model: reactive arthritis (P = 0.036), inflammatory back pain (P = 0.026), sacroiliitis (P = 0.045), use of coxibs (P = 0.001) and the maximum score of BASDAI (P = 0.022, P = 0.006) were independently associated with the use of TNFi. The use of coxibs was associated with the indication of using TNFi in both patients with axial spondyloarthritis (P = 0.001) and peripheral (P < 0.001).
ConclusionsThe onset of the disease in the form of reactive arthritis behaved as a protective factor for the subsequent need to use TNFi, while presenting with inflammatory back pain, sacroiliitis, demonstrated by any method, treatment with coxibs, and the maximum score of BASDAI greater than 4 associated with the use of these medications.
Las espondiloartritis (SpA) son un grupo de enfermedades inflamatorias que afectan tanto al esqueleto axial como al periférico, los cuales presentan entesitis y artritis periférica. Estas entidades afectan principalmente a población joven, comparten varias manifestaciones clínicas radiológicas y tienen un origen inmunogenético común. Como grupo, las SpA afectan al 1% de la población adulta joven, sobre todo en los países nórdicos y en población caucásica1-3.
Hasta hace dos décadas había pocas alternativas terapéuticas: medidas no farmacológicas tales como ejercicios aérobicos y medicamentos como los antiinflamatorios no esteroideos (AINE), sulfasalazina y metotrexato, así como infiltraciones locales con esteroides. Estos tratamientos mostraron eficacia en el control de dolor y la rigidez de las articulaciones periféricas y la entesitis, pero tienen limitada eficacia para el compromiso axial4,5. En las etapas iniciales de la enfermedad los AINE, incluidos los inhibidores de ciclooxigenasa 2 (coxib) son los fármacos de elección; han demostrado buen control del dolor lumbar inflamatorio y pueden retrasar el compromiso axial en algunos pacientes, por lo cual deben administrarse de forma continua. Sin embargo, en algunos casos su eficacia es limitada, existen contraindicaciones para su uso o bien los efectos adversos superan los posibles beneficios. En estos casos se indican los inhibidores del factor de necrosis tumoral (TNFi)6-8.
En la actualidad existen varios TNFi, entre ellos etanercept (receptor soluble), infliximab (anticuerpo monoclonal quimérico), adalimumab (anticuerpo monoclonal humanizado), certolizumab (anticuerpo monoclonal pegilado, sin la fracción fc) y golimumab (anticuerpo monoclonal humanizado). El uso de TNFi es cada vez más frecuente en los pacientes con SpA, lo que ha cambiado la historia natural y la calidad de vida de estos enfermos9-11. Identificar tempranamente aquellos sujetos que los requerirán, así como los factores asociados con su uso puede ayudar a hacer un tratamiento más oportuno, efectivo y racionalizado. En Colombia se han realizado pocos estudios para determinar el comportamiento clínico de estas enfermedades y no se han identificado los factores que obligan al médico reumatólogo a utilizar terapia biológica12-14.
El propósito del estudio fue conocer los factores que se asocian o explican la necesidad de usar TNFi en los pacientes con SpA en algún momento de la evolución.
Pacientes y métodosEl objetivo principal del estudio fue determinar los factores que mejor explican la necesidad de utilizar TNFi en una población de pacientes con SpA del noroccidente colombiano. Los objetivos secundarios fueron asociar los factores demográficos, clínicos, de laboratorio, genéticos, radiológicos y de tratamiento con el uso de TNFi y determinar los factores que se asocian, con independencia de la indicación de estos medicamentos.
Se hizo un estudio descriptivo, de corte transversal, que incluyó a la totalidad de los pacientes con SpA diagnosticados en el hospital Pablo Tobón Uribe de la ciudad de Medellín, entre el 1.o de enero del 2005 y el 31 de diciembre del 2016, con seguimiento mínimo de un año.
Fueron incluidos todos los pacientes mayores de 18 años que cumplieron los criterios ASAS, consultaron a los servicios de reumatología, hospitalización o urgencias de la institución y fueron evaluados por reumatólogo, y se excluyeron aquellos sujetos con otras enfermedades reumáticas que pudieran interferir con la evaluación clínica, como artritis reumatoide, lupus eritematoso sistémico, artrosis en la columna y fibromialgia. También fueron excluidos los pacientes con enfermedades autoinmunitarias, infecciones y neoplasias que contraindican el uso de TNFi.
Las variables independientes fueron demográficas (edad, sexo, edad al inicio de los síntomas y antecedentes familiares de espondiloartritis, psoriasis, uveítis, enfermedad inflamatoria intestinal), clínicas (manifestación inicial de la espondiloartritis, talalgia, uveítis, entesitis, dactilitis, psoriasis cutánea, psoriasis ungular, diarrea, uretritis, artritis, enfermedad de Crohn, colitis ulcerosa, dolor lumbar inflamatorio, dolor glúteo, rigidez matinal, enfermedad intestinal inflamatoria y tipo de espondiloartritis), de clinimetría (puntaje del BASDAI y BASFI basal, máximo y promedio durante la evolución de la enfermedad y al inicio del TNFi), de laboratorio (velocidad de sedimentación globular [VSG] y proteína C reactiva [PCR] y HLA-B27), de imágenes (RMN [edema medular óseo vertebral y en las articulaciones sacroilíacas], presencia de erosiones, sindesmofitos, fusión de las articulaciones sacroilíacas y radiografías simples de estas para aplicar la clasificación de NY) y de tratamiento (AINE, esteroides orales, coxib, metotrexato, sulfasalazina). La variable de desenlace fue la indicación de iniciar TNFi por el reumatólogo tratante; estos medicamentos se analizaron como grupo para facilitar el análisis.
Plan de análisisLa población se describió según las características demográficas, clínicas, radiológicas, de laboratorio, familiares y de tratamiento. Las variables continuas paramétricas se resumieron con medias y desviaciones estándar (DE) y las variables no paramétricas, con medianas y rangos intercuartílicos (RQ).
La asociación entre la indicación de TNFi y las variables categóricas se exploró con prueba exacta de Fisher, en tanto que la distribución de las variables cuantitativas se evaluó con las pruebas de Kolmogrov-Smirnof. Asimismo, la asociación de estas variables con el desenlace se evaluó por medio de las pruebas t de Student, para aquellas con distribución normal o U de Mann Withney para aquellas con distribución no normal.
El análisis multivariante se hizo mediante regresión logística explicativa por el método enter para obtener los OR crudos y ajustados. En el modelo inicial se incluyeron las variables con p < 0,25 (criterio de Hosmer Lemeshow). En el modelo final se incluyeron aquellas con p < 0,25 en el análisis univariante, excluyendo las variables colineales15. Los análisis se hicieron con el programa SPSS® versión 22, licencia del hospital Pablo Tobón Uribe. Los valores p < 0,05 se consideraron significativos.
El estudio no implicó ningún riesgo para los pacientes, por lo cual no se requirió la firma de consentimiento informado. Todos los pacientes que acudieron a la institución firmaron habeas data. El protocolo fue aprobado por el comité de ética e investigación del hospital.
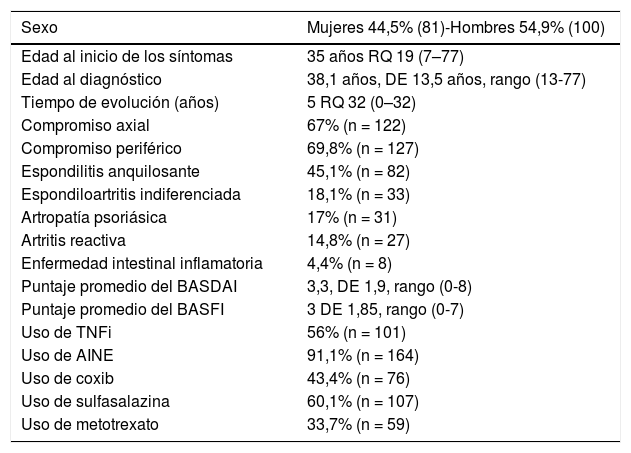
ResultadosLa población está constituida por 181 pacientes, con edad promedio de 45,3 años, DE 13,39 (20-83). En el 27,5% (50) los síntomas de SpA iniciaron en los primeros 25 años, en el 40,7% (74) entre los 26 y los 40 años y en el 31,9% (57) después de los 40 años. La tabla 1 muestra las principales manifestaciones clínicas, demográficas y los tratamientos de la población.
Características demográficas, clínicas y de tratamiento de una población de 181 pacientes con espondiloartritis
| Sexo | Mujeres 44,5% (81)-Hombres 54,9% (100) |
|---|---|
| Edad al inicio de los síntomas | 35 años RQ 19 (7–77) |
| Edad al diagnóstico | 38,1 años, DE 13,5 años, rango (13-77) |
| Tiempo de evolución (años) | 5 RQ 32 (0–32) |
| Compromiso axial | 67% (n = 122) |
| Compromiso periférico | 69,8% (n = 127) |
| Espondilitis anquilosante | 45,1% (n = 82) |
| Espondiloartritis indiferenciada | 18,1% (n = 33) |
| Artropatía psoriásica | 17% (n = 31) |
| Artritis reactiva | 14,8% (n = 27) |
| Enfermedad intestinal inflamatoria | 4,4% (n = 8) |
| Puntaje promedio del BASDAI | 3,3, DE 1,9, rango (0-8) |
| Puntaje promedio del BASFI | 3 DE 1,85, rango (0-7) |
| Uso de TNFi | 56% (n = 101) |
| Uso de AINE | 91,1% (n = 164) |
| Uso de coxib | 43,4% (n = 76) |
| Uso de sulfasalazina | 60,1% (n = 107) |
| Uso de metotrexato | 33,7% (n = 59) |
Los pacientes cursaron con enfermedad activa. El puntaje basal de BASDAI fue de 4 RQ 3 (0-8) y el 89% (161) tuvo puntaje de 4 puntos o más. El puntaje máximo de BASDAI fue de 4,97, DE 1,94 (4-9), y en el 75,3% (137) este fue mayor de 4 puntos. Igualmente, presentaron compromiso funcional importante. El puntaje basal del BASFI fue de 4 RQ 3 (0-7) y el 89% (162) de los sujetos inició con 4 puntos o más en este ítem. Durante la evolución tuvieron un puntaje máximo de BASFI de 4,11, DE 1,99 (0-8), y el 56,6% (103) tuvo 4 puntos o más en algún momento.
El 42,9% (78) de los pacientes tuvo VSG acelerada en algún momento de su evolución, con un valor de 33,5 mm/h, RQ 39 (2-126). La PCR se encontró aumentada en el 40,7% (74) de los sujetos, con un valor de 6 mg/dL RQ 32 (0-32). El HLA-B27 fue positivo en el 55,7% (59/106) de los casos.
Se exploró la presencia de sacroilitis en la radiografía simple de pelvis en 125 (69%) pacientes de la población de estudio. Se clasificó como grado 0 al 40,8% (51) de ellos; grado I, 6,4% (8); grado II, 8,8% (11); grado III, 28,8% (36) y grado IV 15,2% (19), según la clasificación de New York. Se obtuvo radiografía simple de columna en 78 (43%) de los pacientes; en 23 de ellos (29,4%) se observaron sindesmofitos lumbares.
El 69,2% (54/78) de los sujetos presentó cambios agudos (edema óseo) y el 37,2% (29/78) cambios crónicos en la RMN de las articulaciones sacroilíacas. En la RMN de columna lumbar el 35% (11/31) presentó cambios agudos y el 22,5% (7/31) cambios crónicos (sindesmofitos).
El 56% (101/180) de los pacientes fue tratado con TNFi por falla a dos AINE en el caso de las SpA axiales y falla a dos AINE, metotrexato y sulfasalazina, en el caso de las SpA periféricas. El 30,8% (31) de los pacientes recibió más de un TNFi. El más utilizado fue adalimumab (31,1%, n = 56), seguido de etanercept (21,7%, n = 39), infliximab (13,9%, n = 25), golimumab (6,1%, n = 11) y certolizumab (0,5%, n = 1).
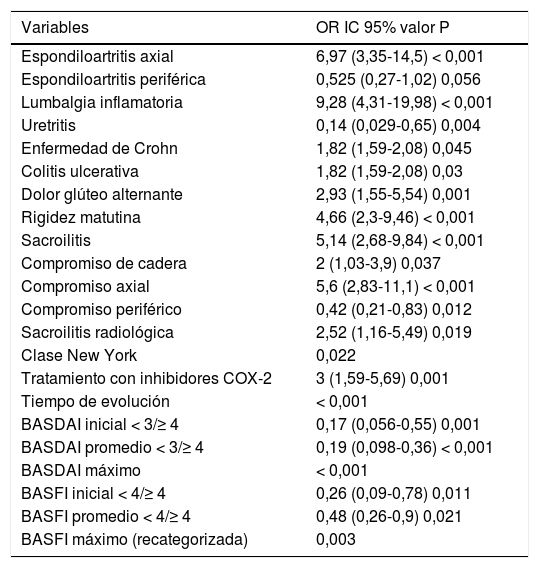
Las variables categóricas que se asociaron con el uso de TNFi se describen en la tabla 2. Aquellas relacionadas con el compromiso del esqueleto axial (espondiloartritis axial, lumbalgia inflamatoria, sacroilitis, rigidez matinal y dolor glúteo alternante), la actividad de la enfermedad, el compromiso funcional, la necesidad de utilizar coxib y tener enfermedad intestinal inflamatoria intestinal fueron factores de riesgo. El predominio de manifestaciones esqueléticas periféricas y el antecedente de uretritis se comportaron como factores protectores para el uso de TNFi.
Variables categóricas asociadas con el uso de TNFi
| Variables | OR IC 95% valor P |
|---|---|
| Espondiloartritis axial | 6,97 (3,35-14,5) < 0,001 |
| Espondiloartritis periférica | 0,525 (0,27-1,02) 0,056 |
| Lumbalgia inflamatoria | 9,28 (4,31-19,98) < 0,001 |
| Uretritis | 0,14 (0,029-0,65) 0,004 |
| Enfermedad de Crohn | 1,82 (1,59-2,08) 0,045 |
| Colitis ulcerativa | 1,82 (1,59-2,08) 0,03 |
| Dolor glúteo alternante | 2,93 (1,55-5,54) 0,001 |
| Rigidez matutina | 4,66 (2,3-9,46) < 0,001 |
| Sacroilitis | 5,14 (2,68-9,84) < 0,001 |
| Compromiso de cadera | 2 (1,03-3,9) 0,037 |
| Compromiso axial | 5,6 (2,83-11,1) < 0,001 |
| Compromiso periférico | 0,42 (0,21-0,83) 0,012 |
| Sacroilitis radiológica | 2,52 (1,16-5,49) 0,019 |
| Clase New York | 0,022 |
| Tratamiento con inhibidores COX-2 | 3 (1,59-5,69) 0,001 |
| Tiempo de evolución | < 0,001 |
| BASDAI inicial < 3/≥ 4 | 0,17 (0,056-0,55) 0,001 |
| BASDAI promedio < 3/≥ 4 | 0,19 (0,098-0,36) < 0,001 |
| BASDAI máximo | < 0,001 |
| BASFI inicial < 4/≥ 4 | 0,26 (0,09-0,78) 0,011 |
| BASFI promedio < 4/≥ 4 | 0,48 (0,26-0,9) 0,021 |
| BASFI máximo (recategorizada) | 0,003 |
Las variables cuantitativas asociadas al uso de TNFi fueron la edad de inicio de los síntomas (p = 0,036), el tiempo de evolución (p = 0,006), el puntaje inicial de BASDAI (p < 0,001) y el puntaje inicial de BASFI (p = 0,002). Los pacientes que requirieron TNFi eran 4,55 años menores al inicio de los síntomas que aquellos que no los necesitaron (-8,31; -0,79, p = 0,018).
Los pacientes con mayor actividad de la enfermedad tuvieron mayor indicación de TNFi; la diferencia de promedios en el puntaje máximo de BASDAI fue de 1,46 (IC 95% 0,89; 2,02), p < 0,001, entre aquellos que recibieron o no recibieron estos medicamentos. La diferencia de promedios en el puntaje de BASDAI durante la evolución fue de 1,59 (IC 95% 1,1; 2,08) p < 0,001 entre los grupos.
El compromiso funcional también se asoció con la necesidad de iniciar TNFi; el puntaje máximo de BASFI fue mayor en el grupo que recibió TNFi (diferencia de promedios 1,46, IC 95% 0,89; 2,02, p < 0,001). Igualmente, durante la evolución el BASFI fue mayor en este grupo (diferencia de promedios 1,59, IC 85% 1,1; 2,08, p < 0,001).
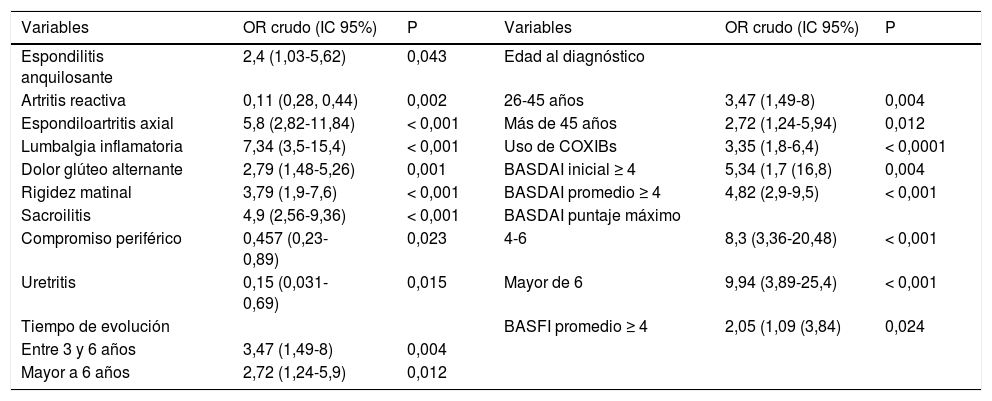
En el modelo univariante de regresión logística la artritis reactiva, la uretritis y el compromiso periférico fueron factores protectores para el uso de TNFi. La espondiloartritis axial, la lumbalgia inflamatoria, el dolor glúteo alternante, la rigidez matinal, la sacroilitis demostrada por cualquier método, el tratamiento con inhibidores COX-2, el tiempo de evolución de tres años o más y los puntajes de BASDAI y BASFI se asociaron con el uso de TNFi. Al diagnóstico, los pacientes mayores de 25 aos tuvieron más uso de TNFi que aquellos diagnosticados con 25 años o menos, pero no hubo diferencias entre aquellos con diagnóstico de espondiloartritis entre los 26 y los 45 o más años (tabla 3).
Factores que mejor explican el uso de TNFi en 181 pacientes con espondiloartritis. Análisis univariante
| Variables | OR crudo (IC 95%) | P | Variables | OR crudo (IC 95%) | P |
|---|---|---|---|---|---|
| Espondilitis anquilosante | 2,4 (1,03-5,62) | 0,043 | Edad al diagnóstico | ||
| Artritis reactiva | 0,11 (0,28, 0,44) | 0,002 | 26-45 años | 3,47 (1,49-8) | 0,004 |
| Espondiloartritis axial | 5,8 (2,82-11,84) | < 0,001 | Más de 45 años | 2,72 (1,24-5,94) | 0,012 |
| Lumbalgia inflamatoria | 7,34 (3,5-15,4) | < 0,001 | Uso de COXIBs | 3,35 (1,8-6,4) | < 0,0001 |
| Dolor glúteo alternante | 2,79 (1,48-5,26) | 0,001 | BASDAI inicial ≥ 4 | 5,34 (1,7 (16,8) | 0,004 |
| Rigidez matinal | 3,79 (1,9-7,6) | < 0,001 | BASDAI promedio ≥ 4 | 4,82 (2,9-9,5) | < 0,001 |
| Sacroilitis | 4,9 (2,56-9,36) | < 0,001 | BASDAI puntaje máximo | ||
| Compromiso periférico | 0,457 (0,23-0,89) | 0,023 | 4-6 | 8,3 (3,36-20,48) | < 0,001 |
| Uretritis | 0,15 (0,031-0,69) | 0,015 | Mayor de 6 | 9,94 (3,89-25,4) | < 0,001 |
| Tiempo de evolución | BASFI promedio ≥ 4 | 2,05 (1,09 (3,84) | 0,024 | ||
| Entre 3 y 6 años | 3,47 (1,49-8) | 0,004 | |||
| Mayor a 6 años | 2,72 (1,24-5,9) | 0,012 |
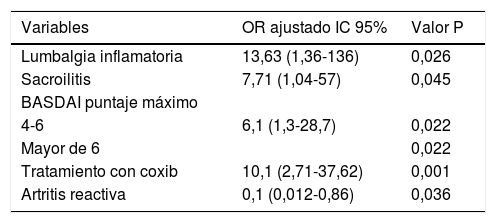
La presentación de lumbalgia inflamatoria, sacroilitis demostrada por cualquier técnica radiológica, el puntaje máximo de BASDAI y el requerimiento de coxib se asociaron con independencia del uso de TNFi en la población (tabla 4). La odds para uso de TNFi fue entre 12 y 13 veces mayor en los pacientes con lumbalgia inflamatoria y entre 6 y 7 veces mayor en quienes se demostró sacroilitis; igualmente, el puntaje máximo de BASDAI fue un factor de riesgo para el uso de estos medicamentos. Los pacientes que iniciaron con artritis reactiva necesitaron menos TNFi durante su evolución. Los pacientes que requirieron el uso de coxib después de dos AINE tradicionales tuvieron entre 9 y 10 veces mayor posibilidad de requerir TNFi.
Factores asociados independientemente con el uso de TNFi
| Variables | OR ajustado IC 95% | Valor P |
|---|---|---|
| Lumbalgia inflamatoria | 13,63 (1,36-136) | 0,026 |
| Sacroilitis | 7,71 (1,04-57) | 0,045 |
| BASDAI puntaje máximo | ||
| 4-6 | 6,1 (1,3-28,7) | 0,022 |
| Mayor de 6 | 0,022 | |
| Tratamiento con coxib | 10,1 (2,71-37,62) | 0,001 |
| Artritis reactiva | 0,1 (0,012-0,86) | 0,036 |
En una población de pacientes con SpA, seguidos en un hospital de alta complejidad, el 56% requirió iniciar TNFi. La presentación de lumbalgia inflamatoria, la sacroilitis demostrada por cualquier método, el tratamiento previo con coxib y el puntaje máximo de BASDAI mayor de 4 se asociaron al uso de estos medicamentos, mientras que el inicio en forma de artritis reactiva se comprobó como un factor protector para este desenlace.
El inicio de la enfermedad fue antes de los 40 años en aproximadamente el 73% de los pacientes, con una mayor frecuencia en hombres, en tanto que el compromiso axial y el periférico estuvieron presentes en el 67% y en el 69% de los pacientes, respectivamente. La espondilitis anquilosante, la espondiloartritis indiferenciada y la artritis psoriásica fueron las más frecuentes, de manera similar a como se ha descrito en otras cohortes16-18.
Aproximadamente el 80% de los pacientes tenía los reactantes de fase aguda elevados y la positividad del HLA-B27 fue del 55%, menor a las descrita para poblaciones europeas, en las que es mayor al 80%. En la cohorte alemana GESPIC se observó que el sexo masculino y un nivel elevado de PCR se asociaron con el daño estructural observado en las radiografías, mientras que la positividad del HLA-B27 determinó la edad de inicio de la enfermedad19.
El compromiso axial y el periférico estuvieron presentes en un alto porcentaje de los pacientes, al igual que la sacroilitis que fue evidenciada tanto en la radiografía simple como en la resonancia en el 59% y en el 69% de los sujetos, respectivamente, hallazgos que pueden explicar los altos puntajes de BASDAI y BASFI al ingreso a la cohorte y durante su seguimiento. Estos parámetros se han considerado relevantes en otras poblaciones estudiadas como criterios de selección para iniciar pacientes con TNFi20,21. Nuestra población en su mayoría requirió rotación de al menos dos AINE en las formas predominantemente axiales y de AINE e inmunomoduladores en las formas periféricas (metotrexato y sulfasalazina).
En el análisis univariante la espondiloartritis axial, la lumbalgia inflamatoria, el dolor glúteo alternante, la rigidez matinal y la sacroilitis demostrada por cualquier método se asociaron a mayor uso de TNFi. El tratamiento con inhibidores COX-2 también fue un factor relacionado con uso de TNFi, posiblemente porque en nuestro medio los coxib se usan como segunda línea de tratamiento debido a que no están incluidos en el plan obligatorio de salud y a que la mayoría de quienes reciben estos medicamentos ha persistido sintomática, falló al menos a 2 AINE convencionales o tuvo contraindicaciones para su uso.
La artritis reactiva, la uretritis y el compromiso periférico fueron factores protectores para el uso de TNFi. Ello podría deberse a que estas formas puedan ser autolimitadas y a que el uso de metotrexato y sulfasalazina podría retrasar o evitar el uso del TNFi en estos pacientes.
Los factores que se han asociado con mal pronóstico, con la progresión radiológica de formas con compromiso axial no radiográficas, con evidente sacroilitis y la necesidad de uso de TNFi son: género masculino, fumar, inicio temprano de la enfermedad, proteína C reactiva elevada al inicio de la enfermedad, tener parámetros de clinimetría elevados tales como el BASDAI y el HAQ, así como el compromiso temprano de las caderas22-24.
Debilidades y fortalezasEl hecho de que la evaluación radiológica de los pacientes no sea completa y uniforme, que en algunos no se haya explorado la presencia de HLA-B27 y no incluir ASDAS en la clinimetría, son debilidades importantes del estudio. Igualmente, el no contar con al menos 10 desenlaces por cada variable incluida en el modelo multivariante de regresión logística para controlar la confusión, le resta poder al modelo. Este es un problema frecuente de los estudios observacionales.
Las principales fortalezas del estudio son el seguimiento de la cohorte desde el año 2005, la inclusión de la totalidad de pacientes diagnosticados en la institución y el análisis de todas las variables asociadas con la necesidad de iniciar TNFi.
ConclusionesEl inicio de la enfermedad en la forma de artritis reactiva se comportó como un factor protector para la necesidad posterior de usar TNFi, mientras que presentar lumbalgia inflamatoria, sacroilitis demostrada por cualquier método, el tratamiento con coxib y el puntaje máximo de BASDAI mayor de 4, se asociaron con el uso de estos medicamentos. La asociación entre coxib y uso de TNFi persistió luego del análisis estratificado por el tipo de espondiloartritis. Se requieren estudios multicéntricos con mayor número de pacientes para controlar los factores de confusión, conocer mejor el comportamiento de las espondiloartritis y el uso de TNFi, así como sus factores predictores en nuestra población.
FinanciaciónEste trabajo fue realizado con el apoyo de la Asociación Colombiana de Reumatología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.