La artritis reumatoide (AR) es una enfermedad autoinmune caracterizada principalmente por deterioro articular y disminución de la densidad mineral ósea. La proteína Dickkopf 1 (DKK1) ejerce una función reguladora negativa de la vía Wnt comprometida con la diferenciación de osteoblastos y se ha observado que puede estar sobreexpresada en pacientes con AR.
ObjetivoProveer información actualizada sobre el conocimiento de la asociación entre los niveles séricos de DKK1 y la presencia de daño óseo y articular en pacientes con AR.
MétodoSe realizó una revisión sistemática cualitativa en las bases de datos Pubmed, Embase, Cochrane y Scielo utilizando los términos Dickkopf 1, DKK1, Dickkopf related protein 1, rheumatoid artrhitis, biomarcador, resorción ósea.
ResultadosSe escogieron 12 estudios que llenaban los requisitos de la búsqueda; 7 fueron cohortes prospectivas, 4 estudios de corte transversal y uno ensayo clínico. De los 12 estudios revisados, 10 analizaron la asociación entre niveles séricos de DKK1 y presencia de daño óseo como desenlace primario. Uno de ellos analizó esta asociación como desenlace secundario y otro la relación RSP01/DKK1. Los resultados hasta la fecha parecen indicar que la DKK1 tendría un papel activo en estadios avanzados de AR y no en la fase inicial.
ConclusionesLa proteína DKK1 desempeña un papel fisiopatológico esencial en la disminución de la masa ósea y la remodelación articular, dependiendo de la fase de la enfermedad, en pacientes con AR. Su papel como biomarcador o estrategia terapéutica sería una interesante alternativa aún en estudio.
Rheumatoid arthritis (RA) is an autoimmune disease that is mainly characterised by joint deterioration and decreased bone mineral density. The Dickkopf 1 protein (DKK1) exerts a negative regulatory function of the Wnt pathway involved in the differentiation of osteoblasts, and has been observed to be overexpressed in patients with RA.
ObjectiveTo provide updated information on current knowledge about the relationship between DKK1 serum levels and the presence of bone and joint damage in RA patients.
MethodA qualitative systematic review was carried out in the PubMed, Embase, Cochrane and Scielo databases using the terms Dickkopf 1, DKK1, Dickkopf related protein 1, Rheumatoid Arthritis, and Bone biomarker.
ResultsA total of 12 studies were chosen that met the requirements of the search. These included 7 prospective cohorts, 4 cross-sectional studies, and 1 clinical trial. Of the 12 studies reviewed, 10 analysed the relationship between serum DKK1 levels and the presence of bone damage as the primary outcome. One of them analysed this relationship as a secondary outcome and another one the RSP01/DKK1 ratio. The results to date seem to indicate that DKK1 could have an active role in advanced stages of RA, but not in the initial phase.
ConclusionsThe DKK1 protein plays an essential pathophysiological role in the decrease of bone mass and joint remodelling, depending on the stage of the disease in patients with RA. Its role as a biomarker or therapeutic strategy would be an interesting alternative still under study.
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica caracterizada por sinovitis crónica, deterioro articular y pérdida ósea excesiva1. Afecta entre el 0,5 y el 2% de la población mundial, siendo más común en mujeres, teniendo un pico de presentación entre los 50 y 60 años2,3. Su etiología es desconocida, sin embargo, se considera el resultado de la exposición a diversos factores medioambientales en individuos genéticamente predispuestos4. Estos factores genéticos y ambientales interactúan y desencadenan alteraciones en el sistema inmunitario que llevan a la generación de autoanticuerpos como el factor reumatoide (FR) y los anticuerpos antipéptidos citrulinados (anti-CCP), generando finalmente la sobre producción de citocinas proinflamatorias y el desarrollo de la artritis inflamatoria5. La pérdida de la masa ósea es una característica común en la AR y se ha demostrado que está presente desde fases tempranas de la enfermedad. En estos pacientes la osteopenia periarticular es una característica importante. Además, pueden apreciarse erosiones en la interfase entre el pannus y el tejido óseo adyacente, los cuales progresan rápido y contribuyen a las deformidades y morbilidad propias de la enfermedad. Dado que la severidad del compromiso óseo y articular influyen directamente en el pronóstico a corto y a largo plazos de estos pacientes, múltiples estudios han intentado determinar qué factores detectados tempranamente pueden predecir desenlaces negativos. El principal predictor de deterioro óseo y articular en AR es la presencia de erosiones al inicio de la enfermedad6. No obstante, el conocimiento actual, la heterogeneidad de los desenlaces en pacientes con AR hace necesario el estudio de nuevos biomarcadores que hagan posible el tratamiento más personalizado y dirigido a metas terapéuticas denominado hoy en día T2T (treat to target). La evidencia reciente indica que la proteína DKK1 puede tener un papel activo en la regulación de la biología ósea7,8.
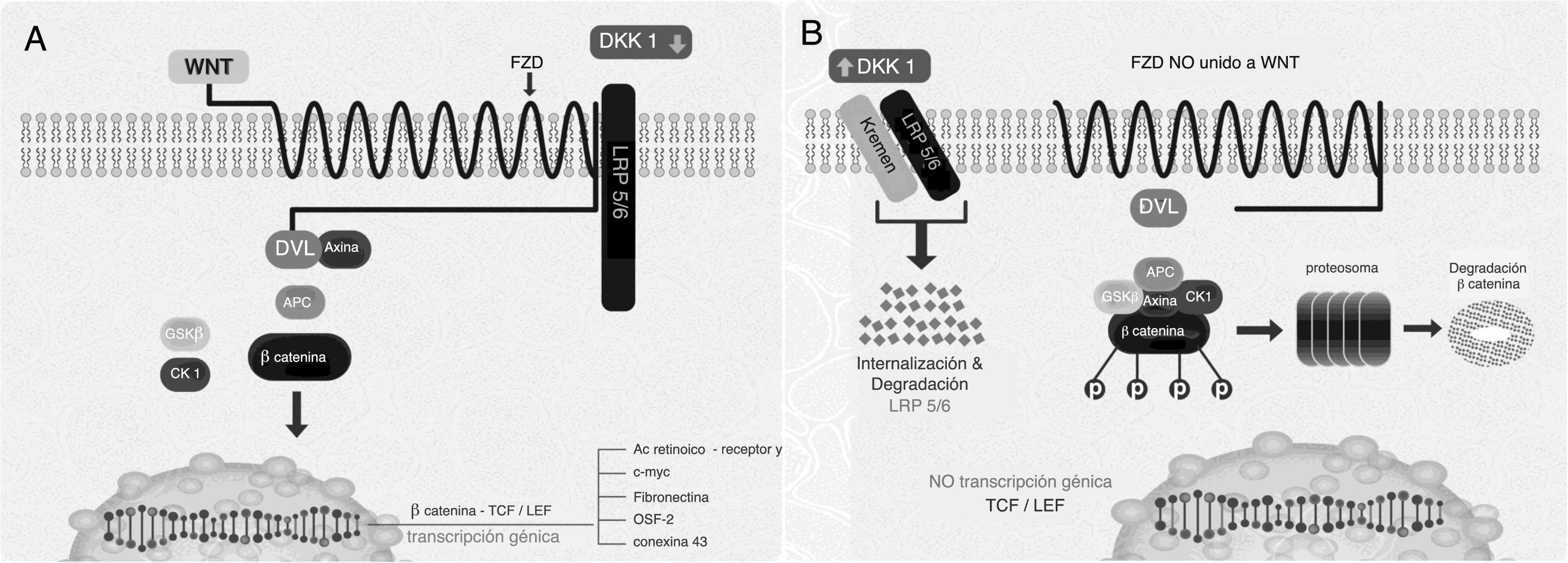
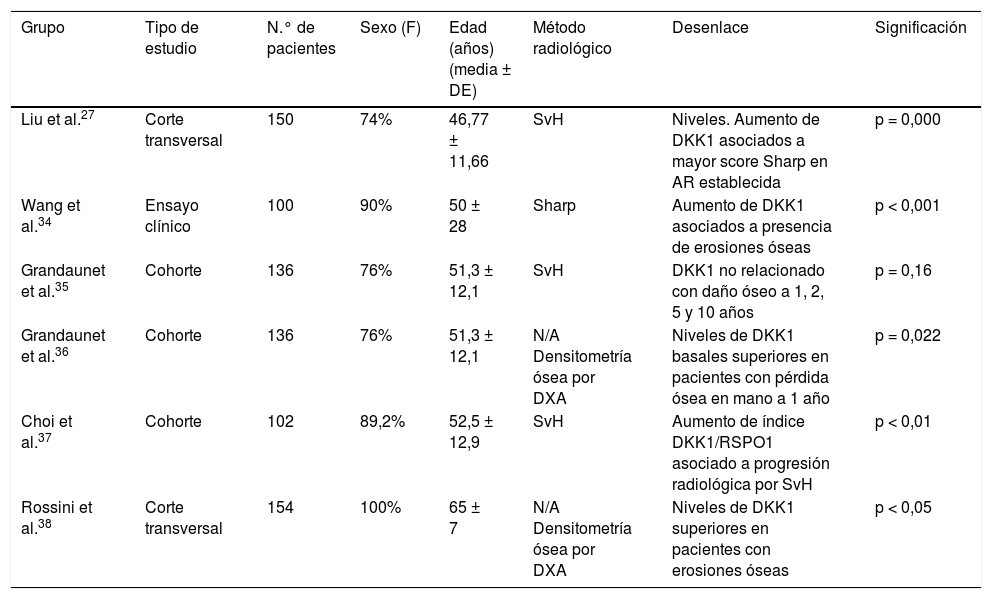
La vía Wnt y su regulación negativa por Dickkopf 1La activación de la vía Wnt induce diferentes señales intracelulares que se dividen en 2 grupos: la vía canónica o clásica y la vía no canónica. La canónica es la más conocida, donde hay una acumulación de β-catenina en el citoplasma y la posterior translocación al núcleo, donde modula la transcripción de diferentes genes (fig. 1A). En condiciones basales, cuando no está estimulada, se encuentra un complejo formado por varias proteínas, como la axina, la proteína de la poliposis adenomatosa del colon (APC) y la glucógeno sintetasa cinasa 3β (GSK3β)7. Esta última la fosforila, lo que la hace susceptible de unirse a la ubiquitina y posteriormente ser degradada en el proteosoma (fig. 1B). Así, los niveles intracelulares de β-catenina se mantienen bajos. Sin embargo, cuando se activa la vía Wnt por la unión de los ligandos Wnt a su receptor, se descompone el complejo axina APC-GSK3β, lo que disminuye la actividad fosforilativa de la GSK3β y, a su vez, se disminuye la fosforilación de la β-catenina y, en consecuencia, su degradación en los proteosomas9. Una vez hipofosforilada se acumula en el citoplasma y se transloca al núcleo, donde regula la expresión genética a través de la activación de factores de transcripción como TCF/LEF110 de moléculas implicadas con la diferenciación, proliferación y maduración de los osteoblastos, como son fibronectina, conexina 43, periostina y el receptor γ de ácido retinoico11. Los ligandos Wnt actúan a través de la fijación de receptores situados en la membrana celular (fig. 1B). Se han descrito varias moléculas con acción inhibidora sobre la vía Wnt. La inhibición de esta vía por DKK1 previene la activación de la proteína dishevelled (proteína asociada al receptor Fzd que actúa corriente abajo), GSK3β se mantiene activado y fosforila β-catenina, la cual luego se somete a degradación proteosomal7,12-14.
Componentes de la vía canónica Wnt. A) Estado de activación e inducción de genes. B) Estado de reposo.
APC: proteína de la poliposis adenomatosa del colon; CK1: caseína cinasa 1; DKK1: Dickkopf1; Dvl: dishevelled; FZ: receptor Frizzled; GSK3β: glucógeno sintetasa cinasa 3β; LEF/TCF: factores de unión y desarrollo linfoide/factores de células T; LRP: proteína relacionada con el receptor del LDL; OSF-2: factor específico de los osteoblastos 2; WNT: Wingless.
Modificado con autorización de Krishnan et al13.
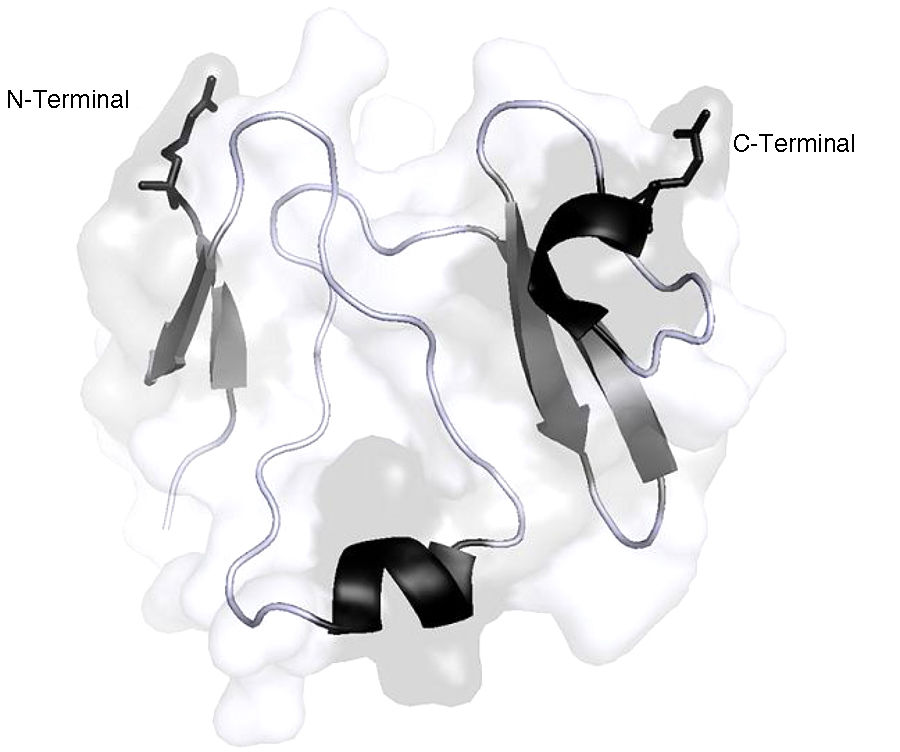
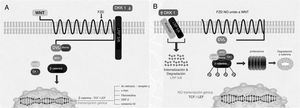
Los 3 miembros de la familia DKK (DKK1, DKK2, DKK4) son antagonistas efectivos de la vía de señalización canónica Wnt-β catenina al unirse directamente y con gran afinidad a LRP 5/615,16. La molécula de DKK contiene 2 dominios conservados ricos en cisteína (N o C de acuerdo con su localización en la proteína), que están conectados por un dominio de unión17 (fig. 2); los dominios C de DKK1 y DKK2 pueden por sí solos inhibir la vía Wnt18,19. Los estudios de mutagénesis han revelado que un lado del dominio C de DKK2 se une a LRP 5/6 y el otro a Kremen20, una molécula que modula el efecto antagonista de DKK sobre la vía Wnt. Por otro lado, la molécula LRP 5/6 puede ser dividida en 3 regiones: el ectodominio (ECD), el dominio transmembrana y el dominio citoplásmico21. El ECD de LRP 5/6 a su vez contiene 4 dominios de hélices β (P) constituidos por 4 aminoácidos (Tyr-Trp-Thr-Asp), cada una de las hélices se acopla a un dominio similar al factor de crecimiento epidérmico (EGF) y luego el ECD está constituido por 3 moléculas de receptor tipo A de lipoproteína de baja densidad (LA)21. Varios estudios de mutagénesis indican que las diferentes moléculas de Wnt se unen a diferentes regiones del ECD de LRP 5/622,23. De acuerdo con estos estudios, se infiere además que los dominios P-EGF 3 y 4 constituyentes del ECD de LRP 5/6 no son necesarios para la señalización por vía Wnt1 pero son esenciales para la inhibición por DKK124. Debido a que, en el caso de Wnt3a la superficie de unión a LRP 5/6 se sobrepone parcialmente con la de unión a DKK1, es probable que el antagonismo ejercido por DKK1 sea debido a un mecanismo de competencia directa con la molécula Wnt3a por su sitio de unión en LRP 5/625.
Representación 3D de la estructura de la proteína DKK-1. Las hélices a se observan en color negro y las hojas plegadas b se observan de color gris oscuro.
Imagen realizada y modificada por Paymol DLP 3D, Cod. RSCB 3S8V chain X. Secuencia disponible en UniProtKB: O94907. Editado por Chila-M. L. 2018.
El objetivo de esta revisión sistemática fue aportar información actualizada sobre la proteína DKK1 y su asociación con deterioro osteoarticular en pacientes con AR.
Materiales y métodosSe realizó una revisión sistemática de la literatura, de estudios experimentales, estudios observacionales analíticos (cohortes) y de corte transversal con el fin de evaluar el papel de la proteína DKK1 y su asociación con desenlaces osteoarticulares (p. ej., erosiones óseas, daño articular, disminución de densidad mineral ósea [DMO]) en pacientes con AR temprana (≤ 2 años de duración) o establecida. Se realizó una búsqueda de estudios primarios, revisiones sistemáticas y metaanálisis en las principales bases de datos científicas utilizando los términos MeSH para cada uno de los componentes de la pregunta PICO (Problema, Intervención, Comparador, Resultados).
Tipos de estudiosFueron incluidos ensayos clínicos controlados, estudios de cohorte y de corte transversal publicados y no publicados, que estuvieran escritos en idioma inglés o español y que evaluaran la asociación de los niveles de DKK1 con desenlaces de deterioro osteoarticular en pacientes con AR temprana o establecida. Para todos los casos el número de pacientes estudiados fue mayor a 50. En los estudios analíticos se incluyeron todos los que contemplaban la exposición, la población objeto y estrategias de control de sesgo.
Tipo de participantesPacientes mayores de 18 años con diagnóstico de AR temprana o establecida.
Tipo de intervenciónDeterminación de los niveles séricos de DKK1.
Tipo de desenlacesAsociación de los niveles de DKK1 en suero con erosiones óseas, disminución de DMO o daño articular.
Búsqueda electrónicaSe realizó una búsqueda en las bases de datos utilizando la estrategia PICO antes mencionada. La búsqueda en Medline se realizó con una combinación de palabras clave y filtros recomendados por la biblioteca Pubmed. Se limitó la búsqueda a artículos publicados en inglés y español.
Términos de búsquedaSe llevó a cabo una búsqueda estructurada de la literatura utilizando las bases de datos electrónicas Pubmed, Embase, Cochrane y Scielo con las palabras clave ((«Arthritis, Rheumatoid»[Mesh]) AND «DKK1 protein, human» [Supplementary Concept]) AND «Bone Resorption»[Mesh] AND «Biomarker»).
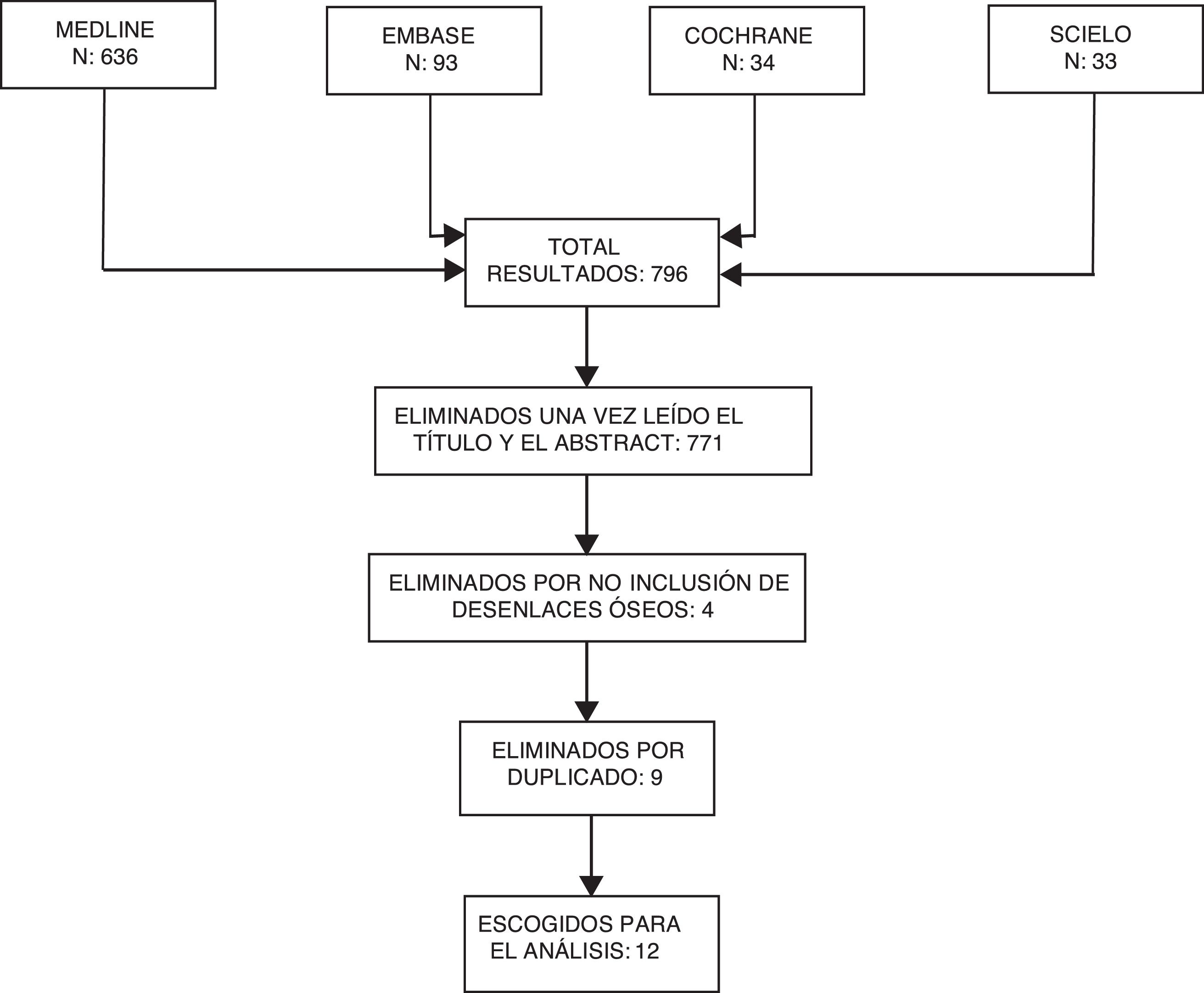
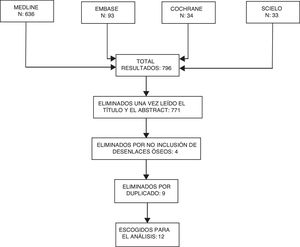
Selección de estudiosSe revisaron los resúmenes de los artículos encontrados para eliminar aquellos irrelevantes. Posteriormente, los artículos escogidos fueron revisados por los autores ACR y JBG de manera independiente para verificar que cumplieran los criterios de inclusión (fig. 3).
Extracción de los datosLos estudios que cumplieron con los criterios de inclusión fueron analizados para la extracción de datos. Los datos fueron extraídos independientemente por 2 de los autores (ACR y JBG) y luego los resultados fueron revaluados por los demás autores (JCM, RVO y CRS) para analizar la consistencia de los datos. Los datos extraídos de cada estudio se resumieron en 2 tablas, para AR temprana y establecida, respectivamente, incluyendo el número de pacientes, la edad, el sexo, puntaje radiológico utilizado, tipo de desenlace osteoarticular, medidas de frecuencia y asociación y significación estadística.
No se realizó metaanálisis debido a la alta heterogeneidad de los estudios.
Datos faltantesAlgunos estudios no reportaron los niveles de DKK1 y otros las medidas de frecuencia y asociación. En estos últimos se tomó la significación estadística y se comparó con los resultados directos del estudio
ResultadosCon los términos de búsqueda empleados se identificaron 839 títulos en las diferentes bases de datos. De estos 814 fueron excluidos después de aplicar los criterios de elegibilidad a sus títulos y resúmenes. Luego se eliminaron los duplicados. Adicionalmente, se excluyeron 3 estudios que no incluían desenlaces osteoarticulares. De los 12 estudios escogidos, 11 fueron escritos en idioma inglés y uno en español; 7 fueron cohortes prospectivas, 4 estudios de corte transversal y uno ensayo clínico. De los estudios revisados, 10 analizaron la asociación entre DKK1 y presencia de daño óseo como desenlace primario. Uno de ellos analizó esta asociación como desenlace secundario y otro la relación RSP01/DKK1.
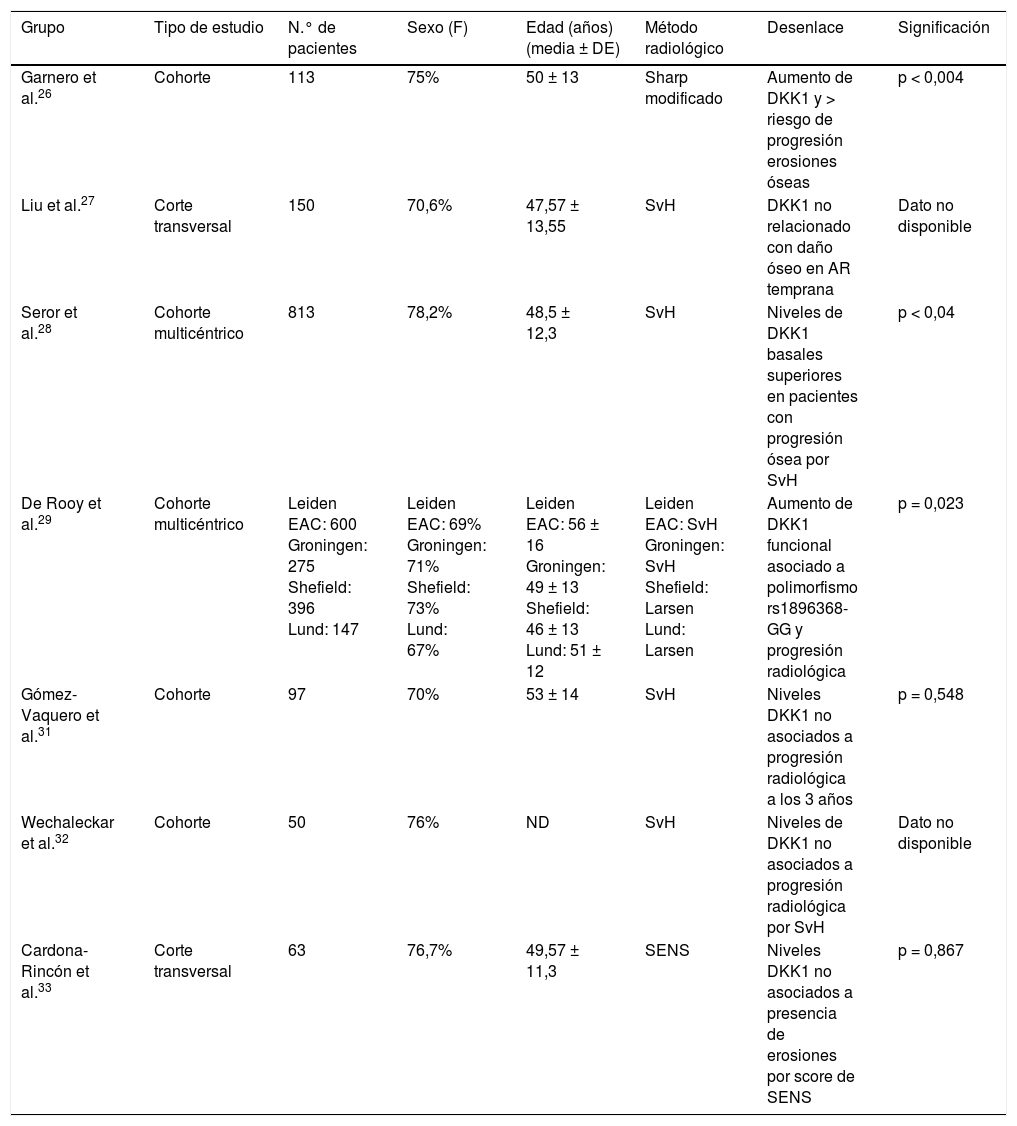
Relación entre niveles de Dickkopf 1 y daño osteoarticular en artritis reumatoide tempranaSiete estudios analizaron la relación entre los niveles de DKK1 y la presencia o progresión de daño óseo o articular en AR temprana, 5 de los cuales fueron cohortes y 2 de corte transversal26-32 (tabla 1).
Estudios de asociación entre niveles séricos de DKK1 y daño óseo en AR temprana
| Grupo | Tipo de estudio | N.° de pacientes | Sexo (F) | Edad (años) (media ± DE) | Método radiológico | Desenlace | Significación |
|---|---|---|---|---|---|---|---|
| Garnero et al.26 | Cohorte | 113 | 75% | 50 ± 13 | Sharp modificado | Aumento de DKK1 y > riesgo de progresión erosiones óseas | p < 0,004 |
| Liu et al.27 | Corte transversal | 150 | 70,6% | 47,57 ± 13,55 | SvH | DKK1 no relacionado con daño óseo en AR temprana | Dato no disponible |
| Seror et al.28 | Cohorte multicéntrico | 813 | 78,2% | 48,5 ± 12,3 | SvH | Niveles de DKK1 basales superiores en pacientes con progresión ósea por SvH | p < 0,04 |
| De Rooy et al.29 | Cohorte multicéntrico | Leiden EAC: 600 Groningen: 275 Shefield: 396 Lund: 147 | Leiden EAC: 69% Groningen: 71% Shefield: 73% Lund: 67% | Leiden EAC: 56 ± 16 Groningen: 49 ± 13 Shefield: 46 ± 13 Lund: 51 ± 12 | Leiden EAC: SvH Groningen: SvH Shefield: Larsen Lund: Larsen | Aumento de DKK1 funcional asociado a polimorfismo rs1896368-GG y progresión radiológica | p = 0,023 |
| Gómez-Vaquero et al.31 | Cohorte | 97 | 70% | 53 ± 14 | SvH | Niveles DKK1 no asociados a progresión radiológica a los 3 años | p = 0,548 |
| Wechaleckar et al.32 | Cohorte | 50 | 76% | ND | SvH | Niveles de DKK1 no asociados a progresión radiológica por SvH | Dato no disponible |
| Cardona-Rincón et al.33 | Corte transversal | 63 | 76,7% | 49,57 ± 11,3 | SENS | Niveles DKK1 no asociados a presencia de erosiones por score de SENS | p = 0,867 |
AR: artritis reumatoide; DKK1: Dickkopf 1; F: sexo femenino; ND: no disponible; SENS: Simple Erosion Narrowing Score; SvH: score de Sharp-van der Heijde.
En el 2008, Garnero et al. realizaron un estudio prospectivo de 113 pacientes con AR temprana que recibían tratamiento con etanercept o metotrexato en monoterapia, en quienes midieron niveles basales de DKK1, e hicieron seguimiento serológico y radiológico con score de Sharp-van der Heijde (SvH) a 1 año. Encontraron que los niveles elevados de DKK1 iniciales se asociaron a mayor riesgo de progresión de las erosiones óseas y estos cambios fueron independientes de la edad, el sexo, el daño radiológico de base, los niveles de PCR y el nivel de actividad de la enfermedad26.
Posteriormente, Liu et al. analizaron los niveles de DKK1 y osteoprotegerina en 150 pacientes con AR temprana y 150 pacientes con AR establecida, y encontraron que los niveles elevados de DKK1 se asociaron a mayor daño óseo mediante puntaje de SvH y actividad clínica por el índice DAS28 en los pacientes del brazo de AR establecida27.
Más recientemente, Seror R et al. analizaron la cohorte de pacientes franceses con AR temprana llamada ESPOIR. En esta cohorte prospectiva se realizaron niveles de DKK1 séricos basales, reactantes de fase aguda, medición clinimétrica de la actividad de la enfermedad y valoración de daño óseo por puntaje de SvH basales y a 2 años. De los pacientes con AR de esta cohorte, 110 tenían erosiones óseas al inicio del seguimiento y esto se correlacionó significativamente con varios factores como anti-CCP, edad, sexo femenino, niveles elevados de PCR, VSG y DKK1. En el análisis multivariado, los niveles de DKK1 se asociaron independientemente a los signos de progresión de daño radiológico por SvH28.
En 2013, de Rooy et al. realizaron un estudio de polimorfismos de nucleótido único (single nucleotide polymorphisms [SNP]) de diferentes integrantes de la vía Wnt en 4 cohortes europeas (LeidenNED, Groningen-NED, Sheffield-UK y Lund-SWE), en las cuales se analizaron 8 SNP de DKK1, 44 de LRP-5, 16 de Kremen-1 y 9 de esclerostina (SOST) y se realizaron modelos de regresión para establecer asociación entre los polimorfismos de estas moléculas y sus niveles séricos, así como progresión radiológica por 2 diferentes puntajes (SvH y Larsen). En los resultados observaron que en la cohorte de Leiden 6 SNP de DKK1, 3 de esclerostina, uno de Kremen y 10 de LRP-5 se asociaron significativamente a progresión de daño articular. En el metaanálisis realizado, 3 SNP de DKK1 se asociaron significativamente a progresión del daño articular y 2 SNP de esclerostina tuvieron tendencia a la significación estadística. Un SNP de DKK1 se asoció a mayores niveles de DKK1 en sangre (rs1896368, p = 0,02)29.
Un estudio de Miceli-Richard et al. intentó emular los hallazgos de de Rooy et al. en la cohorte francesa ESPOIR; sin embargo, ninguno de los 10 SNPs de DKK1 estudiados se asoció a progresión de daño estructural por el puntaje de SvH30.
Estudios posteriores no han logrado encontrar asociación entre los niveles de DKK1 y alteraciones radiográficas en pacientes con AR temprana31-33.
Gómez-Vaquero et al. realizaron un estudio de cohorte en 97 pacientes con AR temprana (mediana 1,6 años de evolución). Después de un seguimiento promedio de 3,3 años, el promedio de la progresión del score de SvH fue 0,88 ± 2,2 unidades. En el análisis multivariado factores como la edad (OR por año = 1,10; p = 0,003) y la PCR elevada (OR = 1,29; p = 0,005), y no los niveles de DKK1, se asociaron a progresión radiológica por SvH31.
También Wechaleckar et al., en 2016, realizaron un estudio de cohorte inicial en 50 pacientes con AR de < 1 año de evolución con doble positividad para FR y anti-CCP. No se encontró asociación entre los niveles basales de DKK1 y la progresión radiológica por SvH a un año de seguimiento32.
Por último, en el 2017 Cardona-Rincón et al. presentaron los resultados de un estudio de corte transversal realizado en 63 pacientes con AR temprana. Nuevamente no se encontró relación estadísticamente significativa entre los niveles de DKK1 y variables como la actividad de la enfermedad por DAS28 o daño radiológico por el puntaje de SENS33.
Relación entre niveles de Dickkopf1 y daño osteoarticular en artritis reumatoide establecidaOtros estudios que han intentado hallar correlación entre los niveles elevados de DKK1 y deterioro osteoarticular se han llevado a cabo en pacientes con AR establecida (tabla 2).
Estudios de asociación entre niveles séricos de DKK1 y daño óseo en AR establecida
| Grupo | Tipo de estudio | N.° de pacientes | Sexo (F) | Edad (años) (media ± DE) | Método radiológico | Desenlace | Significación |
|---|---|---|---|---|---|---|---|
| Liu et al.27 | Corte transversal | 150 | 74% | 46,77 ± 11,66 | SvH | Niveles. Aumento de DKK1 asociados a mayor score Sharp en AR establecida | p = 0,000 |
| Wang et al.34 | Ensayo clínico | 100 | 90% | 50 ± 28 | Sharp | Aumento de DKK1 asociados a presencia de erosiones óseas | p < 0,001 |
| Grandaunet et al.35 | Cohorte | 136 | 76% | 51,3 ± 12,1 | SvH | DKK1 no relacionado con daño óseo a 1, 2, 5 y 10 años | p = 0,16 |
| Grandaunet et al.36 | Cohorte | 136 | 76% | 51,3 ± 12,1 | N/A Densitometría ósea por DXA | Niveles de DKK1 basales superiores en pacientes con pérdida ósea en mano a 1 año | p = 0,022 |
| Choi et al.37 | Cohorte | 102 | 89,2% | 52,5 ± 12,9 | SvH | Aumento de índice DKK1/RSPO1 asociado a progresión radiológica por SvH | p < 0,01 |
| Rossini et al.38 | Corte transversal | 154 | 100% | 65 ± 7 | N/A Densitometría ósea por DXA | Niveles de DKK1 superiores en pacientes con erosiones óseas | p < 0,05 |
AR: artritis reumatoide; DKK1: Dickkopf 1; DXA: dual X-ray absorciometry; F: sexo femenino; N/A: no aplica; RSPO1: R-spondina 1; SvH: score de Sharp-van der Heijde.
Tres cohortes, 2 estudios de corte transversal y un ensayo clínico estudiaron la asociación de DKK1 y desenlaces óseos en AR establecida.
En 2011 un grupo de investigadores encabezados por los doctores Wang y Liu analizaron los niveles de DKK1 en suero de 100 pacientes con AR establecida y 100 pacientes con otras enfermedades reumatológicas, como osteoartritis y espondilitis anquilosante, encontrando que los niveles de esta proteína estaban significativamente elevados en el grupo de AR. Además, los niveles de DKK1 se correlacionaron con los niveles de PCR, VSG y cambios radiológicos por puntaje de SvH. En este estudio también se observó que los pacientes con AR que tenían manejo con anti TNF-α (infliximab) o anti-IL-1 (anakinra) presentaban disminución de los niveles séricos de DKK134.
También en 2011, Grandaunet et al. realizaron un estudio de cohorte prospectiva en 136 pacientes con AR establecida con un promedio de duración de la enfermedad de 2,2 años. Se realizaron niveles séricos de DKK1 y factor de crecimiento de hepatocitos (HGF) y se efectuó la valoración radiológica con puntaje de SvH. En este estudio se encontró que los niveles elevados de HGF y no los de DKK1 se asociaban a daño osteoarticular35.
En el mismo grupo se realizó un estudio de cohorte prospectiva en 136 pacientes con AR establecida, en quienes midieron los niveles basales de HGF y DKK1, así como estudio densitométrico basal y a 1, 2 y 5 años. En este estudio los niveles basales de DKK1 se correlacionaron con mayor pérdida ósea periarticular al año, la cual se mantuvo después de realizar el análisis multivariado36.
En el estudio de Choi et al., realizado en 2014, se encontró que pacientes con AR y progresión radiográfica de la enfermedad tenían un significativo aumento de los niveles séricos de DKK1 y del índice DKK1/R-Spondina (antagonista del DKK1). En el análisis multivariado los niveles séricos de DKK1 por sí solos no se asociaron con progresión radiológica pero sí el índice DKK1/R-Spondina37.
Por último, en 2015 Rossini et al. realizaron un estudio de corte transversal en 154 mujeres posmenopáusicas con AR establecida, pareadas por edad, sexo, índice de masa corporal (IMC) y niveles de vitamina D. Se midieron los niveles de DKK1 y se realizó la valoración radiológica y la medición de DMO en columna y cadera. Se encontró que entre las pacientes con AR, los niveles de DKK1 ajustados por edad, niveles de PTH y duración de la enfermedad, fueron significativamente superiores en pacientes que presentaban erosiones óseas38.
DiscusiónLa AR es una enfermedad autoinmune, inflamatoria, crónica y progresiva, caracterizada principalmente por el daño de pequeñas articulaciones de manos y pies y la disminución de la DMO generalizada. Desde el inicio de la enfermedad muchos pacientes pueden tener erosiones óseas y se conoce que la presencia de estas es el factor más importante en predecir la aparición de futuras erosiones y deterioro óseo38-40, y se relaciona con una menor DMO41. Además de ello, la presencia de ciertos factores, como los reactantes de fase aguda elevados, el número de articulaciones inflamadas, la presencia de FR o anti-CCP, el sexo femenino, la presencia de afectación predominante en miembros superiores y no inferiores, la edad y el IMC alterado, ha demostrado su asociación con progresión de daño radiológico en pacientes con AR42. No todos los pacientes con AR tienen el mismo patrón de progresión del daño óseo y es por ello vital poder diferenciar a quienes tendrán peores desenlaces con el fin de optimizar recursos y mejorar los resultados clínicos29.
En los últimos años se ha mejorado el conocimiento de los componentes de la vía osteogénica (canónica) Wnt y sus reguladores negativos. El papel de la proteína DKK1, como molécula con diferentes roles, ha despertado tanto interés en la comunidad científica que cada vez se publican más estudios de esta molécula como marcador serológico asociado a diferentes desenlaces en distintas enfermedades, tanto reumatológicas como las espondilitis anquilosantes42, el lupus eritematoso sistémico43,44 o la osteoartritis45, así como no reumatológicas, como el carcinoma hepatocelular46, la enfermedad aterosclerótica y la diabetes47, entre otras. En AR se han realizado estudios de DKK1 tanto en líquido sinovial48,49 como en hueso50, en los cuales se ha podido determinar la sobreexpresión de esta proteína en los lugares más afectados por esta patología, lo cual constituye una muestra fehaciente de la relación temporal y espacial entre esta proteína y los hallazgos clínicos o radiológicos en los pacientes con AR. Existe una relación muy estrecha entre los niveles elevados de TNF-α y los de DKK1 en pacientes con AR y se ha demostrado que citocinas como TNF-α e IL-1β pueden estimular indirectamente la producción de DKK1 por los sinoviocitos tipo fibroblastos7,48. Así mismo, el tratamiento con anticuerpos anti-TNF-α en estos pacientes se ha asociado a disminución de los niveles de DKK1 en suero34,51,52, de la misma manera que con los anticuerpos anti-IL-653. Esto indica que los niveles de DKK1 podrían tener un papel importante no solo en la predicción de desenlaces óseos, sino en la evaluación de respuesta a anti-TNF-α o anti-IL-6; sin embargo, se deben realizar los estudios adecuados para responder esta pregunta.
Los resultados de los diferentes estudios analizados en esta revisión sistemática indican que la proteína DKK1 puede ser una ayuda adicional para el clínico con el fin de identificar aquellos pacientes que requieren un tratamiento más agresivo. Sin embargo, existe poca evidencia en los pacientes con AR temprana dado su tiempo de evolución corto (tabla 1), teniendo en cuenta la importancia que tiene la predicción de desenlaces desde el inicio de la enfermedad. También es preciso anotar que si bien los niveles de DKK1 se asociaron a erosiones óseas o disminución mineral, en estos estudios no hubo asociación significativa con la disminución del espacio articular, lo que está en concordancia con el conocimiento actual acerca de la implicación de la vía Wnt y no sus reguladores negativos (DKK1, esclerostina) en el remodelado articular de los pacientes con AR7.
En la presente revisión se intentó dividir los estudios actuales de DKK1 en AR en 2 grupos: pacientes con AR temprana y pacientes con AR establecida. Sin embargo, dado que no existe un consenso actual sobre el punto de corte entre la forma temprana y tardía de la enfermedad, se determinó clasificar los estudios de acuerdo con lo considerado por los autores de los mismos (p. ej., en algunos estudios AR temprana se estableció en pacientes con duración de la enfermedad < 2 años y en otros < 1 año o < 6 meses). Otro inconveniente que tienen los estudios de DKK1 séricos es que la mayoría miden el DKK1 circulante y no el DKK1 funcional (DKK1 unido a LRP 5/6). Según algunos autores, el DKK1 funcional se correlaciona de mejor manera con el estado de resorción ósea en comparación con el DKK1 circulante13,54. Por otro lado, en estos estudios se ha demostrado que la mayoría de los pacientes que sobreexpresan DKK1 tienen progresión del daño óseo; sin embargo, aún no se sabe por qué algunos pacientes con niveles normales o bajos de DKK1 presentan progresión del daño radiológico. Se debe señalar, además, que si bien en algunos estudios realizados hasta la fecha se ha demostrado la asociación de DKK1 con la progresión del daño radiológico, en otros estudios, como los de Grandaunet et al.35, Gómez-Vaquero et al.31 y Liu et al.27, en el subgrupo de AR temprana no se pudo establecer esta asociación. Una explicación probable de esta discordancia puede estar dada por la amplia heterogeneidad de la población estudiada teniendo en cuenta diferencias en los parámetros de laboratorio de los niveles de DKK1, diferentes poblaciones estudiadas, el tiempo de duración de la enfermedad, el tratamiento biológico concomitante o glucocorticoide, entre otros. Además de esto, se deben tener en cuenta las múltiples y posibles causas de alteraciones preanálisis, como son la variabilidad diurna, las comorbilidades del paciente y las condiciones técnicas de medición.
ConclusionesDiversos estudios se han llevado a cabo tanto en pacientes con AR temprana como establecida, en los cuales se han asociado los niveles séricos elevados de DKK1 con desenlaces adversos, como mayor progresión de daño óseo por radiología o disminución de masa ósea por densitometría. La proteína DKK1 desempeña un papel fisiopatológico esencial en la disminución de la masa ósea y la remodelación articular en pacientes con AR. Su papel como biomarcador o estrategia terapéutica en esta población es muy interesante y aún no se ha determinado. Los resultados hasta la fecha parecen indicar que el DKK1 tendría un papel activo como biomarcador en estadios avanzados de AR y no en la fase inicial.
FinanciaciónEsta revisión está soportada por los proyectos en curso: Hospital Militar Central (Código: 2015-047), Asociación Colombiana de Reumatología Convocatoria 2016 y Universidad El Bosque (Código: PCI 2016-8806).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al Dr. Krishnan Venkatesh por su amable atención a la solicitud de autorización de uso y modificación de figura 1.
A la señora Brigitte Espinosa, bibliotecóloga de la Biblioteca Médica, Subdirección de Docencia e Investigación Científica, Hospital Militar Central, por su asesoría.
A la Dra. Adriana Beltrán, directora de la División de Investigaciones, Subdirección de Docencia e Investigación Científica, Hospital Militar Central, por su asesoría en el diseño de la revisión sistemática.