La osteoporosis es una enfermedad esquelética caracterizada por una disminución de la densidad mineral ósea (DMO) y la alteración de la microarquitectura ósea, lo que resulta en un incremento del riesgo de fractura. Tradicionalmente, se ha medido haciendo una densitometría por rayos X (DXA). Sin embargo, la multiespectrometría ecográfica por radiofrecuencia (REMS) ha emergido como una técnica prometedora para la evaluación de esta enfermedad. Diferentes estudios han evaluado la factibilidad y la precisión de la REMS, y han mostrado correlaciones significativas con DXA en diferentes sitios anatómicos y distintas poblaciones, incluyendo mujeres postmenopáusicas, hombres, pacientes con artritis reumatoide y trasplantados renales, entre otros. La REMS también ha demostrado su capacidad para detectar artefactos óseos y proporcionar mediciones confiables en su presencia. Aunque la DXA sigue siendo el estándar de oro para el diagnóstico de la osteoporosis, la REMS se ha revelado como una herramienta eficaz y prometedora en la valoración de la DMO y el riesgo de fractura. Su capacidad para descartar artefactos y ofrecer mediciones precisas en diversas poblaciones resalta su potencial como complemento o alternativa a la evaluación de la osteoporosis.
Osteoporosis is a skeletal disorder characterized by decreased bone mineral density (BMD) and a disruption of bone microarchitecture, leading to an increased fracture risk. Traditionally, BMD has been measured using X-ray densitometry (DXA). However, Radiofrequency Echographic Multi Spectometry (REMS) has emerged as a promising technique for the assessment of osteoporosis. Various studies have evaluated the feasibility and precision of REMS, showing significant correlations with DXA in different anatomical sites and populations, including post-menopausal women, renal transplant patients, and those with rheumatoid arthritis, among others. REMS has also demonstrated the ability to detect bone artifacts and provide reliable measurements in their presence. While DXA remains the gold standard for diagnosing osteoporosis, REMS has proven to be an effective and promising tool in assessing BMD and fracture risk. Its capability to rule out artifacts and offer precise measurements in diverse populations highlights its potential as a complement or alternative in the evaluation of osteoporosis.
La osteoporosis es una enfermedad esquelética sistémica que aumenta el riesgo de fracturas, debido a la disminución de la masa ósea y el deterioro de la microarquitectura del tejido óseo1. La densidad mineral ósea (DMO) medida por densitometría por rayos X (DXA) es el estándar de oro para diagnosticar esta enfermedad. No obstante, presenta limitaciones, como su dependencia de la radiación y la posibilidad de errores en la adquisición e interpretación de las imágenes densitométricas2. Aunque la radiación de la DXA es relativamente baja, no se debe considerar sin riesgos; es esencial adherirse al principio de mantenerla «tan bajo como sea razonablemente alcanzable»1,3.
La Food and Drug Administration (FDA) aprobó la medición de la DMO por DXA en 1988. Posteriormente, en 1994, la Organización Mundial de la Salud (OMS) definió la osteoporosis con base en el T-score, que compara la DMO del paciente con una población de referencia adulta joven4. Se diagnostica la enfermedad cuando la DMO está 2,5 desviaciones estándar por debajo del promedio para un adulto joven4,5. A pesar de ser una definición precisa, su sensibilidad es limitada, y muchos pacientes con fracturas no cumplen con este criterio6.
Los puntos de referencia para las mediciones de la DMO son la cadera y la columna, ya que las fracturas en estas áreas son los predictores más precisos de fractura osteoporótica, además del alto grado de alteración de la calidad de vida en caso de una fractura en estos sitios anatómicos7,8. A esto se suma que se trata de los sitios de elección preferidos para monitorización por su alta sensibilidad al cambio8.
La DMO obtenida por DXA refleja solo una parte de la fortaleza ósea, la cual mide la resistencia a la fractura y está determinada por la suma de varias características esqueléticas. Estas características se dividen en 4 componentes principales: composición, microarquitectura, tamaño y forma. Sin embargo, se cuenta con estudios que han demostrado que la DMO representa solo el 50-70% de la variación de la fortaleza ósea, ya que describe aspectos relacionados con la cantidad de tejido óseo, pero tiende a sobreestimar la información acerca de la calidad ósea. Ejemplos de esto incluyen la geometría, la morfología, los parámetros de la microarquitectura, así como la densidad de los compartimentos trabeculares y corticales y las propiedades elásticas. Estos aspectos no son evaluados por la DXA actual, lo que podría explicar por qué muchas fracturas ocurren en pacientes cuyas densitometrías no están en el rango de osteoporosis9,10.
Dentro de las desventajas de la DXA se incluye el uso de rayos X, la falta de portabilidad, la necesidad de personal técnico altamente especializado y una ubicación específica que cuente con espacio suficiente para mantener al operador a más de 1m de distancia del equipo. Además, el control de calidad de la DXA puede verse afectada o por defectos del preprocesamiento y el posprocesamiento de las imágenes10,11. De hecho, muchos resultados de la DXA contienen errores (en un estudio por encima del 90%), principalmente en el análisis, la interpretación, el posicionamiento del paciente (en el 9% de las adquisiciones femorales y en el 8% de las lumbares), los artefactos (osteofitos, calcificaciones aórticas, fracturas) y errores demográficos10,12,13. Dentro de los errores posteriores a la adquisición, encontramos la necesidad de reubicación de la identificación automática de la región de interés (ROI) por parte del técnico, a fin de obtener un resultado confiable10.
Muchos pacientes no están siendo evaluados o tratados para la osteoporosis, y la falta de tamizaje y diagnóstico es uno de los principales contribuyentes a la denominada «crisis del tratamiento de la osteoporosis», a pesar de contarse ampliamente con medicamentos seguros y efectivos para prevenir fracturas14. La proporción de las mujeres que se realizan DXA, así como las mujeres con osteoporosis, ha declinado establemente de manera progresiva en la última década, y es uno de los contribuyentes a la reversión de la tasa de decline de la incidencia de fractura de cadera. El tamizaje de osteoporosis persiste bajo, incluso después de su evento centinela: la fractura15.
Desafortunadamente, cerca del 75% de los casos de osteoporosis no son diagnosticados, debido a la ausencia de herramientas diagnósticas precisas y ampliamente disponibles16. Por lo tanto, es posible que nuevos enfoques imagenológicos puedan ayudar a incrementar el número de individuos evaluados y a mejorar la predicción del riesgo de fractura17. En este contexto, se están explorando técnicas de imagen alternativas. Aunque algunas tienen potencial, presentan inconvenientes. Sin embargo, las técnicas no ionizantes, como la resonancia magnética y el ultrasonido cuantitativo (USQ), pueden ser prometedoras. En este caso, la multiespectrometría ecográfica por radiofrecuencia (REMS) podría ofrecer un enfoque innovador2,9,17.
ObjetivoRealizar una revisión narrativa no sistemática de la literatura sobre la utilidad de la REMS (Radiofrequency Echographic Multi Spectometry) en el diagnóstico de la osteoporosis y su correlación con la DMO por la DXA.
Materiales y métodosSe hizo una revisión narrativa no sistemática de la literatura en idiomas inglés y español. La búsqueda se centró en artículos publicados entre los años 1990 y 2023, en bases de datos como: Pubmed, Embase y Lilacs. Se emplearon los términos MESH (medical subject headings): Osteoporosis [Majr]; Radiofrequency Echographic Multi Spectometry [Majr]; diagnosis [Majr]; densitometry [Majr]; se combinaron utilizando operadores booleanos (AND, OR). Además, se utilizó la estrategia de agrupamiento retrógrado.
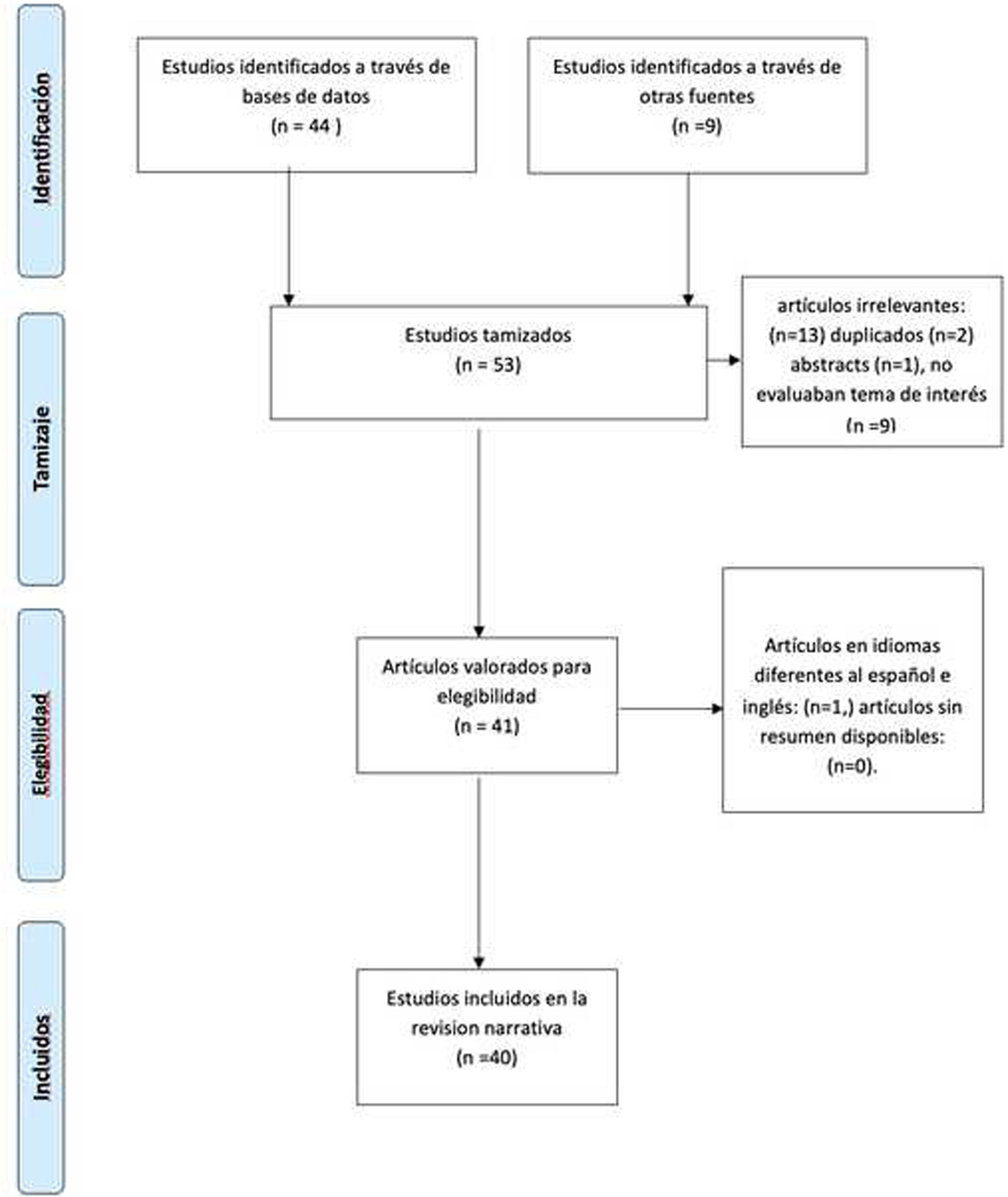
ResultadosTras la búsqueda inicial, se identificaron 53 artículos para tamizaje. Se retiraron 13: artículos por resultados duplicados: 4; abstracts: 2, no relacionados con el objetivo de la búsqueda: 7. Tras revisar títulos y resúmenes, se seleccionaron 40 artículos que proporcionaban la información necesaria para esta revisión (fig. 1).
Ultrasonido cuantitativoEl ultrasonido cuantitativo (USQ) lo utilizaron por primera vez Langton et al. en 1984 para el diagnóstico de osteoporosis y la estimación del riesgo de fractura. Se escogió inicialmente el calcáneo por accesibilidad, volumen y por ser un hueso esponjoso cuyas superficies lateral y medial están paralelas. En dicho estudio se demostró que la pendiente de la atenuación dependiente de frecuencia en el calcáneo podía discriminar entre pacientes osteoporóticos y no osteoporóticos18. El ultrasonido cuantitativo aplicado al hueso usa ondas de sonido a aproximadamente 0,2 a 2MHz. Las propiedades del hueso alteran progresivamente la forma, la intensidad y la velocidad de las ondas propagadas. Este puede utilizarse en modo de transmisión o reflexión y permite evaluar parámetros como la calidad, la elasticidad, la microarquitectura y la fortaleza ósea19.
Los dispositivos de USQ se pueden clasificar según el sitio donde miden las propiedades óseas (falanges, muñeca, tibia, cadera, columna), el fabricante o el tipo de transmisión del US (más comúnmente utilizado).
Existen 4 tipos de transmisión de US: trabecular transversa, cortical transversa, axial cortical y dispositivos de medición ecopulsado (tabla 1)20,21.
Clasificación de los dispositivos de ultrasonido cuantitativo
| Dispositivo de US cuantitativo | Características | Sitio de medición | Aprobado FDA |
|---|---|---|---|
| Transmisión trabecular transversa | Permite el viaje de sondas de ultrasonido a través del hueso trabecular, 2 transductores: transmisor y receptor se colocan a cada lado del hueso.Adquiere parametros BUA, SOS y SI. | Calcáneo | Sí |
| Transmisión cortical transversa | Las ondas de ultrasonido viajan a través del hueso cortical usando transductores a ambos lados del hueso medido. | Falanges y radio distal | No |
| Transmisión axial cortical | Ondas de US guiadas que viajan a través del hueso cortical.Los transductores: transmisor y receptor se colocan a través del eje del hueso medido y las ondas viajan por la diáfisis. | FalangesRadioTibia | Pocos se han aprobado |
| Eco pulsado (REMS) | Integra el análisis de imágenes de US y señales de radiofrecuencia retrodispersas. | Columna lumbar y cuello femoral | Sí |
BUA: atenuación US banda ancha (del inglés Broad-band Ultrasound Attenuation); REMS: multiespectrometría ecográfica por radiofrecuencia; SI: índice de rigidez (del inglés Stiffness Index); SOS: velocidad ultrasónica (del inglés Speed of Sound).
En las técnicas de transmisión transversa trabecular y cortical, las ondas de ultrasonido viajan a través del hueso trabecular, y se requieren transductores, uno que funcione como transmisor y el otro como receptor, ubicados a ambos lados del hueso. Los 2 parámetros convencionales e iniciales medidos por el USQ transversal son la atenuación del ultrasonido y la velocidad del sonido, que se obtienen mediante la técnica de sustitución, donde la señal transmitida a través del sitio esquelético en respuesta a una excitación de banda ancha se compara con la señal transmitida a través de un medio de referencia con atenuación y velocidad del sonido conocidas. La atenuación dependiente de la frecuencia se obtiene del análisis espectral de las 2 señales19.
La atenuación del ultrasonido o atenuación US banda ancha (BUA, por sus siglas en inglés) se define como la pendiente en la cual la atenuación incrementa con frecuencia, generalmente entre 0,2 y 0,6MHz, y se mide en decibeles por MHz (dB/MHz). La velocidad ultrasónica o velocidad del sonido (SOS, por sus siglas en inglés) se mide en metros por segundo (m/s)dos20. El BUA y la SOS se pueden combinar para dar un parámetro adicional como el índice de rigidez (SI=0,67* BUA+0,28*SOS-420)19.
Las mediciones de USQ convencional, BUA y SOS requieren 2 transductores, por lo tanto, solo son aplicables en sitios apendiculares (p. ej., muñeca, tibia, falanges) y no en sitios anatómicos centrales22. Su poder pronóstico limitado deriva de la ausencia de relaciones claras con el estado de salud de cadera o columna, que son los sitios de fractura que acarrean los mayores costos y las reducciones más severas en la calidad de vida del paciente. Cabe resaltar que los dispositivos de medición de eco pulsado solo requieren un transductor, por lo cual es aplicable a sitios centrales como la cadera y la columna donde las mediciones a través de transmisión (transversa) son difíciles.
En la técnica de transmisión axial, se utiliza un transmisor y un receptor para medir la velocidad del sonido a través de la capa cortical ósea, paralelo a su eje largo. En contraste con la transmisión transversa, no requiere un transductor a cada lado del hueso19.
La posición actual de la Sociedad Internacional para la Densitometría Clínica (International Society for Clinical Densitometry [ISCD]) con respecto al USQ es que el único sitio esquelético validado es el calcáneo, su capacidad de predicción de fracturas por fragilidad se ha comprobado solo en sujetos mayores de 65 años, y puede utilizarse para identificar una población con muy bajo riesgo de fractura, caso en el cual no se requiere una evaluación diagnóstica. Sin embargo, la ISCD también especifica que las mediciones en columna lumbar y fémur por DXA son las preferidas para tomar decisiones terapéuticas, y el USQ no puede utilizarse para la monitorización terapéutica de los pacientes.
Adicionalmente, el rendimiento del USQ en comparación con la DXA ha producido resultados contradictorios. Los enfoques de ultrasonido cuantitativo pueden considerarse valiosos como métodos de tamizaje, pero las decisiones clínicas y terapéuticas requieren confirmación por DXA en sitios centrales22. Por lo tanto, los resultados del USQ no pueden ser utilizados rutinariamente para iniciar un tratamiento sin una confirmación posterior mediante DXA, y esto se debe a que el QUS no mide la DMO, que es el criterio diagnóstico actual para la osteoporosis. Se requiere un método para convertir o adaptar los resultados del US a la escala de DXA23.
A pesar de los datos clínicos limitados y los problemas asociados con el USQ en el calcáneo, el ultrasonido por eco pulsado ha sido aprobado por la FDA para la medición de la DMO, el T-score y Z-score (parámetros no evaluados por otros dispositivos de USQ), y para la monitorización de cambios óseos en la práctica clínica, un concepto que nunca ha sido estudiado por el USQ. La idea no es reemplazar las mediciones de la DMO, sino complementarlas y hacerlas más accesibles20.
Esta técnica puede ser útil en pacientes que requiere tamizajes y tratamientos intensivos en poblaciones de alto riesgo.
Dispositivos de medición eco pulsadoEl hueso trabecular, que es un medio dispersivo, permite que las trabéculas óseas dispersen las ondas de ultrasonido24. Esta dispersión puede ser cuantificada ecográficamente a través de la retrodispersión. Por medio de modelos de regresión de datos experimentales y mediciones de hueso in vivo, se ha relacionado la retrodispersión ultrasónica con parámetros de microarquitectura, lo que proporciona información que complementa la medición tradicional de la masa ósea24.
Entre los parámetros notables se incluyen:
- •
Coeficiente de reflexión integrada (Integrated Reflection Coefficient [IRC])
- •
Banda ancha de ultrasonido retrodispersa (Broadband, Ultrasound Backscatter [BUB])
- •
Retrodispersión aparente (Apparent Integrated Backscatter [AIB])24
- •
Pendiente de la retrodispersión aparente (TSAB)
- •
Frecuencia de pendiente de retrodispersión aparente (Frequency Slope of Apparent Backscatter [FSAB])
Estos parámetros tienen un potencial destacado para reflejar aspectos esenciales como la estructura, la densidad, la composición y las propiedades mecánicas del hueso trabecular10.
El eco pulsado (EP) se distingue de otros dispositivos de USQ por su versatilidad. Su diseño, que requiere solo un transductor, lo hace ideal para mediciones en ubicaciones esqueléticas clave como la columna y la cadera, y permite análisis separados del hueso trabecular y cortical24.
Una tecnología destacada dentro de los dispositivos de eco pulsado es la multiespectrometría ecográfica por radiofrecuencia (Radiofrequency Echographic Multi Spectrometry [REMS]), que ofrece un diagnóstico de osteoporosis midiendo la DMO y predice el riesgo de fractura mediante el cálculo del Fragility Score. Esto se logra mediante el procesamiento automático de señales de ultrasonido no filtradas, obtenidas en mediciones de cadera y columna9.
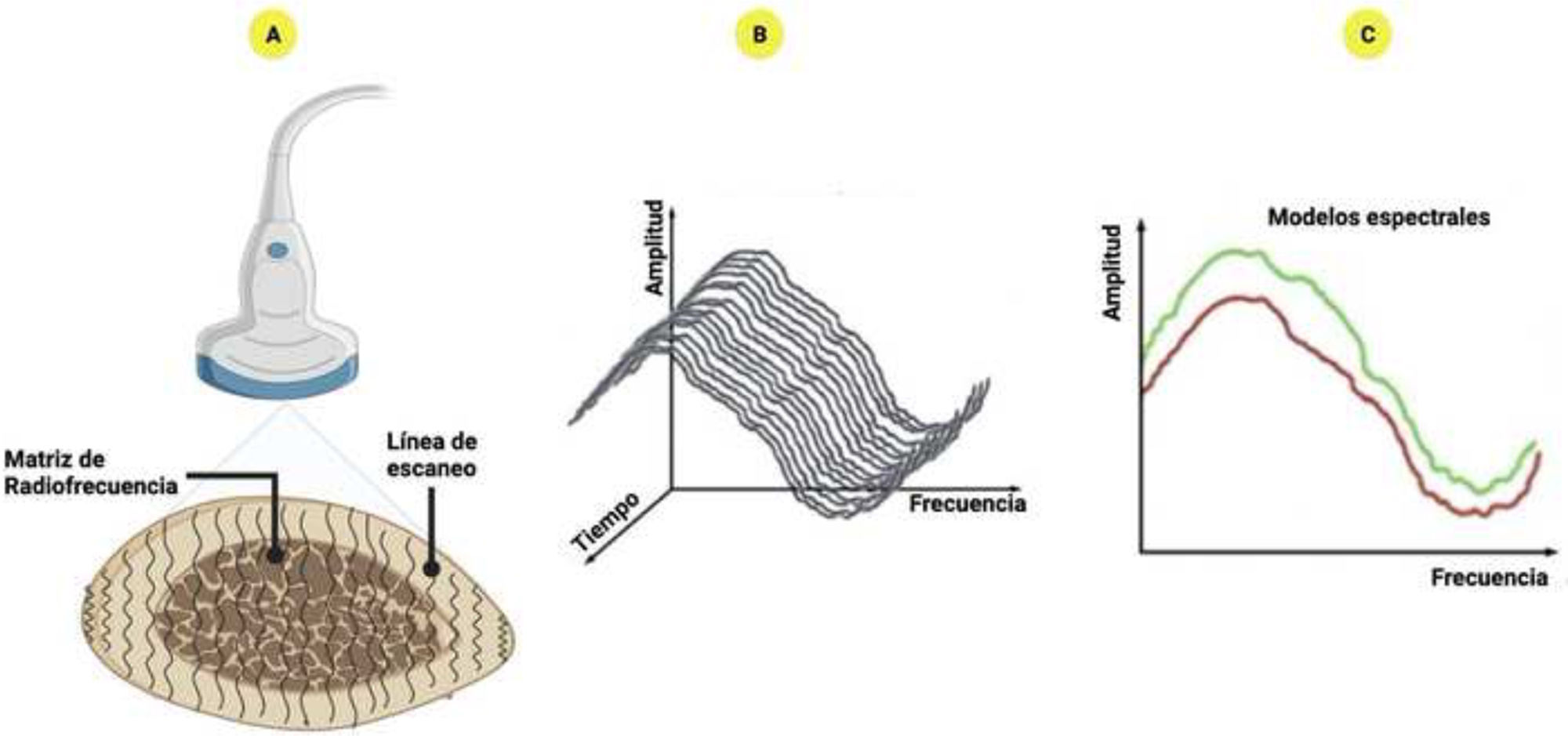
El proceso se basa en la medición espectral de pulsos de ultrasonido de retrodispersión sin filtrar, específicamente de la columna lumbar o el fémur proximal. A diferencia de las técnicas convencionales, retiene toda la información relacionada con las características del hueso insonificado9. La condición ósea es evaluada al comparar el espectro adquirido con los modelos correspondientes de osteoporosis, uno para el estado patológico y otro para el sano. Las señales adquiridas proporcionan información detallada sobre la cantidad y la calidad ósea, lo cual facilita la caracterización de la fragilidad ósea y la predicción de la probabilidad de fracturas (fig. 2)9,22.
Datos de la multiespectrometría ecográfica por radiofrecuencia (REMS): A) El análisis del REMS se caracteriza por el procesamiento de las señales nativas no filtradas de varias líneas de escaneo; B) Espectro derivado de cada línea de escaneo; C) Comparación con los modelos espectrales de sujetos sanos (verde) y osteoporóticos (rojo).
La REMS está integrada inherentemente con la imagen de ultrasonido. Las imágenes en modo-B son esenciales por 2 motivos: determinan la región de interés (ROI) para cálculos en el hueso, a través de un algoritmo de segmentación automático, y facilitan la adquisición de múltiples señales de radiofrecuencia, lo cual proporciona una base confiable para un análisis espectral posterior.
Con la REMS, cada línea ecográfica se traduce en una señal de radiofrecuencia, y el software distingue entre el cartílago y el hueso cortical y trabecular en estas señales. Se selecciona específicamente la porción trabecular para el análisis, lo que asegura que las señales de artefactos en el hueso cortical no afecten los resultados25.
Finalmente, para determinar la densidad mineral ósea, la REMS compara el espectro específico del hueso en cuestión contra una base de datos de modelos espectrales de referencia. A partir de ahí se derivan el T-score y el Z-score, utilizando la base de datos normativa de la National Health and Nutrition Examination Survey (NHANES), lo que permite la clasificación del paciente en categorías como una masa ósea normal, osteopenia u osteoporosis9.
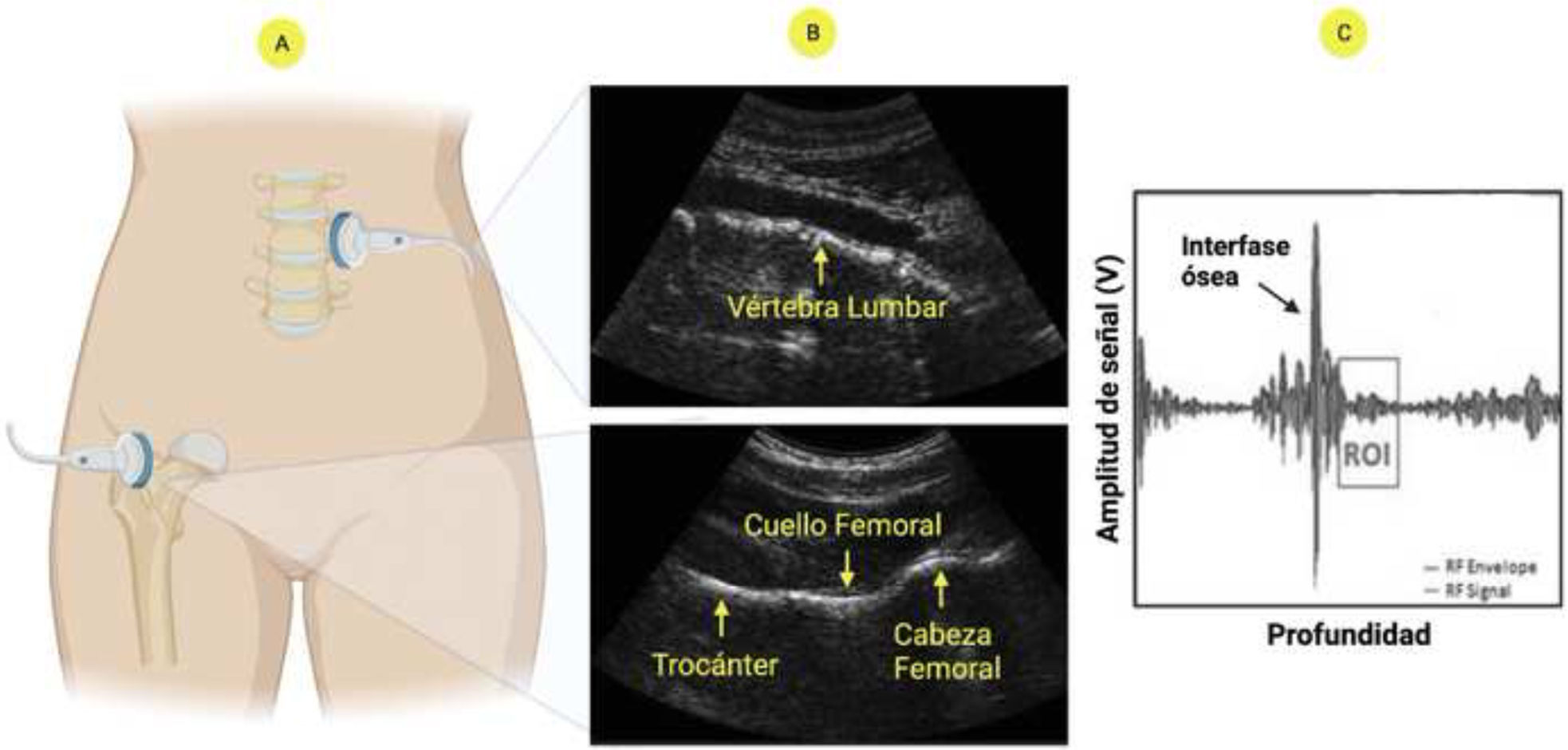
Procedimiento de medición ecográfica para evaluación óseaAjustes preliminares- •
Inicialmente, una inspección ecográfica preliminar determina el foco (21-100mm) y la profundidad (60-210mm). Estos parámetros son los únicos que requieren un ajuste manual, dependiendo de la anatomía específica del paciente, para observar la interfaz deseada, como la superficie vertebral o el cuello femoral.
- •
Se coloca la sonda ecográfica convexa en una posición transabdominal, por debajo del esternón.
- •
Una vez localizada la vértebra L1, el transductor se desplaza hasta L4, siguiendo las indicaciones visuales y auditivas del software EchoStudio®.
- •
Este proceso toma alrededor de 80s, aproximadamente 20s por vértebra.
- •
Tras el escaneo, hay un tiempo de procesamiento de imagen de 1-2min. Se generan y almacenan 100 imágenes de datos de radiofrecuencia para análisis subsecuente off-line26.
- •
La sonda ecográfica convexa se coloca paralelamente al eje de cuello del femoral, esto permite visualizar la interfaz de la cabeza femoral, el cuello y el trocánter.
- •
Una vez comienza la adquisición, el operador mantiene esta imagen por 40s, siguiendo las indicaciones del equipo. Posteriormente, se espera 60s para que el equipo procese los datos de forma automática.
- •
El espectro de radiofrecuencia extraído del hueso en estudio se compara con modelos antropométricamente similares, que están almacenados en una base de datos predefinida que incluye perfiles de huesos patológicos y no patológicos27.
- •
A partir de esta comparación se realiza la cuantificación de la DMO y se determina la categorización diagnóstica (fig. 3).
- •
Se determina el «puntaje de osteoporosis», que refleja la porción del espectro identificada como osteoporótica después del análisis espectral.
- •
A partir de este puntaje, se obtiene un valor para la DMO utilizando ecuaciones lineales.
- •
Finalmente, se calcula el «puntaje de fragilidad», diseñado para ofrecer una estimación del riesgo de fractura que es independiente de la DMO27,28.
El puntaje de fragilidad (PF) es una métrica diseñada para ofrecer una estimación del riesgo de fractura, independiente de la DMO9. Se enfoca en identificar características estructurales específicas de huesos susceptibles a fracturas, utilizando señales de radiofrecuencia no filtradas retrodispersas de la columna lumbar y la cadera26,27.
Este puntaje, que cuantifica la fragilidad esquelética general, puede discriminar entre pacientes con y sin fracturas; es más bajo en los controles y se correlaciona inversamente con los valores de la DMO medidos por DXA. El puntaje asigna un valor en un rango de 0 a 100, basado en la comparación entre el espectro específico del paciente y un espectro de referencia obtenido de pacientes «frágiles» con fracturas osteoporóticas y «no frágiles» sin fracturas9,26,27,29.
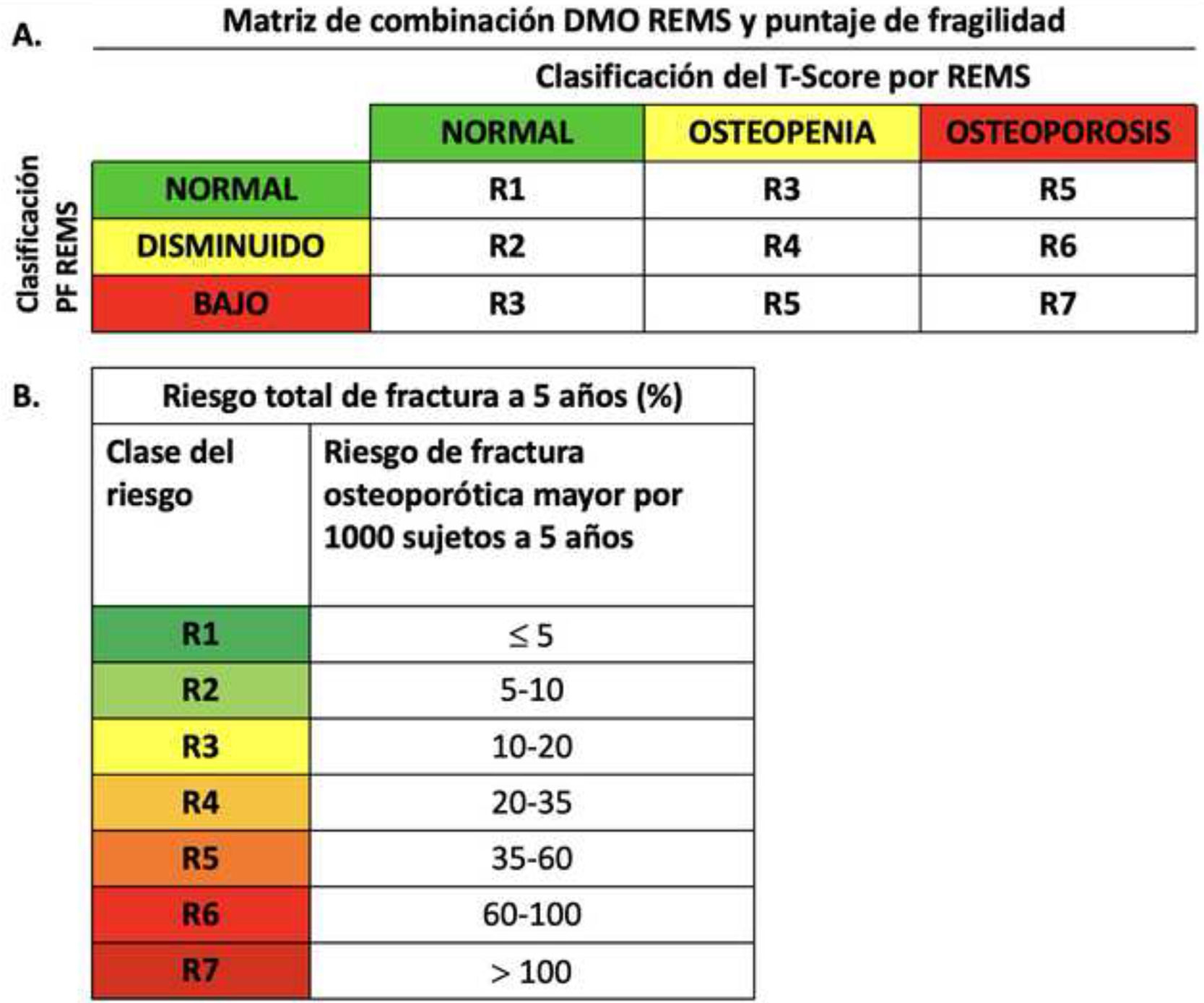
Para determinar el riesgo de fractura en pacientes, es posible integrar el T-score de la REMS con los valores del PF. Esto se hace mediante una matriz de combinación, que clasifica a los pacientes en una escala de riesgo progresiva de R1 a R7. Esta clasificación considera tanto la cadera como la columna vertebral y proporciona una estimación porcentual del riesgo de fractura a lo largo de un periodo de 5 años (fig. 4)29.
Hallazgos clave de estudios relevantesGrecco et al. encontraron una correlación lineal entre el puntaje de fragilidad y el FRAX (con la DMO femoral) para la estimación del riesgo de fractura a 10 años: fractura mayor (r=0,71, 0 p<0,001) y de cadera (r=0,70)26. Sin embargo, las correlaciones disminuyeron al usar el FRAX basado solo en factores de riesgo: para fractura osteoporótica mayor, r=0,051; y para cadera, r=0,4626.
Pisani et al. estudiaron la eficacia del PF para identificar pacientes con riesgo de fractura por fragilidad en un periodo de 5 años30. El área bajo la curva del PF de columna lumbar para distinguir entre mujeres con y sin fracturas por fragilidad incidentes fue de 0,811 (p<0,0001), significativamente superior al T-score obtenido por la REMS, 0,636 (p=0,02); y DXA, 0,603 (p=0,001)30. Para la cadera, el PF tuvo un área bajo la curva de 0,780 (p<0,001), comparado con el T-score de cadera por la REMS, 0,637 (p=0,03); y DXA, 0,611 (p=0,02). En mujeres, un PF mayor a 37,2 presentó un OR de 9,23 (IC 95%: 6,47-13,17: p<0,0001), mientras que para los T-score de la REMS y DXA, los OR fueron de 3,58 (IC 95%: 2,57-4,99; p<0,0001) y 2,5 (IC 95%: 1,81-3,44; p<0,0001), respectivamente30.
En varones, el área bajo la curva fue de 0,780 (p<0,0001) para la columna y 0,809 para la cadera (p<0,0001), superando al T-score por la REMS y DXA en ambos casos30.
Por lo tanto, podemos concluir que el PF podría convertirse en una alternativa para la valoración de la fragilidad ósea obtenida a través de un instrumento de investigación no ionizante, sin requerir conocimiento detallado de los factores de riesgo clínicos y de la DMO13,26.
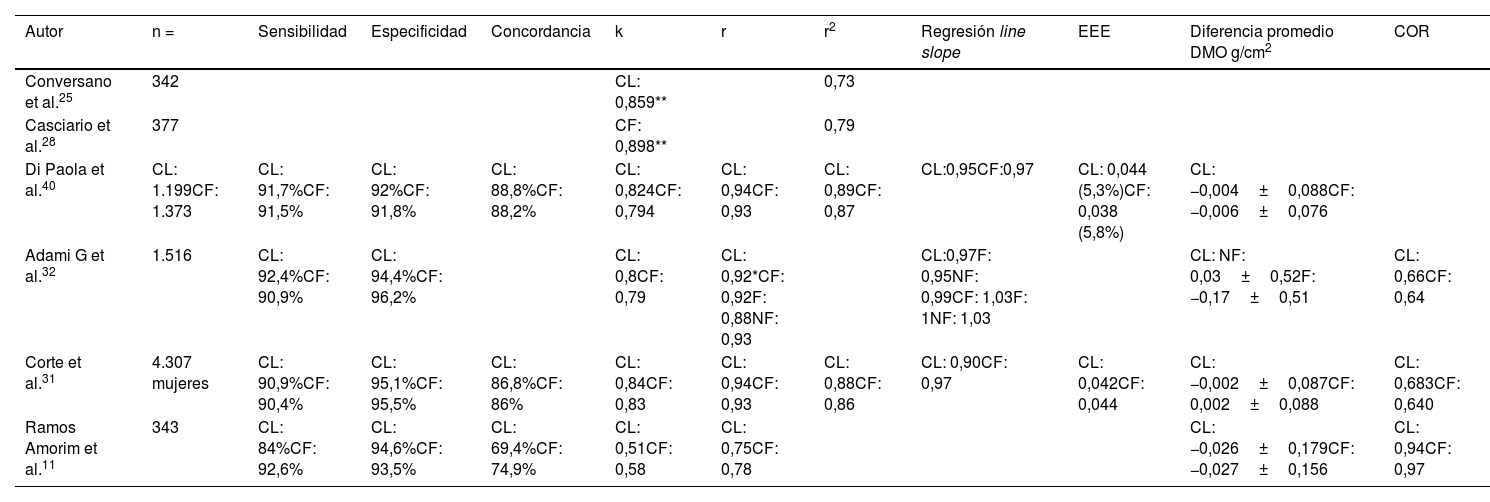
Precisión y correlación entre la REMS y la DXALos diferentes estudios en los cuales se comparó el rendimiento de la REMS con respecto a la DXA se resumen en la tabla 2.
Rendimiento de la REMS en las diferentes cohortes
| Autor | n = | Sensibilidad | Especificidad | Concordancia | k | r | r2 | Regresión line slope | EEE | Diferencia promedio DMO g/cm2 | COR |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Conversano et al.25 | 342 | CL: 0,859** | 0,73 | ||||||||
| Casciario et al.28 | 377 | CF: 0,898** | 0,79 | ||||||||
| Di Paola et al.40 | CL: 1.199CF: 1.373 | CL: 91,7%CF: 91,5% | CL: 92%CF: 91,8% | CL: 88,8%CF: 88,2% | CL: 0,824CF: 0,794 | CL: 0,94CF: 0,93 | CL: 0,89CF: 0,87 | CL:0,95CF:0,97 | CL: 0,044 (5,3%)CF: 0,038 (5,8%) | CL: −0,004±0,088CF: −0,006±0,076 | |
| Adami G et al.32 | 1.516 | CL: 92,4%CF: 90,9% | CL: 94,4%CF: 96,2% | CL: 0,8CF: 0,79 | CL: 0,92*CF: 0,92F: 0,88NF: 0,93 | CL:0,97F: 0,95NF: 0,99CF: 1,03F: 1NF: 1,03 | CL: NF: 0,03±0,52F: −0,17±0,51 | CL: 0,66CF: 0,64 | |||
| Corte et al.31 | 4.307 mujeres | CL: 90,9%CF: 90,4% | CL: 95,1%CF: 95,5% | CL: 86,8%CF: 86% | CL: 0,84CF: 0,83 | CL: 0,94CF: 0,93 | CL: 0,88CF: 0,86 | CL: 0,90CF: 0,97 | CL: 0,042CF: 0,044 | CL: −0,002±0,087CF: 0,002±0,088 | CL: 0,683CF: 0,640 |
| Ramos Amorim et al.11 | 343 | CL: 84%CF: 92,6% | CL: 94,6%CF: 93,5% | CL: 69,4%CF: 74,9% | CL: 0,51CF: 0,58 | CL: 0,75CF: 0,78 | CL: −0,026±0,179CF: −0,027±0,156 | CL: 0,94CF: 0,97 |
COR: característica operativa del receptor; EEE: error estándar de estimado.
Conversano et al. evaluaron a 342 pacientes entre 51 y 60 años, para lo cual hicieron DMO por DXA y la REMS en la columna lumbar25. Los pacientes se subdividieron en una base de referencia para construir el modelo espectral de US y una población de estudio para evaluar la repetibilidad y la precisión. La precisión de la REMS para el diagnóstico fue del 91,1%, con un K=0,859 (p<0,0001) (un valor de K>0,8 indica una concordancia casi perfecta entre la DXA y las clasificaciones por US, y un K>0,75 indica una reproducibilidad excelente, y tienden a ser altos en métodos con muy buena precisión. Se encontró además una correlación significativa entre la REMS y DXA, con r2=0,73.
Casciaro et al. evaluaron la factibilidad y precisión de la REMS en el cuello femoral comparado con DXA en 377 pacientes de entre 61 y 70 años28. Tras subdividir los pacientes para construir el modelo espectral y evaluar la repetibilidad, la precisión basada en US fue del 94,7%, con un K=0,898 (p<0,0001). Se observó una correlación significativa entre la REMS y la DXA con un r2=0,79.
Di Paola et al. evaluaron la precisión y la exactitud de la REMS en comparación con la DXA en 1.914 mujeres posmenopáusicas de entre 51 y 70 años. En este estudio, la REMS mostró una buena concordancia con la DXA; la diferencia de la DMO media (sesgo±2 DS) fue −0,004±0,088g/cm2 para la columna vertebral y −0,006±0,076g/cm2 para el cuello femoral. El análisis de regresión mostró una correlación significativa entre las 2 tecnologías: para la CL una pendiente de 0,95 y un r=0,94 (p<0,001), con un error estándar estimado (EEE)=5,3%. En CF, la pendiente fue de 0,97, r=0,93 (p<0,001) y un EEE=5,8%.
En un estudio similar en una cohorte multicéntrica de la Unión Europea, Cortet et al. evaluaron a 4.307 mujeres caucásicas de entre 30 y 90 años, con un enfoque adicional en la detección de pacientes con fracturas por fragilidad previas31. Este estudio demostró una fuerte correlación en entre la DMO medida por la REMS y DXA, con un r=0,94 para CL y r=0,93 para CF. En la evaluación de CF, se encontró una sensibilidad del 90,4% y una especificidad del 95,5%. En CL la sensibilidad fue del 90,9% y la especificidad del 95,1%.
En Latinoamérica se ha realizado un estudio, conducido por Amorim-Ramos et al. en Brasil con 343 pacientes11. La diferencia promedio en la DMO (sesgo±1,96 DS) fue de −0,026±0,179g/cm2 para CL y −0,027±0,156g/cm2 para CF.
La REMS para la predicción del riesgo de fracturaAdami et al. llevaron a cabo un estudio prospectivo y observacional para evaluar la eficacia del T-score obtenido mediante la REMS en la identificación de individuos con alto riesgo de fracturas por fragilidad32. Compararon resultados REMS y DXA en las mujeres caucásicas de 30 a 90 años y monitorizaron la aparición de nuevas fracturas durante 5 años. Las participantes se dividieron en 2 grupos según la ocurrencia de fracturas: el grupo F́ (con fracturas) y el grupo NF́ (sin fracturas). De las 1.516 mujeres inscritas, 1.370 completaron el seguimiento, y el 14% sufrió fracturas por fragilidad32. Hubo diferencias significativas en el T-score de la REMS y de la DXA entre los 2 grupos (p<0,001). Con un umbral de T-score de −2,5, la REMS diferenció a los pacientes con fracturas con una sensibilidad del 65,1% y una especificidad del 57,7% (OR=2,6; p<0,001), mientras que la DXA mostró una sensibilidad del 57,1% y una especificidad del 56,3% (OR=1,7; p=0,0032). Para el cuello femoral, la REMS tuvo una sensibilidad del 40,2% y una especificidad del 79,9% (OR=2,81; p<0,001), y la DXA tuvo una sensibilidad del 42,3%, y una especificidad del 79,3% (OR=2,68; p<0,001).
Detección de artefactosLa tecnología REMS puede descartar señales de artefactos óseos, identificando señales espectrales atípicas. Un estudio con 87 pacientes con artefactos vertebrales incluyó 22 casos con vertebroplastia, 26 con fracturas vertebrales y 38 con espondiloartrosis. En la columna lumbar, la DMO y el T-score por la REMS fueron más bajos que por la DXA, sin correlación. No obstante, en el cuello femoral hubo una alta correlación entre ambos métodos (p<0,01)33.
En cuanto a los artefactos en CF, un paciente con clavo intramedular después de una fractura pertrocantérica desplazada en el fémur izquierdo se llevó DXA del CF derecho y la REMS de ambos fémures. Se diagnosticó osteoporosis en el fémur derecho por ambas tecnologías, y en el CF izquierdo con clavo intramedular con la REMS, y se correlacionó con los valores del lado derecho33. Los resultados de pacientes con artefactos en columna y con clavos intramedulares en cadera muestran la capacidad de la REMS de evaluar sitios anatómicos no asequibles por la DXA33. Caffarelli et al., quienes evaluaron la capacidad de la REMS para diagnosticar osteoporosis en mujeres posmenopáusicas, encontraron que los T-scores de la REMS eran significativamente más bajos que los de la DXA en la columna lumbar y regiones femorales (p<0,01 y p<0,05, respectivamente)34. En presencia de espondiloartrosis, la REMS clasificó a un mayor porcentaje de mujeres osteoporóticas (35,1%) en comparación con DXA (9,3%), y de forma similar, la REMS clasificó a más pacientes como osteoporóticas (58,7 frente al 23,3% por DXA)34.
De manera anecdótica, se ha reportado el diagnóstico de fracturas ocultas de cadera (fracturas no desplazadas e invisibles en los rayos X) durante la localización del ROI en el cuello femoral, y se han observado como disrupciones de la cortical ósea29.
Poblaciones especialesTrasplantados renalesEn trasplantados renales la REMS mostró una buena concordancia con DXA al clasificar a los pacientes como osteopénicos u osteoporóticos. Sin embargo, la REMS pudo ser más sensible en algunos aspectos, especialmente en la columna lumbar35.
Artritis reumatoideLos pacientes con AR son una subpoblación particularmente susceptible a la osteoporosis. Esto se debe a la actividad crónica no controlada de la enfermedad, una menopausia precoz y el uso de corticosteroides. Se ha identificado que la comorbilidad de la osteoporosis ocurre hasta en el 46,8% de los pacientes con AR, lo que duplica tanto la prevalencia como el riesgo de fracturas en comparación con la población general33,36. Bojinca et al. evaluaron a 106 pacientes con AR, con una duración media de 3,2 años, y los compararon con 119 controles, con el objetivo de valorar la confiabilidad diagnóstica de la REMS en comparación con la DXA. Los pacientes no habían sido sometidos a DXA o tenían diagnóstico previo de osteoporosis. En este estudio se encontró una mayor prevalencia de osteoporosis entre los pacientes con AR, comparado con los controles, lo que replica los hallazgos previos de estudios con DXA37.
VaronesUn estudio realizado por Ciardo et al. demostró que la REMS es una tecnología confiable para diagnosticar osteoporosis en hombres. En 313 varones adultos, con una edad media de 57,7 años (30-87), la correlación de Pearson fue r=0,92 (r2=0,85); y en el análisis Bland-Altman, la DS fue −0,002±0,092g/cm2,38.
La concordancia en la clasificación diagnóstica hecha por la REMS y por la DXA es muy alta, con una sensibilidad del 89,1% y una especificidad del 90,7%; el K de Cohen fue de 0,71. Si se consideran las 3 posibilidades diagnósticas (normal, osteopenia, osteoporosis), la concordancia diagnóstica entre tecnologías fue del 81,5%38, lo que confirma resultados similares obtenidos en poblaciones femeninas.
Anorexia nervosaLa disminución de la DMO y el incremento del riesgo de fracturas por fragilidad son una complicación de la anorexia nervosa, por reducción del hueso cortical y trabecular, con un aumento de 7 veces el riesgo de fractura cuando se compara con mujeres de su misma edad, pero con peso normal. El uso de la DXA podría tener limitación de su uso en pacientes jóvenes, por la necesidad de hacer mediciones frecuentes. Se encontró una buena correlación entre la DMO por DXA y la DMO medida por la REMS en CL: (r=0,64; p<0,01) en CF (r=0,86; p<0,01) y CT (r=0,84; p<0,01)39.
En CL y CT hubo un acuerdo cuando se comparó con la DXA; solo en CF el Z-score por REMS fue significativamente menor, comparado con DXA (p<0,01)39.
LimitacionesLa tecnología REMS, a pesar de sus ventajas en el diagnóstico de la osteoporosis, se enfrenta a limitaciones significativas, especialmente en términos de precisión operativa. La capacitación del personal es crucial, ya que errores en la selección de la profundidad y el foco durante el escaneo pueden llevar a la exclusión de pacientes de los estudios. Un entrenamiento más riguroso y extendido (se recomiendan 3 días), ha demostrado ser efectivo para reducir estos errores40.
Las dificultades técnicas adicionales incluyen el manejo de pacientes con colostomías, cirugías abdominales recientes o dolor durante el escaneo, así como los problemas para identificar las estructuras óseas11. Estas dificultades son más pronunciadas en poblaciones especiales como individuos con obesidad extrema o diferencias étnicas, lo que requiere una mayor investigación para comprender mejor estas variaciones11,40.
ConclusionesEsta revisión de la literatura destaca a la REMS como una tecnología innovadora y prometedora en el diagnóstico de la osteoporosis. La REMS, con su capacidad para proporcionar mediciones precisas y detectar cambios sutiles en la densidad ósea, representa un avance significativo en la práctica clínica, particularmente en entornos donde las modalidades tradicionales como la DXA no están disponibles o son menos efectivas.
La principal ventaja de la REMS radica en su capacidad única para analizar la estructura ósea de manera no invasiva y con alta precisión, lo que permite una detección temprana y precisa de la osteoporosis y, por lo tanto, un manejo más efectivo de la enfermedad. Además, su portabilidad y facilidad de uso hacen de la REMS una herramienta valiosa para el seguimiento continuo de la osteoporosis, especialmente en las poblaciones con difícil acceso a la tecnología DXA. Comparativamente, la REMS ha demostrado ser tan confiable como la DXA en varios estudios, con la ventaja adicional de ser menos propenso a errores debido a artefactos óseos. Sin embargo, es importante reconocer que aún se requieren investigaciones adicionales para evaluar completamente su eficacia en diferentes subgrupos de pacientes y en comparación directa con otras tecnologías. Además, la REMS tiene el potencial de impactar positivamente en la salud pública y la economía de la salud.
La prevención de fracturas osteoporóticas y la reducción de la carga económica asociada con el manejo de la osteoporosis son posibles beneficios tangibles de la implementación más amplia de la REMS en la práctica clínica. Finalmente, a pesar de sus prometedoras aplicaciones, la REMS no está exenta de limitaciones. Se necesita más investigación, especialmente estudios a gran escala, para explorar su aplicabilidad en diferentes condiciones clínicas y poblaciones. Estas investigaciones deberían centrarse en proporcionar datos comparativos sólidos que respalden aún más la adopción de la REMS como una herramienta estándar en el diagnóstico y el manejo de la osteoporosis.
Responsabilidades éticasEsta revisión no sistemática de la literatura no implicó directamente a pacientes ni requirió la administración de tratamientos. Por lo tanto, no fue necesario solicitar consentimiento informado para recibir tratamiento o para la participación en investigación primaria. No obstante, cabe destacar que esta revisión se ha realizado con un compromiso estricto con la normativa vigente en investigación bioética. Dado el carácter secundario de la investigación y la naturaleza de los datos recopilados exclusivamente de fuentes bibliográficas, no se requirió la autorización explícita de un comité de ética institucional.
Los datos incluidos en este artículo se derivan de fuentes de dominio público o de estudios previamente publicados que habían obtenido las autorizaciones éticas pertinentes.
FinanciaciónLos autores declaran que la investigación no fue financiada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos profundamente al Dr. Adolfo Díez-Pérez por su meticulosa revisión y sus constructivos comentarios. Su contribución ha sido invaluable para la mejora de este manuscrito.