La artritis reumatoide (AR) es una enfermedad inflamatoria sistémica crónica, caracterizada por la formación de pannus, destrucción articular, deformidad, discapacidad y disminución de la calidad y de la expectativa de vida. La vía de señalización Wnt juega un papel importante en un sinnúmero de procesos fisiológicos. Desde hace algunos años ha sido implicada en la regulación de células fundamentales para la homeostasis del hueso. Estudios recientes sugieren que esta vía juega un rol en la patogénesis de la AR, mediante la sobreexpresión de inhibidores de esta vía como la proteína Dickkopf1 (DKK1), la cual afecta de manera negativa la diferenciación y la actividad de los osteoblastos. Niveles elevados de esta proteína se han asociado a mayor progresión radiológica y a actividad de la enfermedad. Sin embargo, aún no está claro el papel de esta vía y del DKK1 en la AR. Más estudios al respecto podrían ayudarnos a comprender las diferencias en la presentación clínica y en el pronóstico de esta enfermedad. Adicionalmente, podrían sugerir nuevos blancos terapéuticos.
Rheumatoid arthritis (RA) is a chronic systemic inflammatory joint disease characterized by the formation of a pannus and joint bone destruction. This leads to deformity, discapacity and a diminished quality of life and life expectancy. The Wnt signaling pathway plays an important role in a great number of physiological processes, and recently has been implicated in the regulation of key cells in bone homeostasis. Recent studies suggest that this pathway plays a role in the pathophysiology of RA by the overexpression of inhibitors like the Dickkopf1 protein (DKK1) that negatively affects the differentiation and activity of osteoblasts. High circulating levels of this protein have been associated with higher rates of radiological progression and greater disease activity in RA. Not much has been published about this subject in patients with RA, so the role of this pathway and DKK1 in RA it is not entirely clear. More studies in this area could improve our understanding about the differences in RA clinical presentation and prognosis, and even more they could provide new possible therapeutic targets for RA.
La artritis reumatoide (AR) es una enfermedad inflamatoria, sistémica, crónica, que afecta entre el 0,5 y el 2% de la población mundial. Es más común en mujeres, y aunque puede ocurrir a cualquier edad, su pico de presentación es entre los 50 y 60años1,2. Su etiología depende de la interacción de factores genéticos y ambientales. El 50% del riesgo se atribuye a factores genéticos3,4. Si no se recibe tratamiento apropiado de manera temprana, la enfermedad progresa, resultando en daño articular, erosiones y destrucción ósea, que es la principal causa de deformidad y discapacidad. Los pacientes que padecen esta enfermedad tienen un 50% más de riesgo de muerte prematura y su expectativa de vida está reducida entre 3 y 10años al compararse con la población general5,6.
La evolución de la enfermedad, sin tratamiento adecuado, implica la formación de pannus, en el cual la membrana sinovial se comporta como una masa de tejido creciente compuesta por macrófagos, osteoclastos y sinoviocitos tipo fibroblasto (FLS). En este sentido el FLS juega un papel importante, su activación y proliferación contribuyen a procesos de reclutamiento, retención y activación de células inflamatorias mediante producción de citocinas, quimiocinas y moléculas de adhesión, formación de nuevos vasos a través de reguladores de la angiogénesis y destrucción del cartílago articular y del hueso mediante la producción de colagenasas y metaloproteasas7-9.
La pérdida de masa ósea es una característica común en la AR, encontrándose desde las fases tempranas. La osteopenia periarticular se aprecia en el tejido óseo adyacente a la inflamación articular. Pueden apreciarse erosiones en la interface entre el pannus y el tejido óseo adyacente, las cuales progresan rápido, contribuyendo a deformidad y morbilidad. Además de este compromiso local, también existe pérdida ósea sistémica que afecta tanto al esqueleto apendicular como al axial, lo cual resulta en un riesgo aumentado de fractura10,11.
Estrategia de búsquedaPara la presente revisión de tema se evaluaron ensayos clínicos, estudios observacionales, trabajos originales y revisiones de tema realizados en humanos y modelos animales, publicados en idiomas inglés y español, sin límite en el tiempo de publicación. Se hizo una búsqueda primaria en Pubmed utilizando los términos MeSH: Wnt Signaling Pathway, rheumatoid arthritis, se descartaron artículos que se enfocaban en temas no reumatológicos, principalmente oncológicos y patología ocular. Adicionalmente, se realizó una búsqueda secundaria de la literatura con términos libres en relación con el tema de interés del proyecto (Dkk1, Dickkopf).
Papel de los osteoclastosEn los últimos 15 años se ha identificado al osteoclasto como la célula responsable de las erosiones focales en AR. En diferentes modelos murinos de AR, los ratones deficientes de osteoclastos no presentan erosiones óseas12,13. Adicionalmente, tanto en modelos murinos como en estudios experimentales en humanos se ha evidenciado un posible beneficio estructural con el uso de bifosfonatos en AR, al disminuir la resorción ósea mediada por estas células14,15.
La diferenciación de los osteoclastos, en el proceso normal de remodelación ósea, es dependiente de la expresión del ligando del receptor activador de factor de transcripción nuclearκB (RANKL) y la señalización a través de RANK. La unión de RANKL a RANK lleva al reclutamiento de factores asociados al receptor de TNF (TRAF) que, a su vez, resultan en la activación de factores de transcripción importantes para la diferenciación y la activación de los osteoclastos. Todo esto es contrarrestado por la osteoprotegerina (OPG), un receptor señuelo para el RANKL, que previene su interacción con el RANK. Es precisamente el balance entre RANKL y la OPG en el microambiente del hueso el principal mecanismo regulador para la diferenciación de los osteoclastos16. Utilizando técnicas de inmunohistoquímica se ha demostrado la expresión de RANKL en sitios de erosión en pacientes con AR, en la interface pannus-hueso y en sitios de erosión subcondral17. Estudios faseii con denosumab, un anticuerpo monoclonal humanizado contra el RANKL, en pacientes con AR recibiendo terapia estándar, demostraron menor progresión en índices de erosión por resonancia magnética a 6meses (índice RAMRIS) y en el índice de Sharp modificado (radiografía simple) a 6 y 12meses. En este mismo estudio se pudo apreciar un aumento significativo en la densidad mineral ósea por absorciometría de rayosX de energía dual (DXA), con disminución significativa de marcadores de resorción ósea y de la pérdida de hueso cortical medida por radiogrametría digital18-20.
Papel de los osteoblastosLos osteoblastos juegan un papel crítico en el mantenimiento de la masa ósea; no solo son responsables de la adecuada formación del hueso, sino que también modulan la diferenciación y la activación de los osteoclastos a través de la producción de RANKL y OPG. Son derivados de las células madre mesenquimales y expresan el factor de transcripción pro-osteogénico Runx2. Estas células maduran de una forma productora de matriz no proliferativa (expresa fosfatasa alcalina y colágeno tipoi) a una capaz de mineralización de matriz (expresa osteocalcina y osteopontina). Algunas de estas células quedan envueltas en la matriz ósea convirtiéndose en osteocitos, su estado terminal de diferenciación. Mientras estas células maduran hay una reducción en la producción de RANKL, con un aumento concomitante en la expresión de OPG11,21.
Actualmente no existe duda sobre la eficacia de los medicamentos antirreumáticos modificadores de la enfermedad en la supresión de la inflamación, lo cual lleva a una disminución o supresión del proceso erosivo articular. Sin embargo, la reparación de estas erosiones mediante formación nueva de hueso es poco común, aunque se ha descrito, principalmente, en pacientes con baja actividad o remisión de la enfermedad22,23.
Un estudio realizado por la Dra. Walsh et al.24, en un modelo murino de AR, demostró que la formación de hueso mineralizado está comprometida en los sitios de erosión, encontrándose un predominio de osteoblastos inmaduros. En este mismo estudio se evidenció mayor expresión de antagonistas de la vía de señalización Wnt (DKK y sFRP), que es esencial para la diferenciación del osteoblasto.
La vía de señalización WntLas moléculas Wnt son una familia de glucoproteínas solubles estructuralmente relacionadas que comparten más de 20 residuos de cisteína. Estas moléculas o ligandos activan numerosas vías de señalización mediante su unión a uno de los 10 receptores de la familia Frizzled (Fz) conocidos hasta ahora. Su descubrimiento fue influido por la investigación en modelos murinos de cáncer y retrovirus oncogénicos. Los doctores Nusse y Varmus25 observaron la integración de material genético de virus oncogénicos al genoma de ratones que posteriormente desarrollarían cáncer de mama. Este gen fue llamado Int1 (integración). Posteriormente se descubrió que este gen era el mismo Wg (Wingless) conocido en la mosca Drosophila. Luego del descubrimiento de otros genes relacionados la nomenclatura cambió, combinando Int y Wg, y el gen Int1 pasó a ser Wnt1.
Actualmente, los genes Wnt y los componentes de esta vía de señalización están implicados en un amplio espectro de fenómenos biológicos, principalmente el desarrollo embrionario (organogénesis), oncología y otros mecanismos celulares asociados a diferentes enfermedades. De manera más reciente la vía de señalización Wnt ha sido implicada en la regulación de la activación y la función de osteoblastos y osteoclastos11,25,26.
Se han descrito 3 vías distintas de señalización Wnt. En términos generales se habla de una vía canónica (dependiente de β-catenina) y una no-canónica, entre la que se encuentran una dependiente de calcio y una llamada de polaridad celular planar (dependiente de Dvl)26.
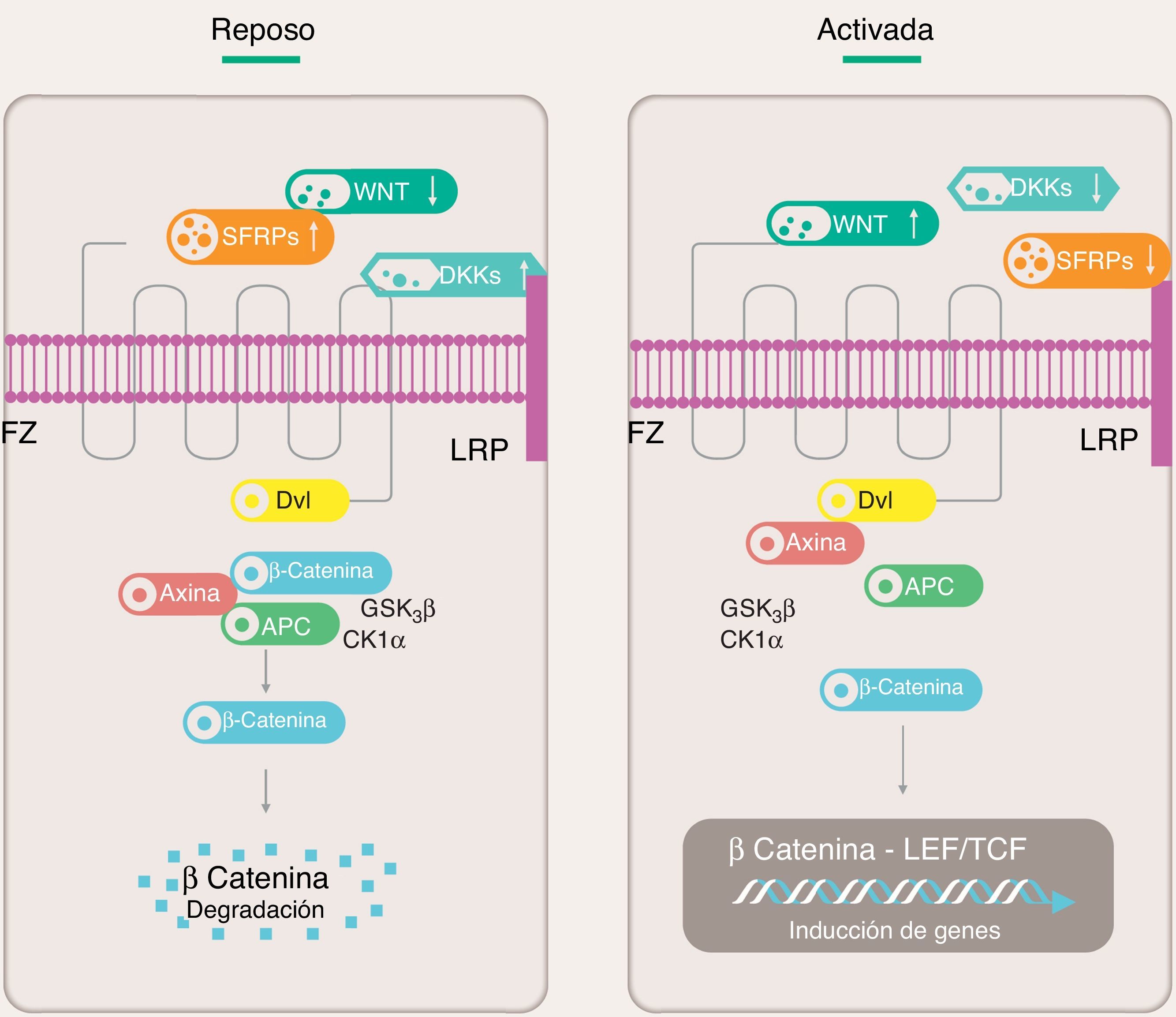
La vía canónicaLas moléculas Wnt luego de ser secretadas por células se unen al receptor Fz, el cual forma un complejo con la proteína receptora de LDL (LRP) que actúa como correceptor. Esta unión favorece una cascada de señalización en la cual participan varias proteínas intracelulares: Disheveled (Dvl), glucógeno sintasa quinasa 3β (GSK3β), poliposis adenomatosa coli (APC) y caseína quinasa1 (CK1). En reposo, la β-catenina es fosforilada por la GSK3β mientras esta forma un complejo con APC, axina y CK1 y es marcada para proteólisis mediante ubiquitinación. En estado activo, la unión Wnt con el complejo Fz/LRP activa la proteína Dvl, que en su estado activo desacopla el complejo multiproteico inactivando la GSK3β. Esto favorece la acumulación de β-catenina en el citoplasma y su translocación al núcleo donde interactúa con el factor estimulador linfoide (LEF) y de célula T (TCF) causando activación transcripcional de genes específicos7,9 (fig. 1).
Vía canónica de señalización Wnt.
APC: proteína de poliposis adenomatosa del colon; CK1α: caseína quinasa 1α; Dkk: Dickkopf; Dvl: proteína Disheveled; FZ: receptor Frizzled; GSK3β: glucógeno sintasa quinasa 3β; LEF: factor estimulador linfoide; LRP: proteína relacionada al receptor de LDL; SFRPs: proteínas secretadas relacionadas a FZ; TCF: factor estimulante de células T.
En la vía no canónica los eventos intracelulares ocurren independientemente de β-catenina. En la dependiente de calcio (Wnt/Ca2+), la señalización a través de Wnt (principalmente Wnt5a) provoca liberación de calcio intracelular y la activación de proteína quinasaC (PKC) y calmodulina quinasaii (CamKII). Por esta vía se activa también el NF-κB, lo cual parece estar implicado en la activación transcripcional de genes que codifican para citocinas y quimiocinas proinflamatorias.
Otra vía no-canónica es la de polaridad celular planar, principalmente relacionada con la regulación organizacional del citoesqueleto. En esta vía la Dvl activada favorece la activación de GTPasas de la familia Rac y Rho. Estas, a su vez, estimulan la activación de quinasas como la JNK y ROK, regulando crecimiento celular y diferenciación9,27.
Regulación de la vía canónicaLa vía canónica de señalización Wnt puede ser regulada de varias maneras, aunque los mecanismos más estudiados son a nivel extracelular. Uno de los mecanismos implica las proteínas Dickkopf (DKK), las cuales se unen al LRP evitando la formación del complejo Wnt-Fz-LRP. Además, en presencia de las proteínas Kremen forman un complejo que internaliza el LRP reduciendo su disponibilidad. La esclerostina y otras proteínas codificadas por el gen SOST bloquean esta vía uniéndose a LRP. Otro mecanismo conocido es a través de las proteínas solubles relacionadas a frizzled (sFRP), que contienen dominios que pueden unir 2 moléculas de Wnt evitando su unión al complejo receptor.
Otros mecanismos posibles, aunque menos estudiados, son a nivel citosólico, a nivel de cualquiera de los componentes del complejo terciario GSK3β-axina-APC o a nivel del núcleo, en cuanto a la disponibilidad de los factores de transcripción TCF y LEF26.
Vía de señalización Wnt en artritis reumatoideEsta vía de señalización ha sido implicada en enfermedades inflamatorias como la AR, aunque el mecanismo exacto no ha sido del todo aclarado. Utilizando inmunohistoquímica se ha podido evidenciar mayor expresión de β-catenina en tejido sinovial de pacientes con AR, al compararse con pacientes con osteoartritis o con trauma reciente. En estas mismas muestras, utilizando western blot y RT-PCR, se confirmó mayor expresión de β-catenina en los FLS. Estudios in vivo han confirmado la expresión de Wnt5a en vasos sanguíneos activados y FLS en AR, pero no en tejido normal. Varias líneas de investigación sugieren que la señalización mediada por Wnt5a juega un papel importante en las inducciones de citocinas y otras moléculas proinflamatorias, además de favorecer la angiogénesis en el tejido sinovial, regulando de manera positiva el factor de crecimiento vascular-endotelial (VEGF), y lo contrario ocurre al bloquear esta vía mediante antisuero anti-Fz528-30. Aún más, algunos componentes de esta vía parecen verse afectados por factores epigenéticos en modelos murinos de AR31.
Hay suficiente evidencia sobre la importancia de la vía de señalización Wnt en la diferenciación, proliferación y sobrevida de los osteoblastos, y la inhibición de esta vía, principalmente la canónica, afecta de manera negativa estas células y, por ende, la producción de hueso tanto en AR como en osteoporosis32.
En varios estudios se ha observado expresión aumentada de miembros de la familia DKK y sFRP (antagonistas de la señalización Wnt) en los sitios de erosión en modelos animales de AR. Asimismo, se han observado niveles elevados en suero de la proteína Dickkopf1 (DKK1) en ratones de modelos de AR comparándolos con sujetos sanos. En este tipo de modelos murinos también se ha visto que al utilizar anticuerpos neutralizantes contra DKK1 se revierte el patrón destructivo propio de la AR a uno que favorece la formación de osteófitos, como en la osteoartritis, y la inhibición de esta vía mediante DKK1 en ratones transgénicos favorece la aparición de osteopenia33,34.
Hemos ya discutido sobre los múltiples y diversos procesos biológicos en los que está involucrada esta vía. En una enfermedad tan compleja y multifactorial como la AR, la vía de señalización Wnt tiene diferentes roles en la inflamación sinovial y la remodelación ósea. Una característica importante de esta enfermedad es el desequilibrio del eje osteoblasto-osteoclasto impulsado por la inflamación articular. La vía de señalización Wnt juega un papel crítico en la diferenciación de osteoblastos a partir de precursores del linaje mesenquimal, y el DKK1, inhibidor natural de esta vía es importante en este sentido, afectando esta diferenciación y la desregulación de osteoclastos en la AR. Esta alteración no está del todo cubierta con los tratamientos actuales para la AR, que están dirigidos, principalmente, a la inflamación sinovial, lo que hace que moléculas como el DKK1 puedan ser en el futuro dianas terapéuticas en esta enfermedad y así, junto con la terapia antiinflamatoria, evitar o corregir el daño óseo35.
Sin embargo, mucha evidencia confirma que la vía de señalización Wnt se encuentra activa durante el desarrollo de la AR, favoreciendo la proliferación sinovial, la sinovitis y la formación del pannus. Por ejemplo, la activación de esta vía contribuye a la formación de osteófitos y al modelo anabólico de remodelación ósea que se puede apreciar en los pacientes con espondilitis anquilosante, mientras que su inhibición favorece erosiones óseas y un modelo catabólico en pacientes con AR. Por el contrario, en los FLS y condrocitos la activación de la vía Wnt promueve la destrucción de la matriz del cartílago, la proliferación del tejido sinovial y el reclutamiento de células inflamatorias9,36-38.
DKK1 en la artritis reumatoideLa DKK1 es un importante regulador de la masa ósea. Su mayor expresión se asocia a osteopenia u osteoporosis39, y su disminución, a mayor masa ósea; de hecho, actualmente se llevan a cabo estudios con anticuerpos dirigidos contra esta molécula para enfermedades como la osteoporosis40.
En un subgrupo de pacientes (113 de 632) escogido de manera aleatoria, que previamente habían participado en un estudio de AR temprana que comparó la eficacia de etanercept vs. metotrexato41, se realizaron mediciones de DKK1 por ELISA y se buscó la asociación con mayor progresión radiológica teniendo en cuenta el score modificado de Sharp. En todos los pacientes, cada aumento en una desviación estándar en los niveles de DKK1 se asoció con un RR de 1,65 de progresión en erosiones óseas (IC95%: 1,06-2,54), y de la misma manera, al separar los grupos por terciles el RR en el tercil superior fue de 4,6 (1,46-13,8) al compararse con los 2 inferiores. No se encontró asociación entre los niveles de DKK1 y la disminución del espacio articular, lo cual está en concordancia con el papel descrito de este factor en la regulación de la remodelación ósea42.
En un estudio realizado en población china en el cual se tomaron muestras de 300 pacientes con AR, 150 con duración de la enfermedad menor a un año y 150 mayor a 5años, se buscó comparar la expresión tanto de DKK1 y OPG (medidos por ELISA) en diferentes estadios de la enfermedad y analizar su asociación con diferentes perfiles clínicos según edad, género, reactantes de fase aguda y mediciones clínicas. Adicionalmente, se tomaron radiografías de manos en los pacientes con AR y fueron evaluadas por radiólogos expertos utilizando el método de Sharp-van der Heijde. Fueron excluidos los pacientes que recibían tratamiento anti-TNF. Se encontró que los niveles de DKK1 estaban elevados en pacientes con enfermedad tardía al compararse con los de enfermedad temprana y población sana (5,87±3,03ng/ml vs. 1,67±1,15). Por otro lado, al compararse con los controles sanos, los niveles de OPG se encontraban elevados en estadios tempranos, no hallándose diferencia significativa al compararse con estadios más avanzados43.
En otro estudio realizado por el mismo grupo se tomaron 100 pacientes con AR, 40 de ellos tratados con infliximab y 30 con anakinra, y el mismo tratamiento se sostuvo por 6meses. Como grupo control se tomaron 140 individuos: 30 con osteoartritis, 30 con espondilitis anquilosante, 30 con lupus eritematoso sistémico, 10 con esclerosis sistémica y 40 controles sanos. Se realizaron mediciones de DKK1 y OPG por ELISA, VSG, PCR, anti-CCP y factor reumatoide, así como radiografías de manos y muñecas evaluadas con el método de Sharp. Las concentraciones de DKK1 fueron significativamente mayores en los pacientes con AR al compararse con el resto de grupos. Se encontró, también, asociación entre los niveles aumentados de DKK1 con la presencia de erosiones óseas, disminución del espacio articular y puntaje de Sharp. Igualmente, se halló correlación de DKK1 con los niveles de VSG y PCR. Luego de 6meses de tratamiento se encontró que los niveles de DKK1 disminuyeron en el subgrupo de pacientes que recibieron infliximab y anakinra. En el caso de infliximab esto fue cierto en los pacientes que se catalogaron como respondedores al tratamiento (30 de 40 pacientes): 6.653,1±3.336pg/ml vs. 3.424,6±1.918pg/ml, con una p significativa44.
Un estudio reciente en el cual se tomaron pacientes con AR del estudio EURIDISS, que incluía inicialmente 238 pacientes con AR menor de 4años de duración y seguidos longitudinalmente y evaluados luego de 1, 2, 5 y 10años, se buscó la asociación entre DKK1 y pérdida ósea periarticular medida por radiogrametría digital con rayosX (DXR). Un total de 136 pacientes tenían radiografías disponibles para un seguimiento de 5años y muestras de sangre desde el inicio. Se encontró que los niveles plasmáticos de DKK1 basales fueron significativamente más altos en los pacientes que desarrollaron osteopenia periarticular al año (2.010pg/ml vs. 1.332pg/ml; p=0,03). Esta diferencia no se observó en los seguimientos a 2 y 5años45. De manera llamativa, un estudio realizado en este mismo grupo de pacientes no encontró asociación entre los niveles basales de DKK1 y la progresión radiológica medida por SHS46.
El Dr. De Rooy47 publicó hace poco un artículo evaluando el componente genético de esta molécula; el estudio evaluó variantes genéticas en diferentes proteínas que intervienen en la vía de señalización Wnt en relación con la progresión del daño articular medido por el método de SHS. El estudio incluyó más de 1.000 pacientes de 4 cohortes europeas, incluyendo la de Leiden. Luego de ajustes y correcciones, solo 3 variantes de un solo nucleótido (SNP) para DKK1 mantuvieron significación estadística y, de ellas, la que más se asoció a daño articular (rs1896368) también se asoció a mayores niveles séricos de DKK1 respecto a los otros genotipos. Aportando más a la evidencia que la vía de señalización Wnt (especialmente la canónica) y la DKK1, en particular, juega un papel importante en la mediación del daño articular en AR48.
ConclusiónLa vía de señalización Wnt juega un papel muy importante en la regulación de la remodelación ósea, y varios de sus componentes se encuentran involucrados en la patogénesis de diferentes enfermedades que tienen al hueso como órgano blanco. En el caso de la osteoporosis, por ejemplo, se encuentra en estudio un anticuerpo monoclonal contra la esclerostina (uno de los inhibidores de esta vía) que en ensayos clínicos faseii ha demostrado efectividad mejorando rápidamente la densidad mineral ósea y disminuyendo los marcadores de resorción ósea49,50. Se han realizado esfuerzos para crear anticuerpos neutralizantes para DKK1 con fines terapéuticos, aunque sin muchos avances32.
Existen pocos estudios, desde el punto de vista clínico, acerca del papel de esta vía en AR. Sin embargo, parece consistente la asociación entre los niveles de DKK1 y una mayor progresión del daño óseo, incluso en lupus eritematoso sistémico, en el cual este tipo de compromiso es poco usual51. Algunos estudios sugieren asociación entre los niveles de DKK1 con la actividad de la enfermedad y reactantes de fase aguda43,44, aunque se requieren más estudios antes de poder afirmar su utilidad como biomarcador. Futuras investigaciones permitirán ampliar el conocimiento sobre esta vía y las moléculas implicadas, pudiendo sugerir nuevos biomarcadores y blancos terapéuticos en AR.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.