Evaluar el impacto de los polimorfismos de los genes TNFA e IL10 y su asociación con el fenotipo clínico de la artritis psoriásica (APs).
Materiales y métodosSe incluyó a 104 individuos venezolanos, no relacionados, agrupados en 52 pacientes con APs, que reunieron los criterios CASPAR, y 52 individuos sanos, sin antecedentes familiares de psoriasis. Los polimorfismos de los genes TNFA e IL10 se determinaron por PCR-SSP.
ResultadosEl genotipo GA y alelo A del polimorfismo TNFA-238G/A parecen conferir protección contra el desarrollo de APs (OR: 0,31, IC del 95%: 0,92 -1,05, p: 0,02). El genotipo GA del polimorfismo TNFA-308G/A está asociado con una edad de inicio de APs tardía (GA=60±13,17 años vs. GG=43,55±14,29 años; p=0,002) y el genotipo GG del polimorfismo IL10-1082A/G con un intervalo mayor entre el inicio de la psoriasis y el desarrollo de la APs (GG=27,4±24,11 años, GA=5,47±7,23 años, AA=7,86±8,51 años, p=0,001). Los genotipos CC de IL10-819C/T e IL10-592C/A confieren riesgo de daño a las articulaciones interfalángicas distales (OR: 4,79, p=0,026).
ConclusionesEl polimorfismo TNFA-238G/A desempeña un papel importante en el desarrollo de la APs en mestizos venezolanos. Asimismo, los polimorfismos TNFA-308G/A, IL10-1082A/G, -819C/T y -592C/A pueden modificar la expresión clínica de la APs.
To evaluate the impact of polymorphisms of TNF-alpha (TNFA) and IL10 genes and their association with clinical phenotypes of psoriatic arthritis (PsA).
Materials and methodsThe study included 104 unrelated Venezuelan individuals, grouped into 52 patients with PsA, who fulfilled the CASPAR criteria, and 52 healthy individuals with no family history of psoriasis. The polymorphisms of the TNFA and IL10 genes were determined by Single Specific Primer-Polymerase Chain Reaction (SSP-PCR).
ResultsThe GA genotype and A allele of the TNFA-238G/A polymorphism appears to confer protection against the development of PsA (OR: 0.31, 95% CI: 0.92 -1.05, P=.02). The GA genotype of the TNFA-308G/A polymorphism is associated with a late onset age of PsA (GA=60±13.17 years vs. GG=43.55±14.29 years, P=.002), and the GG genotype of the IL10 -1082A/G polymorphism with a longer time interval between the onset of psoriasis and the development of PsA (GG=27.4±24.11 years, GA=5.47±7.23 years, AA=7.86±8.51 years, P=.001). The CC genotypes of IL10-819C/T and IL10-592C/A confers risk of damage to distal interphalangeal joints (OR: 4.79, P=.026)
ConclusionsThe TNFA-238G/A polymorphism plays an important role in the development of PsA in mixed-race Venezuelans. Likewise, TNFA-308 G/A, IL10 -1082 A/G, -819C/T, -592C/A polymorphisms may modify the clinical expression of PsA.
La psoriasis (Ps) es una condición inflamatoria de la piel que afecta al 2% de la población y entre el 6 y el 42% de estos pacientes pueden desarrollar inflamación articular, la cual se denomina artritis psoriásica (APs). La APs produce una afectación clínica muy heterogénea, pudiendo afectar a articulaciones periféricas, columna vertebral y entesis con diferentes patrones y severidad. Tanto la Ps como la APs son enfermedades multifactoriales, en las que la interacción de los genes y el ambiente desempeñan un papel importante en su desarrollo. Estudios epidemiológicos han mostrado una fuerte agregación familiar para ambas enfermedades1.
El factor de necrosis tumoral alfa (TNF-α) es una molécula clave en la respuesta inflamatoria y se ha demostrado que desempeña un papel importante en la génesis y mantenimiento de la Ps y la APs. En las lesiones de piel y de la membrana sinovial de los pacientes con Ps y APs hay una expresión incrementada de TNF-α y su bloqueo con fármacos biológicos mejora sustancialmente ambas enfermedades2. Dos polimorfismos, ubicados en la región promotora del gen TNFA, afectan a la expresión de TNF-α y han sido ampliamente estudiados. Estudios in vitro han demostrado que el alelo A del polimorfismo TNFA-308G/A está asociado con una expresión incrementada de TNF-α3 y el alelo A del polimorfismo TNFA-238G/A con una expresión disminuida4. La influencia de los polimorfismos TNFA-308G/A y TNF-238 G/A en Ps y APs se ha estudiado en distintas poblaciones, observándose diferentes resultados y en algunos casos contradictorios, debido probablemente a diferencias étnicas y metodológicas5-12.
Otra citocina importante es la interleucina-10 (IL-10), la cual posee funciones principalmente antiinflamatorias13. Esta citocina se ha observado disminuida en suero y lesiones de pacientes con Ps14, aunque algunos estudios han mostrado un aumento en el líquido sinovial y la membrana sinovial de pacientes con APs15. En la región promotora del gen IL10 existen varios polimorfismos, con repercusiones funcionales en la expresión del gen16. Diferentes estudios de asociación de variabilidad del gen IL10 con APs han sido realizados en distintas poblaciones, observándose resultados diversos6,8,17.
Considerando que las citocinas IL-10 y TNF-α desempeñan un papel importante en la APs y que la variabilidad de los genes que las codifican puede afectar a la expresión de las mismas, planteamos evaluar el impacto de los polimorfismos de los genes TNFA e IL10 y su asociación con el fenotipo clínico de la APs.
Materiales y métodosEl estudio fue realizado en 52 pacientes venezolanos, no relacionados, con APs que reunieron los criterios CASPAR18. Fueron excluidos los pacientes menores de 18 años, aquellos que tuviesen algún familiar con APs participando en este estudio y pacientes con determinación o sospecha de solapamiento con enfermedades del colágeno. Los pacientes fueron remitidos de diferentes consultas de reumatología del país, tanto pública como privada, en un período de 14 meses.
El grupo control estuvo conformado por 52 individuos sanos venezolanos, no relacionados, sin antecedentes personales o familiares de Ps o APs.
Datos demográficos y otras características de la enfermedad fueron recolectados previamente, información que se utilizó para establecer subgrupos clínicos, severidad y daño de la enfermedad, además, del tipo de tratamiento. Asimismo, se recolectaron las comorbilidades más frecuentes en estos pacientes.
Los pacientes firmaron un consentimiento informado aprobado por el Comité de Bioética del IVIC, en su sesión N.° 1570, DIR-1067/1570/2016 0130/09, y del Hospital Clínico Universitario de Caracas-UCV, en su reunión ordinaria N.° 16, CBE N° 52/2014.
Extracción del ADN genómicoEl ADN genómico fue extraído a partir de células mononucleares de sangre periférica según el protocolo descrito por Bunce, en el cual se utiliza cloroformo como solvente orgánico19.
Genotipificación del gen TNFALa variante TNFA-308G/A (rs1800629) se determinó usando los iniciadores descritos por Verjans et al.20, pero usando un protocolo modificado por el laboratorio, que consistió en incrementar la temperatura de alineamiento de los iniciadores a 64°C, optimizándose así la especificidad de la reacción. Estos SNP de la región promotora fueron analizados por reacción en cadena de la polimerasa utilizando iniciadores de secuencia específicas (PCR-SSP). La variante TNFA-238G/A (rs361525) se determinó usando los iniciadores y el protocolo descrito previamente por Magalhaes et al.12. Para cada polimorfismo (-238 y -308) se prepararon 2 mezclas de reacción, una para el alelo ancestral o silvestre (-238G y -308 G, respectivamente) y otra para el alelo mutado o poco frecuente (-238A y -308 A, respectivamente).
Genotipificación del gen IL10Las variantes IL10-1082A/G (rs1800896), -819C/T (rs1800871) y -592C/A (rs1800872) se determinaron usando los iniciadores y el protocolo descritos por Kingkeow et al.21. Estos SNP de la región promotora fueron analizados por PCR-SSP. Para cada polimorfismo (-1082, -819 y -592) se prepararon 2 mezclas de reacción, una para el alelo ancestral o silvestre (-1082G, -819C y -592C, respectivamente) y otra para el alelo mutado o poco frecuente (-1082A, -819 T y -592A, respectivamente).
Análisis estadísticoLas frecuencias alélicas y genotípicas fueron calculadas por conteo directo. El equilibrio de Hardy-Weinberg (H-W) fue calculado a través de la prueba ji cuadrado (χ2). La significación estadística de las diferencias de frecuencias (alelos, genotipos, haplotipos) entre los grupos fue estimada por la prueba χ2 usando tablas de contingencia 2×2. Los valores de p se consideraron significativos cuando el valor de p<0,05. Las correlaciones entre la variabilidad de los genes estudiados y las distintas variables clínicas se realizaron utilizando el paquete estadístico IBM SPSS Statistic 17, aplicando el test t de Student para comparaciones de solo 2 grupos y ANOVA cuando existieron más de 2 grupos. La determinación de haplotipos de los polimorfismos de la región promotora del gen del TNF (-308, -238) e IL10 (-1082, -819, -592) se realizó con el programa SNPStats22.
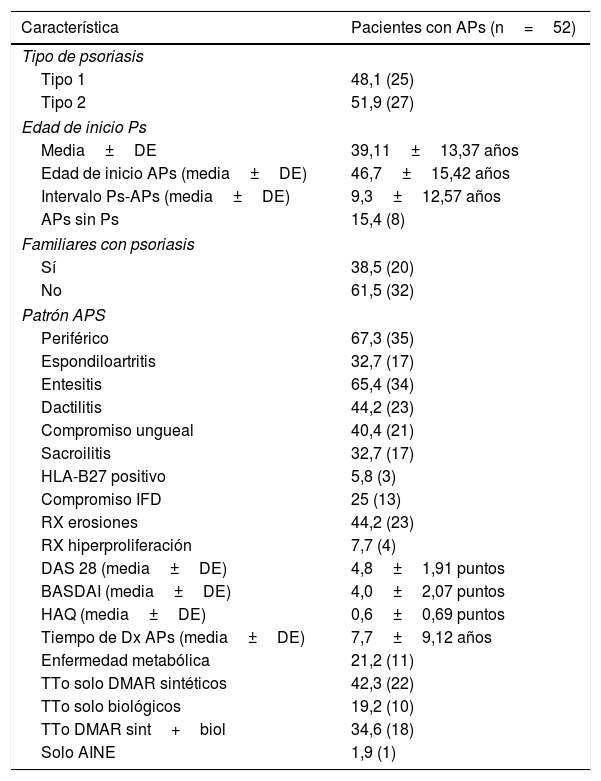
ResultadosCaracterísticas demográficas y clínicasEl promedio de edad de los pacientes con APs es significativamente mayor al del grupo control (54,42 años vs. 44,63 años, respectivamente; p=0,001); sin embargo, en cuanto al sexo no se observaron diferencias significativas entre ambos grupos. Con respecto a las características clínicas, el 48% de los pacientes presentaba Ps tipo 1, es decir, las lesiones de piel aparecieron por primera vez antes de los 40 años, y el 38,5% tenía antecedentes familiares de Ps. La enfermedad articular fue clasificada en 2 grupos: una forma periférica que comprendió el 67,3% de los pacientes y otra forma que adicionalmente tenía compromiso axial (sacroilitis), llamada espondiloartritis, que comprendió el 32,7% de los pacientes. Otras manifestaciones, como la afectación de entesis, compromiso ungueal, dactilitis, compromiso radiológico y los tipos de tratamientos farmacológicos, además de los índices compuestos de actividad de la enfermedad y función, como el DAS 28 y BASDAI y HAQ, son mostrados en la tabla 1.
Características clínicas de los pacientes
| Característica | Pacientes con APs (n=52) |
|---|---|
| Tipo de psoriasis | |
| Tipo 1 | 48,1 (25) |
| Tipo 2 | 51,9 (27) |
| Edad de inicio Ps | |
| Media±DE | 39,11±13,37 años |
| Edad de inicio APs (media±DE) | 46,7±15,42 años |
| Intervalo Ps-APs (media±DE) | 9,3±12,57 años |
| APs sin Ps | 15,4 (8) |
| Familiares con psoriasis | |
| Sí | 38,5 (20) |
| No | 61,5 (32) |
| Patrón APS | |
| Periférico | 67,3 (35) |
| Espondiloartritis | 32,7 (17) |
| Entesitis | 65,4 (34) |
| Dactilitis | 44,2 (23) |
| Compromiso ungueal | 40,4 (21) |
| Sacroilitis | 32,7 (17) |
| HLA-B27 positivo | 5,8 (3) |
| Compromiso IFD | 25 (13) |
| RX erosiones | 44,2 (23) |
| RX hiperproliferación | 7,7 (4) |
| DAS 28 (media±DE) | 4,8±1,91 puntos |
| BASDAI (media±DE) | 4,0±2,07 puntos |
| HAQ (media±DE) | 0,6±0,69 puntos |
| Tiempo de Dx APs (media±DE) | 7,7±9,12 años |
| Enfermedad metabólica | 21,2 (11) |
| TTo solo DMAR sintéticos | 42,3 (22) |
| TTo solo biológicos | 19,2 (10) |
| TTo DMAR sint+biol | 34,6 (18) |
| Solo AINE | 1,9 (1) |
Las frecuencias se muestran en porcentaje y entre paréntesis el número de individuos.
AINE: antiinflamatorios no esteroideos; DE: desviación estándar; DMAR: fármacos reumáticos modificadores de la enfermedad; Dx: diagnóstico; IFD: interfalángicas distales; RX: radiología; TTo: tratamiento, sint+biol: fármacos sintéticos y biológicos administrados conjuntamente.
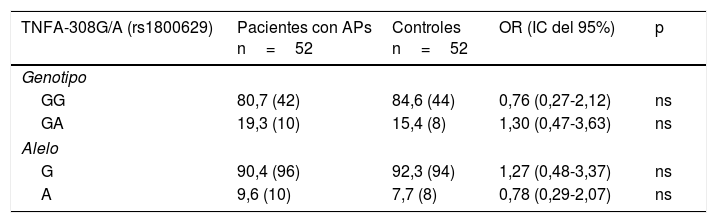
Se pudo constatar la existencia de equilibrio de H-W para la distribución genotípica de los sitios polimórficos TNFA-308G/A y TNFA-238G/A en los individuos sanos. En la tabla 2 se muestra la distribución de las frecuencias alélicas y genotípicas de las variantes TNFA-308G/A y TNFA-238G/A, observándose para ambos polimorfismos y grupos estudiados, solo 2 de los 3 genotipos posibles (GG y GA). Al establecer comparaciones de las frecuencias genotípicas y alélicas de la variante TNFA-308G/A, entre pacientes con APs y controles, no se observaron diferencias significativas. En contraste, para la variante TNF-238G/A se observaron frecuencias incrementadas de manera significativa para el genotipo GG (OR=3,22, IC del 95%, 0,95-10,80, p=0,025) y el alelo G (OR=2,95, IC del 95%, 0,91-9,61, p=0,03) en los pacientes con APs con respecto a los controles, y una frecuencia significativamente incrementada del genotipo GA (OR=0,31, IC del 95%, 0,09-1,05, p=0,025) y el alelo A (OR=0,03, IC del 95%, 0,10-1,09, p=0,036) en los controles con respecto a los pacientes.
Distribución de las frecuencias genotípicas y alélicas de las variantes -308G/A (rs1800629) y -238G/A (rs361525) del gen TNFA en pacientes con artritis psoriásica y controles
| TNFA-308G/A (rs1800629) | Pacientes con APs n=52 | Controles n=52 | OR (IC del 95%) | p |
|---|---|---|---|---|
| Genotipo | ||||
| GG | 80,7 (42) | 84,6 (44) | 0,76 (0,27-2,12) | ns |
| GA | 19,3 (10) | 15,4 (8) | 1,30 (0,47-3,63) | ns |
| Alelo | ||||
| G | 90,4 (96) | 92,3 (94) | 1,27 (0,48-3,37) | ns |
| A | 9,6 (10) | 7,7 (8) | 0,78 (0,29-2,07) | ns |
| TNFA-238G/A (rs361525) | Pacientes con APs n=52 | Controles n=52 | OR (IC del 95%) | p |
|---|---|---|---|---|
| Genotipo | ||||
| GG | 92,3 (48) | 78,8 (41) | 3,22 (0,95-10,88) | 0,025 |
| GA | 7,7 (4) | 21,2 (11) | 0,31 (0,09-1,05) | 0,025 |
| Alelo | ||||
| G | 96,2 (100) | 89,4 (93) | 2,95 (0,91-9,61) | 0,03 |
| A | 3,8 (4) | 10,6 (11) | 0,39 (0,10-1,09) | 0,03 |
La frecuencia está expresada en porcentaje. Los valores mostrados entre paréntesis representan el número de individuos portadores del genotipo para el sitio polimórfico estudiado.
IC: intervalo de confianza, ns: no significativo; p: valor de probabilidad (p ¿ 0,05=valor significativo).
Se observó en ambos grupos estudiados la existencia de los 4 haplotipos posibles TNF-308/-238, que por orden de frecuencia fueron: GG, GA, AG y AA. Este último se observó en un individuo control y es considerado un haplotipo raro debido a la baja frecuencia del alelo A en ambos polimorfismos de TNFA. Asimismo, no se observó asociación entre los haplotipos y la APs.
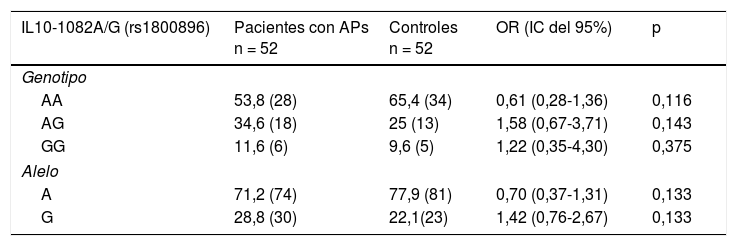
Distribución de las frecuencias genotípicas y alélicas del polimorfismo -1082 (rs1800896), -819 (rs1800871) y -592 (rs1800872) del gen IL10 en pacientes con artritis psoriásica y controles sanosSe pudo constatar la existencia de equilibrio de H-W para la distribución genotípica de los sitios polimórficos IL10-1082A/G, IL10-819C/T y IL10-592C/A en los individuos sanos. En la tabla 3 se muestra la distribución de las frecuencias alélicas y genotípicas de las variantes IL10-1082A/G, IL10-819C/T e IL10-592C/A, observándose para cada polimorfismo los 3 genotipos posibles en ambos grupos estudiados. Al establecer comparaciones de las frecuencias genotípicas y alélicas de las variantes IL10-1082A/G, IL10-819C/T e IL10-592C/A entre pacientes con APs y controles sanos no se observaron diferencias significativas.
Distribución de las frecuencias genotípicas y alélicas de las variantes -1082 (rs1800896), -819 (rs1800871) y -592 (rs1800872) del gen IL10 en pacientes con artritis psoriásica y controles sanos
| IL10-1082A/G (rs1800896) | Pacientes con APs n = 52 | Controles n = 52 | OR (IC del 95%) | p |
|---|---|---|---|---|
| Genotipo | ||||
| AA | 53,8 (28) | 65,4 (34) | 0,61 (0,28-1,36) | 0,116 |
| AG | 34,6 (18) | 25 (13) | 1,58 (0,67-3,71) | 0,143 |
| GG | 11,6 (6) | 9,6 (5) | 1,22 (0,35-4,30) | 0,375 |
| Alelo | ||||
| A | 71,2 (74) | 77,9 (81) | 0,70 (0,37-1,31) | 0,133 |
| G | 28,8 (30) | 22,1(23) | 1,42 (0,76-2,67) | 0,133 |
| IL10-819C/T (rs1800871) | Pacientes con APs n = 52 | Controles n = 52 | OR (IC del 95%) | p |
|---|---|---|---|---|
| Genotipo | ||||
| CC | 50 (26) | 42,3 (22) | 1,36 (0,62-2,95) | 0,216 |
| CT | 38,5 (20) | 36,5 (19) | 1,08 (0,49-2,40) | 0.420 |
| TT | 11,5 (6) | 21,2 (11) | 0,48 (0,16-1,43) | 0,093 |
| Alelo | ||||
| C | 69,2 (72) | 60,6 (63) | 1,46 (0,82-2,59) | 0,096 |
| T | 30,8 (32) | 39,4 (41) | 0,68 (0,38-1,21) | 0,096 |
| IL10-592 (rs1800872) | Pacientes con APs n=52 | Controles n=52 | OR (IC del 95%) | p |
|---|---|---|---|---|
| Genotipo | ||||
| AA | 11,5 (6) | 21,2 (11) | 0,48 (0,16-1,43) | 0,093 |
| AC | 38,5 (20) | 36,5 (19) | 1,08 (0,49-2,40) | 0,420 |
| CC | 50 (26) | 42,3 (22) | 1,36 (0.62-2,95) | 0,217 |
| Alelo | ||||
| A | 30,8 (32) | 39,4 (41) | 0,68 (0,38-1,21) | 0,092 |
| C | 69,2 (72) | 60,6 (63) | 1,46 (0,82-2,59) | 0,096 |
Los valores mostrados entre paréntesis representan el número de individuos portadores del genotipo para el sitio polimórfico estudiado. La frecuencia está expresada en porcentaje.
IC: intervalo de confianza, p: valor de probabilidad (p ¿ 0,05=valor significativo).
Se observó en ambos grupos estudiados la existencia de 3 de los 4 posibles haplotipos -IL10-1082/-592/-819, que por orden de frecuencia fueron: ATA, ACC y GCC. Sin embargo, no se observó asociación entre los haplotipos y APs.
Correlación entre las características clínicas de los pacientes con artritis psoriásica y los polimorfismos de los genes TNFA e IL10Al correlacionar las diferentes manifestaciones clínicas con los polimorfismos genéticos estudiados, se observaron diferencias de medias y asociaciones significativas entre:
- 1.
El genotipo GA del polimorfismo TNFA-308G/A y un inicio de edad más tardía para desarrollar APs (GA=60±13,17 años; GG=43,55±14,29; p=0,002).
- 2.
El genotipo GG del polimorfismo IL10-1082A/G con un mayor intervalo o latencia Ps-APs, es decir, mayor tiempo entre la aparición de la APs posterior al inicio de la Ps (GG=27,4±24,11 años, GA=5,47±7,23 años, AA=7,8±8,51 años, p=0,001).
- 3.
La presencia del alelo T (TT o CT) del polimorfismo IL10-819C/T y del alelo A (AA o CA) del polimorfismo IL10-592C/A con protección a erosiones y pérdida del espacio articular de las articulaciones interfalángicas distales (IFD) (OR: 0,20, IC del 95%, 0,049-0,880, p = 0,026). En contraste, los genotipos CC de -819C/T y -592C/A confieren riesgo de daño a las articulaciones IFD (OR: 4,79, IC del 95%, 1,13-20,20, p = 0,026).
Para las demás características y manifestaciones de la enfermedad no se observaron diferencias significativas.
DiscusiónLa APs es una enfermedad multifactorial, donde la interacción de una combinación de variantes o alelos comunes en la población con baja penetrancia, junto con factores desencadenantes del medio ambiente determina la aparición de la enfermedad1. La heterogeneidad clínica de la APs podría ser reflejo de la heterogeneidad genética que existe en estos pacientes y algunos genes polimórficos, involucrados en ciertas vías inflamatorias, pudieran estar relacionados con el riesgo a desarrollar APs o podrían ser modificadores del fenotipo de la enfermedad1,23. Algunas citocinas tienen una importancia considerable en la patogenia de la enfermedad, por ello se planteó estudiar los polimorfismos de los genes que codifican para 2 de estas citocinas, como son TNF-α e IL-10. Aunque estudios de asociación entre estos genes y APs se han realizado en poblaciones europeas5-10 y asiáticas14,17,24, aún no se han descrito en la población mestiza hispanoamericana, siendo este un primer estudio de este tipo de población, observándose diferencias con los resultados descritos en otras poblaciones.
En este estudio se observó una asociación entre el alelo A y el genotipo GA del polimorfismo TNFA-238G/A y riesgo disminuido a desarrollar APs. En estudios previos, realizados en Ps y APs, se ha descrito una asociación positiva entre el alelo A de TNFA-238G/A y la susceptibilidad a desarrollar estas 2 enfermedades25,26. Sin embargo, esta asociación ha sido descrita principalmente en poblaciones europeas, pero no en poblaciones asiáticas11,25. En varios estudios de Ps y APs se ha demostrado, que en poblaciones europeas, el alelo A del polimorfismo TNFA-238G/A se encuentra en desequilibrio de ligamiento con el alelo HLA-Cw65-7. Este desequilibrio de ligamiento es relevante en la asociación de riesgo entre APs y el polimorfismo TNFA-238G/A porque el alelo HLA-Cw6ha sido asociado con Ps tipo 126 y APs en pacientes que inician las lesiones de piel antes de los 40 años27. Dado que en las poblaciones europeas el alelo A de TNFA-238 y HLA-Cw6 se encuentra en desequilibrio de ligamiento, se podría considerar que el alelo A del polimorfismo TNFA-238G/A no es la variante causal, sino que el alelo HLA-Cw6 podría ser el responsable de esta asociación de riesgo.
Una debilidad de este estudio fue la imposibilidad de tipificar el alelo HLA-Cw6 en todos los pacientes; sin embargo, en un estudio realizado en mestizos venezolanos con Ps sin APs se describió una frecuencia del 5,4% de alelo HLA-Cw6 en individuos sanos con respecto a una frecuencia del 21,8% en los pacientes con Ps28; esta prevalencia de HLA-Cw6 es mucho menor que la descrita en otras poblaciones, como la europea. Por lo tanto, la asociación observada entre el alelo A y el genotipo GA del polimorfismo TNFA-238G/A y protección a desarrollar APs podría explicarse porque el alelo A del polimorfismo TNFA-238G/A ha sido asociado con una expresión disminuida de TNF-α4.
Una diferencia importante del presente estudio con otras cohortes es que se incluyó un mayor porcentaje de pacientes con Ps tipo 2; esto último pudiese explicar la diferencia de los resultados obtenidos con los publicados en otras poblaciones, ya que se ha demostrado que estos 2 grupos de pacientes con Ps se comportan genéticamente diferente, por ejemplo, la frecuencia del alelo HLA-Cw6 no es mayor en los pacientes con Ps tipo 2 con respecto a la población general26.
Asimismo, se observó una asociación significativa entre el genotipo GA del polimorfismo TNFA-308G/A y el inicio tardío de la APs. Estos resultados concuerdan con un estudio realizado en caucásicos, en el cual se describe la asociación del genotipo GA del polimorfismo TNFA-308G/A y un promedio de edad mayor de inicio de Ps7 y con un estudio realizado en pacientes españoles con APs, en el cual se observa una frecuencia incrementada del alelo A del TNFA-308G/A en pacientes femeninos con Ps tipo 227.
Sin embargo, es importante señalar que el polimorfismo TNFA-857C/T, localizado en la región promotora del gen TNFA, se ha asociado con susceptibilidad a APs en distintas poblaciones europeas29,30. Asimismo, la variante rs12044149, cercana al gen IL23R, y la variante rs9321623, cercana al gen TNFAIP3, han sido fuertemente asociadas con APs, pero no con Ps cutánea31.
Al correlacionar los polimorfismos del gen IL10 con la expresión o el fenotipo de la enfermedad (variables clínicas de la enfermedad), solo 2 de ellas resultaron significativas. Una fue el intervalo o la latencia entre la aparición de la Ps y APs, el cual fue mayor en aquellos pacientes que presentaban el genotipo GG del polimorfismo IL10-1082A/G. Esta asociación resulta interesante porque este polimorfismo está relacionado con una mayor producción de IL-10, indicando que una mayor concentración de esta citocina pudiese estar demorando las manifestaciones articulares en aquellos pacientes con diagnóstico de Ps, aunque es importante mencionar que no todos los pacientes con Ps van a desarrollar APs y que en no todos los pacientes con APs las lesiones de piel preceden las manifestaciones articulares32. Sin embargo, no deja de ser un resultado interesante para ser confirmado con otras metodologías, ya que pudiese tener una implicación terapéutica, como por ejemplo el uso de IL-10 recombinante pudiese evitar la aparición de las manifestaciones articulares en aquellos pacientes que tienen un diagnóstico de Ps.
La otra manifestación clínica que resultó significativamente asociada con estos polimorfismos de IL10 fue el compromiso de las articulaciones IFD, observándose una asociación de los genotipos CC de IL10-819C/T e IL10-592C/A, respectivamente, y daño de las articulaciones IFD. Estos genotipos se han asociado con una mayor producción de IL-1016, pero su asociación con este subgrupo de pacientes con APs no resulta fácil de explicar. Sin embargo, se ha descrito la presencia de una subpoblación incrementada de macrófagos CD163+ polarizados a un fenotipo M2, en presencia de IL-10, en la membrana sinovial de pacientes con APs33,34, aunque el papel de estos macrófagos en la patogenia de la APs aún se desconoce. Otra posible explicación es que los alelos de los polimorfismos IL10-819C/T e IL10-592C/A se encuentran en desequilibrio de ligamiento con otros genes cercanos, que por otros mecanismos, por ejemplo respuesta inmunitaria o reparación ósea, se asocian a compromiso articular de las IFD. Es importante destacar que en algunos de los pacientes mayores de 40 años, incluidos en este estudio, no fue posible diferenciar si el daño de estas articulaciones había ocurrido por la APs o por osteoartritis de manos. Sin embargo, en cualquiera de las 2 circunstancias no existen trabajos previos que documenten esta interesante asociación.
En conclusión, los resultados obtenidos permiten considerar que existe una asociación de riesgo del polimorfismo TNFA-238G/A y APs en pacientes mestizos venezolanos. En contraste los polimorfismos TNFA-308G/A e IL10-1082A/G, IL10-819C/T e IL10-592C/A modifican la expresión de la enfermedad, como el inicio más tardío de la APs y la aparición de una de sus manifestaciones, como lo es la afectación de las IFD. Esto confirma la influencia de factores genéticos sobre la APs y de manera indirecta demuestra la relación que existe entre algunas vías de citocinas con el inicio y el desarrollo de esta enfermedad. Finalmente, para validar estos hallazgos deben realizarse estudios en un grupo de pacientes más grande y en otras poblaciones mestizas hispanoamericanas.
FinanciaciónEste trabajo fue financiado por fondos del Instituto Venezolano de Investigaciones Científicas.
Conflicto de interesesEl Dr. Luis. Gutiérrez posee una subvención de investigación (IIR/PFIZER)
Grupo Venezolano para el estudio de la espondiloartritis (GRUVES).