Las metástasis de los tumores sólidos se producen cuando las células de un carcinoma primario o metastásico migran en el sistema circulatorio y proliferan en lugares distantes del organismo. Los carcinomas son de origen epithelial, y no es habitual que estas células se encuentren en el torrente circulatorio. La presencia de células tumorales circulantes (CTC) en sangre periférica detectadas con CellSearch®Circulating Tumor Cell System, está asociada a menor supervivencia libre de enfermedad (SLE) y menor supervivencia global (SG) en pacientes de cáncer de mama, colorrectal y de próstata metastatizante. Esta prueba sirve para ayudar en la monitorización de pacientes con cáncer de mama, colorrectal o próstata. Además, en el presente artículo revisamos otras técnicas de detección de células tumorales circulantes y su aplicabilidad clínica.
Cancer metastasis occurs when cells shed from a primary or metastatic tumor, enter the circulation, and begin to grow in distant locations of the body. Carcinomas are derived from epithelial cells that are not normally found in circulation. The presence of circulating tumor cells (CTC) in the peripheral blood, as detected by the CellSearch® Circulating Tumor Cell Kit, is associated with disease free survival and decreased overall survival in patients treated for metastatic breast, colorectal or prostate cancer. The test is to be used as an aid in the monitoring of patients with metastatic breast, colorectal or prostate cancer. In our article we will evaluate other methods of analysing circulating tumor cells and their clinical application.
La determinación de células tumorales circulantes (CTC) no es un concepto nuevo, en 1869 Ashworh publicó un caso donde las células malignas similares a las del tumor primario circulaban en sangre periférica1.
Estas observaciones permitieron que durante mucho tiempo, se supusiera que su presencia significaba una progresión de la enfermedad neoplásica maligna y que se podía relacionar directamente con las metástasis tumorales. Pero su verdadero significado biológico no había podido ser establecido, debido a su escaso número y por no contar con técnicas que permitieran su aislamiento e identificación eficaz.
En los últimos años se ha producido un gran interés en las CTC de los tumores sólidos tanto en sangre periférica como en médula ósea, debido al advenimiento de nuevas técnicas de inmunohistoquímica, biología molecular y citometría de flujo; pero éstas no han logrado ser automatizadas-estandarizadas y reproducibles hasta ahora, lo que sí se logra con CellSearch® Circulating Tumor Cell System, que permite el uso de protocolos estándares para la preparación de las muestras y la interpretación de los resultados. Es capaz de detectar en sangre periférica, 1 CTC por 1 × 105-7 células mononucleares mediante inmunomagnetismo2.
Este sistema es el único, hasta el momento que se encuentra aprobado por la agencia gubernamental de control de alimentos y medicamentos de los EE.UU. (FDA) para la determinación de CTC en pacientes con cáncer de mama, colorrectal y próstata3,4.
La determinación de CTC en sangre periférica con CellSearch® se puede realizar en cualquier momento de la enfermedad permitiendo valorar el pronóstico del paciente y predecir la SLE y una SG. Además, nos permite la monitorización de estos pacientes junto con los métodos clínicos actuales (tabla 1).
Importancia de las CTC en su detección, determinación del número y caracterización celular
| CTCDetección y determinación del número | CTCCaracterización |
| Establecen el pronóstico en tumores sólidos y vigilan la recurrencia de la enfermedad. | Determinan los factores pronósticos y predictivos de los tumores sólidos. |
| Estudian si el tratamiento tiene respuesta antitumoral. | Vigilan la diseminación, la resistencia a medicamentos y que terapias inducen la muerte celular tumoral. |
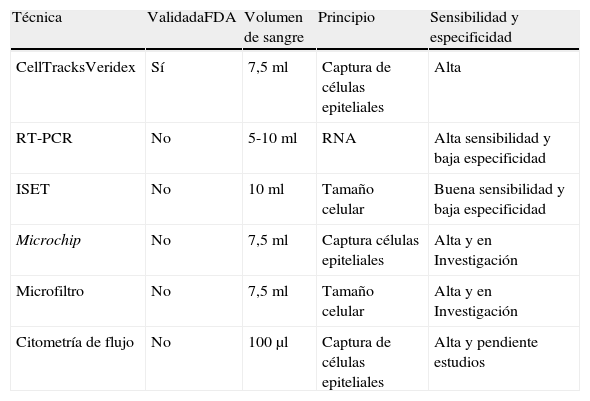
Actualmente se trabaja en otros sistemas de detección a través de RT-PCR (transcriptasa reversa y reacción en cadena de polimerasa), CTC-chip (microchips), microfiltro, citometría de flujo, FAST (método citométrico) y FISH (hibridación in situ fluorescente). Estas técnicas se encuentran en investigación o requieren ensayos clínicos para poder ser validadas (tabla 2).
Comparación de las técnicas utilizadas para determinar las CTC
| Técnica | ValidadaFDA | Volumen de sangre | Principio | Sensibilidad y especificidad |
| CellTracksVeridex | Sí | 7,5 ml | Captura de células epiteliales | Alta |
| RT-PCR | No | 5-10 ml | RNA | Alta sensibilidad y baja especificidad |
| ISET | No | 10 ml | Tamaño celular | Buena sensibilidad y baja especificidad |
| Microchip | No | 7,5 ml | Captura células epiteliales | Alta y en Investigación |
| Microfiltro | No | 7,5 ml | Tamaño celular | Alta y en Investigación |
| Citometría de flujo | No | 100μl | Captura de células epiteliales | Alta y pendiente estudios |
El principio de las metástasis en el cáncer, consiste en la migración de las células malignas al sistema circulatorio y su localización posterior en órganos distantes. Así vemos como el cáncer de próstata metastatiza al tejido óseo, el cáncer de mama al pulmón o el cáncer colorrectal al tejido hepático, como primer lugar anatómico de localización.
La muestraLa muestra basal se recoge antes de comenzar cualquier régimen de quimioterapia. Las muestras posteriores se extraen en intervalos de 3 o 4 semanas, para seguir los niveles de CTC durante el tratamiento.
Si el paciente recibe doxorubicina, se debe esperar a que transcurran al menos 7 días desde la administración de una dosis antes de extraer la muestra. Esto es debido a que en las muestras enriquecidas con niveles tóxicos de doxorubicina se produce un marcaje alterado de leucocitos con citoqueratina y CD45 dualmente positivos, ya que este agente quimioterapéutico es un compuesto fluorescente que se incorpora en las células nucleadas.
La venopunción se realiza con técnicas asépticas y se extraen 10ml de sangre total en CellSave® Preservative Tubes. El tubo de sangre periférica es procesado en Celltracks®AutoPrep® System que nos proporciona una muestra enriquecida y lista para ser analizada en el Celltracks® Analyzer II.
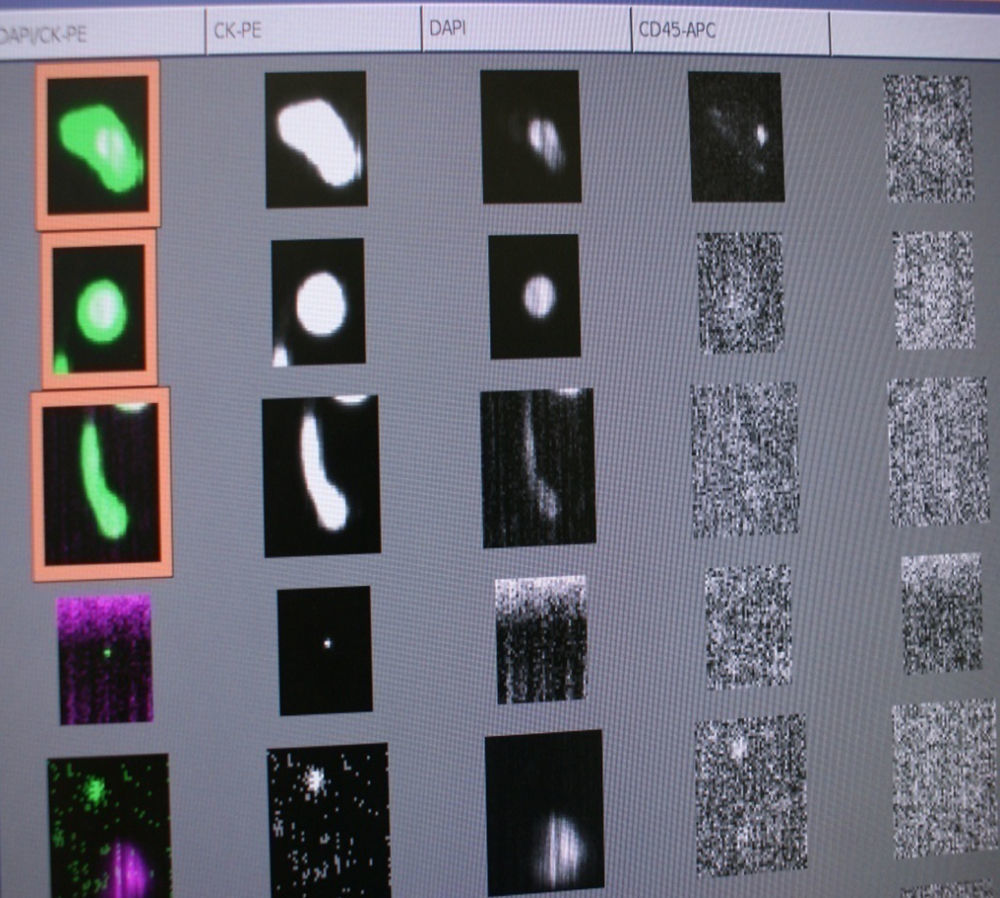
La técnicaEl principio básico de la técnica consiste en una selección por partículas inmunomagnéticas (ferrofluido) y tinción con reactivos inmunofluorescentes. El reactivo del ferrofluido consiste en nanopartículas con un núcleo magnético rodeado de una capa polimérica revestida con anticuerpos dirigidos al antígeno EpCAM para capturar las CTC. Tras la captura inmunomagnética y el enriquecimiento, se añaden los reactivos fluorescentes para la identificación y enumeración de las CTC (figura 1).
Los reactivos fluorescentes incluyen:
- •
Anti-CK-phycoerythrin (PE): específico para la proteína citoqueratina intracelular, esta marcación es una característica de las células epiteliales.
- •
DAPI: marcador que tiñe el núcleo de todas las células nucleadas. Por ello nos marca tanto los leucocitos, como las células epiteliales.
- •
Anti-CD45-Allophycocyanin (APC): específico para marcar los leucocitos.
El conjunto de células seleccionadas con el ferrofluido se depositan en un cartucho que se introduce en un dispositivo de presentación celular MagNest® (figura 2). El fuerte campo magnético del dispositivo MagNest®, atrae a las células epiteliales marcadas magnéticamente unidas al ferrofluido hacia la superficie del cartucho.
CellTracks Analyzer II® explora automáticamente toda la superficie del cartucho, adquiere las imágenes y muestra al operador cualquier evento donde CK-PE y la fluorescencia DAPI aparecen en el mismo lugar. Las imágenes son presentadas al operador en un formato de galería para su clasificación final.
Interpretación de los resultados analizados en Celltracks® Analyzer IIEl resultado nos indica el número de CTC en 7,5ml de sangre periférica de la muestra extraída previamente. Esta interpretación solo es realizada por personal entrenado para ello, cada evento clasificado como célula tumoral debe tener un fenotipo: EpCAM positivo, CK positivo, DAPI positivo y CD45 negativo (figura 3.)
Cáncer de mama metastásico: se considera que un recuento de CTC de 5 o más por 7,5ml de sangre en cualquier fase de la enfermedad, se asocia a un peor pronóstico, es predictivo de una SLE y una SG más corta5.
Cáncer colorrectal metastásico: un recuento de CTC de 3 o más por 7,5ml de sangre en cualquier fase de la enfermedad se asocia a un pronóstico malo, es predictivo de una SLE y una SG más corta5.
Cáncer de próstata metastásico: se considera que un recuento de CTC de 5 o más por 7,5ml de sangre en cualquier fase de la enfermedad, se asocia a un pronóstico malo, es predictivo de una SLE y una SG más corta5,6.
Aplicaciones clínicasEn los tres tumores epiteliales estudiados (mama, colon y próstata), la determinación identifica y cuantifica las CTC en sangre periférica de manera fiable y reproducible. Esto sugiere la utilidad de la técnica y de los resultados, así como su aplicación en el seguimiento y terapéutica. Es importante considerar que en los estudios realizados todos los individuos sanos mostraron menos de 2 CTC en 7,5ml de sangre periférica.
Teniendo en cuenta lo antes mencionado, se ha establecido:
- -
En cáncer de mama metastático las CTC se asocian a supervivencia, supervivencia libre de enfermedad y predicción de la respuesta terapéutica7.
- -
En cáncer colorrectal metastático las CTC, se asocian a supervivencia y supervivencia libre de enfermedad. En cáncer colorrectal localizado, las CTC predicen el estadío tumoral y son factor pronóstico independiente de SG y SLE8.
- -
En cáncer de próstata metastático las CTC predicen una SLE y una SG más corta. Se ha demostrado una correlación positiva entre el número de CTC y los valores de PSA, con el tamaño del tumor y con la presencia o no de adenopatías9. Los hallazgos confirman que las cantidades de CTC antes del tratamiento ayudan a predecir la supervivencia de los pacientes de cáncer de próstata que inician la quimioterapia de primera línea.
Tanto en cáncer de mama, colorrectal y próstata diseminados, los niveles de CTC están significativamente más elevados, sin importar cuál de estos tumores epiteliales estemos evaluando.
Detección mediante transcriptasa reversa y reacción en cadena de polimerasa (RT-PCR) de células tumorales circulantesLa utilización de la transcriptasa reversa y reacción en cadena de la polimerasa (RT-PCR) para amplificar el RNAm se presenta como una metodología para la detección de células circulantes derivadas de tumores de órganos sólidos. Las muestras son obtenidas de sangre periférica, los pacientes sanos son los controles negativos y como control positivo se suele utilizar un ganglio linfático afectado por el tumor a estudiar o muestra del tumor.
La muestraLa muestra de sangre periférica varía de 5 a 10ml, esta se recoge en tubos de etilenodiaminotetraacetato (EDTA), usualmente 5 tubos y se guardan a una temperatura de 4°C. Esta muestra debe ser procesada dentro de un periodo de 2-4 horas una vez es extraída10.
La técnicaLa sangre obtenida se centrifuga a 2.500rpm durante 5 minutos, el plasma debe ser desechado y se recoge el suero, este suero se transfiere a un tubo de policarbonato. Posteriormente se le añaden 45ml de H2O-dietil pirocarbonato (DEP) y PBS-10X, se agita y se centrifuga a 2.500rpm durante 5 minutos para obtener un pellet excento de glóbulos rojos. Para la extracción del RNA de linfocitos se utilizan diversos kits comerciales.
Se debe cuantificar el RNA extraído mediante espectrofotómetro de luz ultravioleta a una densidad óptica de 260nm y 280nm. Se analiza el RNA mediante electroforesis en gel de agarosa al 1%. Los geles se visualizan en un transiluminador ultravioleta y son fotografiados.
- •
Oligonucleótidos: son utilizados para amplificar el número de pares de bases del gen estudiado. La integridad del RNA se estudia con los primers correspondientes al DNAc de beta-actina sentido y antisentido (los primers elegidos amplifican el número de pares de bases que estamos buscando).
- •
Transcriptasa reversa: las muestras de RNA se incuban con la enzima de transcripción inversa, que ante los cebadores y desoxinucleótidos trifosfatos (dNTP), cataliza la retrotranscripción de las cadenas de DNA complementarias al del RNA (DNAc), la temperatura óptima de transcripción es determinada según el gen estudiado, que por lo general son 42°C. El proceso se realiza mediante un kit comercial, donde cada tubo de reacción contiene un volumen de 20μl, compuesto por RNA (1μg), tampón de transcriptasa reversa (100mM Tris-HCl, pH 8,8 a 25°C, 500 mMKCl,Tritón X-100), proteína inhibidora de RNasas (rRNAsin) (0,4μmol), transcriptasa reversa (AMV) (24U), Poli T (oligo-dT primer) (1mmol), dNTPs (10mM)12 y agua hasta 20μl (la transcripción inversa se realiza en un termociclador, donde la temperatura y el tiempo se determina según el tumor a estudio, que suele ser a 42°C durante 15 minutos).
- •
Reacción en cadena de la polimerasa: el resultado de la transcripción inversa se diluye al 1/10 en H2O-DEP, utilizando una alícuota de 5μl para la PCR. Cada tubo de reacción contiene: el resultado de la transcriptasa reversa (5μl), tampón de la enzima Taq polimerasa (10μl), dNTPs (0,2mM), enzima Taq polimerasa (5U/μl), primer Sense y Antisense del gen tumoral estudiado (1μmol) y agua hasta 100μl.
Los ciclos utilizados para la amplificación del gen se determinan según el gen a estudiar, siguiendo los siguientes pasos: desnaturalización del DNA (1 minuto a 94°C), acoplamiento de los cebadores y DNA diana (2 minutos) y por último la extensión (3 minutos a 72°C y 30 ciclos con una extensión final de 7 minutos a 72°C)10.
Interpretación de los resultadosEl resultado de la PCR se analiza mediante electroforesis en gel de agarosa al 2%. Para poder extrapolar al tamaño de los fragmentos del DNA estudiado se debe usar un marcador de peso molecular.
Aplicaciones clínicasLa utilización de la RT-PCR permite amplificar el RNAm presente en sangre periférica y por tanto es una metodología que se utiliza para detectar pequeñas cantidades de células malignas circulantes en tumores sólidos.
Tiene como inconveniente la pérdida de la información morfológica y el alto porcentaje de falsos positivos observados en los pacientes sanos.
Esta técnica muestra resultados variables en los diferentes estudios, por lo que no ha podido ser reproducible y validada. Está en controversia si con esta técnica se puede predecir el pronóstico y la respuesta terapéutica en los tumores sólidos estudiados11.
Detección mediante microchip de células tumorales circulantesEsta tecnología ha sido desarrollada en el centro para el Cáncer del Hospital General de Massachusetts, en colaboración con el Centro de Investigación de Sistemas Biomicroelectromecánicos, donde el principio básico es un microchip capaz de aislar, contabilizar y analizar las células tumorales circulantes en sangre periférica.
La técnicaConsiste en un microchip llamado CTC-chip, que se instala sobre un soporte de tamaño similar al de una tarjeta de crédito; su superficie es de silicona y está recubierto de alrededor de 80.000 puntos detectores microscópicos (micropostes), cargados con anticuerpos capaces de detectar las proteínas (EpCAM) que se expresan en la mayor parte de los tumores sólidos de origen epitelial.
Estos puntos detectores, de una sección inferior a la de un cabello, están dispuestos sobre la superficie del microchip con una geometría tal que al circular la sangre de la muestra entre ellos, con un flujo y una velocidad prefijados por medio de una bomba neumática, capturan las células cancerosas en posiciones determinadas en la tarjeta de silicona dependiendo del anticuerpo con el que está cargado cada punto detector. Esta técnica permite detectar células tumorales con una sensibilidad de una entre mil millones. Y dependiendo del anticuerpo cargado en cada punto detector se fijarán a él células tumorales distintas, por lo que el microchip es capaz de identificar diferentes tumores por su huella molecular. Asímismo, en base a un modelo matemático, se puede constatar el número de células tumorales presentes en la sangre.
Aplicaciones clínicasEl microchip puede encontrar una de sus mejores aplicaciones en el seguimiento en tiempo real, de la respuesta a las distintas terapias quimioterapéuticas.
En las pruebas clínicas realizadas, se utilizaron muestras de sangre periférica de 68 pacientes afectados por diferentes tipos de tumores sólidos como: pulmón, mama, páncreas, próstata, o colorrectal. Se realizaron en total 116 test y el microchip detectó con total claridad la presencia de células tumorales en la sangre en 115 de ellos.
Los investigadores, con las pruebas realizadas, conceden a este método una fiabilidad del 99%. En los test de las muestras de sangre de los pacientes sanos en ningún caso se encontraron células tumorales.
Serán necesarios varios trabajos adicionales antes de proceder a la aplicación clínica de estos CTC-chips.
Detección a través de filtros de células tumorales circulantesEn el mercado existe el filtro ISET (Isolation by Size of Epithelial Tumour Cells), donde los poros del filtro son de 8μm, pero se observa que los leucocitos de mayor tamaño quedan atrapados en el filtro, por lo que es considerada una técnica con buena sensibilidad y baja especificidad.
La técnica microfiltroSe basa en un dispositivo microfiltro desarrollado por un equipo de la Escuela Keck de Medicina de la Universidad del Sur de California, en Los Ángeles, en colaboración con el Instituto de Tecnología de California, en Pasadena.
Con esta técnica se capturan las CTC en virtud de su tamaño, basándose en el principio de que la célula tumoral es mucho más grande que sus contrapartes. Se tarda en promedio 90 segundos para procesar 7,5ml de sangre periférica13.
Aplicaciones clínicasLa técnica del microfiltro es más rápida pero se encuentra aún en una fase temprana de desarrollo y necesita más trabajo y validación. Por ejemplo, se deberá normalizar alguna variable como la tasa a la cual la sangre es empujada a través del filtro.
Detección a través de citometría de flujo de células tumorales circulantesLa citometría de flujo es una tecnología que permite la medición simultánea de múltiples características físicas y químicas de las células en suspensión. El citómetro permite conocer información sobre las células estudiadas en cuanto a su tamaño, su granularidad o complejidad interna y evaluación química.
La muestraLa muestra corresponde a 100μl de sangre total, 10μl del marcador determinado, se incuba de 10-15 minutos a temperatura ambiente, se añade el lisador y se analiza en el equipo.
La técnicaUtiliza un sistema óptico-electrónico donde se registra cómo la célula interactúa con un rayo láser. Con esta técnica se detecta la capacidad de la célula para desviar la luz incidente (láser) y emitir fluorescencia. Además de detectar moléculas específicas celulares como anticuerpos conjugados o antígenos específicos de epitelios (intracelulares) en el caso de las CTC.
Los marcadores usados para CTC son citoqueratinas y mucin-1, los cuales no se encuentran en los precursores hematopoyéticos.
- •
Componentes: un sistema de fluidos, un sistema óptico compuesto por una fuente de luz y de separación espectral, un sistema electrónico con un control mecánico de luz y detectores, un sistema de colección y análisis de pulsos, además de un sistema informático, el cual analiza y presenta los datos de las células estudiadas14.
Aunque las aplicaciones más relevantes están relacionadas con la hematología e inmunología clínica, esta técnica utilizada para determinar las CTC tiene la ventaja de que las células no se lisan y por ello se conserva la morfología con la tipificación posterior15. Su aplicación clínica en tumores epiteliales sólidos aún no se encuentra estandarizada.
Otros estudios de investigación han demostrado que la citometría de flujo multiparamétrica tiene muy buena sensibilidad con una mínima cantidad de 10 células por mililitro de sangre periférica, en un volumen total de 10ml (100 células en total)16.
Detección a través del sistema fast-citométrico (Fiber-optic array scanning Technology) de células tumorales circulantesLa muestraLa muestra corresponde a 10ml de sangre periférica.
La técnicaEsta técnica utiliza marcadores de inmunohistoquímica: CK (citoqueratinas) característica de la célula epitelial y DAPI para la determinación nuclear, con estos marcadores se tipifican las CTC en sangre periférica.
Las CTC son captadas a través del FAST scanning y se observan con el microscopio de inmunofluorescencia a 40X, buscando las células con fenotipo DAPI y CK positivas. Posteriormente se observan con la coloración de Wright-Giemsa, a través de un microscopio óptico17.
Con esta técnica se evalúa pleomorfismo, se determina el cociente núcleo/citoplasma y se observa la cromatina de las CTC.
Aplicación clínicaEsta técnica ha sido utilizada para determinar la presencia de las CTC de tumores sólidos, especialmente en cáncer de mama, enfocada en estudiar las características citomorfológicas de las CTC e investigar nuevas dianas terapéuticas. Aún falta realizar estudios clínicos para que esta técnica sea validada.
Detección a través de FISH (Hibridación in situ fluorescente) de células tumorales circulantesLa técnicaEsta técnica utiliza moléculas fluorescentes para poder localizar genes o fragmentos de DNA de la CTC. Se preparan cortas secuencias de DNA, llamadas sondas, las que son complementarias de las secuencias de DNA, según el tumor sólido a estudiar.
Estas sondas son marcadas con fluorocromos y posteriormente se hibridan al DNA complementario, permitiendo así localizar las secuencias en las que se encuentran. Se aplica sobre las CTC y se observa la fluorescencia al microscopio de epifluorescencia.
Lo que se pretende observar son cambios citogenéticos según el tipo de CTC estudiada; la presencia de deleciones, translocaciones o amplificación de genes específicos en los cromosomas de las CTC.
AplicaciónEs un método validado para la genotipificación de las CTC, lo que ha permitido estudiar y ampliar conceptos en la genética del cáncer.
ConclusionesLa determinación de CTC permite monitorizar el seguimiento de la enfermedad, se puede elegir una opción terapéutica y demostrar si este tratamiento está siendo efectivo. Pero también con las CTC se logra evitar que los pacientes se expongan a tratamientos ineficaces y altas toxicidades.
Los resultados de CellSearch® deben utilizarse de manera conjunta a la información clínica obtenida de las pruebas diagnósticas, al examen físico y a la historia clínica completa. Esta técnica es hasta ahora la única aprobada en el mercado para detección de CTC y autorizada por la FDA.
El número de CTC encontradas en los carcinomas, están directamente relacionadas con el pronóstico y la supervivencia.
Actualmente CellSearch® no solo se aplica para valorar el pronóstico o la supervivencia de los pacientes con tumores sólidos; también se usa para valorar la respuesta a la quimioterapia y para determinar los protocolos a seguir según la respuesta al tratamiento.
La utilización de la RT-PCR permite amplificar el ARNm presente en sangre periférica y por tanto es una metodología útil para detectar pequeñas cantidades de células malignas circulantes. Pero no está validada, se pierde la morfología y tiene alto número de falsos positivos.
El microchip es una técnica que promete avances en el seguimiento de la respuesta a las distintas terapias. Pero aún requiere más estudios clínicos para su validación.
El microfiltro podría tener el inconveniente, de que el tamaño de las células tumorales varía enormemente según los tipos de tumores estudiados.
La citometría de flujo tiene la ventaja de preservar todas las células tumorales de la muestra.
La técnica FAST ha sido empleada para conocer la morfología y tamaño de las CTC.
La FISH es usada para estudios citogenéticos de las CTC, lo que ha permitido avanzar en la genética del cáncer.
En los próximos años seguramente conoceremos gracias a estas técnicas mencionadas, las características específicas de las CTC y su capacidad de metastatizar. Podremos saber qué porcentaje de ellas son células madre u otra subpoblación de células tumorales circulantes, con mayor capacidad de metastatizar, de proliferación, de resistencia a la quimioterapia y radioterapia. Esto permitiría tomar decisiones terapéuticas que aumenten la supervivencia de los pacientes afectados con tumores de órganos sólidos.
Una perspectiva interesante para los dispositivos de enumeración CTC es que podrían eventualmente ser utilizados para el diagnóstico del cáncer. En un escenario especulativo, una muestra de sangre tomada, por ejemplo, para medir los niveles de lípidos también se podrían utilizar para la presencia de CTC y podría indicar la presencia de un cáncer no sospechado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.